第三课时 盐类水解的应用
- 格式:ppt
- 大小:344.50 KB
- 文档页数:39



第三节:(第3课时)盐类水解的应用一、盐类水解的概念:。
二、盐类的水解规律、、、。
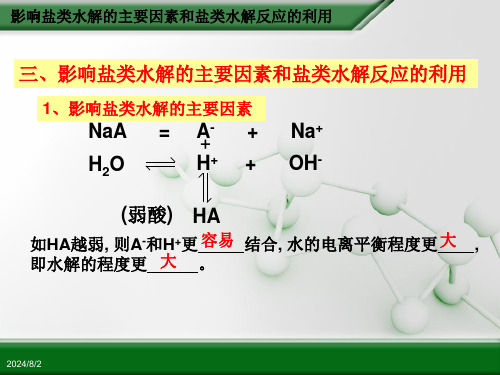
三、盐溶液呈酸碱性的原因四、影响盐类水解的因素内因:盐本身的性质——越弱越水解外因:1、温度:越热越水解2、浓度:越稀越水解。
3、加入酸、碱及其他能反应的物质会影响盐的水解。
(一般酸可抑制阳离子水解;碱可抑制阴离子水解促进。
)4、加入其他能反应的物质会影响盐的水解。
*五、双水解能进行到底的条件:(要求已降低)1. 弱酸弱碱盐(强酸弱碱盐+弱酸强碱盐溶液)2. 生成的碱或酸的溶解度比其盐(或生成盐)的要小得多。
常见的、典型的双水解反应:HCO3-HCO3-CO32-Fe3+CO32-NH4+AlO2-AlO2-Fe3+Al3+S2-AlO2-Al3+HS-AlO2-Cu2+SO32-NH4+Mg2+HSO3-SiO32-常见的双水解反应方程式有(盐与盐在溶液中反应):Al3+ + 3HCO3- == Al(OH)3↓+ 3CO2↑(泡沫灭火机)2Al3+ + 3S2- + 6H2O == 2Al(OH)3↓+ 3H2S↑Al3+ + 3AlO2- + 6H2O == 4Al(OH)3↓2Fe3+ + 3CO32- + 3H2O == 2Fe(OH)3↓+ 3CO2↑Fe3++ 3ClO- + 3H2O == Fe(OH)3↓+ 3HClO六、盐类水解的应用1、判断溶液的酸碱性:(1)将0.1mol/L的下列溶液按PH由小到大的顺序排列①Na2CO3②NaHCO3③NaOH ④NaNO3⑤CH3COOH ⑥NaHSO4⑦NH4Cl_________________ ______(2)酸式盐溶液的酸碱性:酸性NaHSO3 NaH2PO4碱性NaHCO3 NaHS Na2HPO42、判断溶液中离子浓度的大小:(1)CH3COONa溶液中离子浓度大小顺序为________________________(2)(NH4)2SO4溶液中离子浓度大小顺序为__________________(3)Na2CO3溶液中离子浓度大小顺序为__________________________3、配制盐溶液时,加酸或碱抑制水解:为了防止配制FeCl3溶液时可能浑浊,应向溶液中加入抑制水解。


第3课时盐类水解的应用及广义水解[核心素养发展目标] 1.了解盐类水解在生产生活、化学实验、科学研究中的应用。
2.能够对盐类水解的知识进行拓展迁移,解决类盐水解问题。
一、盐类水解的应用1.在化学实验中的应用FeCl3溶液显酸性,原因是Fe3++3H2O Fe(OH)3+3H+2.在生产生活中的应用明矾可作净水剂,原理为Al3++3H2O Al(OH)3(胶体)+3H+化肥的使用铵态氮肥与草木灰不能混合施用除锈剂NH4Cl溶液与ZnCl2溶液可作焊接时的除锈剂,原理为NH+4+H2O NH3·H2O+H+、Zn2++2H2O Zn(OH)2+2H+热纯碱去污能力强加热,促进Na2CO3的水解,使c(OH-)增大,去污能力增强3.盐溶液蒸干灼烧后所得产物的判断(1)盐溶液水解生成难挥发性酸时,蒸干后一般得原物质,如CuSO4(aq)蒸干得CuSO4(s)。
(2)盐溶液水解生成易挥发性酸时,蒸干灼烧后一般得到对应的氧化物,如AlCl3(aq)蒸干得Al(OH)3,灼烧得Al2O3。
(3)考虑盐受热时是否分解。
原物质蒸干灼烧后固体物质Ca(HCO3)2CaCO3或CaONaHCO3Na2CO3KMnO4K2MnO4和MnO2NH4Cl 分解为NH3和HCl,无固体物质存在(4)还原性盐在蒸干时会被O2氧化。
如Na2SO3(aq)蒸干得Na2SO4(s)。
(1)盐溶液都可用磨口玻璃塞的试剂瓶盛放()(2)由于CH3COO-和NH+4相互促进水解,所以没有CH3COONH4溶液()(3)等浓度等体积的CH3COOH与NaOH溶液混合,恰好呈中性()答案(1)×(2)×(3)×1.实验室中如何用FeCl3晶体配制FeCl3溶液?为什么?提示将FeCl3晶体溶于较浓的盐酸中,然后加水稀释到所需的浓度;加酸抑制FeCl3水解。
2.Na2CO3不能用磨口玻璃塞的试剂瓶储存,还有哪些试剂不能?提示因为玻璃的主要成分是SiO2,SiO2能和碱反应,因此碱溶液及水解呈碱性的盐溶液,如NaOH、KOH、Na2S、Na2SiO3等都不能用磨口玻璃塞的试剂瓶储存。






