蝴蝶兰组培快繁技术研究
- 格式:pdf
- 大小:156.70 KB
- 文档页数:2

蝴蝶兰组织培养关键技术探讨蝴蝶兰是一种广受欢迎的花卉,其美丽的花朵和特殊的香气吸引了许多人的喜爱。
在现代花卉产业中,蝴蝶兰的组织培养技术已经得到了广泛的应用,成为了繁育和生产优质蝴蝶兰的重要手段。
本文将探讨蝴蝶兰组织培养的关键技术,包括材料准备、消毒与无菌技术、培养基配方、激素处理、光照和温度控制等方面,旨在为蝴蝶兰组织培养提供更多的经验和技术指导。
一、材料准备蝴蝶兰组织培养的材料准备包括培养基、植物组织和器皿等。
培养基的配制是组织培养的关键,通常包括基本培养基、植物生长调节剂、维生素和其他添加剂。
基本培养基可以选择MS培养基、WPM培养基等,其中MS培养基是最为常用的一种。
植物生长调节剂一般包括生长素、细胞分裂素等,可以促进植物幼芽的生长和分化。
在材料准备阶段,需要严格按照配方比例进行称量和混合,确保培养基的质量和稳定性。
植物组织的准备是指从蝴蝶兰植株中获取适宜的组织,并进行无菌处理。
通常可以选择茎尖、叶片或花序等组织作为培养材料,要求组织样品新鲜健康、无病虫害,并在无菌条件下进行操作。
器皿的准备包括试管、培养瓶、培养皿等,需要进行高压蒸汽消毒和紫外线照射,以确保器皿内部的无菌环境。
二、消毒与无菌技术消毒与无菌技术是蝴蝶兰组织培养过程中至关重要的一环。
在培养基、植物组织和器皿的准备过程中,必须保持严格的无菌操作,以避免外源微生物的污染。
常用的消毒方法包括高压蒸汽消毒、紫外线照射和化学消毒剂处理等。
高压蒸汽消毒是最常用的无菌处理方法,通过高温高压的蒸汽可以有效杀灭器皿表面的微生物。
紫外线照射则是利用紫外线的杀菌作用来对器皿和工作台面进行消毒处理。
化学消毒剂主要包括过氧化氢、乙醇、漂白粉等,它们可以在无菌条件下对实验器皿和操作场所进行处理,消灭潜在的细菌和真菌。
还需要配备无菌工作台、无菌手套、口罩和无菌操作衣等个人防护装备,确保操作人员和操作环境的无菌状态。
三、培养基配方培养基中还需要添加维生素、氨基酸、糖类和微量元素等,以提供植物生长和代谢所需的营养物质。

蝴蝶兰组培快繁基本培养基和生长调节剂组合实验设计引言蝴蝶兰是一种重要的观赏花卉,其快速繁殖技术对于大规模培育和商业性生产具有重要意义。
本实验旨在设计一种适用于蝴蝶兰组培快繁的基本培养基配方,并探究生长调节剂在蝴蝶兰组培快繁过程中的作用。
二级标题一:基本培养基配方的选择蝴蝶兰组培培养的基本培养基是组织培养的基础,对于蝴蝶兰的快速繁殖起着关键作用。
我们在选择基本培养基配方时需要考虑以下几个因素:三级标题一:无机营养物质无机营养物质是植物生长所必需的元素,包括氮、磷、钾等。
对于蝴蝶兰的组培快繁,常用的基本培养基配方是MS培养基,其中含有适量的氮、磷、钾以满足蝴蝶兰的生长需求。
三级标题二:有机营养物质有机营养物质是植物生长所必需的碳、氢、氧等元素,常用的有机营养物质包括蔗糖、蛋白胨等。
在蝴蝶兰组培快繁过程中,添加适量的蔗糖和蛋白胨可以促进蝴蝶兰的无菌生长。
三级标题三:pH值调节蝴蝶兰生长适宜的pH值范围一般为5.5-6.5,因此在基本培养基配方中需要调节pH值,保持其在适宜范围内。
二级标题二:生长调节剂的选择与作用生长调节剂在植物生长过程中起到非常重要的调节作用,对于蝴蝶兰组培快繁尤为关键。
我们可以通过添加不同的生长调节剂来控制蝴蝶兰的生长和分化过程。
三级标题一:激素类生长调节剂激素类生长调节剂包括赤霉素、生长素等,它们可以调节植物的生长和发育过程。
在蝴蝶兰组培快繁中,添加适量的生长素可以促进蝴蝶兰愈伤组织的分化和生长。
三级标题二:抗氧化剂和活性氧清除剂在蝴蝶兰组培快繁过程中,组织培养条件容易引起氧化应激,导致细胞氧化损伤。
因此,适量添加抗氧化剂和活性氧清除剂可以提高蝴蝶兰的生长质量和成活率。
三级标题三:生长抑制剂生长抑制剂可以抑制蝴蝶兰的生长和伸长,促进其分化和壮苗。
适量添加生长抑制剂可以使蝴蝶兰组培快繁的苗期短,株型美观。
三级标题四:其他辅助剂除了上述生长调节剂,还可以添加一些辅助剂,如维生素、微量元素等,以提供植物生长过程中所需的其他营养物质和生长因子。

蝴蝶兰组培的研究进展研究论文蝴蝶兰组培的研究进展研究论文蝴蝶兰,兰科蝴蝶兰属植物,属热带、亚热带气生兰。
原产于菲律宾、印度尼西亚、泰国、马来西亚和我国台湾等地,其株型美观、花形奇特似蝶、枝叶繁茂,花朵硕大、花色鲜艳、花期持久,观赏价值极高,在热带兰中素有“兰花皇后”的美誉,有较高的观赏和经济价值,深受国内外花卉市场的欢迎。
但是,由于蝴蝶兰是单茎性气生兰,植株很少发育侧枝,很难采用常规分株方式进行无性繁殖。
其种子也不含胚乳或其他组织,在自然条件下萌发率极低,因此无法利用播种方式进行有性繁殖。
而采用组织培养方法进行种苗繁殖是目前蝴蝶兰大规模生产的唯一途径。
蝴蝶兰快速繁殖的途径主要是利用无菌播种和利用各种类型的外植体诱导类原球茎,进而诱导分生苗实现快繁,不用通过诱导愈伤组织而直接分化丛生芽。
蝴蝶兰组培快繁的影响因素1.无菌播种途径蝴蝶兰种子的胚发育不完全,不易发芽,用人工合成的培养基促使种子无菌萌发,可以得到较高发芽率。
种子培养过程中使用的培养基有KC、MS、花宝等,其中改良KC 培养基是蝴蝶兰种胚萌发的理想培养基。
对不同无菌播种方法包括撒播法、涂布法、稀释法进行了比较,结果表明稀释法较好,种子分布均匀,利用率高,明显减少转接次数,且原球茎发育健壮整齐【1】。
果龄采收期也影响着无菌播种效果。
也可采用无菌播种途径快繁蝴蝶兰,能够在短期内获得大量幼小植株,且技术简单、成本较低,是现阶段经济有效的快速繁殖方法,也是工厂化育苗的重要途径【2】。
但由于蝴蝶兰种子苗是一种杂交品系,因此后代变异率高,除了少数自花系列较稳定以外,难以形成品质均一的大规模栽培品种。
因此,在采用无菌播种进行蝴蝶兰种苗生产时,要对父母本进行严格的选择,以确保后代性状的尽可能一致。
2.类原球茎途径原球茎是兰科植物组织培养产生的特有现象,通过离体器官诱导原球茎快繁法获得试管苗基本一致,增殖系数较高,变异性较少,适合大规模繁殖,是兰花组培快繁的一个主要形式。

蝴蝶兰组织培养快繁技术的优化
本论文对蝴蝶兰组织培养快繁技术的优化进行了较系统的研究,主要结果如下: (1)用腋芽启动的幼嫩花梗培养,灭菌15min最佳;培养基为
MS+6-BA3.0mg/L时出芽率最高,达90%以上。
(2)茎尖原球茎状体诱导率较高,培养基为MS+6-BA5.0mg/L+NAA0.5mg/L时诱导率最高,达100%;切割茎尖顶端有
利于诱导原球茎状体。
(3)原球茎状体增殖的最佳培养基为MS+6-BA3.0mg/L+NAA0.2mg/L+1.5‰活性炭,增殖系数达 2.3;原球茎块在培养瓶内有群体优势效应,切块3.0mm时增
殖系数最大。
(4)原球茎在较长时间不进行转移就可变绿分化。
添加6-BA和NAA的1/2MS有利于生根,平均根数达到 3.2条。
(5)过渡
培养能够提高蝴蝶兰组培苗移栽成活率,比对照提高12.5个百分点;室内炼苗
3d+室外炼苗3d有利于移栽,移栽成活率达90.0%。
苔藓为适宜栽培基质。
获得体细胞无性系变异材料2份:一种是圆叶蝴蝶兰,
另一种是裂叶蝴蝶兰。
(6)利用农杆菌菌株GV3101(质粒pBI121),对绿色荧光蛋白基因GFP导入技术进行了初步研究。
在20mg/L卡那霉素(Kan)选择培养基上获得蝴蝶兰原球
茎分化和生根的健壮植株129株。
PCR检测结果表明,其中59株是转基因植株。

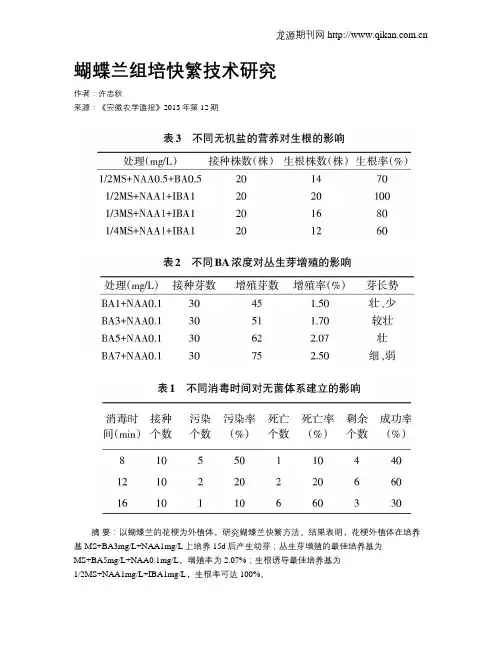
蝴蝶兰组培快繁技术研究作者:许忠秋来源:《安徽农学通报》2013年第12期摘要:以蝴蝶兰的花梗为外植体,研究蝴蝶兰快繁方法。
结果表明,花梗外植体在培养基MS+BA3mg/L+NAA1mg/L上培养15d后产生幼芽;丛生芽增殖的最佳培养基为MS+BA5mg/L+NAA0.1mg/L,增殖率为2.07%;生根诱导最佳培养基为1/2MS+NAA1mg/L+IBA1mg/L,生根率可达100%。
关键词:蝴蝶兰;组织培养;快速繁殖中图分类号 Q949.71+8.43 文献标识码 A 文章编号 1007-7731(2013)12-23-02蝴蝶兰(Phalaenopsis amabilis Bl.)是兰科蝴蝶兰属多年生名贵花卉,于1750年发现,现已发现70多个原生种,原产马来西亚等热带地区,大多数产于潮湿的亚洲地区,在中国台湾和泰国、菲律宾、马来西亚、印度尼西亚等地都有分布,其中以台湾出产最多,因花形似蝶而得名。
其株型美观、枝叶繁茂,花朵硕大、花色鲜艳,而且花期特别长,一般为2~3个月,最长可达半年,适于家庭摆设或作切花用于花篮、花束等,在热带兰中素有“兰花皇后”的美誉,有较高的观赏和经济价值,深受国内外花卉市场的欢迎。
但是,由于蝴蝶兰是单茎性气生兰,植株很少发育侧枝,很难采用常规分株方式进行无性繁殖,其种子也不含胚乳或其他组织,在自然条件下萌发率极低,因此无法利用播种方式进行有性繁殖,而采用组织培养方法进行种苗繁殖是目前蝴蝶兰大规模生产的唯一途径。
近年来,国内外学者对蝴蝶兰的组织培养技术进行了大量研究,蝴蝶兰组织培养诱导原球茎的外植体有茎尖、叶片、花梗腋芽、花梗节间切段等诱导类原球茎,进而诱导分生苗实现快繁。
蝴蝶兰的繁育方法有2种:丛生芽和原球茎增殖。
原球茎增殖容易出现变异,采用丛生芽增殖能够很好地保持原有品种的特性,还可利用花梗腋芽、叶片等作为外植体接种在不同培养基上进行离体培养,再利用诱导产生的不定芽的茎尖进行茎尖培养,可得到大量的原球茎状体。

蝴蝶兰组织培养技术研究进展摘要:蝴蝶兰的传统繁殖方式为分株繁殖,繁殖系数低,速度慢,不能满足日益增长的市场需求。
组织培养是蝴蝶兰快速繁殖的有效途径,本文综述了蝴蝶兰的原球茎诱导增殖培养,并对我国未来蝴蝶兰研究发展进行了展望。
关键词:蝴蝶兰;原球茎;组织培养蝴蝶兰是兰科蝶属植物,花形奇特,色彩艳丽,花期持久,一般2~3个月,最长可达半年,适于家庭摆设或作切花用于花篮、花束等。
但蝴蝶兰很难用传统的方式进行无性繁殖。
蝴蝶兰是单茎性气生兰,植株很少发育侧芽,且种子极难萌发,对其进行常规性的繁殖,增殖速度很慢,故多采用组织培养的方法对其进行快速繁殖。
原球茎是兰科植物组织培养产生的特有现象。
原球茎的发生途径可以由花梗节段、幼叶、根段、茎尖等部位直接产生,也可以通过诱导愈伤组织,再从愈伤组织诱导原球茎产生。
不同外植体原球茎的诱导,其特点及培养基的选择也不同。
本文就蝴蝶兰原球茎诱导增殖培养的研究现状进行综述。
1 外植体的选择外植体的来源是决定外植体能否培养成功的重要因素,不同品种、不同器官之间的分化程度和能力存在差别,因此,在进行组织培养时必须选择合适的外植体进行无菌操作才能保证蝴蝶兰组织培养的成功。
常用于蝴蝶兰组织培养的外植体有茎尖、根、叶片和花梗芽。
1.1 茎尖茎尖是最早用于兰花快速繁殖的外植体,较容易诱导培养,是成功率较高的部位。
利用蝴蝶兰的茎尖诱导出类原球茎,再由类原球茎分化成苗。
这种培养的突出问题在于蝴蝶兰为单茎性植株,剥取茎尖就损坏了母株本身,而蝴蝶兰茎极短,操作困难,易污染。
但茎尖培养的优点是比较容易获取类原球茎或愈伤组织,因为茎尖分生组织细胞的生理年龄小,易于脱分化和分化,同时,操作细致还能达到脱毒效果,获得无病毒苗。
1.2 根尖蝴蝶兰根为外植体诱导原球茎的诱导率相对较低。
以蝴蝶兰新发生的根尖段切成0.5~0.8 cm接种到培养基上,遮光处理4~5 d,14d后可形成愈伤组织。
将蝴蝶兰根平放在培养基上经过约50 d的培养后,根尖顶端可长出原球茎,其诱导率在75%左右,而根尖分生区以外的根段上却诱导不出原球茎。


蝴蝶兰的组织培养快速繁殖技术蝴蝶兰属兰科蝶兰属, 蝴蝶兰以花姿似蝴蝶翩翩飞舞而得名, 属于单茎类的兰花, 但茎极短, 被大片的椭圆形叶所遮盖, 几乎无法明显的看出来。
花茎的长短因品种之不同而差异甚大, 可有10~100cm 不等, 而花朵的大小也因品种不同有所差异。
有花的直径大于15cm 的大花种, 也有小于2cm 的小花种。
而花色则有越来越多的趋势, 计有纯白、粉红、紫红、黄、绿、黄色带赤斑纹、白色红唇、白底红条纹等,不胜枚举。
常规繁殖较慢, 常通过组织培养加快繁殖, 现对其组织培养技术介绍如下。
1 原球茎的诱导培养1.1 茎尖的培养将除去叶的茎用流水冲洗干净, 再用10%的漂白粉溶液表面消毒15min, 除去叶原基后, 用5%的漂白粉溶液灭菌10min, 用无菌水冲洗干净。
在无菌条件下将茎尖及叶基部腋芽切成大小约2~3mm 的方块, 进行接种。
1.2 蝴蝶兰的诱导培养基为VW、KC、MS、BK 古川仁郎用培养基附加15%的椰乳进行液体和固体培养。
液体培养时, 至于以160 转/min 速度震荡培养, 10d 左右更换新的培养液。
培养温度为25 ℃, 光强2 000LX , 每天光照16~24h, 1 个月左右诱导出原球茎, 这时可转移到固体培养基上继续培养。
也可取试管苗植株的直径约为0.30mm 的茎尖, 不需消毒接种在MS+6- BA3mg/l 的培养基上, 培养温度为23~27 ℃, 光强1 500LX, 14d 后茎尖膨大, 颜色转绿, 3 个月后, 原球茎直径生长达6mm。
1.3 叶片培养取试管实生苗叶片为外殖体, 实生苗年龄以3~4 个月为最好, 其诱导率及每个外殖体上的原球茎增殖的个数最高。
田中道男1975 年报道, 对于120d 的小苗,可将整叶切下直接插入培养基中, 效果比将叶切断好。
并且取自第1 叶的外殖体, 原球茎形成率较老叶好; 将幼叶片切断进行培养时, 中间部分原球茎形成率比顶部和基部好; 成年植株用叶片基部好; 切断大小与诱导率直接相关, 切断太小成活率低, 以0.50cm左右为最好。


蝴蝶兰组培快繁基本培养基和生长调节剂组合实验设计一、引言蝴蝶兰(Phalaenopsis)是一种常见的兰科植物,因其花朵形状美丽、色彩丰富而备受喜爱。
为了满足市场需求,提高蝴蝶兰的生产效率,组培快繁技术被广泛应用于蝴蝶兰的繁殖和培育过程中。
本文将重点介绍蝴蝶兰组培快繁基本培养基和生长调节剂组合实验设计。
二、实验目的通过对不同基本培养基和生长调节剂组合的试验,探索最适合蝴蝶兰组培快繁的条件,以提高组培快繁技术的效率和成功率。
三、实验材料与方法1. 实验材料:- 蝴蝶兰种子胚乳- 不同基本培养基(如MS、B5等)- 不同生长调节剂(如激素类和营养类)- 培养器具(如试管、琼脂瓶等)2. 实验方法:- 准备不同浓度和配比的基本培养基。
- 将清洗后的蝴蝶兰种子胚乳接种到不同基本培养基中。
- 添加适量的生长调节剂,并控制培养条件(如温度、光照等)。
- 定期观察和记录实验结果,包括发芽率、生长速度、株高等指标。
四、实验设计1. 单因素实验设计根据文献资料和经验,选择一种基本培养基和一个生长调节剂进行单因素实验。
可以通过改变生长调节剂的浓度或配比来观察其对组培快繁效果的影响。
选择MS培养基作为基本培养基,添加不同浓度的激素类生长调节剂(如BA、IAA等),然后观察不同处理下蝴蝶兰种子胚乳的发芽率和生长情况。
2. 正交试验设计正交试验设计可以同时考虑多个因素对组培快繁效果的影响,并通过分析结果确定最佳组合条件。
选择几个常用的基本培养基和生长调节剂进行正交试验设计。
选择MS和B5两种常用基本培养基,分别配合不同浓度的激素类和营养类生长调节剂,共设计16个处理组合。
然后观察不同处理下蝴蝶兰种子胚乳的发芽率、生长速度、株高等指标,并通过正交试验分析确定最佳组合条件。
3. 响应面试验设计响应面试验设计可以进一步优化组培快繁条件,并确定最佳的基本培养基和生长调节剂组合。
根据前期实验结果,选择影响组培快繁效果较大的几个因素进行响应面试验设计。
蝴蝶兰快繁技术的研究蝴蝶兰具有较高的观赏价值和经济价值。
其花形、花色变化无穷,花期可达三个月,长期以来深受消费者的喜爱。
近二十年来,台湾的蝴蝶兰产业蓬勃发展,中国内地的蝴蝶兰市场也在迅速扩大。
对于国内蝴蝶兰产业化的发展来说,建立和完善快繁技术是当务之急。
通过类原球茎进行快繁是蝴蝶兰商业化生产的一个重要途径,本试验对蝴蝶兰叶片类原球茎的诱导和增殖作了初步探讨。
对于蝴蝶兰叶片类原球茎诱导而言,进行叶片培养时先要经过两个星期的暗处理,然后移到明处可以提高类原球茎诱导率;培养基中6-BA是诱导类原球茎必不可少的因素,添加腺嘌呤10mg/L可以提高类原球茎诱导率;试验还在明确6-BA剂量(10mg/L)的前提下,利用正交设计方法L<sub>16</sub>(4<sup>5</sup>)探讨了培养基中NAA、肌醇、VB<sub>1</sub>、VB<sub>6</sub>、琼脂粉五种因素对蝴蝶兰叶片诱导类原球茎的影响。
结果表明:NAA是影响蝴蝶兰叶片诱导类原球茎的主要因素,VB<sub>1</sub>、VB<sub>6</sub>及琼脂粉次之,肌醇的影响程度较弱。
试验的结果分析表明,蝴蝶兰叶片诱导类原球茎的最优组合是NAA1mg/L,肌醇100mg /L,VB<sub>1</sub>5mg/L,琼脂粉8g/L。
对于类原球茎的增殖,试验采用二次正交旋转组合设计法探讨了五个因素(NAA、蔗糖、麦芽糖、VB<sub>1</sub>、VB<sub>6</sub>)对蝴蝶兰类原球茎增殖的影响。
结果表明:对于类原球茎增殖来说NAA的浓度最为重要,其次是蔗糖、麦芽糖和VB<sub>1</sub>,VB<sub>6</sub>对类原球茎增殖没有影响。
蝴蝶兰组织培养技术研究蝴蝶兰组织培养技术研究一、实验目的1.能够正确选取外植体,并最其进行前处理2.能够有效防止外植体褐变的发生。
3.能够正确进行继代培养与壮苗正根培养。
4.能够利用无菌播种方式进行种子繁殖。
5.培养团队精神、责任心和科学的思维能力。
二、实验原理随着植物组织培养技术在植物快繁上的应用,近年来,对蝴蝶兰组织培养研究较多的是用胚、幼叶、茎尖和根尖、花梗腋芽等多种器官为外植体进行组织培养研究,由于所选外植体材料各异,难度也有高低,虽然有些技术已经用于大规模工厂化生产,但仍面临一些困难,有待于进一步探索和完善。
根据目前蝴蝶兰的发展状况,本文将在以花梗侧芽、茎尖、叶片为外植体材料进行组织快繁技术上作深入的探讨和研究。
三、实验仪器及试剂花梗腋芽诱导培养基为1/ 2MS +BA2. 5 mg/L + NAA0. 2 mg/L 增殖培养基为1/ 2 MS + BA3. 5 mg/L + KT1.0 mg/L + NAA0.5 mg/L + 椰乳10 %。
生根培养基为1/ 2MS + BA1. 5 mg/L +NAA0.3 mg/L + 80 g/L 香蕉泥诱导培养基为1/3MS+NAA0.5~1.0毫克/升+6-BA3.0~5.0毫克/升+椰乳15%+蔗糖30克/升+琼脂6克/升,或KC+NAA1.0毫克/升+6-BA5.0毫克/升+椰乳15%+蔗糖20克/升+琼脂6克/升柠檬酸300毫克/升以上培养基p H 均为5.6四、实验步骤与方法(一)花梗腋芽和顶芽组织培养快速繁殖技术蝴蝶兰为总状花序,通常由花梗基部算起在第4或至第7节才会分化花朵。
除最基部一节外,剥开位于该节位以上各节的苞片都可看到腋芽,近顶端的节含有未完全分化的花原始体,花轴基部的芽往往为休眠芽,常具有苞片覆盖,连同花序的顶端,都是花梗腋芽组织培养的好材料。
1.花梗腋芽的培养途径对花梗腋芽有两条培养途径,一是切取带腋芽的花梗茎段培养;二是不带花梗组织剥取茎尖生长点培养。
学生管理制度教学管理制度学分制实施方案一、总则1、为全面贯彻党的教育方针,深化教育教学改革,主动适应科技、经济和社会发展的需要,努力培养应用型人才,我院决定实行学分制。
2、实行学分制旨在调动学生学习的积极性和主动性,充分发挥教师的主导作用,贯彻因材施教的原则。
3、实行学分制是我院教学管理体制和运行机制建设的重要举措,为保证学分制管理的稳步、顺利开展,特制订本实施办法。
二、学制设定本科标准学制为四年、专科标准学制为三年,制定基于标准学制的指导性教学计划。
实施学分制后,本科学生在校学习的年限为4-6年;专科学生在校学习的年限为3-4年。
三、免听、免修与重修经所在系同意,报教务处批准,学生对所选部分课程可免听自学,免听学生可直接参加该课程的考试,成绩绩点达到平均值以上者可取得该课程的学分。
对参加全国或省级比赛获奖的学生或参加并通过社会认可的全国性等级考试的学生,经所在系同意,报教务处批准可免修某门课程。
经两次考试后成绩不合格者一律实行重修,重修的方式可以是跟下一轮课程重修,也可参加由学校专门组织的重修班。
重修考试不合格,可继续申请重修,重修次数不作限制,但总的学习时间不得超过规定的年限。
详见学院“关于课程免听、免修的规定”和“关于补考和重修的管理规定”。
四、辅修制在现行基础上扩大辅修专业比例。
在学制年限内除本专业外凡修满某辅修专业课程规定学分者,可获得该专业辅修专业证明书。
学生修读辅修专业课程按教育成本交费。
辅修制的实行为学生跨学科、跨专业的选课提供了保证,和其它学校联合逐步实现跨学校的选课及互相承认学分。
凡在规定的学制年限内,取得了本专业毕业所需的全部学分之外,又取得了辅修专业教学计划规定的总学分,在获得本专业本科毕业证书及学士学位证书的前提下,对跨学科辅修并达到授位条件者可授予辅修专业学士学位。
五、考核与成绩课程分为考试课,考查课。
考试课成绩按百分制评定。
考查课按优、良、中、及格、不及格五等级考核。