专题1 第1单元 第3课时 物质的聚集状态
- 格式:docx
- 大小:60.24 KB
- 文档页数:4




第3课时物质的聚集状态一、物质的聚集状态及其结构和性质1.物质的聚集状态主要有气态、液态和固态三种。
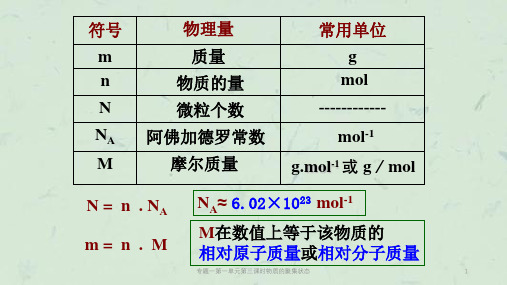
2.不同聚集状态物质的微观结构与性质二、物质体积的影响因素物质体积的大小取决于构成这种物质的粒子数目、粒子大小和粒子之间的距离。
1.固态或液态物质固态或液态物质粒子之间的距离是非常小的,故1 mol固态或液态物质的体积主要取决于粒子的大小,不同的固态或液态物质,粒子的大小是不相同的,因此,1 mol不同的固态或液态物质的体积是不相同的。
2.气态物质对于气体来说,粒子之间的距离远大于粒子本身的直径,所以 1 mol气体的体积主要取决于气体粒子之间的距离。
而在同温同压下,任何气体粒子之间的距离可以看成是相等的,1 mol任何气体都具有相同的体积。
三、气体摩尔体积1.概念:单位物质的量的气体所占的体积。
2.符号及单位:符号为V m,常用单位有L/mol(或L·mol-1)和m3/mol(或m3·mol-1)。
3.气体摩尔体积的数值气体摩尔体积的数值决定于气体所处的温度和压强。
例如标准状况下,气体摩尔体积约为22.4_L·mol-1(较常用);25 ℃和101 kPa的条件下,气体摩尔体积约为24.8 L·mol-1。
4.物质的量(n)、气体体积(V)和气体摩尔体积(V m)的关系为V m=Vn。
四、阿伏加德罗定律内容:同温同压下,相同体积的任何气体都含有相同的分子数。
探究点一气体摩尔体积及相关计算一、标准状况下的气体摩尔体积及有关计算1.标准状况下的气体摩尔体积并不一定只有在标准状况下1 mol气体的体积才是22.4 L,在非标准状况下,1 mol气体也有可能是22.4 L。
2.标准状况下气体体积的计算(1)气体的物质的量n=V 22.4 L/mol(2)气体的摩尔质量M=V m·ρ=ρ×22.4 L/mol(标准状况)(3)气体的分子数N=n·N A=V22.4 L/mol·N A(4)气体的质量m=n·M=V22.4 L/mol·M二、化学方程式中的化学计量数与几个物理量的关系结论:(1)化学方程式中各物质的化学计量数之比等于各物质的分子数之比,等于各物质的物质的量之比,即ν1ν2ν3…=N1N2 N3…=n1n2n3…(2)对于有气体参加的反应,在同温同压下各气体的化学计量数之比等于各气体的体积之比,即ν1ν2ν3…=V1V2V3…1.两种气体体积相同,所含的分子数一定相同吗?提示:不一定。
第三课时物质的聚集状态
—————————————————————————————————————[三级训练·节节过关]
1.相同物质的量的各固体或液体的体积并不相同,其主要原因是()
A.粒子大小不同B.粒子质量不同
C.粒子间距离不同D.粒子的状态不同
2.下列说法正确的是()
A.标准状况下,22.4 L任何气体都约含有6.02×1023个分子
B.含1 mol氦原子的氦气在标准状况下的体积约为11.2 L
C.常温常压下,11.2 L Cl2含有的分子数为0.5N A
D.标准状况下,11.2 L蔗糖含有的分子数为0.5N A
3.下列说法正确的是()
A.常温常压下,22.4 L CO2中含有N A个CO2分子
B.标准状况下,4.48 L CO含有0.2N A个原子
C.22.4 L Cl2中含有N A个Cl2分子
D.标准状况下,1.12 L O2和1.12 L CO2均含0.1N A个氧原子
4.在标准状况下,4 g H2、11.2 L O2、1 mol H2O中,所含分子数最多的是________,含原子数最多的是__________,质量最大的是________,体积最小的是________。
1.下列有关气体体积的叙述中,正确的是()
A.一定温度和压强下,各种气态物质的体积的大小,由构成气体的分子大小决定
B.一定温度和压强下,各种气态物质的体积的大小,由构成气体的分子数决定
C.不同的气体,若体积不同,则它们所含的分子数也不同
D.气体摩尔体积是指1 mol任何气体所占的体积约为22.4 L
2.常温常压下,用等质量的CH4、CO2、O2、SO2分别吹出四个气球,其中气体为CH4的是()
3.下列说法正确的是()
A.1 mol CO和1 mol N2所含分子数相等,质量相等,它们所占的体积也相等
B.22.4 L H2和71 g Cl2恰好反应生成2 mol HCl
C.非标准状况下,1 mol任何气体的体积一定不是22.4 L
D.1 mol HCl在标准状况下的体积约是22.4 L
4.下列说法中,正确的是()
A.1 mol O2和1 mol N2所占的体积都约为22.4 L
B.H2的气体摩尔体积约为22.4 L
C.在标准状况下,1 mol H2和1 mol NaCl所占的体积都约为22.4 L
D.在标准状况下,22.4 L由N2、N2O组成的混合气体中所含有的N的物质的量为2 mol 5.下列说法正确的是(N A表示阿伏加德罗常数的值)()
A.在常温常压下,11.2 L N2含有的分子数为N A
B.标准状况下,4 g H2所占的体积约是22.4 L
C.32 g O2在标准状况下所占的体积约为22.4 L
D.在同温同压下,相同体积的任何气体单质所含的原子数相同
6.在标准状况下,某气体密度为1.25 g·L-1,则该气体的相对分子质量为()
A.12.5B.14
C.28 D.30
7.同温同压下,下列有关比较等质量的二氧化硫气体和二氧化碳气体的叙述中正确的是()
A.密度比为16∶11 B.密度比为11∶16
C.体积比为1∶1 D.体积比为16∶11
8.标准状况下,同质量的气体A和B,已知B的体积大于A,则它们的摩尔质量的关系是()
A.M A=M B B.M A>M B
C.M A<M B D.无法确定
9.某气体由双原子分子构成,它的摩尔质量为M g·mol-1,该气体有m g,阿伏加德罗常数的值用N A表示,则:
(1)该气体的物质的量为________mol;
(2)该气体在标准状况下的体积为________L;
(3)该气体所含原子总数为________个。
10.(1)质量之比为16∶7∶6的三种气体SO2、CO、NO,其分子数之比为________;氧原子数之比为________;相同条件下的体积之比为________。
(2)标准状况下,1.7 g NH3的体积为________L,它与标准状况下________L H2S含有相同数目的H。
(3)某气态氧化物的化学式为RO2。
标准状况下,1.28 g该氧化物的体积为448 mL,则该氧化物的摩尔质量为________,R的相对原子质量为__________。
1.下列叙述正确的是( )
A .1 mol 任何气体的体积都约为22.4 L
B .1 mol 任何物质在标准状况下所占的体积都约是22.4 L
C .标准状况下,1 mol O 2所占的体积约是22.4 L
D .标准状况下,22.4 L 气体的物质的量不一定是1 mol
2.在标准状况下,下列物质占体积最大的是( )
A .98 g H 2SO 4
B .6.02×1023个N 2分子
C .44.8 L HCl
D .6 g H 2
3.在体积相同的两个密闭容器中分别充满O 2、O 3气体,当这两个容器内温度和气体密度相等时,下列说法正确的是( )
A .两种气体的压强相等
B .O 2比O 3的质量小
C .两种气体的分子数目相等
D .两种气体的氧原子数目相等
4.设阿伏加德罗常数的数值为N A ,标准状况下m g O 2和N 2的混合气体含有b 个分子,则n g 该混合气体在相同状况下所占的体积应是( )
A.22.4nb mN A L
B.22.4mb nN A
L C.22.4nN A mb L D.nbN A 22.4m
L 5.同温同压下,具有相同体积的任何气体中含有的分子数相同。
在一定温度和压强下,10体积气体A 2跟30体积气体B 2化合生成20体积某气体C ,则气体C 的化学式为( )
A .AB
B .A 2B
C .AB 3
D .AB 2
6.在同温同压下,某集气瓶充满O 2时为116 g ,充满CO 2时为122 g ,充满气体A 时为114 g ,则A 的相对分子质量为( )
A .44
B .32
C .28
D .17
7.下列关于a g H 2和b g He 的说法正确的是( )
A .同温同压下,H 2和He 的体积比是a ∶2b
B .同温同压下,若a =b ,则H 2与He 的物质的量之比是1∶1
C .体积相同时,He 的质量一定大于H 2的质量
D .同温同压下,若二者的物质的量相等,其体积也相等
8.在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强
均相同,且甲的密度大于乙的密度,则下列说法正确的是()
A.甲的分子数比乙的分子数多
B.甲的物质的量比乙的物质的量少
C.甲的摩尔体积比乙的摩尔体积小
D.甲的相对分子质量比乙的相对分子质量小
9.对一定量气体体积的探究。
(1)已知1 mol不同气体在不同条件下的体积:
(2)从上表分析得出的结论:
①1 mol任何气体,在标准状况下的体积都约为______。
②1 mol不同的气体,在不同的条件下,体积__________(填“一定”“一定不”或“不一定”)相等。
(3)理论依据:相同条件下,1 mol任何气体的体积几乎相等,原因是:
①________________________________________________________________________,
②________________________________________________________________________。
(4)应用:在标准状况下,4 g O2的体积为多少升?(写出计算过程)
(3)①气体分子数目相等②相同条件下,气体分子间距离几乎相等
(4)V(O2)=n·V m=m
M·V m=
4 g
32 g·mol×22.4 L·mol
-1=2.8 L。
10.CO和CO2的混合气体18 g,完全燃烧后测得CO2体积为11.2 L(标准状况),则:
(1)混合气体中CO的质量是________g;
(2)混合气体中CO2在标准状况下的体积是________L;
(3)混合气体在标准状况下的密度是________g·L-1。