酚与醌
- 格式:doc
- 大小:458.50 KB
- 文档页数:22




醌化反应可逆反应概述说明以及解释1. 引言1.1 概述醌化反应是一种常见的有机化学反应,其反应物为酚类化合物和氧气或者有机过氧化物。
它通过加氧作用将酚类化合物氧化生成对应的醌。
与许多有机反应不同的是,醌化反应具有可逆性,即在适当的条件下,可以将醌还原为酚。
1.2 文章结构本文将从以下几个方面全面介绍和解释醌化反应的可逆性。
首先,我们将对醌化反应的基本原理进行阐述,包括反应机制和影响因素等内容。
然后,我们将探究实验设计及其结果分析以验证该反应的可逆性。
接下来,我们将深入讨论该反应在工业领域、生物化学领域以及环境影响研究中的重要意义和广泛应用。
最后,在总结主要结论的同时,我们也会提出目前存在的问题,并展望未来可能的研究方向。
1.3 目的该文旨在全面了解和探究醌化反应的可逆性,并为读者提供关于该领域内最新研究的综述。
通过对反应原理、实验验证和应用意义等方面的深入讨论,我们希望能够揭示醌化反应可逆性的机制,为更好地理解和利用该反应在化学领域中的作用提供指导和启示。
2. 醌化反应:2.1 反应原理:醌化反应是一种在有机化学中常见的重要反应类型。
其基本原理是通过将有机物中的羟基(-OH)氧化为对应的醌基(=O),从而实现有机物的转化。
具体而言,醌化反应是通过羟基上的脱氢作用完成的,将羟基上的氢原子去除并与其他官能团结合,生成一个含有酮基(C=O)和亚胺键形式的产物。
2.2 反应条件:醌化反应通常需要一定的温度和催化剂存在下进行。
常见的催化剂包括过氧化合物、金属离子和马来酰亚胺等。
此外,反应溶剂也是影响醌化反应进行与否及产率的重要因素。
不同的官能团在不同的温度范围内对于醌化反应具有不同的敏感性,因此,在设计和优化条件时需要根据具体目标分子进行调整。
2.3 可逆性解释:传统意义上,醌化反应被认为是一个不可逆的过程。
然而最新研究发现,在特定条件下,例如加入辅助剂或在低温下进行反应等,醌化反应可以被逆转。
这种可逆性可以通过控制消耗氧气的速率、改变催化剂的浓度和引入还原剂等方式实现。

酚氧化生成醌的催化研究酚是一种重要的有机化合物,它在医药、化妆品、染料等领域有广泛的应用。
然而,酚的化学性质和稳定性都较差,容易发生氧化反应并产生副产品。
因此,开展酚的催化研究十分必要。
本文将围绕“酚氧化生成醌的催化研究”展开阐述。
第一步,酚的氧化反应机理。
酚在空气中接触氧气,经历一个氧化反应,生成醌。
氧化反应的过程中,酚损失一个电子,形成自由基。
自由基与氧气反应,生成酚的氧化产物——醌。
醌是一种含有两个羟基的化合物,它比酚更加稳定,不易被氧化。
第二步,催化酚氧化反应的方法。
酚氧化反应常常需要催化剂的参与。
常用的催化剂包括金属离子、过渡金属化合物、氧化物等。
催化剂具有提高反应速率、增强反应选择性等作用。
第三步,酚氧化反应的应用。
酚氧化反应在农药、药物合成、香料、颜料等方面有着广泛的应用。
例如,人工合成抗生素需要进行酚氧化反应,生成双酚A,再经过催化反应生成波多霉素。
另外,酚氧化还被用于颜料的制备。
例如氧气氧化苯酚可以得到醌类颜料,其中苯醌主要应用于油墨、涂料等领域。
第四步,酚氧化反应存在的问题。
酚氧化反应常常伴随着强烈的自由基引发副反应,引起化学反应的不确定性。
另外,酚氧化反应难以控制,特别是在反应温度、反应物质量等条件变化的情况下,产物选择性难以保证。
因此,酚氧化反应的优化、改进是一个重要的研究方向。
综上所述,酚氧化生成醌的催化研究在化学领域具有广泛的应用前景。
然而,酚氧化反应的不确定性和选择性问题也需要我们继续加以探究。
未来,我们需要继续加大研究力度,不断提高催化剂的效率和选择性,推动酚氧化反应技术创新和发展。



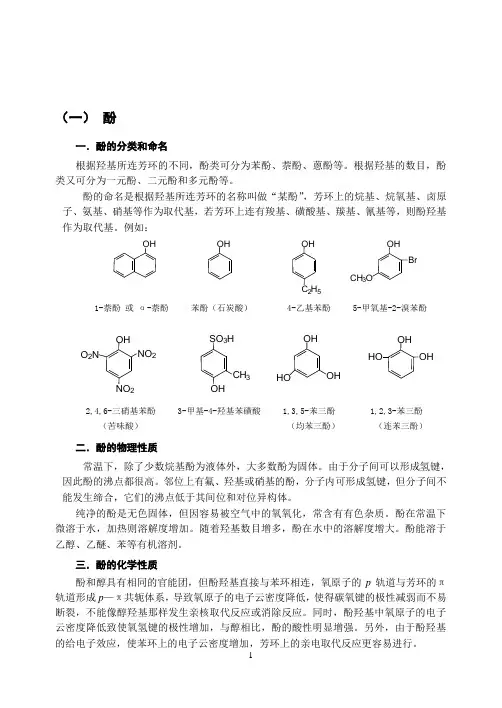
(一) 酚一.酚的分类和命名根据羟基所连芳环的不同,酚类可分为苯酚、萘酚、蒽酚等。
根据羟基的数目,酚类又可分为一元酚、二元酚和多元酚等。
酚的命名是根据羟基所连芳环的名称叫做“某酚”,芳环上的烷基、烷氧基、卤原子、氨基、硝基等作为取代基,若芳环上连有羧基、磺酸基、羰基、氰基等,则酚羟基作为取代基。
例如:1-萘酚 或 α-萘酚 苯酚(石炭酸) 4-乙基苯酚 5-甲氧基-2-溴苯酚2,4,6-三硝基苯酚 3-甲基-4-羟基苯磺酸 1,3,5-苯三酚 1,2,3-苯三酚 (苦味酸) (均苯三酚) (连苯三酚)二.酚的物理性质常温下,除了少数烷基酚为液体外,大多数酚为固体。
由于分子间可以形成氢键,因此酚的沸点都很高。
邻位上有氟、羟基或硝基的酚,分子内可形成氢键,但分子间不能发生缔合,它们的沸点低于其间位和对位异构体。
纯净的酚是无色固体,但因容易被空气中的氧氧化,常含有有色杂质。
酚在常温下微溶于水,加热则溶解度增加。
随着羟基数目增多,酚在水中的溶解度增大。
酚能溶于乙醇、乙醚、苯等有机溶剂。
三.酚的化学性质酚和醇具有相同的官能团,但酚羟基直接与苯环相连,氧原子的p 轨道与芳环的π轨道形成p —π共轭体系,导致氧原子的电子云密度降低,使得碳氧键的极性减弱而不易断裂,不能像醇羟基那样发生亲核取代反应或消除反应。
同时,酚羟基中氧原子的电子云密度降低致使氧氢键的极性增加,与醇相比,酚的酸性明显增强。
另外,由于酚羟基的给电子效应,使苯环上的电子云密度增加,芳环上的亲电取代反应更容易进行。
OH OH OH 2H 5OHBrCH 3OOHOHOHNO 2O 2N2SO 3H CH 3HOOHHOOH苯酚中p-π共轭示意图综上所述,酚的主要化学性质可归纳如下:1.酸性酚类化合物呈酸性,大多数酚的pKa 都在10左右,酸性强于水和醇,能与强碱溶液苯酚的酸性比碳酸弱,能溶于碳酸钠溶液,但不能溶于碳酸氢钠溶液,在苯酚钠的溶液中通入二氧化碳能使苯酚游离出来。

OHH 3CCH 3第十章 酚、醌羟基直接连接在芳环上的化合物称为酚(phenols )(Ar-OH), 该羟基称为酚羟基,以区别于醇羟基。
如下面两个化合物互为构造异构体,第一个化合物(羟基不是直接连在苯环上)属醇类化合物,第二个化合物属酚类化合物。
CH 2OHCH 3p -甲基苯甲醇 2,6-二甲基苯酚酚很容易被氧化成环状的不饱和二酮,我们把这种特殊的酮叫做醌(quinones )。
这两类化合物均是重要的工业原料,有许多具有很强的生理活性,有的甚至是生物体内不可缺少的,下面分别加以讨论。
第一节 酚一、结构和命名苯酚是平面分子,C -O键的键长比甲醇中的C -O键短。
偶极方向与甲醇的相反。
136pmH 3142pmH 3Cμ = 1.6D 1.7D苯酚和甲醇碳氧键长的差别是由于前面章节已提及过的其成键轨道的s 成分越多,键长越短;另外是由于苯酚氧原子的未共用电子对所占有p 轨道和苯酚π轨道共轭,氧上的未共用电子对可离域到苯环上,它的真实结构可用共振式表示:(1) (2) (3) (4)(1)最稳定,对共轭杂化体的贡献最大,(2)(3)和(4)式中有电荷的分离,虽不稳定,但对共振杂化体亦有较少的贡献。
因此碳氧间亦有部分双键的特征,使键长缩短,C-O键不易断裂,羟基不易被取代。
在甲醇中,羟基是吸电子基,偶极方向指向羟基。
但在苯酚中,由于羟基通过共轭对苯环所起的给电子作用超过了它对苯环的吸电子诱导作用,所以偶极方向指向苯环。
根据芳环上所连羟基的数目,可把酚类分为一元酚,二元酚,三元酚……,但常把含有一个以上羟基的酚称为多元酚。
命名时,都以苯酚(萘酚,蒽酚等)作为母体,它们的英文名都是以-ol结尾,如苯环上连接有其它取代基则可看作是苯酚的衍生物。
对于多元酚只须在“酚”字前面用二、三……等表示羟基的数目,并用阿拉伯数字1,2,3……等表明羟基和其它基团所在的位次。
例如:OH OHCH3苯酚4-甲(基)苯酚4-methyl phenolphenol 或对-甲基苯酚p-methyl phenolOHOH2-萘酚2-naphthalenol 9-蒽酚9-anthrol或β-萘酚β-naphthol 或γ-蒽酚γ- anthrol 多元酚类似于多元醇的系统命名。
多酚形成醌
多酚是一类具有多个酚羟基的化合物,其在生物体内具有重要的
生理功能。
多酚可以通过氧化反应形成酌物,这一过程被称为“多酚
形成醌”。
多酚形成醌是多酚生物活性的重要途径,而醌物则因其具
有良好的抗氧化性被广泛运用于药物、食品和护肤品等领域。
多酚形成醌的过程可以分为四步:
第一步,多酚在受到适当的诱导剂或氧化剂作用后失去一个或多
个电子,形成具有自由基性质的多酚单元。
这个步骤通常称为“引发”步骤。
第二步,由于多酚单元的极性特征,它容易发生互相作用,发生
交联、缩合等化学反应,生成高分子量的多酚聚合物。
在这个阶段中,还可能出现多酚与蛋白质的复合物形成,这样的反应会改变蛋白质的
构象和活性。
第三步,多酚聚合物进一步发生氧化反应,使其中的醚键、芳香
环等化学键结构发生断裂,而成为酌物。
酌物的一个特征就是存在碳
醌和氧醌两种结构,其中碳醌比氧醌更稳定。
第四步,酌物能够进一步反应,发生还原还原成多酚。
这个过程
被称为“消解”步骤,它使多酚生物活性得以再次体现。
多酚形成醌是多酚生物活性的最终表现形式之一。
以茶多酚为例,多酚形成醌后,具有更强的抗氧化、抗衰老、抗炎症等多种生理功能,这些功能也是茶多酚被广泛应用于食品、化妆品等领域的原因之一。
总之,多酚形成醌是一种复杂的生化反应过程,这个过程不仅能
够改变多酚的生物活性,而且还能够制备出具有强抗氧化性能的高分
子化合物。
随着对多酚形成醌和多酚生物活性的研究不断深入,相信
未来还会有更多的应用领域得到开拓。
第十章酚与醌参考答案(一)教材练习题10.1 苯酚解离形成苯氧负离子,氧原子上的负电荷可通过与苯环的p- 共轭而得以有效分散,使苯氧负离子趋于稳定。
环己基氧负离子中氧原子与sp3杂化碳原子相连,无共轭作用,稳定性较小。
10.2 当硝基与酚羟基处于邻位或对位时,硝基除了表现出强的吸电子诱导效应外,还能够通过强的吸电子共轭效应使得苯氧负离子的负电荷离域到硝基的氧原子上,因此使得其酸性大大增强。
在间硝基苯氧负离子中,氧原子上的负电荷不能通过共轭效应得到分散,只有硝基的强吸电子诱导效应发挥分散电荷的作用,因此间硝基苯氧负离子虽然比苯氧负离子稳定,但不如邻、对位异构体稳定。
10.3 用(3)最佳。
由教材表10-1查知对甲基苯酚和2,4-二硝基苯酚的p K a值分别为10.17和3.96,故最佳条件应在两者之间。
此时对甲基苯酚溶于有机相而2,4-二硝基苯酚呈负离子状态溶于水相中。
10.4 间位取代苯酚。
因为邻对位取代基除诱导效应外,还可能有共轭效应。
10.5OO O10.6O HCHCHCH2CH310.7 酚羟基能与三氯化铝形成配合物,所以三氯化铝需要大过量。
10.8 不能。
因为苯酚结构单元容易被氧化成醌。
10.9 因为苯酚容易被空气中的氧氧化为对苯醌而显粉红色。
可采取重结晶法提纯。
10.10H3C O2H3COSO2-N O2H3210.11 苯和萘的芳香性较强,比较稳定。
而蒽和菲的芳香性较差,9,10位比较活泼,容易被氧化。
10.12O O O H O H(二)教材习题 1.O HCH 3(H 3C )2H CCH 2CHH OC H 2H 3C OCO O HO HO HH O(1)(2)(3)(4)3-乙基-4-硝基苯酚 (5)4-苄基-2-氯苯酚 2.O C H 2CHO C H 3C H 2O CH 2C H CH 2O HO H(1)(2)OO OO(3)O HO CH 2C H 3N O 2B r(4)(6)C O O H O CCH 3OCH 3O HCH (CH 3)2H 3CC(5)H 3CC H 3OOO HO HN HH N+O HO H(7)(8)3.(1)(B ) > (C ) > (A ) (2)(C ) > (B ) > (E ) > (F ) > (D ) > (A )4.氟的吸电子诱导效应强于给电子的共轭效应,因此三种氟苯酚的酸性均比苯酚强。
第十七章 酚和醌 Phenols and Quinones本章目录17.1 酚的结构与命名 17.2 酚的制备17.3 苯酚及其衍生物的反应 一、酚的酸性二、成醚反应和Claisen 重排 三、成酯反应和Fries 重排四、酚芳环上的亲电取代反应 五、酚的氧化与芳醚的Birch 还原 六、与FeCl 3的显色反应 17.4 萘酚 17.5 多元酚 17.6 醌酚是羟基与芳环直接相连的化合物的总称,通式为:ArOH ,根据芳环上连有的羟基数目,酚分为:一元酚、二元酚和多元酚。
17.1 酚的结构与命名一、结构:典型的酚为苯酚,其结构类似于烯醇,也有烯醇与酮式的互变:OO23s p羟基对苯环有吸电子诱导和给电子共轭,其+C>-I ,偶极矩μ=1.6D ,其方向由羟基到苯环。
共轭的结果可用其共振式表示如下:+OH +OH +--共轭的结果使酚羟基容易解离出H +:O--O --+H +比较酚及其负离子的共振结构,结果表明:共振对酚盐负离子的稳定性更强,因此,酚可解离,表现酸性。
酚羟基的共振使其邻对位电子云密度增大,故酚的芳环易于发生亲电取代,且主要发生在羟基的邻对位。
二、命名按官能团的排列顺序,有两种情况:1、当酚羟基为官能团时,命名为芳酚,其它基团作为取代基。
含两个羟基称二酚,三个羟基称三酚,如:OHCH 3OH OHOHOHOHOH苯酚(石炭酸) 间甲苯酚 5-甲基-2- 邻苯二酚 间苯二酚异丙基苯酚 (儿茶酚) (雷琐酚)phenol m-cresol resorcinolO HHO HH OO HO HO H O HO H对苯二酚 间苯三酚 连苯三酚 β-萘酚 氢醌 (根皮酚) (焦焙酚) β-haphthol 2、酚羟基作为取代基:O H C O O HO HOHC H OSO 3H对羟基苯甲酸 3-羟基-4-甲基苯甲醛 5-羟基-1-萘磺酸三、酚的物理性质和光谱性质苯酚:低熔点无色固体(mp :40.3℃),具有特殊气味,显酸性。
1834年龙格Lunge 在煤焦油中发现,俗称石炭酸。
空气中久置变成粉红色,长时间放置变深棕色。
部分溶于冷水8g/100g 水、25℃,与热水互溶。
易溶于醇和醚。
有强腐蚀性,有一定的杀菌能力。
用于防腐和消毒剂。
在工业上用途极广,可用于制备酚醛树脂、离子交换树脂、合成纤维、染料、药物、炸药等。
其它酚与苯酚相似,大多为低熔点固体或高沸点的液体。
甲苯酚的各种异构体的混合物称甲酚,可用于消毒。
“来苏水”即为甲酚与肥皂的混合液。
酚类具有杀菌防腐作用。
光谱性质:IR :与醇相似,在极稀溶液中测定,未缔合羟基在3640~3600cm -1有一尖锐的伸缩振动峰,缔合羟基在3500~3200cm -1有一宽的吸收峰。
C -O 伸缩振动在1300~1200C -O 处。
NMR :酚氢的化学位移值受温度、浓度、溶剂的影响很大,约4~8ppm ,缔合氢δ值为10.~16ppm.17.2 酚的制备酚的工业来源为煤焦油,但含量有限,常用合成法生产,主要有以下几种方法:一、苯磺酸盐碱熔法最早的制酚方法,反应在高温下进行。
SO 3HSO 3NaNa 2SO 3SO 2ONa OHNaOH(s)320~350022OHSO 3Na NaOH0HCl优点:产率高缺点:操作工序多,不易连续化生产,耗用大量的硫酸和NaOH ,腐蚀设备,反应温度高。
二、氯苯水解法氯苯在高温、高压和催化剂作用下,可用稀碱(6~8%)水解得苯酚钠,酸化得苯酚。
C 0O HO N aC lC u+N a O HH C l20M P a副产物:二苯醚、邻、对位苯基苯酚。
改进法:氧化氯化法。
唯一采用气相反应生成苯酚的方法,20世纪20年代开始在美国生成(Dow 和Booker公司)。
OHCl+HCl+1/2O 2+230CH 2O(g)Cu/Ca 3(PO 4)2400~4500C氧氯化优点:经济,可连续生产。
卤素的邻对位有强吸电子基时,水解反应可在较温和的条件下进行。
三、异丙苯法异丙苯在液相中于100~120℃通入空气,催化氧化生成过氧化氢异丙苯(CHP ),再与稀硫酸作用发生重排,分别生成苯酚和丙酮。
优点:原料来源丰富,经济合理,未反应的异丙苯可循环使用。
丙酮是重要的工业原料,每生产一吨苯酚可得到600kg 的丙酮,总产率为~60%。
四、重氮盐法重氮盐水解得酚;也可把重氮盐转化成羧酸酯,然后再水解成酚,这样产率较高。
Ph -NH 2 + HNO 2 → Ph -N 2+Cl -+ H 2O → Ph -OH五、格氏试剂-硼酸酯法由于卤苯水解困难,可先将其转变为格氏试剂,再与硼酸三甲酯反应,生成芳基硼酸二甲酯,酯水解得芳基硼酸,芳基硼酸在醋酸水溶液中,用15%过氧化氢小心水解,可制得酚。
OB(OH)MgBrB(OCH 3)2B(OCH )-8015%H 2O 2CH 3COOH 270%六、芳烃直接氧化法由于酚很容易被氧化,因此,用芳烃直接氧化得酚往往得不到预期的酚。
但某些芳烃在合适条件下可得到较好结果,如1,2,3,5-四甲基苯在CH 2Cl 2中,在BF 3作用下,与三氟过乙酸反应,得2,4,6-三甲基苯酚。
OH+CF 3CO 3H BF 3CH 2Cl2-40~70C+CF 3COOH甲苯在一定温度和压力下用Co 催化氧化生成苯甲酸,苯甲酸脱羧生成苯酚,由美国Dow 化学公司开发出来。
OHCH 3COOHH 2OCo,P,七、芳香铊盐的置换水解法芳烃用三氟乙酸铊(TTFA,Thallium trifluoroacetate )铊化,得芳基三氟乙酸铊盐,然后用铅盐处理取代铊,进一步转化为芳基三氟乙酸芳基酯,在碱性溶液中水解,得酚。
如对繖花烃经铊化、氧化、水解得香芹酚。
CH 33)2CH 3CH 9CH 3)2Ti(OCOCF 3)2CH 3CH(CH 3)2OHCH 3CH(CH 3)2OCOCF 3TTFA 4Ph 3PHCl/H 2O NaOH/H O香芹酚反应特点:1、 反应稳定低,速率快。
2、 铊化主要发生在取代基的对位,因此可得到对位异构体。
(异构体控制)3、 三苯基膦把氧化性的三价铊还原为无氧化能力的一价铊;四价铅被还原成二价铅。
稀盐酸可沉淀出一价铊和二价铅,利于分离。
17.3 苯酚及其衍生物的反应羟基与芳环相连,羟基氧与苯环共轭,两者相互影响,其结果:芳环使羟基酸性增强,而羟基使芳环上电子云密度增大,使芳环容易发生亲电取代反应。
酚的衍生物还能发生一些特殊的重要反应。
结构与性质:a c i d it yc i t y a nd n uc le o p hi l i c o ,m ,pe l ec t r o p hi l i c su b s t it u t i o n o x i d a ti o n一、酚的酸性酚具有酸性,其pKa 值为10,介于水(15.7)和碳酸(6.4)之间。
当在浑浊的苯酚水溶液中加入5%NaOH 溶液,则溶液澄清,当在澄清溶液中通入CO 2后,溶液又变浑浊。
利用这一现象可鉴别苯酚。
苯酚衍生物酸性的影响因素:(1)主要取决于芳环上取代基的电子效应(诱导和共轭)。
如:OHNO 2NO 2OH2OHNO 2NO 2OHNO 2NO 2O 2NOHOHpKa/250C9.94 7.22 8.39 7.15 4.09 0.25ClOH OHpKa/250COH OCH 3OH3OH9.02 9.38 9.65 10.21 9.94即:苯环上的吸电子基减少了苯环上的电子云密度,酚解离后形成的负离子电荷可以得到有效地分散,而稳定;而给电子基团则增大了苯环上的电子云密度,使酚解离后形成的负离子电荷不能有效分散,酚盐负离子不稳定,氢不易于解离,酸性减弱。
(2)酚羟基邻位取代基的空间位阻。
酚羟基邻位有空间位阻很大的取代基时,由于酚氧负离子ArO -的溶剂化受阻而使其酸性减弱,如2,4,6-三新戊基苯酚的酸性很弱,不能与强碱Na/NH 3溶液反应。
OHCH 2C(CH 3)3CH 2C(CH 3)3(CH 3)3CCH 23二、成醚反应和Claisen 重排酚盐负离子能作为亲核试剂参与反应,如:与卤代烃反应发生烷基化,与重氮甲烷反应发生甲基化生成芳醚,等,反应可在水、醇、或醚等有机溶剂中进行。
O HN a O H O Nao r22O C H3O RO H O C H3C H2N2+N2讨论:1、不活泼的卤代芳烃、烯卤不能作为酚O-烷基化试剂。
但邻对位有强吸电子基的卤代芳烃可与醇钠反应生成芳醚。
ClNO2 NO2NO2NO2OCH3CH3ONa芳环上的亲核取代反应2、二甲基硫酸酯毒性大,使用时注意防护。
3、重氮甲烷作甲基化试剂,条件温和,产率高。
但价格高、毒性大,不宜大量使用,常用于稀有酚的甲基化。
芳基烃基醚的性质:1、酸性分解:与脂肪醚相似,芳基烃基醚也可在酸性条件下被氢碘酸HI分解,生成酚和碘代烷。
O C H3H I O H+C H3I2、催化氢解:在钯或铂催化条件下,有的芳基醚很容易氢解,如芳基苯甲醚:OCH2CH2PhH2OH+Pd or PtPhCH3若分子中有杂原子与苯甲基相连,如苯甲醇、苯甲酸酯、苯甲型胺、卤甲基苯等均易被还原为烃。
3、Claisen重排烯丙基芳基醚在高温下重排为邻烯丙基酚,邻烯丙基酚可以进一步重排为对烯丙基酚的反应称Claisen重排。
O C H2C H=C*H2α β γ2o o0CO HC*H2C H=C H2γ β γC02o oO HO C H2C H=C*H2α β γ反应机理:(分子内重排,环状过渡态机理)OαβOHOHααββγγ[3,3]-σ迁移 (互变异构) [3,3]-σ迁移讨论:1、取代烯丙基重排时,无论双键的构型是Z 或E ,重排后总是生成E 构型。
这是由于反应经过的六元环过渡态具有稳定的椅式构象。
2、当其两个邻位均被其它基团所占据,重排发生在对位。
若邻对位均被占据,重排反应不发生。
3、Claisen 重排具有普遍性,也可发生于其它化合物中,如烯丙氧基化合物CH 2=CHCH 2O -CH=CH 2 → CH 2=CH CH 2CH 2CH=O 。
三、成酯反应和Fries 重排与醇不同,酚需在酸、碱催化下,与活泼的酰化试剂――酰卤或酸酐反应形成酯。
在特殊仪器中,也可使酚直接与羧酸酯化。
如:OHOCOR OCOCH 3OCOCH 3催化剂:酸——硫酸、磷酸;碱——碳酸钾、吡啶等。
Fries,K 重排:酚酯类化合物在Friedel-Crafts 催化剂(如AlCl 3,ZnCl 2,FeCl 3等)路易斯酸催化下,发生酰基重排,生成邻、对位酚酮的混合物的反应。
1、反应:OCOCH 3OHCOCH 3+O C O C H 2ClHOOHHOCOCH 2ClAlCl 3CS 2氯乙酰儿茶酚OH HOn +n OCOO n+2nHCl双酚A 光气 聚碳酸酯2、反应机理:分子间重排(交叉实验证明)OCOR AlCl 3O +AlCl 3-COROAlCl 3-+COR-H +OAlCl 3-COR+OAlCl 3-H +AlCl 3OH+OHCOR3、影响因素:(1)酯的结构:迁移基团可以是烷基或芳基,苯环上有间位定位基时不利于重排反应的进行。