有机化学酚和醌
- 格式:ppt
- 大小:1.11 MB
- 文档页数:44

有机化学第十九章酚和醌•酚的概述和性质•醌的概述和性质•酚和醌的合成方法•酚和醌的反应机理•酚和醌的分析方法•酚和醌的生理活性和应用酚的概述和性质01酚的定义和分类定义酚是一类具有羟基(-OH)直接连在芳香环上的有机化合物。
分类根据芳香环的类型和取代基的不同,酚可分为苯酚、萘酚、蒽酚等。
外观大多数酚为无色或淡黄色的结晶或液体。
溶解性酚易溶于有机溶剂,如乙醇、乙醚等,部分溶于水。
熔沸点酚的熔沸点一般较高,且随着分子量的增加而升高。
酸性酚具有弱酸性,能与强碱反应生成酚盐。
氧化反应酚易被氧化,如苯酚在空气中放置会逐渐氧化为粉红色。
取代反应酚羟基上的氢原子可被卤素、硝基等取代,生成相应的卤代酚、硝基酚等。
缩合反应酚可与醛、酮等发生缩合反应,生成具有特殊香味的缩醛或缩酮。
醌的概述和性质02醌的定义和分类定义醌是一类含有两个羰基(=O)的有机化合物,通式为R-CO-CO-R'。
分类根据取代基的不同,醌可分为苯醌、萘醌、菲醌等。
03熔点与沸点醌类化合物的熔点和沸点较高,且随着分子量的增加而升高。
01外观大多数醌为黄色或橙色结晶或粉末。
02溶解性醌类化合物一般易溶于有机溶剂,如乙醇、乙醚、氯仿等,难溶于水。
缩合反应在碱性条件下,两分子醌可发生缩合反应,生成具有共轭结构的二酮类化合物。
氧化还原反应醌类化合物具有较强的氧化性,可被还原剂(如钠、锌等)还原为对应的酚。
同时,它们也能与氧化剂(如酸性高锰酸钾)发生氧化反应。
加成反应在特定条件下,如催化加氢或烷基化反应中,醌类化合物可发生加成反应,生成相应的醇或醚。
取代反应醌类化合物的羰基活性较高,易发生亲核取代反应,如卤代、硝化、磺化等。
酚和醌的合成方法03芳香烃磺化法芳香烃与浓硫酸在高温下反应,生成芳香磺酸,再经水解得到酚。
芳香烃硝化法芳香烃与硝酸在低温下反应,生成芳香硝基化合物,再经还原得到酚。
芳香烃卤化法芳香烃与卤素在光照或高温下反应,生成芳香卤代烃,再经水解得到酚。


第一部分名校考研真题第11章酚和醌一、选择题1.下列化合物碱性最强的是()。
[中国科学院-中国科学技术大学2001研]【答案】(A)【解析】酚的碱性与酚羟基上氧的孤对电子有关,氧原子上的电子云密度越大,碱性越强。
氰基、溴原子都为吸电子基,使氧原子上电子云密度降低。
2.下列化合物中,酸性最强的是()。
[天津大学2000研]【答案】(D)【解析】硝基为吸电子基,使邻、对位的电子云密度降低,使酚羟基的酸性增强。
3.下列物种作为离去基团时最易离去的是()。
[大连理工大学2004研]【答案】(A)【解析】硝基为吸电子基,使负电荷得以分散,故(A)最稳定,作为离去基团,最易离去。
二、简答题1.为什么?[上海大学2004研]答:甲氧基的给电子共轭效应使对位电子云密度增大,从而使对位酚羟基的酸性减弱,而间位甲氧基只有吸电子的诱导效应而无给电子的共轭效应,故间甲氧基苯酚的酸性比对甲氧基苯酚强。
2.从反应机理说明为什么烷芳混合醚(ArOR)在与氢碘酸共热时,只得到RI和ArOH,而不是ArI和ROH。
[南京大学2002研]答:醚与氢碘酸共热时先生成烊盐,然后发生碳氧键的断裂,生成醇和碘代烷。
对于混合醚,碳氧键断裂的顺序为:三级烷基>二级烷基>一级烷基>芳基,芳基与氧的孤对电子共轭,因此烷芳混合醚与氢碘酸共热时,芳基与氧相连的碳氧键没有断裂,烷基与氧相连的碳氧键断裂,产物为酚和碘代烷。
3.化合物(A)和(B)中哪个酸性较强?(C)和(D)相比较呢?简述理由。
[华东理工大学2003研]答:硝基的吸电子共轭效应,使邻、对位电子云密度降低,酚羟基的酸性增强,故酸性(B)>(A);甲基的立体效应使(C)中硝基的π-π共轭效应减弱。
化合物(A)和(B)中酸性(B)>(A);化合物(C)和(D)中酸性(D)>(C)。
甲基的立体效应使(C)中硝基的共轭效应减弱。
4.以苯以及必要的有机、无机试剂为原料合成3,4,5-三溴苯酚。
[武汉大学2002研]答:酚羟基为邻对位定位基,若先合成苯酚,再溴化将得到2,4,6一三溴苯酚,而题目要求合成3,4,5一三溴苯酚,故必须借助氨基的定位效应来定位,然后通过重氮化来完成目标产物的合成。

第19章酚和醌
一、选择题
下列化合物进行亲电取代反应最容易的是()。
A.苯酚
B.苯乙酮
C.苯
D.甲苯
【答案】A
二、填空题
写出下列化合物酸度增强顺序。
A.苯酚
B.4-乙酰苯酚
C.2-乙酰苯酚
【答案】A<C<B
三、简答题
1.环己醇中混有少量的苯酚,试除去之。
答:加氢氧化钠溶液振荡,使苯酚溶在氢氧化钠溶液中而除去。
2.2,4,6-三叔丁基苯酚在乙酸溶液中与溴反应,生成化合物(A),分子式为,产率几乎是定量的。
(A)的红外光谱中在1630cm-1和1650cm-1处有吸收峰,谱有三个单峰,其面积比为9:18:2,试推测(A)的结构。
答:2,4,6-三叔丁基苯酚的环上电子云密度较高,很容易在酸性条件下与溴发生下列反应:
3.请设计出分离“对甲基苯酚、间硝基苯甲酸、邻二甲苯”混合物的流程图。
答:
4.由苯酚及不超过4个碳原子的有机化合物和其他必要试剂为原料,合成局部麻醉。
答:。
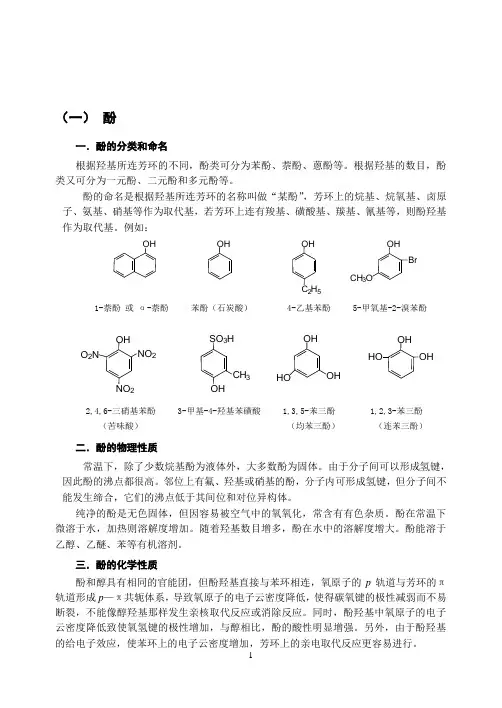
(一) 酚一.酚的分类和命名根据羟基所连芳环的不同,酚类可分为苯酚、萘酚、蒽酚等。
根据羟基的数目,酚类又可分为一元酚、二元酚和多元酚等。
酚的命名是根据羟基所连芳环的名称叫做“某酚”,芳环上的烷基、烷氧基、卤原子、氨基、硝基等作为取代基,若芳环上连有羧基、磺酸基、羰基、氰基等,则酚羟基作为取代基。
例如:1-萘酚 或 α-萘酚 苯酚(石炭酸) 4-乙基苯酚 5-甲氧基-2-溴苯酚2,4,6-三硝基苯酚 3-甲基-4-羟基苯磺酸 1,3,5-苯三酚 1,2,3-苯三酚 (苦味酸) (均苯三酚) (连苯三酚)二.酚的物理性质常温下,除了少数烷基酚为液体外,大多数酚为固体。
由于分子间可以形成氢键,因此酚的沸点都很高。
邻位上有氟、羟基或硝基的酚,分子内可形成氢键,但分子间不能发生缔合,它们的沸点低于其间位和对位异构体。
纯净的酚是无色固体,但因容易被空气中的氧氧化,常含有有色杂质。
酚在常温下微溶于水,加热则溶解度增加。
随着羟基数目增多,酚在水中的溶解度增大。
酚能溶于乙醇、乙醚、苯等有机溶剂。
三.酚的化学性质酚和醇具有相同的官能团,但酚羟基直接与苯环相连,氧原子的p 轨道与芳环的π轨道形成p —π共轭体系,导致氧原子的电子云密度降低,使得碳氧键的极性减弱而不易断裂,不能像醇羟基那样发生亲核取代反应或消除反应。
同时,酚羟基中氧原子的电子云密度降低致使氧氢键的极性增加,与醇相比,酚的酸性明显增强。
另外,由于酚羟基的给电子效应,使苯环上的电子云密度增加,芳环上的亲电取代反应更容易进行。
OH OH OH 2H 5OHBrCH 3OOHOHOHNO 2O 2N2SO 3H CH 3HOOHHOOH苯酚中p-π共轭示意图综上所述,酚的主要化学性质可归纳如下:1.酸性酚类化合物呈酸性,大多数酚的pKa 都在10左右,酸性强于水和醇,能与强碱溶液苯酚的酸性比碳酸弱,能溶于碳酸钠溶液,但不能溶于碳酸氢钠溶液,在苯酚钠的溶液中通入二氧化碳能使苯酚游离出来。






醌化反应可逆反应概述说明以及解释1. 引言1.1 概述醌化反应是一种常见的有机化学反应,其反应物为酚类化合物和氧气或者有机过氧化物。
它通过加氧作用将酚类化合物氧化生成对应的醌。
与许多有机反应不同的是,醌化反应具有可逆性,即在适当的条件下,可以将醌还原为酚。
1.2 文章结构本文将从以下几个方面全面介绍和解释醌化反应的可逆性。
首先,我们将对醌化反应的基本原理进行阐述,包括反应机制和影响因素等内容。
然后,我们将探究实验设计及其结果分析以验证该反应的可逆性。
接下来,我们将深入讨论该反应在工业领域、生物化学领域以及环境影响研究中的重要意义和广泛应用。
最后,在总结主要结论的同时,我们也会提出目前存在的问题,并展望未来可能的研究方向。
1.3 目的该文旨在全面了解和探究醌化反应的可逆性,并为读者提供关于该领域内最新研究的综述。
通过对反应原理、实验验证和应用意义等方面的深入讨论,我们希望能够揭示醌化反应可逆性的机制,为更好地理解和利用该反应在化学领域中的作用提供指导和启示。
2. 醌化反应:2.1 反应原理:醌化反应是一种在有机化学中常见的重要反应类型。
其基本原理是通过将有机物中的羟基(-OH)氧化为对应的醌基(=O),从而实现有机物的转化。
具体而言,醌化反应是通过羟基上的脱氢作用完成的,将羟基上的氢原子去除并与其他官能团结合,生成一个含有酮基(C=O)和亚胺键形式的产物。
2.2 反应条件:醌化反应通常需要一定的温度和催化剂存在下进行。
常见的催化剂包括过氧化合物、金属离子和马来酰亚胺等。
此外,反应溶剂也是影响醌化反应进行与否及产率的重要因素。
不同的官能团在不同的温度范围内对于醌化反应具有不同的敏感性,因此,在设计和优化条件时需要根据具体目标分子进行调整。
2.3 可逆性解释:传统意义上,醌化反应被认为是一个不可逆的过程。
然而最新研究发现,在特定条件下,例如加入辅助剂或在低温下进行反应等,醌化反应可以被逆转。
这种可逆性可以通过控制消耗氧气的速率、改变催化剂的浓度和引入还原剂等方式实现。
苯酚氧化成苯醌机理
苯酚氧化成苯醌是一个重要的有机化学反应,其反应机理主要包括以下几个步骤:
1. 氧化反应:在氧的存在下,苯酚首先被氧气氧化成苯醌。
这一步通常需要有氧气或者氧化剂的存在,如过氧化氢、过氧化苯甲酰等,这些氧化剂能够提供活泼的氧原子,进而氧化苯酚的酚基。
2. 脱水醛:苯醌的羰基部分在接受氧气的同时,会失去水分子,形成对苯二醌。
这个过程也被称作脱水醛,使得苯醌的分子结构进一步稳定。
3. 生成苯醌:最后,对苯二醌经过还原反应,被还原为苯醌。
还原反应往往需要还原剂的存在,如亚硫酸氢钠、亚硫酸氢钾等。
通过这一步骤,苯醌的产物最终形成。
总的来说,苯酚氧化成苯醌的机理是一个多步反应过程,通过氧化、脱水醛和还原等步骤,最终得到苯醌这一重要的化合物。
这一反应机理不仅在有机合成领域有重要应用,也为化学研究提供了丰富的实验数据和理论基础。
在实际应用中,各种反应条件和催化剂的选择都会影响到反应的进行和产物的选择性,因此对苯酚氧化成苯醌的机理的深入理解和研究具有重要意义。
酚氧化成醌的反应机理
酚氧化成醌的反应机理可以概括为以下几个步骤:
1. 酚分子失去一个质子,形成酚负离子。
这是本反应的关键步骤。
2. 酚负离子发生亲电加成,攻击邻近的另一个酚分子的芳环上的一个碳原子,形成一个间位二面体中间体。
3. 中间体失去一个氧分子,形成一个芳香的靛红色的醌衍生物。
这是本反应的最终产物。
4. 醌衍生物脱去一个质子,重新形成酚分子。
这个酚分子可以再次发生和其他酚分子的反应,从而形成更多的醌衍生物。
总之,酚氧化成醌的反应机理是通过酚负离子的亲电加成和氧化作用而实现的,最终生成醌衍生物。
这个反应机理对于许多生物和化学过程都非常重要,并被广泛应用于有机合成、药物化学和材料科学等领域。
醌的化学结构醌是一种有机化合物,其化学结构由苯环上两个氧原子和一个酮基团构成。
它的分子式为C6H4O2,结构式为O=C1C=CC=C1O。
醌的化学结构使其具有许多特殊的化学性质和应用价值。
醌具有较高的氧化还原性,可以进行多种氧化还原反应。
其中最常见的是醌与还原剂之间的反应,形成对应的醇化合物。
例如,苯醌可以与亚硫酸钠反应,得到对应的苯酚。
这种反应在有机合成中非常重要,可以用于合成各种醇化合物。
醌还可以通过氧化反应生成醌酮。
在氧化剂的作用下,醌分子中的酮基团被氧化为醌酮。
这些醌酮化合物在有机合成和药物合成中有广泛的应用。
例如,环己酮可以通过环己醌的氧化得到,进而用于合成尼龙等聚合物。
醌还可以发生亲电取代反应。
由于醌分子中的氧原子具有较高的电负性,容易被亲电试剂攻击,发生取代反应。
例如,苯醌可以与溴反应,生成溴代苯酮。
这种亲电取代反应在有机合成中也具有重要的应用。
醌还具有自身的特殊性质。
由于醌分子中的两个氧原子的共振结构,使得醌分子具有较高的稳定性。
醌还具有较强的吸收紫外光的能力,因此常被用作紫外吸收剂。
醌还可以与许多有机物形成稳定的配合物,具有一定的荧光性质,因此在荧光探针和染料方面也有应用。
总结起来,醌是一种具有特殊化学结构的有机化合物,其分子中含有苯环、氧原子和酮基团。
醌具有较高的氧化还原性,可以进行多种氧化还原反应。
醌还可以发生亲电取代反应,并具有自身的特殊性质。
由于醌具有多种特殊性质,因此在有机合成、药物合成、紫外吸收剂、荧光探针和染料等方面都有重要的应用价值。
醌的化学结构为我们研究其性质和应用提供了基础,并为有机化学的发展做出了重要贡献。