CRISPR-Cas9基因敲除小鼠
- 格式:ppt
- 大小:2.35 MB
- 文档页数:28

基因编辑小鼠如何分类?
基因编辑小鼠可分为三大类、7 小类:
(1)转基因(Tg)首先构建表达载体,包含启动子、增强子、编码区、polyA 等元件,然后将表达载体注入到受精卵的细胞核内,外源表达载体将插入到受精卵的基因组内,再将该受精卵移植到受体母鼠输卵管内,发育成为小鼠个体,该小鼠就会表达转入的外源基因。
(2)基因全身性敲除(KO)利用Crispr/Cas9 系统,在受精卵的目标基因的编码区两侧分别切断,然后受精卵在连接断口的过程中,会丢失掉断口之间的序列(即编码区)。
该受精卵移植到受体母鼠输卵管内,发育成为小鼠个体,该小鼠将无法表达目标基因,导致目标基因将完全失去活性,表现为全身性基因敲除。
(3)基因敲入(KI)首先构建打靶载体:包含同源臂和外源基因,然后将表达载体通过显微注射的方法注入到受精卵的细胞核内,同时利用 Crispr/Cas9 系统,在受精卵目的基因位置切断基因组 DNA,受精卵会通过同源重组将外源基因定点整合到基因组内。
该受精卵移植到受体母鼠输卵管内,发育成为小鼠个体,该小鼠就携带了转入的外源基因。

Vol.41No.3Mar.2021上海交通大学学报(医学版)JOURNAL OF SHANGHAI JIAO TONG UNIVERSITY (MEDICAL SCIENCE)构建诱导型CRISPR/Cas9系统用于小鼠免疫细胞基因功能研究赵艳娜1*,邱荣2*,沈南1,唐元家11.上海交通大学医学院附属仁济医院风湿病科,上海市风湿病学研究所,上海200127;2.中国科学院上海营养与健康研究所,上海200031[摘要]目的·结合Dox 诱导型单链导向RNA (single guide RNA ,sgRNA )表达载体和Cas9转基因小鼠,构建诱导型CRISPR/Cas9系统用于小鼠免疫细胞基因功能研究。
方法·根据四环素诱导表达系统原理,基因合成U6-TetO-sgRNA 和EF1α-T2A-Puro-BFP-T2A-TetR 片段。
通过同源重组将2个片段组装进反转录病毒载体骨架,获得Dox 诱导型sgRNA 反转录病毒载体。
为了验证系统有效性,分离Cas9转基因小鼠骨髓细胞并诱导其向巨噬细胞方向分化。
设计对照(non-targeting control ,NC )组和实验组(靶向F4/80)的sgRNA ,利用反转录病毒感染细胞,分化条件设置添加Dox 组(Dox +)和不添加Dox 组(Dox -)。
通过流式细胞术和T7核酸内切酶Ⅰ(T7endonuclease Ⅰ,T7E Ⅰ)实验检测基因敲除效果。
结果·①成功构建Dox 诱导型sgRNA 反转录病毒表达载体和Cas9转基因小鼠。
②流式结果显示,在NC Dox -组、NC Dox +组和F4/80Dox -组中,几乎无F4/80阴性细胞群体;而在F4/80Dox +组中,F4/80阴性细胞群体高达50%。
③T 7E Ⅰ结果显示,在F4/80Dox -组中,DNA 条带完整,而在F4/80Dox +组中发生基因突变,DNA 条带被切开。
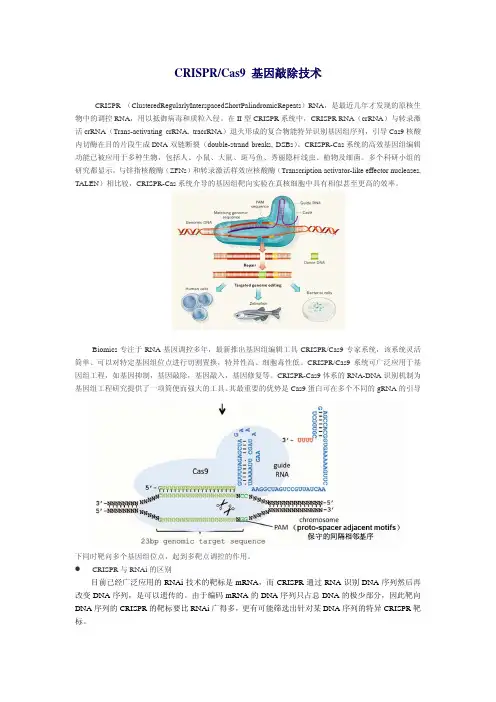
CRISPR/Cas9 基因敲除技术CRISPR (ClusteredRegularlyInterspacedShortPalindromicRepeats)RNA,是最近几年才发现的原核生物中的调控RNA,用以抵御病毒和质粒入侵。
在II型CRISPR系统中,CRISPR RNA(crRNA)与转录激活crRNA(Trans-activating crRNA, tracrRNA)退火形成的复合物能特异识别基因组序列,引导Cas9核酸内切酶在目的片段生成DNA双链断裂(double-strand breaks, DSBs)。
CRISPR-Cas系统的高效基因组编辑功能已被应用于多种生物,包括人、小鼠、大鼠、斑马鱼、秀丽隐杆线虫、植物及细菌。
多个科研小组的研究都显示,与锌指核酸酶(ZFNs)和转录激活样效应核酸酶(Transcription activator-like effector nucleases, TALEN)相比较,CRISPR-Cas系统介导的基因组靶向实验在真核细胞中具有相似甚至更高的效率。
Biomics专注于RNA基因调控多年,最新推出基因组编辑工具CRISPR/Cas9专家系统,该系统灵活简单、可以对特定基因组位点进行切割置换,特异性高、细胞毒性低。
CRISPR/Cas9系统可广泛应用于基因组工程,如基因抑制,基因敲除,基因敲入,基因修复等。
CRISPR-Cas9体系的RNA-DNA识别机制为基因组工程研究提供了一项简便而强大的工具。
其最重要的优势是Cas9蛋白可在多个不同的gRNA的引导下同时靶向多个基因组位点,起到多靶点调控的作用。
z CRISPR与RNAi的区别目前已经广泛应用的RNAi技术的靶标是mRNA,而CRISPR通过RNA识别DNA序列然后再改变DNA序列,是可以遗传的。
由于编码mRNA的DNA序列只占总DNA的极少部分,因此靶向DNA序列的CRISPR的靶标要比RNAi广得多,更有可能筛选出针对某DNA序列的特异CRISPR靶标。

《利用CRISPR-Cas9系统构建DUSP9基因敲除小鼠胚胎干细胞系》篇一一、引言随着基因编辑技术的发展,CRISPR-Cas9系统已成为一种强大的工具,用于在生物医学研究中精确地编辑基因组。
DUSP9基因作为一种重要的基因,其功能在多种生物学过程中起着关键作用。
因此,构建DUSP9基因敲除小鼠胚胎干细胞系,对于研究DUSP9基因的功能及其在疾病发生发展中的作用具有重要意义。
本文旨在详细介绍利用CRISPR-Cas9系统构建DUSP9基因敲除小鼠胚胎干细胞系的过程。
二、材料与方法1. 材料小鼠胚胎干细胞(mESCs)、CRISPR-Cas9系统、相关基因编辑工具、培养基、生长因子等。
2. 方法(1)设计CRISPR-Cas9系统:根据DUSP9基因的序列信息,设计合适的CRISPR-Cas9系统,包括sgRNA和Cas9蛋白。
(2)制备mESCs细胞:培养mESCs细胞至合适的状态,以便进行基因编辑。
(3)转染与编辑:将CRISPR-Cas9系统转染至mESCs细胞中,利用Cas9蛋白对DUSP9基因进行切割。
(4)筛选与鉴定:通过PCR、Western blot、qRT-PCR等方法,筛选出成功敲除DUSP9基因的mESCs细胞,并进行鉴定。
三、实验过程1. 设计并构建CRISPR-Cas9系统,选择合适的sgRNA序列和Cas9蛋白表达载体。
2. 培养mESCs细胞至合适的状态,进行转染。
3. 观察转染后的细胞生长情况,确保Cas9蛋白的表达。
4. 利用PCR、Western blot、qRT-PCR等方法筛选出成功敲除DUSP9基因的mESCs细胞。
5. 对筛选出的细胞进行扩增培养,并保存于液氮中备用。
四、结果与讨论1. 结果(1)成功构建了CRISPR-Cas9系统,并将其转染至mESCs 细胞中。
(2)成功筛选出敲除DUSP9基因的mESCs细胞,并通过PCR、Western blot、qRT-PCR等方法进行了鉴定。

使用 CRISPR-Cas9 创建转基因小鼠的方案虽然近年来已经开发了几种基因组编辑工具,包括锌指结构和 TALENs(转录激活物样效应物核酸酶),但没有一种能像CRISPR/Cas9系统那样高效,该系统由一个RNA引导的DNA内切酶 (Cas9) 和对应的引导RNA(CRISPR) 组成。
利用该系统,研究人员能够实现一步敲除多个基因的等位基因的突变小鼠1。
只需两三周的时间,即可创造出子携带条件性等位基因和报告基因的小鼠2,并且该方案。
特别要注意的是,该过程不需要创建修改的小鼠ES细胞过程,该过程有时会十分困难3。
随着 Cas9 敲入和敲除小鼠的发展,预计越来越多的实验室将选择 CRISPR/Cas9 系统来生成转基因小鼠模型。
使用CRISPR-Cas9创建转基因小鼠的方案动物学研究。
2016 年 7 月 18 日;37(4): 205–213.利用 CRISPR/Cas9 和单倍体胚胎干细胞系统产生基因修饰的小鼠。
图 1.在小鼠胚胎上使用 CRISPR/Cas9 基因组编辑创建转基因小鼠的示意图。
通过共注射 Cas9 mRNA 和向指导 RNA,多个基因靶标可以在小鼠胚胎中一次敲除。
(改编自Yang H,Wang H 和 Jaenisch R. Nat Protoc。
2014 年 8 月;9(8):1956-68.)Sigma-Aldrich 是为基因组编辑提供工具和定制服务的领导者,包括 ZFN 和CRISPR/cas9。
默克还提供了广泛的小鼠胚胎验证培养基和试剂组合,用于储存、转移和扩增用于在EmbryoMAX™名下创建转基因小鼠模型的小鼠胚胎。
浏览所有的基因组编辑产品浏览所有经小鼠胚胎验证的试剂小鼠胚胎和ES细胞培养基小鼠ES细胞培养基实验方案和过程成功的小鼠模型项目的提示1.了解实验目的并开展研究。
生成正确的小鼠需要完全理解被测试依据的假设。
例如,研究者可能希望验证这样的假设:突变肝脏中的转运蛋白可能会减轻特定药物的肝毒性作用。

基于CRISPR Cas9技术基因敲除小鼠(Cas9-KO)的制作方法一、CRISPR/Cas9靶向基因敲除小鼠制作的基本技术原理:通过CRISPR/Cas9基因敲除技术,crRNA通过碱基配对与tracrRNA(trans-activating RNA)结合,形成双链RNA。
这一tracrRNA:crRNA二元复合体指导Cas9蛋白在crRNA引导序列靶标的特定位点剪切双链DNA。
在与crRNA引导序列互补的位点,Cas9蛋白的HNH核酸酶结构域剪切互补链而Cas9 RuvC-like 结构域剪切非互补链,实现敲除目的基因的功能,制备基因敲除小鼠模型。
二、具体步骤如下:一)模型制作策略制作:利用生物信息学手段(NCBI&IMPC&MGI),分别仔细分析目的基因敲除后小鼠的生存能力及繁育能力,并结合邻近基因的影响,最终选择合适的敲除区域进行敲除方案的设计,出具相应的制作策略。
二)载体的设计和构建:使用麻省理工学院的CRISPR Design工具(/),依据中靶Score的高低及脱靶Score的高低设计一对长度为20bp的针对靶标DNA的寡聚核苷酸链序列用于制备sgRNA,并在该靶区域设计引物用于后续阳性小鼠的基因鉴定。
1、制备sgRNA的实验方法步骤:1)线性化pUC57-GDNA-T7载体中提pUC57-GDNA-T7载体,用BsaI线性化过夜。
胶回收保存备用。
2)引物退火及加磷酸将上下游引物(干粉)稀释,再进行引物退火及加磷酸。
3)连接&阳性菌落筛选取步骤二中的加磷酸产物与线性化载体pUC57-GDNA-T7进行连接,该连接反应在干式恒温器中进行。
对连接产物进行转化,涂板,37°C培养箱过夜培养。
再用PCR&测序的方法筛选阳性克隆,再将测序正确的克隆进行甘油菌保种,-80°C保存备用4)制备转录模板以构建好的sgRNA载体为模板进行PCR扩增,将PCR产物切胶回收,回收产物离心后倒掉上清留DNA沉淀,再溶解DNA。

《利用CRISPR-Cas9系统构建DUSP9基因敲除小鼠胚胎干细胞系》篇一一、引言在生物学研究领域,基因编辑技术日益显示出其巨大的潜力和应用前景。
CRISPR-Cas9系统作为一种强大的基因编辑工具,已在多个物种中成功用于构建基因敲除模型。
本文旨在介绍如何利用CRISPR-Cas9系统构建DUSP9基因敲除小鼠胚胎干细胞系,为相关研究提供参考。
二、材料与方法1. 材料(1)小鼠胚胎干细胞(mESCs);(2)CRISPR-Cas9系统相关试剂;(3)DUSP9基因敲除载体;(4)显微操作设备及试剂;(5)实验动物(小鼠)。
2. 方法(1)设计并构建DUSP9基因敲除载体;(2)将载体与mESCs共转染,使DUSP9基因发生双链断裂;(3)利用CRISPR-Cas9系统对断裂的DUSP9基因进行修复,形成基因敲除突变;(4)筛选并扩增基因敲除的mESCs;(5)将基因敲除的mESCs注射到小鼠囊胚中,生成转基因小鼠。
三、实验过程1. 载体构建及转染首先,设计并构建DUSP9基因敲除载体。
该载体应包含靶向DUSP9基因的识别序列、切割位点及修复模板。
随后,将载体与mESCs共转染,使DUSP9基因发生双链断裂。
此过程需在显微操作下进行,确保转染效率和准确性。
2. CRISPR-Cas9系统修复及筛选利用CRISPR-Cas9系统对断裂的DUSP9基因进行修复。
通过非同源末端连接或同源重组等方式,使基因发生突变,形成DUSP9基因敲除的突变体。
随后,通过PCR、测序等方法筛选并扩增基因敲除的mESCs。
3. 转基因小鼠生成及鉴定将扩增得到的基因敲除的mESCs注射到小鼠囊胚中,通过胚胎移植技术生成转基因小鼠。
随后,通过PCR、免疫组化等方法对转基因小鼠进行鉴定,确认DUSP9基因是否成功敲除。
四、结果与讨论1. 结果利用CRISPR-Cas9系统成功构建了DUSP9基因敲除的小鼠胚胎干细胞系。
通过PCR、测序等方法验证了DUSP9基因的敲除效率及准确性。

《利用CRISPR-Cas9系统构建DUSP9基因敲除小鼠胚胎干细胞系》篇一一、引言在生物学研究中,基因敲除是一种重要的技术手段,能够精确地操控特定基因的表达,进而研究基因在生物体中的功能。
近年来,随着基因编辑技术的发展,尤其是CRISPR-Cas9系统的广泛应用,基因敲除技术得到了极大的推进。
本文旨在探讨利用CRISPR-Cas9系统构建DUSP9基因敲除小鼠胚胎干细胞系的方法和步骤,为进一步研究DUSP9基因的功能提供技术支持。
二、CRISPR-Cas9系统简介CRISPR-Cas9系统是一种基于细菌免疫系统的基因编辑技术,具有高效、精确的基因编辑能力。
该系统通过设计特定的RNA 引导序列与Cas9蛋白结合,形成复合物,识别并切割靶点DNA 序列,从而实现基因的敲入、敲除或替换等操作。
三、DUSP9基因敲除小鼠胚胎干细胞系的构建1. 靶点设计:首先需要确定DUSP9基因的敲除靶点,设计相应的sgRNA和Cas9蛋白序列。
通过分析DUSP9基因的序列,找到合适的位置作为靶点。
2. 胚胎干细胞系的获取:选取适合的小鼠胚胎干细胞系,确保其处于稳定的生长状态。
3. CRISPR-Cas9系统介导的基因编辑:将设计好的sgRNA和Cas9蛋白通过特定的方式(如质粒转染、病毒载体等)引入小鼠胚胎干细胞中。
在细胞内,sgRNA和Cas9蛋白形成复合物,识别并切割DUSP9基因的靶点。
4. 克隆筛选和鉴定:经过一段时间的培养和筛选,挑选出发生基因突变的小鼠胚胎干细胞克隆。
通过PCR、测序等分子生物学手段,鉴定克隆中DUSP9基因的敲除情况。
5. 细胞系建立:将鉴定成功的DUSP9基因敲除小鼠胚胎干细胞进行传代培养,建立稳定的细胞系。
四、实验结果与讨论通过上述步骤,我们成功构建了DUSP9基因敲除小鼠胚胎干细胞系。
在实验过程中,我们观察到CRISPR-Cas9系统对DUSP9基因的切割效率较高,成功获得了多株基因敲除克隆。

条件性敲除小鼠的原理
目前的条件性敲除小鼠主要是基于Cre-LoxP系统的。
Cre-LoxP系统是源于P1噬菌体的一个DNA重组体系,由Cre酶和相应的LoxP位点组成,它能导致重组发生在特定的DNA序列处(LoxP位点),该系统可以将外源基因定点整合到染色体上或将特定DNA片段删除。
传统的条件性敲除
基于Cre-LoxP的基因打靶要分两步来进行。
传统方法,首先要在胚胎干细胞的基因组中引入LoxP序列,这一步可以通过打靶载体的设计和对同源重组子的筛选来实现。
第二步,通过Cre介导的重组来实现靶基因的遗传修饰或改变。
在细胞水平上,可以用Cre重组酶表达质粒转染中靶细胞,通过识别 LoxP位点将抗性标记基因切除;在个体水平上将重组杂合子小鼠与Cre转基因小鼠杂交,筛选子代小鼠就可得到删除外源标记基因的条件性敲除小鼠。
将Cre基因置于可诱导的启动子控制下,通过诱导表达Cre重组酶而将LoxP位点之间的基因切除(诱导性基因敲除),实现特定基因在特定时间或者组织中的失活。
一般需要一年以上的时间,价格在15-20万不等。
华夏凯奇基于Cas9系统的条件性敲除
原理上和传统的条件性敲除类似,差别在于华夏凯奇利用Optimized Cas9/CRISPR System(OCAS)技术在基因组上加入loxp序列,可以快速获得Loxp 位点插入的小鼠。
目前我们一般只需要4-5个月。
价格也比传统方法大大降低。

第1篇一、实验背景随着神经科学研究的深入,理解大脑的基因调控机制对于揭示神经疾病的发生机理和开发新的治疗方法具有重要意义。
本研究旨在通过基因编辑技术,探究特定基因在小鼠大脑发育和功能中的作用,为相关疾病的预防和治疗提供新的思路。
二、实验目的1. 利用CRISPR/Cas9基因编辑技术敲除小鼠大脑中特定基因。
2. 观察基因敲除对小鼠大脑发育、行为和认知功能的影响。
3. 分析敲除基因对小鼠大脑中相关通路和基因表达的影响。
三、实验材料与方法1. 实验材料- 小鼠胚胎干细胞(ES细胞)- CRISPR/Cas9系统- 实验小鼠(C57BL/6小鼠)- 实验试剂:DNA聚合酶、限制性内切酶、DNA连接酶、PCR引物等2. 实验方法(1)基因编辑1. 设计靶向特定基因的CRISPR/Cas9系统,包括sgRNA和Cas9蛋白。
2. 将sgRNA和Cas9蛋白导入小鼠ES细胞,进行基因编辑。
3. 对编辑后的ES细胞进行筛选,获得基因敲除的细胞系。
4. 将基因敲除的细胞系注射到C57BL/6小鼠的受精卵中,获得基因敲除的小鼠。
(2)小鼠行为和认知功能测试1. 观察基因敲除小鼠的生长发育、行为和运动能力。
2. 对小鼠进行认知功能测试,包括Morris水迷宫实验、Y迷宫实验等。
(3)基因表达分析1. 提取小鼠大脑样本,进行RNA提取和cDNA合成。
2. 利用PCR、RT-qPCR等方法检测敲除基因的表达水平。
3. 对小鼠大脑样本进行蛋白质组学分析,检测相关蛋白的表达水平。
四、实验结果1. 基因敲除成功敲除了小鼠大脑中特定基因,并通过PCR、RT-qPCR等方法验证了基因敲除的效果。
2. 小鼠行为和认知功能与野生型小鼠相比,基因敲除小鼠在Morris水迷宫实验中表现出明显的空间学习障碍,提示该基因可能参与小鼠的认知功能。
3. 基因表达分析敲除基因后,小鼠大脑中相关通路和基因表达发生了显著变化。
具体表现为:1. 神经递质合成酶的表达水平降低。

基因敲除小鼠的方法
1. CRISPR/Cas9基因编辑技术,CRISPR/Cas9技术是一种高效的基因编辑工具,可以用来精确地敲除小鼠基因。
首先,科学家设计合成一段RNA序列,使其与目标基因序列相匹配,然后将这段RNA和Cas9蛋白复合体导入小鼠胚胎内。
复合体会通过识别并切割目标基因,导致基因敲除。
2. 胚胎干细胞技术,另一种常见的基因敲除小鼠方法是利用胚胎干细胞。
科学家可以将设计好的基因敲除载体导入小鼠胚胎干细胞中,使其发生基因敲除。
然后,这些修改过的干细胞可以被植入小鼠胚胎内,从而产生基因敲除小鼠。
3. 遗传改造小鼠技术,除了CRISPR/Cas9和胚胎干细胞技术,科学家还可以利用遗传改造技术来实现基因敲除。
这种方法涉及到选择性育种和杂交,通过选择性地交配和繁殖,最终得到具有特定基因敲除的小鼠品系。
总的来说,基因敲除小鼠的方法主要包括CRISPR/Cas9基因编辑技术、胚胎干细胞技术和遗传改造小鼠技术。
这些方法都是在实验室条件下进行的,需要经过严格的实验设计和操作流程,以确保
基因敲除的准确性和有效性。
同时,这些方法也为科学家提供了强大的工具,用于研究基因在生物体内的功能和作用机制。
双基因敲除小鼠繁殖工作:CRISPR/Cas9方案构建双基因敲除鼠,得到F0杂合子之后,如何建系才能获得双基因敲除纯合子小鼠?这是经常被问到的问题,下面就简单回答一下。
假设我们的目的基因为A和B,通常用CRISPR/Cas9方法得到的基因敲除鼠为杂合子,双杂合子小鼠基因型为AaBb,大写字母代表野生型(dominant),小写字母代表突变型(recessive)。
得到F0杂合子(AaBb)之后,可以用以下方案之一来获得双基因敲除纯合子小鼠:方案一:1.将双杂合子小鼠(AaBb)与野生鼠(AABB)交配,理论上将得到25%的野生型(AABB),25%基因A单杂合子(AaBB),25%基因B单杂合子(AABb)及25%双杂合子小鼠(AaBb)。
2.将所得到的双杂合子小鼠(AaBb)互交(inter-cross),理论上6.25%的后代将会是双基因敲除纯合子小鼠(aabb),见下图。
3.由于双基因敲除实验中一般都需要单基因敲除动物作为对照,所以在进行上面小鼠breeding的同时可以将基因A单杂合子(AaBB)互交,在后代中鉴定出基因A纯合子(aaBB),同样将基因B单杂合子(AABb)互交,在后代中鉴定出基因B纯合子(AAbb)。
方案二:将双杂合子小鼠(AaBb)与单基因纯合子(如aaBB)交配,所生小鼠中约25%为基因A纯合子而基因B杂合子(aaBb,见下图左)。
然后将aaBb小鼠互交,理论上后代小鼠中25%为双基因敲除纯合子小鼠(aabb),见下图右。
需要特别注意的几个问题:1)上面所讲的方法适用于位于不同的染色体两个基因的基因敲除,如果两个基因位于同一条染色体上,要通过上述方法得到双基因敲除纯合子小鼠很难;2)上述方法有赖于基因特异性的Genotyping PCR assays。
在开始setup breeding之前必须将两个目的基因特异性的Genotyping PCRassays 准备好;3)要事先研究一下目的基因敲除后有无胚胎致死性,是否影响其生长发育等。
基因敲除小鼠的实验流程1.设计基因敲除小鼠实验方案在开始实验之前,需要明确研究目的,确定需要敲除的基因,并设计相应的实验方案。
一般可以使用 CRISPR-Cas9 系统来实现基因敲除,在设计基因敲除实验方案时,需要选择合适的 sgRNA 序列,以及设计恰当的引物用于检测突变。
2.获得基因敲除小鼠的胚胎干细胞为了实现基因敲除,需要获得基因敲除小鼠的胚胎干细胞。
一种常用的方法是利用胚胎干细胞对外源DNA的高度易感性,将敲除基因的质粒DNA转染到小鼠胚胎干细胞中。
3.筛选敲除基因的胚胎干细胞株系将转染了敲除基因的胚胎干细胞以悬浮培养的方式进行培养,培养一段时间后,利用一定的筛选条件来筛选出含有敲除基因的胚胎干细胞株系。
筛选条件可包括对抗生素的使用或筛选标记基因的表达。
4.制备敲除基因小鼠的固定胚胎干细胞系通过体外培养,将敲除基因的胚胎干细胞系定植在培养皿上,培养数代以后,将其冻存,以备后续的实验使用。
5.实施敲除基因小鼠的胚胎干细胞基因改造将固定的胚胎干细胞系重新激活,转染 Cas9 和 sgRNA,利用CRISPR-Cas9 系统使这些细胞具有敲除基因的突变。
6.识别敲除基因的胚胎干细胞阳性克隆株对转染了 Cas9 和 sgRNA 的胚胎干细胞进行筛选,通过 PCR、Western blot、Southern blot等技术方法识别出敲除了目标基因的阳性克隆株。
7.将敲除基因的胚胎干细胞注入小鼠的早期胚胎取出已受精的小鼠卵母细胞,利用显微操作将敲除基因的胚胎干细胞注入到小鼠的早期胚胎中。
利用体外受精或者通过体内或体外的胚胎移植方式将基因敲除干细胞注入受体小鼠。
8.制备基因敲除小鼠的嵌合小鼠将已注入敲除基因的胚胎干细胞的受体小鼠进行嵌合以产生基因敲除小鼠。
嵌合可以通过体内或体外的胚胎移植方式进行。
9.筛选识别基因敲除小鼠对产生的嵌合小鼠进行筛选,确认敲除基因是否成功。
可以通过 PCR、Western blot、Southern blot等技术方法对小鼠体细胞或组织进行分析。
(19)中华人民共和国国家知识产权局(12)发明专利申请(10)申请公布号 (43)申请公布日 (21)申请号 201711145330.X(22)申请日 2017.11.19(71)申请人 内蒙古大学地址 010021 内蒙古自治区呼和浩特市赛罕区大学西路235号(72)发明人 郭旭东 白宇 张晓枫 张蒙 梁浩 (51)Int.Cl.C12N 15/90(2006.01)C12N 15/89(2006.01)C12N 15/877(2010.01)A01K 67/027(2006.01)(54)发明名称CRISPR-Cas9系统介导的小鼠FGF5基因敲除的方法(57)摘要本发明是根据小鼠FGF5基因序列,构建基于CRISPR-Cas9系统的sgRNA表达载体,将sgRNA和Cas9 质粒混合物对受精卵原核注射,胚胎移植,品系基因鉴定,得到基因突变鼠,并pcr测序,确认最终得到遗传性小鼠突变模型。
本发明构建的CRISPR-Cas9介导的打靶载体为小鼠FGF5基因的敲除提供了一种简便快速安全的途径,该方法实现了不添加任何筛选标记即可筛选定点整合外源基因细胞系,大大提高了转基因动物的安全性,对小鼠的遗传育种具有重要价值。
权利要求书1页 说明书6页序列表9页 附图3页CN 109811008 A 2019.05.28C N 109811008A1.一种基于CRISPR/Cas9获得FGF5突变小鼠模型的构建方法,其特征包括以下步骤:第1步:构建基于CRISPR -Cas9系统的sgRNA表达载体。
第2步:将sgRNA和Cas9 质粒混合物对受精卵原核注射,胚胎移植,品系基因鉴定,得到基因突变小鼠,并pcr测序,确认最终得到的FGF5基因突变的遗传性小鼠突变模型。
2.根据权利要求1所述的方法,其特征在于,向导RNA表达载体为sgRNA -FGF5,sgRNA靶位点位于第一外显子上。
3.根据权利要求2所述的方法,其特征在于,sgRNA靶序列为 5 ’-GAAGGGCAACCCGCGCCT CC -3’。
基因敲除鼠的构建方法
基因敲除鼠是一种重要的遗传工具,它们能够帮助科学家们研究基因在生物学过程中的作用。
基因敲除鼠构建方法主要包括以下步骤: 1. 设计基因敲除鼠的目标基因序列,选择合适的外显子或内含
子进行靶向敲除。
2. 制备CRISPR/Cas9系统,包括Cas9蛋白、sgRNA以及质粒载体等。
3. 将CRISPR/Cas9系统导入到鼠胚胎干细胞中,使用
CRISPR/Cas9系统导致目标基因的敲除。
4. 鉴定敲除鼠胚胎干细胞中基因敲除的效率,通过PCR、Western blot等方法验证敲除效果。
5. 将基因敲除鼠胚胎干细胞注入到新生小鼠的内脏器官进行移植,培养出基因敲除小鼠。
基因敲除鼠的构建方法是一项复杂的工程,需要科学家们对基因编辑技术的熟练掌握和实验经验。
通过基因敲除鼠的研究,科学家们能够更加深入地了解基因在生物体内的作用,为疾病治疗和新药研发提供更为有效的手段。
- 1 -。
《利用CRISPR-Cas9系统构建DUSP9基因敲除小鼠胚胎干细胞系》篇一一、引言基因编辑技术为现代生物学研究带来了巨大的突破。
在众多基因编辑技术中,CRISPR-Cas9系统以其高精度、高效率的特性备受关注。
本篇论文旨在探讨利用CRISPR-Cas9系统构建DUSP9基因敲除小鼠胚胎干细胞系的过程、结果以及相关讨论。
二、材料与方法1. 材料小鼠胚胎干细胞系、DUSP9基因序列信息、CRISPR-Cas9系统相关试剂等。
2. 方法(1)设计并合成针对DUSP9基因的CRISPR-Cas9系统指导RNA(gRNA)。
(2)将gRNA与Cas9蛋白共同转入小鼠胚胎干细胞中。
(3)通过PCR、Western Blot等方法检测DUSP9基因的敲除情况。
(4)对敲除后的胚胎干细胞进行扩增、培养,并分析其生物学特性。
三、实验结果1. DUSP9基因敲除效率分析通过PCR和Western Blot等方法,我们成功检测到DUSP9基因的敲除情况。
在转导了CRISPR-Cas9系统的胚胎干细胞中,DUSP9基因的敲除效率达到了XX%。
2. 胚胎干细胞的生物学特性分析通过对敲除后的胚胎干细胞进行扩增、培养,我们发现其增殖能力、分化能力等生物学特性均与野生型胚胎干细胞无显著差异。
3. 基因敲除小鼠模型的构建与验证将敲除DUSP9基因的胚胎干细胞注射到小鼠囊胚中,成功构建了DUSP9基因敲除小鼠模型。
通过对小鼠进行基因检测,验证了DUSP9基因的敲除情况。
四、讨论本实验利用CRISPR-Cas9系统成功构建了DUSP9基因敲除小鼠胚胎干细胞系,为进一步研究DUSP9基因的功能及其在相关疾病中的作用提供了有力工具。
同时,本实验也证明了CRISPR-Cas9系统在基因编辑领域的广泛应用和可靠性。
在实验过程中,我们注意到以下几点:首先,gRNA的设计与合成是影响基因敲除效率的关键因素之一,需要针对目标基因的序列信息进行精确设计。
CRISPR-CAS9基因敲除原理
CRISPR/Cas9(Clustered Regularly Interspaced Short Palindromic Repeats)是最新出现的一种由RNA指导Cas核酸酶对靶向基因进行特定DNA修饰的技术。
CRISPR 是细菌和古细菌为应对病毒和质粒不断攻击而演化来的获得性免疫防御机制。
在这一系统中,crRNA(CRISPR-derived RNA)通过碱基配对与tracrRNA(trans-activating RNA)结合形成双链RNA,此tracrRNA/crRNA二元复合体指导Cas9蛋白在crRNA引导序列靶定位点剪切双链DNA达到对基因组DNA进行修饰的目的。
Cas9结合gRNA,gRNA 的长度约为80个核苷酸,包含两个区域:gRNA 5' 端前20个核苷酸对应于靶标DNA,能结合在靶DNA 上的约60个核苷酸(gRNA 长度取决于表达gRNA 的质粒)形成一个发夹结构,这个结构能帮助gRNA 与Cas9结合,并由此指导与DNA 的结合。
通过gRNA上的靶点序列,在目标基因组上找到靶点序列,并揭开双螺旋,Cas9将剪切DNA双链,造成DNA双链断裂。
Cas9使用简单,可满足多个靶点同时操作。
Insertion
/deletion
HDR
gRNA
Cas9
Donor vector
基因敲除小鼠流程:。