基因敲除小鼠的构建
- 格式:ppt
- 大小:3.19 MB
- 文档页数:15

《锌指核酸酶介导的小鼠MSTN基因敲除的研究》篇一一、引言基因编辑技术近年来取得了重大突破,其中锌指核酸酶(ZFNs)技术因其高精度和灵活性在基因功能研究、疾病模型构建以及基因治疗等领域得到了广泛应用。
肌肉生长抑制素(Muscle Growth Suppressor,MSTN)基因是调控肌肉生长的关键基因,其敲除能够显著提高动物肌肉生长量。
本研究旨在利用锌指核酸酶技术介导小鼠MSTN基因敲除,以期为肌肉生长相关研究提供新的思路和实验依据。
二、材料与方法1. 材料(1)实验动物:选用健康小鼠作为实验对象。
(2)锌指核酸酶:根据MSTN基因序列设计并构建的ZFNs 系统。
(3)实验试剂与仪器:包括DNA提取试剂、PCR仪、显微镜等。
2. 方法(1)构建锌指核酸酶介导的MSTN基因敲除系统:利用CRISPR/Cas9系统相关原理,设计并构建针对MSTN基因的ZFNs系统。
(2)小鼠基因组DNA提取与ZFNs介导的基因敲除:从小鼠组织中提取基因组DNA,利用ZFNs系统对MSTN基因进行敲除。
(3)敲除效果检测:通过PCR、测序等方法检测MSTN基因敲除效果及对小鼠肌肉生长的影响。
三、实验结果1. ZFNs介导的MSTN基因敲除效率高:通过PCR和测序结果分析,发现ZFNs系统成功介导了MSTN基因的敲除,且敲除效率较高。
2. 敲除MSTN基因对小鼠肌肉生长有显著影响:与对照组相比,MSTN基因敲除后的小鼠肌肉生长量显著增加,表明MSTN 基因在肌肉生长过程中发挥了重要的调控作用。
3. 敲除后小鼠未出现明显的不良反应:通过对小鼠的生长、发育、行为等方面进行观察,未发现明显的不良反应或并发症。
四、讨论本研究利用锌指核酸酶技术成功介导了小鼠MSTN基因的敲除,并证实了MSTN基因在肌肉生长过程中的重要调控作用。
此外,本研究还发现,敲除MSTN基因后的小鼠未出现明显的不良反应,表明该技术具有较高的安全性和可行性。

基因敲除动物模型构建步骤
①. 基因载体的构建:把目的基因和与细胞内靶基因特异片段同源的DNA 分子都重组到带有标记基因(如neo 基因,TK 基因等)的载体上,成为重组载体。
基因敲除是为了使某一基因失去其生理功能,所以一般设计为替换型载体。
②.ES 细胞的获得:现在基因敲除一般采用是胚胎干细胞,最常用的是鼠,而兔,猪,鸡等的胚胎干细胞也有使用。
常用的鼠的种系是129及其杂合体,因为这类小鼠具有自发突变形成畸胎瘤和畸胎肉瘤的倾向,是基因敲除的理想实验动物。
而其他遗传背景的胚胎干细胞系也逐渐被发展应用。
③.同源重组:将重组载体通过一定的方式(电穿孔法或显微注射)导入同源的胚胎干细胞(ES cell)中,使外源DNA 与胚胎干细胞基因组中相应部分发生同源重组,将重组载体中的DNA 序列整合到内源基因组中,从而得以表达。
一般地,显微注射命中率较高,但技术难度较大,电穿孔命中率比显微注射低,但便于使用。
④.选择筛选已击中的细胞:由于基因转移的同源重组自然发生率极低,动物的重组概率为10-2 ~10-5 ,植物的概率为10-4 ~10-5 。
因此如何从众多细胞中筛出真正发生了同源重组的胚胎干细胞非常重要。
目前常用的方法是正负筛选法(PNS法),标记基因的特异位点表达法以及PCR 法。
其中应用最多的是PNS法。
⑤.表型研究:通过观察嵌和体小鼠的生物学形状的变化进而了解目的基因变化前后对小鼠的生物学形状的改变,达到研究目的基因的目的。
⑥.得到纯合体:由于同源重组常常发生在一对染色体上中一条染色体中,所以如果要得到稳定遗传的纯合体基因敲除模型,需要进行至少两代遗传。

Gla基因敲除小鼠构建技术原理
基因敲除小鼠是什么?是否就是我们平日所说的实验室用的小白鼠?其实小鼠有很多种,小白鼠只是其中一种,通常普通的小白鼠多被药厂用作临床试验,而基因敲除的小鼠,则用于更尖端的生物医学研究。
基因敲除小鼠技术原理:是先在小鼠的胚胎干细胞上通过基因重组的办法进行基因修饰——就是将胚胎干细胞中的靶向基因改掉,然后将“修饰”后的胚胎干细胞植入小鼠的早期胚胎,生成嵌合体小鼠。
这种嵌合体小鼠长大后,体内同时存在被“修饰”过的基因和未被“修饰”的基因。
下面是,Gla基因敲除小鼠介绍
基因名:Gla
别名:A;Ags
NCBI号:11605
品系背景:C57BL/6N
修饰方式:conventional knockout
表型提示:MGI:1347344
品系描述:Gla位于小鼠的X号染色体,采用CRISPR/Cas9技术,设计sgRNA,通过应用高通量电转受精卵方式,获得Gla基因敲除小鼠,性成熟后取精子冻存。


《锌指核酸酶介导的小鼠MSTN基因敲除的研究》篇一一、引言随着基因编辑技术的发展,锌指核酸酶(ZFNs)作为一种重要的基因编辑工具,在生物医学领域得到了广泛的应用。
其中,对小鼠肌肉生长抑制素(Muscle Growth Suppressor,MSTN)基因的敲除研究,对于了解肌肉生长机制、改良动物育种以及疾病治疗等方面具有重要意义。
本文旨在探讨锌指核酸酶介导的小鼠MSTN基因敲除的原理、方法及其实验结果。
二、材料与方法1. 材料本实验所需材料包括小鼠胚胎干细胞、锌指核酸酶、基因敲除载体、相关试剂等。
所有材料均经过严格的质量控制,确保实验的准确性。
2. 方法(1)构建锌指核酸酶介导的MSTN基因敲除载体;(2)将敲除载体转入小鼠胚胎干细胞;(3)筛选出阳性克隆,并进行扩增;(4)将扩增后的胚胎干细胞注入小鼠体内,获得基因敲除小鼠;(5)对基因敲除小鼠进行表型分析、基因型鉴定及功能验证。
三、实验结果1. 基因敲除载体的构建与鉴定通过PCR、酶切及测序等方法,成功构建了锌指核酸酶介导的MSTN基因敲除载体,并经过严格的鉴定,确保其正确性。
2. 胚胎干细胞的转染与筛选将构建好的敲除载体转入小鼠胚胎干细胞,经过筛选,成功获得阳性克隆。
扩增后,得到大量可用于后续实验的胚胎干细胞。
3. 基因敲除小鼠的获得与鉴定将扩增后的胚胎干细胞注入小鼠体内,经过一段时间的生长发育,成功获得基因敲除小鼠。
通过PCR、Southern Blot等方法,对基因敲除小鼠进行基因型鉴定,确认MSTN基因已被成功敲除。
4. 表型分析与功能验证对基因敲除小鼠进行表型分析,发现其肌肉生长明显增强。
通过与野生型小鼠进行比较,进一步验证了MSTN基因在肌肉生长中的重要作用。
此外,还对基因敲除小鼠进行了其他相关功能的验证,为后续研究提供了有力支持。
四、讨论本研究利用锌指核酸酶介导的方法,成功实现了小鼠MSTN 基因的敲除。
通过对基因敲除小鼠的表型分析和功能验证,证实了MSTN基因在肌肉生长中的重要作用。

使用CRISPR-CAS系统构建可遗传的基因敲除小鼠和大鼠致编辑:CRISPR-CAS系统已经成为一种细胞和模式生物中有效的基因编辑技术。
我们使用CRISPR-CAS系统,通过同时注入两种单导向RNA靶向Uhrf2,同时带入Cas9 mRNA来诱导小鼠的DNA片段缺失。
此外,我们通过一种单一的显微注射方法得到了敲除Mc3R和Mc4R两种基因的大鼠。
在小鼠和大鼠中均观察到较高的种系转移效率(突变可遗传)。
成簇有序间隔短回文重复关联蛋白系统(CRISPR-CAS系统)是一种在细菌和古细菌中演变的针对病毒和质粒入侵的基于RNA的后天免疫系统。
【Bamboo注:该系统由一段Cas基因(双链DNA核酸酶)加一段特异序列组成,Cas作用为结合导向RNA,切割目的基因,导向RNA为CRISPR序列转录而成,有二级结构】根据作用机制不同,CRISPR-CAS系统目前有三种类型。
在第二类型(下文称该系统)中,CRISPR序列转录RNA(crRNA)和反式激活RNA(TraceRNA)结合后有能力引导Cas9核酸内切酶到特定的序列,从而导致目标DNA双链缺失。
【Bamboo注:机理:摄取了病毒DNA后,CRISPR 序列在转录产物tracrRNA,表达产物CAS蛋白,RNA酶共同作用下产生导向RNA,导向RNA含有病毒DNA序列,可遗传给下一代,再遇到病毒DNA时将其剪切】之前的研究表明在哺乳动物中有多种基因工程使用RNA介导的Cas9核酸酶系统。
最近,使用该系统进行高效基因编辑已经在斑马鱼、小鼠和细菌中实现。
几个小组也证明通过该系统介导的在细胞和斑马鱼中基因靶向效率与ZFNs(锌指核酸酶)和TALENs(转录活化因子效应核酸酶)【Bamboo注:另外两种常见DNA编辑方式】相似或较高。
虽然已经有报道在单个小鼠胚胎中可使用该系统打乱多个基因,但是在动物体中尚未见该系统介导的突变种系转移。
此外,长的特异的基因组DNA片段能否被该系统敲除也是未知的。

基因敲除小鼠的原理嘿,小伙伴们!今天咱们来聊聊基因敲除小鼠这个超级有趣的东西。
想象一下,小鼠的基因就像一本本小秘籍,每本秘籍都写着小鼠身体各个部分怎么生长、怎么工作。
而基因敲除呢,就像是一个调皮的小魔法师,把其中一本秘籍的好多页给撕掉或者改写了。
那这个小魔法师是怎么做到的呢?首先呢,科学家们得找到一种很厉害的工具,这个工具就像是一把超级小剪刀,这个小剪刀的名字叫做核酸内切酶。
它能专门识别小鼠基因里特定的小片段,就像钥匙和锁一样匹配。
比如说,有个基因片段长得像个小月亮,那这把小剪刀就专门找这种小月亮形状的片段。
然后呢,当小剪刀找到这个特定的片段后,咔嚓一下就把这个片段给剪断啦。
这一剪断可不得了,就像在那本秘籍中间挖了个大坑一样。
这个基因片段被剪断以后啊,小鼠的身体就会像突然接到了一个错误指令。
原本这个基因告诉身体要长出长长的尾巴,现在因为这个基因被破坏了,可能尾巴就长不长啦,或者长得奇奇怪怪的。
但是这个过程可不是随随便便就能成功的哦。
科学家们要做很多准备工作。
他们得精心挑选那些能够准确找到目标基因的小剪刀,这就好比是在一堆钥匙里找一把能开特定锁的钥匙,得特别细心才行。
而且,这个小剪刀要很稳定,不能乱剪其他不该剪的基因片段,不然小鼠身体里就乱套啦,就像把整个图书馆的书都弄乱了一样。
在这个过程中呢,还有一个很重要的步骤,就是要把这把小剪刀送到小鼠的细胞里面去。
这可不容易呢,就像要把一个小快递准确无误地送到一个超级小的收件箱里。
科学家们有时候会用一些特殊的方法,比如说把小剪刀和一些能轻松进入细胞的小物质结合起来,就像给小剪刀装上了一个导航仪,让它能顺利地到达目的地。
一旦小剪刀成功进入细胞,并且找到了目标基因并且剪断了它,这个细胞就开始按照新的指令来工作啦。
这个新的指令就是没有了被敲除的那个基因的指令。
然后这个细胞就会不断地分裂,产生更多的细胞,每个细胞都带着这个被改变的基因信息。
慢慢地,整只小鼠就会表现出因为这个基因被敲除而产生的各种变化啦。

双基因敲除小鼠繁殖工作:CRISPR/Cas9方案构建双基因敲除鼠,得到F0杂合子之后,如何建系才能获得双基因敲除纯合子小鼠?这是经常被问到的问题,下面就简单回答一下。
假设我们的目的基因为A和B,通常用CRISPR/Cas9方法得到的基因敲除鼠为杂合子,双杂合子小鼠基因型为AaBb,大写字母代表野生型(dominant),小写字母代表突变型(recessive)。
得到F0杂合子(AaBb)之后,可以用以下方案之一来获得双基因敲除纯合子小鼠:方案一:1.将双杂合子小鼠(AaBb)与野生鼠(AABB)交配,理论上将得到25%的野生型(AABB),25%基因A单杂合子(AaBB),25%基因B单杂合子(AABb)及25%双杂合子小鼠(AaBb)。
2.将所得到的双杂合子小鼠(AaBb)互交(inter-cross),理论上6.25%的后代将会是双基因敲除纯合子小鼠(aabb),见下图。
3.由于双基因敲除实验中一般都需要单基因敲除动物作为对照,所以在进行上面小鼠breeding的同时可以将基因A单杂合子(AaBB)互交,在后代中鉴定出基因A纯合子(aaBB),同样将基因B单杂合子(AABb)互交,在后代中鉴定出基因B纯合子(AAbb)。
方案二:将双杂合子小鼠(AaBb)与单基因纯合子(如aaBB)交配,所生小鼠中约25%为基因A纯合子而基因B杂合子(aaBb,见下图左)。
然后将aaBb小鼠互交,理论上后代小鼠中25%为双基因敲除纯合子小鼠(aabb),见下图右。
需要特别注意的几个问题:1)上面所讲的方法适用于位于不同的染色体两个基因的基因敲除,如果两个基因位于同一条染色体上,要通过上述方法得到双基因敲除纯合子小鼠很难;2)上述方法有赖于基因特异性的Genotyping PCR assays。
在开始setup breeding之前必须将两个目的基因特异性的Genotyping PCRassays 准备好;3)要事先研究一下目的基因敲除后有无胚胎致死性,是否影响其生长发育等。

第1篇一、实验背景随着神经科学研究的深入,理解大脑的基因调控机制对于揭示神经疾病的发生机理和开发新的治疗方法具有重要意义。
本研究旨在通过基因编辑技术,探究特定基因在小鼠大脑发育和功能中的作用,为相关疾病的预防和治疗提供新的思路。
二、实验目的1. 利用CRISPR/Cas9基因编辑技术敲除小鼠大脑中特定基因。
2. 观察基因敲除对小鼠大脑发育、行为和认知功能的影响。
3. 分析敲除基因对小鼠大脑中相关通路和基因表达的影响。
三、实验材料与方法1. 实验材料- 小鼠胚胎干细胞(ES细胞)- CRISPR/Cas9系统- 实验小鼠(C57BL/6小鼠)- 实验试剂:DNA聚合酶、限制性内切酶、DNA连接酶、PCR引物等2. 实验方法(1)基因编辑1. 设计靶向特定基因的CRISPR/Cas9系统,包括sgRNA和Cas9蛋白。
2. 将sgRNA和Cas9蛋白导入小鼠ES细胞,进行基因编辑。
3. 对编辑后的ES细胞进行筛选,获得基因敲除的细胞系。
4. 将基因敲除的细胞系注射到C57BL/6小鼠的受精卵中,获得基因敲除的小鼠。
(2)小鼠行为和认知功能测试1. 观察基因敲除小鼠的生长发育、行为和运动能力。
2. 对小鼠进行认知功能测试,包括Morris水迷宫实验、Y迷宫实验等。
(3)基因表达分析1. 提取小鼠大脑样本,进行RNA提取和cDNA合成。
2. 利用PCR、RT-qPCR等方法检测敲除基因的表达水平。
3. 对小鼠大脑样本进行蛋白质组学分析,检测相关蛋白的表达水平。
四、实验结果1. 基因敲除成功敲除了小鼠大脑中特定基因,并通过PCR、RT-qPCR等方法验证了基因敲除的效果。
2. 小鼠行为和认知功能与野生型小鼠相比,基因敲除小鼠在Morris水迷宫实验中表现出明显的空间学习障碍,提示该基因可能参与小鼠的认知功能。
3. 基因表达分析敲除基因后,小鼠大脑中相关通路和基因表达发生了显著变化。
具体表现为:1. 神经递质合成酶的表达水平降低。

条件性敲除小鼠定义:条件性基因敲除小鼠(也叫Flox小鼠)是指在目的基因中含有成对的loxp位点的小鼠,与Cre工具小鼠交配后可在特定的组织或细胞中敲除目的基因。
CKO如何实现?重组酶系统(如:Cre-loxP)介导的位点特异性重组技术。
Cre是重组酶(38kDa),可识别34bp 长的DNA 序列loxP。
loxP 两侧各13bp 构成回文结构,中间8bp为非回文结构,因此loxp具有方向性。
(当DNA 分子上存在两个同向loxP 序列时,Cre可将两个loxP 序列之间的DNA 片段切出并环化,同时将loxP 两侧的序列进行连接;当DNA 分子上存在两个方向相反的loxP 序列时,Cre 可导致loxP 之间的序列发生反转。
)CKO敲除的是什么?条件性基因敲除的靶基因中必须带有可以被Cre 重组酶识别的loxP 序列,这种基因称为floxed gene。
带有floxed 靶基因的小鼠称为flox 小鼠。
在这种小鼠中,通常采用DNA 同源重组方法,在拟敲除基因片段的两侧分别放置一个同向的loxP 位点。
loxP 位点的存在应不影响该基因的功能,故选择对照为flox/flox小鼠CKO敲除何时何地发生?除了flox 小鼠以外,重组酶系统介导的条件性基因敲除还需要另一类重要的基因工程小鼠的参与——Cre 工具鼠。
Cre 工具鼠中,将Cre 重组酶的编码序列置于特定的基因启动子下,Cre 的表达特性决定了靶基因何时何地发生敲除。
Cre 在哪一种组织细胞中表达,靶基因的敲除就发生在哪种组织细胞;Cre 的表达水平将影响靶基因在此种组织细胞中进行修饰的效率;使用诱导型Cre 重组酶可以通过给予诱导剂,决定在特定的发育时期或疾病发生阶段,定时地进行基因敲除。
(范衡宇老师课件)实验时,将flox 小鼠和Cre 工具鼠进行交配,最后获得flox 纯合且Cre 杂合的小鼠。
在这类小鼠中,凡是表达Cre 的细胞,两个loxP 之间的序列被切除,从而实现组织特异性基因敲除。
基因敲除小鼠的方法
1. CRISPR/Cas9基因编辑技术,CRISPR/Cas9技术是一种高效的基因编辑工具,可以用来精确地敲除小鼠基因。
首先,科学家设计合成一段RNA序列,使其与目标基因序列相匹配,然后将这段RNA和Cas9蛋白复合体导入小鼠胚胎内。
复合体会通过识别并切割目标基因,导致基因敲除。
2. 胚胎干细胞技术,另一种常见的基因敲除小鼠方法是利用胚胎干细胞。
科学家可以将设计好的基因敲除载体导入小鼠胚胎干细胞中,使其发生基因敲除。
然后,这些修改过的干细胞可以被植入小鼠胚胎内,从而产生基因敲除小鼠。
3. 遗传改造小鼠技术,除了CRISPR/Cas9和胚胎干细胞技术,科学家还可以利用遗传改造技术来实现基因敲除。
这种方法涉及到选择性育种和杂交,通过选择性地交配和繁殖,最终得到具有特定基因敲除的小鼠品系。
总的来说,基因敲除小鼠的方法主要包括CRISPR/Cas9基因编辑技术、胚胎干细胞技术和遗传改造小鼠技术。
这些方法都是在实验室条件下进行的,需要经过严格的实验设计和操作流程,以确保
基因敲除的准确性和有效性。
同时,这些方法也为科学家提供了强大的工具,用于研究基因在生物体内的功能和作用机制。
基因敲除小鼠的实验流程1.设计基因敲除小鼠实验方案在开始实验之前,需要明确研究目的,确定需要敲除的基因,并设计相应的实验方案。
一般可以使用 CRISPR-Cas9 系统来实现基因敲除,在设计基因敲除实验方案时,需要选择合适的 sgRNA 序列,以及设计恰当的引物用于检测突变。
2.获得基因敲除小鼠的胚胎干细胞为了实现基因敲除,需要获得基因敲除小鼠的胚胎干细胞。
一种常用的方法是利用胚胎干细胞对外源DNA的高度易感性,将敲除基因的质粒DNA转染到小鼠胚胎干细胞中。
3.筛选敲除基因的胚胎干细胞株系将转染了敲除基因的胚胎干细胞以悬浮培养的方式进行培养,培养一段时间后,利用一定的筛选条件来筛选出含有敲除基因的胚胎干细胞株系。
筛选条件可包括对抗生素的使用或筛选标记基因的表达。
4.制备敲除基因小鼠的固定胚胎干细胞系通过体外培养,将敲除基因的胚胎干细胞系定植在培养皿上,培养数代以后,将其冻存,以备后续的实验使用。
5.实施敲除基因小鼠的胚胎干细胞基因改造将固定的胚胎干细胞系重新激活,转染 Cas9 和 sgRNA,利用CRISPR-Cas9 系统使这些细胞具有敲除基因的突变。
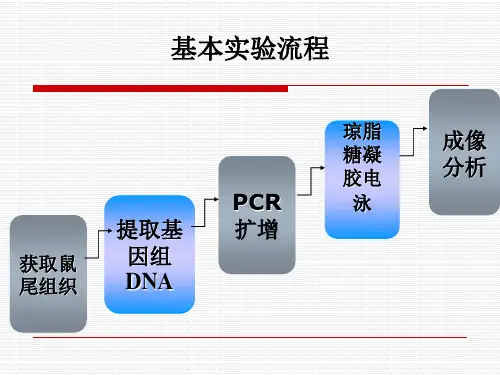
6.识别敲除基因的胚胎干细胞阳性克隆株对转染了 Cas9 和 sgRNA 的胚胎干细胞进行筛选,通过 PCR、Western blot、Southern blot等技术方法识别出敲除了目标基因的阳性克隆株。
7.将敲除基因的胚胎干细胞注入小鼠的早期胚胎取出已受精的小鼠卵母细胞,利用显微操作将敲除基因的胚胎干细胞注入到小鼠的早期胚胎中。
利用体外受精或者通过体内或体外的胚胎移植方式将基因敲除干细胞注入受体小鼠。
8.制备基因敲除小鼠的嵌合小鼠将已注入敲除基因的胚胎干细胞的受体小鼠进行嵌合以产生基因敲除小鼠。
嵌合可以通过体内或体外的胚胎移植方式进行。
9.筛选识别基因敲除小鼠对产生的嵌合小鼠进行筛选,确认敲除基因是否成功。
可以通过 PCR、Western blot、Southern blot等技术方法对小鼠体细胞或组织进行分析。
基因敲除鼠的构建方法
基因敲除鼠是一种重要的遗传工具,它们能够帮助科学家们研究基因在生物学过程中的作用。
基因敲除鼠构建方法主要包括以下步骤: 1. 设计基因敲除鼠的目标基因序列,选择合适的外显子或内含
子进行靶向敲除。
2. 制备CRISPR/Cas9系统,包括Cas9蛋白、sgRNA以及质粒载体等。
3. 将CRISPR/Cas9系统导入到鼠胚胎干细胞中,使用
CRISPR/Cas9系统导致目标基因的敲除。
4. 鉴定敲除鼠胚胎干细胞中基因敲除的效率,通过PCR、Western blot等方法验证敲除效果。
5. 将基因敲除鼠胚胎干细胞注入到新生小鼠的内脏器官进行移植,培养出基因敲除小鼠。
基因敲除鼠的构建方法是一项复杂的工程,需要科学家们对基因编辑技术的熟练掌握和实验经验。
通过基因敲除鼠的研究,科学家们能够更加深入地了解基因在生物体内的作用,为疾病治疗和新药研发提供更为有效的手段。
- 1 -。
基因敲除小鼠原理基因敲除是一种常用的遗传工程技术,它通过人为地改变生物体的基因组,使得某个特定基因在生物体中失去功能。
基因敲除技术在动物模型研究中得到了广泛的应用,特别是在小鼠模型的构建中发挥着重要作用。
下面将介绍基因敲除小鼠的原理及其应用。
基因敲除小鼠原理。
基因敲除小鼠是指通过基因工程技术,将小鼠的某个特定基因进行改变,使得该基因在小鼠体内失去功能。
基因敲除小鼠的构建通常分为以下几个步骤:1. 选择目标基因,首先需要选择需要敲除的目标基因,通常选择与某种疾病或生理过程相关的基因作为目标。
2. 构建敲除载体,将目标基因的敲除载体导入到小鼠的胚胎干细胞中,使得目标基因在胚胎干细胞中发生敲除。
3. 胚胎干细胞筛选,经过敲除载体导入后,对胚胎干细胞进行筛选,筛选出发生了基因敲除的干细胞。
4. 小鼠胚胎的移植,将发生了基因敲除的胚胎干细胞移植到受精小鼠卵母细胞内,通过体外培育和移植到母体小鼠子宫内,使得基因敲除小鼠的胚胎发育成熟。
5. 基因敲除小鼠的鉴定,对出生的小鼠进行基因型分析,确认是否成功构建了基因敲除小鼠模型。
基因敲除小鼠的应用。
基因敲除小鼠模型在生物医学研究中有着广泛的应用,主要包括以下几个方面:1. 功能基因研究,通过敲除特定基因,可以研究该基因在生物体内的功能及其对生物体生理过程的影响,为相关疾病的研究提供重要的实验模型。
2. 疾病模型构建,基因敲除小鼠模型可用于构建各种疾病模型,如肿瘤模型、免疫缺陷病模型等,用于研究疾病的发病机制及寻找治疗方法。
3. 药物筛选,基因敲除小鼠模型可用于药物的筛选和评价,通过观察敲除某个基因后对药物疗效的影响,为新药的研发提供重要参考。
4. 基因治疗研究,基因敲除小鼠模型可用于基因治疗的研究,通过敲除某个致病基因或导入正常基因,探索基因治疗的可行性及疗效。
总结。
基因敲除小鼠模型是一种重要的生物医学研究工具,通过对特定基因的敲除,可以研究该基因在生物体内的功能及其对生理过程的影响,为相关疾病的研究提供重要的实验模型。
CRISPR-CAS9基因敲除原理
CRISPR/Cas9(Clustered Regularly Interspaced Short Palindromic Repeats)是最新出现的一种由RNA指导Cas核酸酶对靶向基因进行特定DNA修饰的技术。
CRISPR 是细菌和古细菌为应对病毒和质粒不断攻击而演化来的获得性免疫防御机制。
在这一系统中,crRNA(CRISPR-derived RNA)通过碱基配对与tracrRNA(trans-activating RNA)结合形成双链RNA,此tracrRNA/crRNA二元复合体指导Cas9蛋白在crRNA引导序列靶定位点剪切双链DNA达到对基因组DNA进行修饰的目的。
Cas9结合gRNA,gRNA 的长度约为80个核苷酸,包含两个区域:gRNA 5' 端前20个核苷酸对应于靶标DNA,能结合在靶DNA 上的约60个核苷酸(gRNA 长度取决于表达gRNA 的质粒)形成一个发夹结构,这个结构能帮助gRNA 与Cas9结合,并由此指导与DNA 的结合。
通过gRNA上的靶点序列,在目标基因组上找到靶点序列,并揭开双螺旋,Cas9将剪切DNA双链,造成DNA双链断裂。
Cas9使用简单,可满足多个靶点同时操作。
Insertion
/deletion
HDR
gRNA
Cas9
Donor vector
基因敲除小鼠流程:。