基因敲除小鼠技术共9页word资料
- 格式:docx
- 大小:80.57 KB
- 文档页数:9

基因敲除小鼠(Knockoutmice)制备技术方法基因敲除小鼠,人们使用复杂的方法使小鼠体内的某一个基因不表达,从而使小鼠呈现这个基因缺失的状态,可用于研究这个基因的功能。
但如果某个基因功能特别重要,这个基因缺失可能具有胚胎致死性,那我们就无法得到这种基因敲除的小鼠了,于是人们发明了条件性基因敲除技术。
这一技术可以实现在特定的时间、特定的细胞或组织内使某个基因沉默。
方法是首先在目的基因(就是打算敲除的那个基因)的两侧分别插入一段名为LoxP的DNA序列(LoxP序列是一段34bp的DNA序列,两端的13个碱基为回文序列,中间的8个碱基决定LoxP的方向。
然后我们需要用到一种带有Cre酶的转基因小鼠了。
Cre重组酶于1981年从P1噬菌体中发现,属于λ Int酶超基因家族。
Cre重组酶基因编码区序列全长1029bp(EMBL数据库登录号X03453),编码38kDa蛋白质。
是一种位点特异性重组酶,能介导两个LoxP位点(序列)之间的特异性重组,使LoxP位点间的基因序列被删除或重组。
LoxP(locus of X-over P1)序列来源于P1噬菌体,是有两个13bp反向重复序列和中间间隔的8bp序列共同组成,8bp的间隔序列同时也确定了LoxP的方向。
Cre 在催化DNA链交换过程中与DNA共价结合,13bp的反向重复序列是Cre酶的结合域。
其序列如下:5' - ATAACTTCGTATA - ATGTATGC - TATACGAAGTTAT - 3'3' - TATTGAAGCATAT - TACATACG - ATATGCTTCAATA - 5'Cre-LoxP系统的特性Cre重组酶介导两个LoxP位点间的重组是一个动态、可逆的过程,可以分成三种情况:1、如果两个LoxP位点位于一条DNA链上,且方向相同,Cre重组酶能有效切除两个LoxP位点间的序列;2、如果两个LoxP位点位于一条DNA链上,但方向相反,Cre重组酶能导致两个LoxP位点间的序列倒位;3、如果两个LoxP位点分别位于两条不同的DNA链或染色体上,Cre酶能介导两条DNA链的交换或染色体易位。



CRISPR/Cas9 是细菌和古细菌在长期演化过程中形成的一种适应性免疫防御,可用来对抗入侵的病毒及外源DNA。
CRISPR/Cas9 系统通过将入侵噬菌体和质粒DNA 的片段整合到CRISPR 中,并利用相应的CRISPR RNAs(crRNAs)来指导同源序列的降解,从而提供免疫性。
原理此系统的工作原理是crRNA(CRISPR—derived RNA )通过碱基配对与tracrRNA (trans-activating RNA )结合形成tracrRNA/crRNA 复合物,此复合物引导核酸酶Cas9 蛋白在与crRNA 配对的序列靶位点剪切双链DNA。
而通过人工设计这两种RNA,可以改造形成具有引导作用的sgRNA (singleguide RNA ),足以引导Cas9 对DNA 的定点切割。
作为一种RNA 导向的dsDNA 结合蛋白,Cas9 效应物核酸酶是已知的第一个统一因子(unifying factor),能够共定位RNA、DNA 和蛋白,从而拥有巨大的改造潜力。
将蛋白与无核酸酶的Cas9(Cas9 nuclease-null)融合,并表达适当的sgRNA ,可靶定任何dsDNA 序列,而sgRNA 的末端可连接到目标DNA,不影响Cas9 的结合。
因此,Cas9 能在任何dsDNA 序列处带来任何融合蛋白及RNA,这为生物体的研究和改造带来巨大潜力.应用基因敲除动物模型一直以来是在活体动物上开展基因功能研究、寻找合适药物作用靶标的重要工具.但是传统的基因敲除方法需要通过复杂的打靶载体构建、ES细胞筛选、嵌合体小鼠选育等一系列步骤,不仅流程繁琐、对技术的要求很高,而且费用大,耗时较长,成功率受到多方面因素的限制。
即使对于技术比较成熟的实验室,利用传统技术构建基因敲除大、小鼠一般也需要一年以上。
2013 年1 月份,美国两个实验室在《Science》杂志发表了基于CRISPR—Cas9 技术在细胞系中进行基因敲除的新方法,该技术与以往的技术不同,是利用靶点特异性的RNA 将Cas9 核酸酶带到基因组上的具体靶点,从而对特定基因位点进行切割导致突变。

基因敲除小鼠pc鉴一、技术介绍与研究进展敲除动物技术已经/ 基因、基因敲入转该技术从上世成为现代生命科学基础研究和药物研发领域不可或缺的重要技术,原核显史,经典技术如DNA纪七八十年代诞生以来,至今已有近四十年的历在小鼠模型构建方面日趋微注射、胚胎干细胞显微注射技术一直以来经久不衰,制备技术一样,逐渐从完善,并且如同剪切酶和抗体等常规分子生物学试剂的催生了数以百基础研究实验室转向商业模式,成为一项高度标准化的新兴产业,然存在一些难以计的创新药物和数以千计的优秀文章。
尽管如此,传统技术仍TALEN和费用高昂等,而ZFN克服的缺陷,如步骤繁琐、周期漫长、成功率低、等新技术的出现,或有可能将这一局面彻底改变。
二、同源重组技术原理同源重组的原理发展起来的,年代中后期基于DNA基因敲除鼠技术是上世纪80)homologous recombination1987年根据同源重组(在Capecchi和Smithies),这的外源基因的定点整合(EStargeted integration的原理,首次实现了),gene knockout(基因敲除)或gene targeting(基因打靶一技术称为利用这种ES的显微注射就可以制作出基因敲出小鼠(KO Mice: knockout mice);由于这一工作,Capecchi和Smithies于2007年与Evans分享了诺贝尔医学奖。
同源重组(homologous recombination)定义:是指发生在姐妹染色单体(sister chromatin) 之间或同一染色体上含有同源序列的DNA分子之间或分子之内的重新组合。
在基因敲除小鼠制作过程中,需要针对目的基因两端特异性片段设计带有相同片段的重组载体,将重组载体导入到胚胎干细胞后外源的重组载体与胚胎干细胞中相同的片段会发生同源重组,如图1所示:1.基因敲除鼠制作同源重组原理示意图图制作流程三、.基因敲除鼠制作过程示意图图2. 载体设计与构建1. Knockout根据研究项目具体情况和要求把目的基因和与细胞内靶基因特异片段同源的的载体上,成为重基因等TK )基因,如片段都重组到带有标记基因DNA (neoKnockout组的载体。

⽤CRISPRCas9⽅案构建双基因敲除⿏,获得双基因敲除纯合⼦⼩⿏的交配⽅案双基因敲除⼩⿏繁殖⼯作:CRISPR/Cas9⽅案构建双基因敲除⿏,得到F0杂合⼦之后,如何建系才能获得双基因敲除纯合⼦⼩⿏?这是经常被问到的问题,下⾯就简单回答⼀下。
假设我们的⽬的基因为A和B,通常⽤CRISPR/Cas9⽅法得到的基因敲除⿏为杂合⼦,双杂合⼦⼩⿏基因型为AaBb,⼤写字母代表野⽣型(dominant),⼩写字母代表突变型(recessive)。
得到F0杂合⼦(AaBb)之后,可以⽤以下⽅案之⼀来获得双基因敲除纯合⼦⼩⿏:⽅案⼀:1.将双杂合⼦⼩⿏(AaBb)与野⽣⿏(AABB)交配,理论上将得到25%的野⽣型(AABB),25%基因A单杂合⼦(AaBB),25%基因B单杂合⼦(AABb)及25%双杂合⼦⼩⿏(AaBb)。
2.将所得到的双杂合⼦⼩⿏(AaBb)互交(inter-cross),理论上6.25%的后代将会是双基因敲除纯合⼦⼩⿏(aabb),见下图。
3.由于双基因敲除实验中⼀般都需要单基因敲除动物作为对照,所以在进⾏上⾯⼩⿏breeding的同时可以将基因A单杂合⼦(AaBB)互交,在后代中鉴定出基因A纯合⼦(aaBB),同样将基因B单杂合⼦(AABb)互交,在后代中鉴定出基因B纯合⼦(AAbb)。
⽅案⼆:将双杂合⼦⼩⿏(AaBb)与单基因纯合⼦(如aaBB)交配,所⽣⼩⿏中约25%为基因A纯合⼦⽽基因B杂合⼦(aaBb,见下图左)。
然后将aaBb⼩⿏互交,理论上后代⼩⿏中25%为双基因敲除纯合⼦⼩⿏(aabb),见下图右。
需要特别注意的⼏个问题:1)上⾯所讲的⽅法适⽤于位于不同的染⾊体两个基因的基因敲除,如果两个基因位于同⼀条染⾊体上,要通过上述⽅法得到双基因敲除纯合⼦⼩⿏很难;2)上述⽅法有赖于基因特异性的Genotyping PCR assays。
在开始set up breeding之前必须将两个⽬的基因特异性的Genotyping PCR assays 准备好;3)要事先研究⼀下⽬的基因敲除后有⽆胚胎致死性,是否影响其⽣长发育等。

ApoE基因敲除小鼠模型特点及原理介绍
展开全文
ApoE小鼠品系名:C57BL/6
ApoE小鼠毛色:黑色
ApoE小鼠基因名:Apoe, apolipoprotein E
ApoE小鼠染色体:7号
ApoE小鼠打靶技术:同源重组
ApoE小鼠基因型:ApoE(-/-)
ApoE小鼠表型特征:ApoE基因剔除小鼠模型表现出异常高血脂症状,随着月龄增加将出现大量类似动脉粥样硬化前期的损伤。
ApoE基因敲除小鼠简介:
ApoE基因敲除小鼠是通过同源重组技术制备的具有3号外显子纯合缺失的小鼠模型。
该小鼠模型表现出异常高血脂症状,在3月龄时即出现动脉脂肪堆积。
随着月龄增加将出现大量类似动脉粥样硬化前期的损伤。
17月龄时小鼠脑内将出现脂瘤性纤维瘤,同时还有脂质小球和泡沫细胞。
最新研究还发现该基因剔除小鼠的学习记忆能力出现障碍(赛业可提供ApoE小鼠)。
ApoE基因是目前国内外研究的热点之一,ApoE与CHD、高脂血症、脑梗塞、AD及慢性乙型肝炎等疾病相关。
ApoE基因敲除小鼠是研究该基因与多种相关疾病的重要模型。
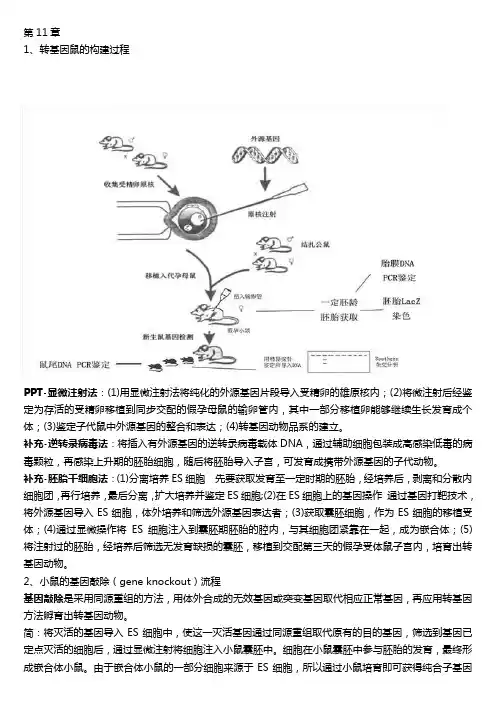
第11章1、转基因鼠的构建过程PPT-显微注射法:(1)用显微注射法将纯化的外源基因片段导入受精卵的雄原核内;(2)将微注射后经鉴定为存活的受精卵移植到同步交配的假孕母鼠的输卵管内,其中一部分移植卵能够继续生长发育成个体;(3)鉴定子代鼠中外源基因的整合和表达;(4)转基因动物品系的建立。
补充-逆转录病毒法:将插入有外源基因的逆转录病毒载体DNA,通过辅助细胞包装成高感染低毒的病毒颗粒,再感染上升期的胚胎细胞,随后将胚胎导入子宫,可发育成携带外源基因的子代动物。
补充-胚胎干细胞法:(1)分离培养ES细胞先要获取发育至一定时期的胚胎,经培养后,剥离和分散内细胞团,再行培养,最后分离,扩大培养并鉴定ES细胞;(2)在ES细胞上的基因操作通过基因打靶技术,将外源基因导入ES细胞,体外培养和筛选外源基因表达者;(3)获取囊胚细胞,作为ES细胞的移植受体;(4)通过显微操作将ES细胞注入到囊胚期胚胎的腔内,与其细胞团紧靠在一起,成为嵌合体;(5)将注射过的胚胎,经培养后筛选无发育缺损的囊胚,移植到交配第三天的假孕受体鼠子宫内,培育出转基因动物。
2、小鼠的基因敲除(gene knockout)流程基因敲除是采用同源重组的方法,用体外合成的无效基因或突变基因取代相应正常基因,再应用转基因方法孵育出转基因动物。
简:将灭活的基因导入ES细胞中,使这一灭活基因通过同源重组取代原有的目的基因,筛选到基因已定点灭活的细胞后,通过显微注射将细胞注入小鼠囊胚中。
细胞在小鼠囊胚中参与胚胎的发育,最终形成嵌合体小鼠。
由于嵌合体小鼠的一部分细胞来源于ES细胞,所以通过小鼠培育即可获得纯合子基因敲除小鼠。
繁:a.获取ES细胞b.基因载体的构建:把目的基因和与细胞内靶基因特异片段同源的DNA分子都重组到带有标记基因的载体上,此重组载体即为打靶载体。
c.将基因打靶载体通过一定的方式(常用电穿孔法)导入同源的胚胎干细胞(EScell)中,使外源DNA与胚胎干细胞基因组中相应部分发生同源重组,将打靶载体中的DNA序列整合到内源基因组中从而得以表达。

Park2基因敲除小鼠模型构建技术原理1、背景信息神经退行性疾病(Neurodegenerative diseases)多发于老年群体,具有病情发展缓慢、发病率高、治愈率低等特点,对患者的健康生活造成较大的影响。
常见的多为遗传和环境风险因素共同作用导致的复杂神经退行性疾病,阿尔茨海默病( Alzheimer's disease,AD) 和帕金森病(Parkinson's disease,PD)是中枢神经退行性疾病中发病率分别位居第一、第二的疾病。
尽管临床症状和神经病理学特征具有显著差异,但帕金森病与阿尔茨海默病具有部分共同的遗传病因。
Park2基因敲除小鼠可用于神经退行性疾病的研究。
PARK2基因又称Parkin基因,其表达产物为Parkin蛋白,1998年Kitada等发现该基因突变可导致常染色体隐性遗传性青少年型帕金森综合征。
据文献报道PARK2的表达在维持神经系统功能方面具有重要作用。
Parkin通过抑制线粒体依赖性和非依赖性细胞凋亡来增强细胞存活。
Parkin被定性为具有抗糖酵解和抗氧化能力的关键肿瘤抑制因子。
突变与线粒体功能障碍有关,导致帕金森病的神经元死亡和肿瘤发生中的异常代谢。
2、基因信息● Gene symbol: Prkn● Gene name: parkin RBR E3 ubiquitin protein ligase● Gene IDsMGI: 1355296NCBI Gene: 50873● 位置:位于小鼠17号染色体上3、应用模拟人类常染色体隐性幼年帕金森病患者中最常见的外显子3缺失突变,可用于帕金森病,多巴胺调节,黑质纹状体功能,线粒体功能、肿瘤形成或其他神经生物学的研究。
4、品系状态冻存精子,活体5、技术CRISPR/Cas9技术。

基因敲除小鼠概念及原理
基因敲除小鼠是一种通过基因敲除技术创造出来的实验动物模型。
基因敲除技术是一种新的分子生物学技术,建立在基因同源重组技术基础以及胚胎干细胞技术基础上。
基因敲除就是通过同源重组将外源基因定点整合入靶细胞基因组上某一确定的位点,以达到定点修饰改造染色体上某一基因的目的的一种技术。
基因敲除小鼠的原理是利用基因同源重组进行基因敲除。
具体来说,通过同源重组将外源基因定点整合入小鼠的基因组上某一确定的位点,以达到定点修饰改造染色体上某一基因的目的。
这种技术克服了随机整合的盲目性和偶然性,是一种理想的修饰、改造生物遗传物质的方法。
基因敲除小鼠具有广泛的应用前景和商业价值,特别是在发育生物学、分子遗传学、免疫学及医学等学科的研究和治疗中。
这种技术的出现为这些学科提供了一个全新的、强有力的研究、治疗手段,具有重要的意义。
ASIC1基因敲除小鼠的繁殖及基因鉴定周仁鹏;吴小山;王志森;葛金芳;陈飞虎【摘要】To breed and identify acid sensing ion channel 1(ASIC1) gene knockout mice, so as to lay the founda-tion for studying ASIC1 protein. The heterozygote mice were bred and reproduced. Genome DNA extracted from the murine tail was subjected to PCR test for genotype identification. Breeding and reproducing of ASIC1 knockout mice were both successful,and the genotypes of the offspring mice were heterozygous( ASIC1+/ -) ,homozygous( ASIC1-/ -) ,and wild-type( ASIC1+/ +) . Appropriate methods of breeding,reproducing and identifying can effective-ly obtain ASIC1-/ - mice.%饲养并繁殖酸敏感离子通道1(ASIC1)基因敲除杂合子小鼠,提取小鼠尾部组织DNA,采用聚合酶链反应( PCR)方法鉴定子代小鼠基因型. ASIC1 基因敲除小鼠的繁育和鉴定均获得成功,子代小鼠基因型分别为杂合子( ASIC1+/-)、纯合子( ASIC1-/ -)和野生型( ASIC1+/ +).【期刊名称】《安徽医科大学学报》【年(卷),期】2015(050)009【总页数】3页(P1341-1343)【关键词】ASIC1;基因敲除小鼠;PCR【作者】周仁鹏;吴小山;王志森;葛金芳;陈飞虎【作者单位】安徽医科大学药学院,合肥 230032;安徽医科大学药学院,合肥230032;安徽医科大学药学院,合肥 230032;安徽医科大学药学院,合肥 230032;安徽医科大学药学院,合肥 230032【正文语种】中文【中图分类】R-332酸敏感离子通道(acid sensing ion channels,ASICs)是一类胞外H+激活的阳离子通道,属于阿米洛利敏感的上皮钠通道/退变素(epithelialNa+channels/degenerin,ENaC/DEG)超家族[1]。
CRISPRCas9基因敲除小鼠模型
根据基因序列设计合成sgRNA,针对Knockin插入点或点突变位置构建含Knockin片段或点突变的同源序列,与Cas9 mRNA共同注射到小鼠受精卵胞质,Cas9核酸酶、sgRNA、基因组靶序列结合并切割双链DNA,以含Knockin的同源序列为模版修复基因组DNA,最终获得在目的DNA序列插入Knockin片段或点突变的Knockin小鼠。
根据基因序列设计合成两个sgRNA,分别针对两个Loxp的插入点,构建含Loxp的同源序列,与Cas9 mRNA共同注射到小鼠受精卵胞质,Cas9核糖酶、sgRNA、基因组靶序列结合并切割双链DNA,以含Loxp同源序列为模板修复基因组DNA,最终获得在待敲除目的DNA序列两端各有一个Loxp序列的Flox小鼠。
敲除PAMM基因对小鼠白色和棕色脂肪组织基因表达的影响孙雪荣;徐明锋;吴洪福;梁杰;吴志远;陈露珠;和文奕;李伟玲;张之炜;刘新光;史玉仓【期刊名称】《中国病理生理杂志》【年(卷),期】2024(40)4【摘要】目的:巨噬细胞集落刺激因子诱导单核细胞活化的类过氧化物酶2(peroxiredoxin-like 2 activated in M-CSF stimulated monocytes,PAMM)是一种具有抗炎、抗氧化功能的蛋白,在脂肪组织中高表达,本文拟利用基因敲除小鼠,探究PAMM对白色和棕色脂肪组织形态及基因表达等的影响,以期为其功能研究提供新思路。
方法:利用CRISPR-Cas9等技术构建PAMM基因敲除(knockout,KO)小鼠,用野生型(wild-type,WT)小鼠作为对照。
收集腹股沟皮下白色脂肪组织(inguinal adipose tissue,IAT)和背部棕色脂肪组织(brown adipose tissue,BAT),通过HE染色观察组织形态,利用RNA-seq和RT-qPCR检测相关基因的表达。
结果:通过基因组PCR及测序,证明基因敲除小鼠构建正确。
敲除PAMM后IAT和BAT形态无明显变化,但E2F靶点、未折叠蛋白反应等基因集在IAT或BAT中富集。
比较WT和KO小鼠组织,发现33个基因的变化趋势在IAT 和BAT中保持一致;而仅在IAT中出现变化的基因,分布在胞外、胞膜等部位,参与免疫和趋化反应等,与钙信号通路等相关;仅在BAT中出现变化的基因,分布在胞外基质、胞核等部位,参与葡萄糖稳态、生物节律等过程。
RT-qPCR检测钙通路及生物节律相关基因,变化趋势与测序结果类似。
本文还观察了敲除PAMM对IAT和BAT之间差异表达基因的影响,发现WT和KO小鼠BAT/IAT的差异基因和通路大多相同,但也有部分基因和通路发生了变化。
结论:PAMM敲除对IAT和BAT的形态结构无明显影响,但显著影响了二者的基因表达及相关信号通路,还可能影响IAT 和BAT之间的相互作用。
转基因、基因敲入/敲除动物技术已经成为现代生命科学基础研究和药物研发领域不可或缺的重要技术,该技术从上世纪七八十年代诞生以来,已有近四十年的历史,经典技术如DNA原核显微注射、胚胎干细胞显微注射技术一直以来经久不衰,并逐渐从基础研究实验室转向商业模式,成为一项高度标准化的新兴产业一、技术介绍与研究进展转基因、基因敲入/敲除动物技术已经成为现代生命科学基础研究和药物研发领域不可或缺的重要技术,该技术从上世纪七八十年代诞生以来,至今已有近四十年的历史,经典技术如DNA原核显微注射、胚胎干细胞显微注射技术一直以来经久不衰,在小鼠模型构建方面日趋完善,并且如同剪切酶和抗体等常规分子生物学试剂的制备技术一样,逐渐从基础研究实验室转向商业模式,成为一项高度标准化的新兴产业,催生了数以百计的创新药物和数以千计的优秀文章。
尽管如此,传统技术仍然存在一些难以克服的缺陷,如步骤繁琐、周期漫长、成功率低、费用高昂等,而ZFN和TALEN等新技术的出现,或有可能将这一局面彻底改变。
二、同源重组技术原理基因敲除鼠技术是上世纪80年代中后期基于DNA同源重组的原理发展起来的,Capecchi和Smithies在1987年根据同源重组(homologous recombination)的原理,首次实现了ES的外源基因的定点整合(targeted integration),这一技术称为"基因打靶"(gene targeting)或"基因敲除"(gene knockout),利用这种ES的显微注射就可以制作出基因敲出小鼠(KO Mice: knockout mice);由于这一工作,Capecchi和Smithies 于2007年与Evans分享了诺贝尔医学奖。
同源重组(homologous recombination)定义:是指发生在姐妹染色单体(sister chromatin) 之间或同一染色体上含有同源序列的DNA分子之间或分子之内的重新组合。
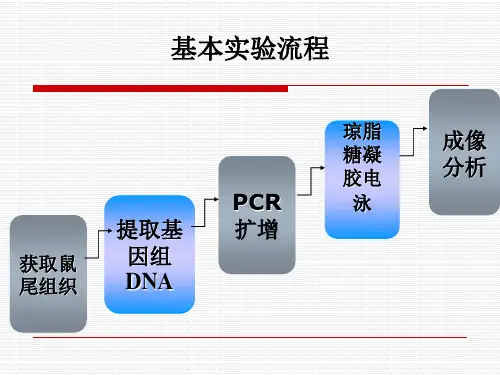
在基因敲除小鼠制作过程中,需要针对目的基因两端特异性片段设计带有相同片段的重组载体,将重组载体导入到胚胎干细胞后外源的重组载体与胚胎干细胞中相同的片段会发生同源重组,如图1所示:图1.基因敲除鼠制作同源重组原理示意图三、制作流程图2.基因敲除鼠制作过程示意图1. Knockout载体设计与构建根据研究项目具体情况和要求把目的基因和与细胞内靶基因特异片段同源的DNA 片段都重组到带有标记基因(如neo 基因,TK 基因等)的载体上,成为重组的Knockout载体。
2. Knockout ES细胞筛选Knockout载体测序验证正确后,将载体线性化,然后电转入ES细胞,通过载体上的正负筛选基因获得阳性的Knockout ES克隆。
选取PCR鉴定打靶载体正确插入的ES基因组DNA用于Southern Blot鉴定,将Southern Blot鉴定的Knockout ES扩大培养并液氮保存。
3. Knockout ES细胞囊胚注射得到嵌合体小鼠扩增经鉴定插入或置换片段位置正确的Knockout ES细胞,以囊胚显微注射的方式将一定数量的Knockout ES细胞注入特定品系小鼠囊胚中,然后将囊胚移植到假孕的小鼠子宫中。
待后代小鼠出生后,通过小鼠的毛色中来源于ES细胞毛色的比例判断嵌合程度的高低,以及该小鼠的后代中可能获得生殖系传递能力。
4. 由嵌合体小鼠繁殖出生殖遗传系Knockout 小鼠将嵌合体小鼠与适当品系的小鼠交配,后代小鼠出生后,通过PCR方式检测小鼠是否含有打靶序列。
如有,则该小鼠为具备生殖遗传能力的Knockout小鼠(F1代鼠)。
5. Knockout小鼠生殖系传递鉴定将嵌合体小鼠和适当品系野生型小鼠交配,通过后代小鼠毛色或PCR基因型鉴定的方法验证嵌合体小鼠生殖系传递能力。
四、基因敲除常见方法一、常规基因敲除鼠(Conventional Knockout)常规基因敲除是通过基因打靶,把需要敲除的基因的几个重要的外显子或者功能区域用Neo Cassette 替换掉。
这样的小鼠其全身所有的组织和细胞中都不表达该基因产物。
此类基因敲除鼠一般用于研究某个基因在对小鼠全身生理病理的影响,而且这个基因没有胚胎致死性。
二、条件性基因敲除小鼠(Conditional Knockout)条件性基因敲除小鼠是通过基因打靶,把两个loxP位点放到目的基因一个或几个重要的外显子的两边。
该小鼠和表达Cre酶小鼠杂交之前,其目的基因表达完全正常。
当和组织特异性表达Cre酶的小鼠进行杂交后,可以在特定的组织或细胞中敲除该基因,而该基因在其他组织或细胞表达正常。
条件性基因敲除鼠适用范围为:(1)该基因有胚胎致死性;(2)用于研究该基因在特定的组织或细胞中的生理病理功能。
三、基因敲入小鼠(Knockin)基因敲入小鼠是通过基因打靶,把目的基因序列敲入到小鼠的相应基因位点,使用小鼠的表达调控元件指导目的基因表达。
此类基因敲入鼠一般用于药物的筛选,信号通路的研究等。
获得嵌合体及之后品系纯化详细流程:五、基因敲除其他方法一、ZFN技术制作基因敲除鼠ZFN能够识别并结合指定的基因序列位点,并高效精确地切断。
随后细胞利用天然的DNA修复过程来实现DNA的插入、删除和修改,这样研究人员就能够随心所欲地进行基因组编辑。
这在过去是无法想象的,传统的基因敲除技术依赖细胞内自然发生的同源重组,其效率只有百万分之一,而ZFN的基因敲除效率能达到 10%。
利用这些技术进行小鼠基因的定点敲除和敲入,可以把时间从一年缩短到几个月。
这项技术中设计特异性的ZFN是最关键的环节,目前研究者采用计算生物学方法设计高特异性的ZFN,但ZFN的脱靶(off target),也就是把不该切的地方切了的问题仍是一个挑战。
也正因为这个原因,利用ZFN技术进行小鼠的基因修饰还无法完全取代传统技术。
二、TALEN技术制作基因敲除鼠TALEN 技术是一种崭新的分子生物学工具。
科学家发现,来自一种植物细菌的TAL蛋白的核酸结合域的氨基酸序列与其靶位点的核酸序列有恒定的对应关系。
利用TAL 的序列模块,可组装成特异结合任意DNA序列的模块化蛋白,从而达到靶向操作内源性基因的目的,它克服了ZFN方法不能识别任意目标基因序列,以及识别序列经常受上下游序列影响等问题,而具有ZFN相等或更好的灵活性,使基因操作变得更加简单方便。
然而同样因为脱靶的问题,利用TALEN技术进行小鼠的基因修饰仍然无法取代传统技术。
六、常见问题与解答1. 什么是ES细胞显微注射?答:胚胎干细胞显微注射是制作基因敲除小鼠的一个最常用的方法。
主要过程是将携带目的基因的胚胎干细胞注射到小鼠的囊胚腔中获得嵌合体小鼠。
所得嵌合体小鼠的组织,将同时含有来源于囊胚的细胞和胚胎干细胞。
嵌合体小鼠必须和野生型小鼠配种以决定遗传改变的生殖系能否传递,这样可能获得转基因或打靶基因(来源于胚胎干细胞)稳定的生殖系传递的小鼠。
一般情况下,大约能获得50%继承了目的基因的后代。
2. 嵌合体遗传学上用以指不同遗传性状嵌合或混杂表现的个体。
免疫学上的涵义则指一个机体身上有两种或两种以上染色体组成不同的细胞系同时存在,彼此能够耐受,不产生排斥反应,相互间处在嵌合状态。
在基因敲除鼠中指通过向囊胚注射被外源基因转化了的胚胎干细胞,使得发育成为的个体中含有不同基因型的细胞,产生的个体也叫嵌合体,即该生物体中嵌合了两种不同遗传结构的细胞(一种是基因型被改变了的细胞,另一种是原来的基因型的细胞)。
3. 条件性敲除的原理?答:Cre-LoxP系统是源于P1噬菌体的一个DNA重组体系,由Cre酶和相应的LoxP位点组成,它能导致重组发生在特定的DNA序列处 (LoxP位点),该系统可以将外源基因定点整合到染色体上或将特定DNA片段删除。
基于Cre-LoxP的基因打靶要分两步来进行。
首先要在胚胎干细胞的基因组中引入LoxP序列,这一步可以通过打靶载体的设计和对同源重组子的筛选来实现。
下一步通过Cre介导的重组来实现靶基因的遗传修饰或改变。
Cre-LoxP系统既可以在细胞水平上用Cre重组酶表达质粒转染中靶细胞,通过识别LoxP位点将抗性标记基因切除,又可以在个体水平上将重组杂合子小鼠与Cre转基因小鼠杂交,筛选子代小鼠就可得到删除外源标记基因的条件性敲除小鼠。
4. 如何鉴定和挑选嵌合体?答:动物只有部分组织细胞整合有外源基因,则称为嵌合体动物。
它的鉴定主要根据毛色去鉴定。
注射的ES和囊胚来源不同的小鼠品系。
它们的毛色不同。
因此可以根据毛色的嵌合率来鉴定和挑选嵌合体。
5. ROSA26与定点插入?答:利用同源重组技术,把外面的cDNA片段或者其他DNA片段,定点插入到ROSA26位置。
ROSA26是一个安全区域,外源性的基因定点插入这个位点不会影响其他基因的表达。
七、行业领先企业Taconic Farms,Inc.成立于1952年,是位于纽约哈得孙河谷地区的一家家族企业。
自成立以来,公司一直是世界上最大的实验室啮齿动物供应商之一,在持续生产高品质、定义明确的大鼠和小鼠方面拥有良好的口碑。
Taconic在转基因小鼠的定制设计和生产、小鼠和大鼠育种、屏障系统、基因和动物健康方面的专业经验为利用活体模型开展药物开发的研究人员提供支持。
Taconic在美国和欧洲设有六个育种工厂和三个服务实验室,员工人数超过1000名,致力于从事技术创新。
赛业生物科技是目前国内探生网biom提醒:最大的转基因/基因敲除鼠技术服务供应商,旗下的赛业转基因动物中心是国际顶尖的转基因/基因敲除模式动物中心,中心拥有数千平方米实验场地,动物种群规模超过10万只,每年可构建转基因鼠模型3000例及基因敲除鼠模型300例,累计构建转基因/基因敲除鼠模型数千例。
中心主要提供转基因小鼠、基因敲除小鼠、基因敲入小鼠等技术服务。
希望以上资料对你有所帮助,附励志名言3条::1、世事忙忙如水流,休将名利挂心头。
粗茶淡饭随缘过,富贵荣华莫强求。
2、“我欲”是贫穷的标志。
事能常足,心常惬,人到无求品自高。
3、人生至恶是善谈人过;人生至愚恶闻己过。