第三单元 化学物质及其变化 A卷
- 格式:doc
- 大小:250.30 KB
- 文档页数:7

单元训练金卷·高三·化学卷(A )第三单元 化学物质及其变化注意事项: 1.答题前,先将自己的姓名、准考证号填写在试题卷和答题卡上,并将准考证号条形码粘贴在答题卡上的指定位置。
2.选择题的作答:每小题选出答案后,用2B 铅笔把答题卡上对应题目的答案标号涂黑,写在试题卷、草稿纸和答题卡上的非答题区域均无效。
3.非选择题的作答:用签字笔直接答在答题卡上对应的答题区域内。
写在试题卷、草稿纸和答题卡上的非答题区域均无效。
4.考试结束后,请将本试题卷和答题卡一并上交。
可能用到的相对原子质量:H1 C12 N14 O16 Na23 S32 Cl35.5 K39一、选择题(每小题3分,共48分)1.北魏贾思勰《齐民要术·作酢法》这样描述苦酒:“乌梅苦酒法:乌梅去核,一升许肉,以五升苦酒渍数日,曝干,捣作屑。
欲食,辄投水中,即成醋尔。
”下列有关苦酒主要成分的说法正确的是A .苦酒的主要溶质是非电解质B .苦酒的主要溶质是强电解质C .苦酒的主要溶质是弱电解质D .苦酒的溶液中只存在分子,不存在离子2.分类是化学学习和研究的常用方法之一。
下列物质的分类正确的是A .H 2O 、H 2CO 3、NH 3都是氧化物B .食用醋、冰红茶、加碘盐都是混合物C .烧碱、纯碱、熟石灰都属于碱D .液氧、氨水、铁都是常用纯净物3.下列说法正确的是①能导电的物质一定是电解质 ②氧化还原反应的实质是电子的转移 ③蛋白质、漂白粉、苛性钾、液氨分别为纯净物、混合物、强电解质和非电解质 ④丁达尔效应可用于区别蛋白质溶液与葡萄糖溶液 ⑤酸性氧化物不一定是非金属氧化物,但是碱性氧化物一定是金属氧化物A .①②④B .①③⑤C .②④⑤D .③④⑤4.钴酞菁分子(直径为1.3×10-9m )的结构和性质与人体内的血红素及植物体内的叶绿素非常相似。
下列关于“钴酞菁”分子的说法中正确的是 A .“钴酞菁”分子均匀分散于水中所形成的分散系属于悬浊液 B .“钴酞菁”分子既能透过滤纸,也能透过半透膜 C .“钴酞菁”分子直径比Na +小 D .“钴酞菁”分子均匀分散于水中形成的分散系能产生丁达尔效应 5.炼丹是古人为追求长生而炼制丹药的方术。
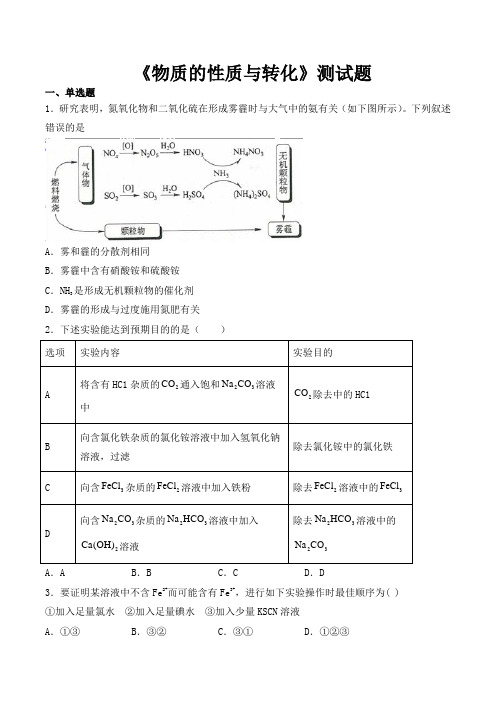
《物质的性质与转化》测试题一、单选题1.研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如下图所示)。
下列叙述错误的是A.雾和霾的分散剂相同B.雾霾中含有硝酸铵和硫酸铵是形成无机颗粒物的催化剂C.NH3D.雾霾的形成与过度施用氮肥有关2.下述实验能达到预期目的的是()A.A B.B C.C D.D3.要证明某溶液中不含Fe2+而可能含有Fe3+,进行如下实验操作时最佳顺序为( )①加入足量氯水②加入足量碘水③加入少量KSCN溶液A.①③B.③②C.③①D.①②③4.下列说法不正确...的是 A .纯碱可以去除油污,也能广泛应用于玻璃、纺织、食品等工业中B .二氧化硫可用于漂白纸浆、编织物,但二氧化硫通入紫色石蕊试液中只变红C .钠钾合金在常温常压下是液体,可用作原子反应堆的导热剂D .浓硫酸可使有机物炭化是由于它的脱水性,因此在实验室中常用作干燥剂 5.下列气体中,不会造成空气污染的是( ) A .N 2B .NOC .NO 2D .SO 26.化学与生活密切相关,下列有关说法不正确...的是 A .新能源汽车的推广与使用,有助于减少光化学烟雾的产生 B .氯气泄漏时,可用蘸有肥皂水的湿毛巾捂住口鼻疏散到安全区域 C .铁在潮湿的空气中放置,易发生化学腐蚀而生锈D .煤脱硫后产生的废料中含有的CaSO 4 ,可用于制造建筑材料7.下表各物质中,A 、B 、C 、D 、E 均含有同一种短周期元素,其中A 是单质,B 常温下是气态氢化物,C 、D 是氧化物,E 是D 和水反应的产物。
则各物质之间通过一步反应就能实现表中所示转化的是( )A .②③B .②④C .①③④D .①②③④8.在给定条件下,下列选项所示的物质间转化均能实现的是A .S 2O −−→点燃SO 3 2H O −−−→H 2SO 4 B .NH 3 2O −−→催化剂,△ NO 2H O −−−→HNO 3C .NaHCO 3(s)−−→Na 2CO 3(s)饱和石灰水−−−−→NaOH(aq) D .Al(s)NaOH −−−−→溶液NaAlO 2(aq)−−−−→过量盐酸Al(OH)3(s)9.将一定量的Fe、Fe2O3、CuO的混合物放入体积为l00mL、浓度为2.2mol·L-1的H2SO4溶液中,充分反应后,生成气体 896mL(标况),得到不溶固体1.28 g,过滤后,滤液中的金属离子只有Fe2+(假设滤液体积仍为 100mL)。

第3章《物质的性质与转化》测试卷一、单选题(共15小题)1.给装有下列少量固体物质的试管加热,试管底部的物质不可能完全消失的是()A.碳酸氢铵B.碳酸氢钠C.氯化铵D.碳酸铵2.用FeCl3溶液腐蚀印刷电路板上的铜,所得溶液中加入铁粉。
对加入铁粉充分反应后的溶液分析合理的是()A.若无固体剩余,则溶液中一定有Fe3+B.若有固体存在,则溶液中一定有Fe2+C.若溶液中有Cu2+,则一定没有固体析出D.若溶液中有Fe2+,则一定有Cu析出3.下列有关硫单质性质的叙述中,正确的是()A.硫与金属或非金属反应时均作氧化剂B.清洗试管内壁粘附的硫黄,可以用CS2清洗C.硫燃烧时,硫过量时燃烧的产物是SO2,氧气过量时燃烧的产物是SO3D.硫在空气中的燃烧产物是SO2,在纯氧中的燃烧产物是SO34.证明某溶液只含有Fe2+而不含有Fe3+的实验方法是()A.先滴加氯水,再滴加硫氰化钾溶液后显血红色B.先滴加硫氰化钾溶液,不显血红色,再滴加氯水后显血红色C.滴加氢氧化钠溶液,先产生白色沉淀,后变灰绿,最后呈红褐色D.只需滴加硫氰化钾溶液5.某无色的混合气体甲可能含有NO2、NO、CO2、O2、NH3、N2中的几种,将100 mL该气体经过如图所示的实验进行处理,结果得到酸性溶液,而几乎无气体剩余,有关该气体组成的判断不正确的是()A.一定含NH3,其体积为20 mLB.一定含CO2,其体积为48 mLC.一定含NO,其体积为30 mLD.该气体中一定不含NO2、N2、O26.下列关于氮气的有关说法中正确的是()A.氮气的化学性质很不活泼,不与任何物质发生反应B.纯净的氮气是不溶于水的无色气体,无毒无味且比空气略重C.一定条件下氮气与氢气发生化合反应生成氨,反应中N2表现还原性D.氮气常用作焊接金属的保护气,是利用氮气化学性质的不活泼性7.如图所示的装置中,干燥的烧瓶内盛有某种气体,烧杯和滴管内盛放某种溶液。

高一化学(必修一)《物质及其变化》单元测试卷及答案解析一、单选题1.在给定条件下,下列选项所示的物质间转化均能实现的是A .FeS 22O高温−−−→SO 222H O −−−→H 2SO 4 B .NH 32O ,Δ催化剂−−−→NO 22H O −−−→HNO 3 C .C 6H 5ONa ()HCl aq −−−→C 6H 5OH ()23Na CO aq −−−−→CO 2D .SiO 2(s)2H O −−−→H 2SiO 3(s)()NaOH aq →Na 2SiO 3(aq)2.在浓盐酸中H 3AsO 3与SnCl 2反应的离子方程式为:3SnCl 2+12Cl -+2H 3AsO 3+6H +=2As+3SnCl 26-+6M ,关于该反应的说法正确的组合是①氧化剂是H 3AsO 3 ②还原性:Cl ->As ③M 为OH - ④SnCl 26-是氧化产物 A .①③B .①④C .①②③D .①②④3.为防止废弃的硒单质(Se)造成环境污染,通常用浓硫酸将其转化成二氧化硒(SeO 2),再用KI 溶液处理后回收Se .发生的反应为:①Se+2H 2SO 4(浓)=2SO 2+SeO 2+2H 2O 、②SeO 2+4KI+4HNO 3=4KNO 3+Se+2I 2+2H 2O ,下列说法错误的是A .①中SO 2是还原产物,SeO 2是氧化产物B .②中KI 是还原剂,HNO 3是氧化剂C .回收Se 过程中每生成0.4mol I 2共转移1.6mol 电子D .氧化性由强到弱的顺序是:H 2SO 4(浓)>SeO 2>HNO 34.NaH 是一种常见的储氢物质,可与水反应释放氢气:NaH+H 2O=NaOH+H 2↑。
关于该反应,下列说法错误的是A .NaH 作还原剂B .氧化产物与还原产物的质量之比为1:1C .H 2O 作氧化剂D .消耗1 mol NaH 时,共转移2 mol 电子5.下列反应的离子方程式书写正确的是 A .锌粒与稀盐酸反应:22Zn+2H =Zn H +++↑ B .溴化钠溶液与氯气反应:22Br Cl =+Cl r +B -- C .氢氧化铜与稀硫酸反应:2OH H O +=H -+ D .铝和NaOH 溶液反应:-22Al+2OH =AlO +H -↑6.物质分类是化学研究的重要方法之一、化学工作者经常根据物质的组成对物质进行分类研究。

绝密★启用前2019新教材鲁科版化学必修-第一册第3章物质的性质与转化单元测试本试卷分第Ⅰ卷和第Ⅱ卷两部分,共100分,考试时间90分钟。
第Ⅰ卷一、单选题(共10小题,每小题3.0分,共30分)1.向100 mL 12 mol·L-1的浓硝酸中加入足量的铜片,充分反应后,被还原的硝酸的物质的量为()A. 0.3 molB. 0.6 molC.小于0.6 molD.介于0.3 mol和0.6 mol之间2.下列关于硫酸的叙述中正确的是()A.浓硫酸、稀硫酸都难挥发B.浓硫酸、稀硫酸都能氧化金属锌,且反应实质相同C.浓硫酸、稀硫酸在加热时都能与铜反应D.浓硫酸、稀硫酸在常温下都能用铁制容器贮存3.下列说法中与酸雨有直接关系的是()①造成植物死亡②造成土壤酸化③使湖泊富营养化,鱼类死亡④危害建筑设施⑤危害桥梁和电信电缆A.②③B.③④⑤C.①③⑤D.①②④⑤4.下列制取SO2、验证其漂白性、收集并进行尾气处理的装置和原理能达到实验目的的是()5.下列反应必须加入氧化剂且一步反应就能完成的是()①N2→NO2②NO2→NO③NO2→HNO3④N2→NO⑤N2→NH3A.①B.②⑤C.④D.③④6.某同学仿照喷泉实验原理在实验室里做了一个“喷烟实验”。
如图所示,在甲、乙两个烧瓶中分别装入X、Y两种无色气体,胶头滴管中盛有含酚酞的NaOH溶液,实验时将胶头滴管内的液体挤入甲烧瓶中,然后打开弹簧夹,便可看到甲烧瓶中的导管喷出白色的烟,同时甲烧瓶中的溶液颜色逐渐变浅最后褪为无色。
则X、Y分别为()A. NH3和HClB. HCl和NH3C. SO2和HClD. NO和HCl7.下列说法正确的是()A.实验室用氯化铵溶液和氢氧化钙溶液混合制取氨气B.雷雨天气时空气中能生成少量的氮氧化物C.铵盐易溶于水,化学性质稳定,受热不易分解D. O2、NO、NO2都能用浓硫酸干燥,且通常情况下能大量共存8.欲除去FeSO4溶液中含有的CuSO4和Fe2(SO4)3等少量杂质,应选用的试剂是 ()A.氨水B.铝粉C.铁粉D. NaOH溶液9.关于氨气和氨水的叙述正确的是()A.氨水的主要成分是NH3B.氨水中滴入酚酞变红色,是因为氨气能电离出OH-C.在1 L 1 mol·L-1的氨水中含NH3·H2O 1 molD. NH3中氮元素为-3价,具有一定的还原性,在一定条件下可被O2氧化10.检验试管中盛有少量白色固体是铵盐的方法是()A.加氢氧化钠溶液,加热,用湿润的红色石蕊试纸在试管口检验,看试纸是否变蓝B.将固体加热,产生的气体通入紫色石蕊试液,看是否变红C.加水溶解,用pH试纸测溶液的酸碱性D.加入氢氧化钠溶液,加热,再滴入酚酞试液二、双选题(共5小题,每小题5.0分,共25分)11.(双选)下列实验正确的是()A.向某无色溶液中滴加稀盐酸无现象,滴加氯化钡溶液,产生白色沉淀,该溶液中一定存在SOB.检验某溶液中是否含SO,应先加入BaCl2溶液,再加入稀硝酸C.检验亚硫酸钠试样是否变质D.将浓硫酸滴到蔗糖表面,固体变黑膨胀,浓硫酸有脱水性和强氧化性12.(双选)在下列反应中,浓硫酸或浓硝酸既表现出酸性又表现出强氧化性的是()A. Cu CuSO4[Cu(NO3)2]B. C CO2C. FeO Fe2(SO4)3[Fe(NO3)3]D. Fe2O3Fe2(SO4)3[Fe(NO3)3]13.(双选)已知硫酸的酸性比亚硫酸的酸性强。

第三章《物质的性质与转化》测试卷一、单选题(共15小题)1.下列说法中正确的是()A.氮气和氢气在点燃或光照条件下可合成氨B.氨水显碱性,能使石蕊试液变红色C.氨气遇到浓盐酸会发生反应而产生白烟D.由氨制取硝酸过程中,氮元素被还原2.利用如图装置,在锥形瓶中,分别加入足量的下列物质,反应后可能产生喷泉的是()A.铜与稀盐酸B.碳酸氢钠与氢氧化钠溶液C.碳酸钙与稀硫酸D.碳酸氢铵与稀盐酸3.检验试管中盛有少量白色固体是铵盐的方法是()A.加氢氧化钠溶液,加热,用湿润的红色石蕊试纸在试管口检验,看试纸是否变蓝B.将固体加热,产生的气体通入紫色石蕊试液,看是否变红C.加水溶解,用pH试纸测溶液的酸碱性D.加入氢氧化钠溶液,加热,再滴入酚酞试液4.将Cu片放入下列溶液中,Cu片质量减轻的是 ()A. CuCl2 B. AgNO3C. Fe2(SO4)3 D. H2SO4(稀)5.在稀盐酸溶液中加入适量铁粉,反应完全后再加入适量氢氧化钠溶液,放置片刻,从反应体系中观察到颜色的变化是()A.无色→灰绿→红褐B.灰绿→红褐→蓝灰色→红棕C.无色→白色→浅绿→灰绿→红褐D.无色→浅绿→白色→灰绿→红褐6.下列属于铵盐的共同性质的是()A.都是晶体,都易溶于水B.铵盐受热均可分解生成NH3C.铵盐都能与碱反应,不能与酸反应D.所有铵盐中,氮元素化合价都是-3价7.已知A为常见的金属单质,根据如图所示的关系,下列叙述中正确的是()A. A为Fe,B为FeOB. C→D溶液的颜色变化:浅绿色→棕黄色C. ④的离子方程式:Fe+Fe3+===2Fe2+D.④的离子方程式:4Fe(OH)2+O2+2H2O===4Fe(OH)38.下列物质的水溶液遇KSCN溶液显红色的是 ()A. FeCl3 B. FeCl2C. KCl D. Na2SO49.下列检验的方法和结论正确的是()A.在未知溶液中滴加BaCl2溶液出现白色沉淀,加稀硝酸,沉淀不溶解,说明该未知溶液中存在SO或SOB.某无色溶液中加入足量稀盐酸无明显现象,再滴加BaCl2溶液有白色沉淀生成,则原溶液中一定含有SOC.向溶液X中滴加BaCl2溶液有白色沉淀,说明X中一定含有SOD.向某溶液中加入稀盐酸,放出的气体通入澄清石灰水,石灰水变浑浊,证明溶液中存在SO 10.锌与100 mL 18.5 mol·L-1的浓硫酸充分反应后,锌完全溶解,同时生成气体甲33.6 L(标准状况)。
物质的性质与转化(时间:90分钟满分:100分)一、选择题(本题共15小题,每小题3分,共45分。
每小题只有一个选项符合题意)1.如图是酸雨形成图,下列说法不正确的是( )A.在酸雨形成过程中没有发生氧化还原反应B.二氧化硫、二氧化氮是形成酸雨的主要因素C.煤和石油的燃烧、汽车尾气等是酸雨污染物的主要来源D.酸雨的危害有破坏农作物,使土壤、湖泊酸化以及加速建筑物、桥梁的腐蚀等解析:选A 二氧化硫具有还原性,可以被氧化为三氧化硫,三氧化硫溶于水生成硫酸,在酸雨形成过程中一定发生了氧化还原反应,A错误;二氧化硫、二氧化氮是形成酸雨的主要因素,分别形成硫酸型酸雨和硝酸型酸雨,B正确;煤和石油的燃烧会排放出SO2和NO2等污染物,汽车尾气中有氮氧化物产生,均是酸雨污染物的主要来源,C正确;pH<5.6的雨水称为酸雨,酸雨对农作物、桥梁、建筑物等有破坏作用,D正确。
2.下列关于SO2和NO2的叙述中正确的是( )A.SO2可使紫色石蕊溶液褪色B.SO2与水作用生成H2SO4C.可用排水法收集NO2D.实验室可用NaOH溶液处理NO2和SO2废气解析:选D SO2的漂白性是有限的,不能使紫色石蕊溶液褪色,A错误;SO2与水作用生成H2SO3,B错误;NO2能与水反应:3NO2+H2O===2HNO3+NO,C错误。
3.对如下四个实验装置,下列表述中合理的是( )A.装置1可用于NH4Cl分解制备NH3B.装置2可用于实验室Cu与稀硝酸反应获得NOC.装置3可用于实验室Zn与浓硫酸反应获得H2D.装置4可用于碳酸氢铵的分解实验解析:选B A项,NH4Cl固体受热分解生成NH3和HCl,而当温度降低时,NH3和HCl又重新化合生成固体NH4Cl,不能用于制备NH3,错误;B项,分液漏斗中加入稀硝酸,烧瓶中加入Cu,打开分液漏斗的活塞控制稀HNO3的加入量,Cu与稀HNO3在烧瓶内反应得到NO,正确;C项,Zn与浓H2SO4反应的主要产物是SO2,且Zn与稀H2SO4反应制备H2时不需要加热,错误;D项,由于NH4HCO3受热分解会产生H2O,试管口应略向下倾斜,错误。
鲁科版高一上学期化学(必修一)《第三章物质的性质与转化》单元检测卷及答案学校:___________班级:___________姓名:___________考号:___________一、选择题。
(18题)1、某同学采用硫铁矿焙烧后的烧渣(主要成分为Fe2O3、SiO2、Al2O3)制取七水合硫酸亚铁(FeSO4•7H2O),设计了如图流程:下列说法不正确的是()A.溶液1中的阳离子可与NH+4、I﹣、SO2-4在同一溶液中大量共存B.固体1为SiO2,试剂X为FeC.向固体2中加入足量NaOH溶液,发生反应的离子方程式:Al(OH)3+OH﹣═AlO-2+2H2OD.从溶液2得到FeSO4•7H2O产品的过程中,须控制条件防止其氧化和分解2、下列试剂中,能使Fe2+转化为Fe3+的是()①氯气②NaCl溶液③酸性KMnO4溶液④次氯酸⑤盐酸⑥Na2SO4溶液A.①②③B.①③④C.②④⑤D.②⑤⑥3、向一定量的Fe、FeO、Fe2O3的混合物中加入100 mL 1 mol·L-1的盐酸,恰好使混合物完全反应,放出22.4 mL(标准状况)气体,向所得溶液中加入KSCN溶液,不变红色。
用足量的CO在高温下还原相同质量的此混合物,所得铁的质量为()A.2.8 gB.11.2 gC.5.6 gD.无法计算4、实验是化学科学的基础。
下列关于化学实验的表述正确的是()A.为除去KI固体中少量I2单质,溶解后采取如图所示操作B.“凡渍药酒,皆须细切,……,便可漉出”,“漉出”指的是浸取C.除去H2中混有的少量HCl,可通过盛有饱和NaHCO3溶液的洗气瓶D.检验Fe2(SO4)3溶液中是否有FeSO4,可选用氯水和KSCN溶液5、向含有水分的蔗糖中缓慢注入浓硫酸,不能显示浓硫酸的()A. 酸性B. 吸水性C. 脱水性D. 氧化性6、有学生为了证明SO2是一种酸性氧化物,做了以下实验:向滴有酚酞的氢氧化钠溶液中通入过量的SO2气体,溶液褪色,关于该实验下列说法错误的是() A.该实验一定能证明SO2是一种酸性氧化物B.若SO2是一种酸性氧化物,溶液中可能会发生反应:SO2+2NaOH===Na2SO3+H2OC.若SO2是一种酸性氧化物,溶液中可能发生的反应是SO2+Na2SO3+H2O===2NaHSO3D.若要证明SO2是一种酸性氧化物,还需在实验结束后再加酚酞或氢氧化钠溶液7、下列气体中既可用浓硫酸干燥,又可用氢氧化钠固体干燥的是()A.Cl2B.O2C.SO2D.NH38、在盛放浓硫酸的试剂瓶的标签上应印有的警示标记是()9、下列关于氮及其化合物的说法正确的是( )A.NO是形成光化学烟雾的大气污染物B.NO、NO均为污染性气体,在大气中可稳定存在2C.NO、NO均易溶于水2D.NO、NO均能与水发生反应210、下列叙述中,正确的是()A.氨水和液氨不同,氨水是混合物,液氨是纯净物B.氨水显碱性,溶液中只有OH-,没有H+C.氨气与氯化氢气体相遇产生白色烟雾D.在反应NH3+H+=== NH4+中,NH3失去电子被氧化11、将NO2、NH3和O2的混合气体28L通过稀H2SO4后,溶液质量增加42g,气体体积缩小为4.48L。
《第3章物质的性质与转化》试卷(答案在后面)一、单项选择题(本大题有16小题,每小题3分,共48分)1、下列物质属于电解质的是()A、蔗糖B、铜C、盐酸D、NaCl2、下列关于化学反应速率的说法中,正确的是()A、反应物的浓度越高,反应速率就一定越快。
B、温度升高,反应速率一定减慢。
C、固体反应物的表面积越小,反应速率就越快。
D、加入催化剂会降低产物的生成速率。
3、下列物质中,属于同一种类型的有机物是:()A. 乙醇和乙酸B. 乙烯和丙烯C. 甲醇和甲醚D. 乙醛和乙酸4、在一定条件下,下列哪种物质可以与水发生反应产生氢气?A. 铜 (Cu)B. 银 (Ag)C. 锌 (Zn)D. 金 (Au)5、下列哪种物质属于有机化合物?A、H2O(水)B、CO2(二氧化碳)C、CH4(甲烷)D、NaCl(氯化钠)6、下列关于物质性质与转化的说法,正确的是()A、在常温下,所有金属都能与盐酸反应生成氢气。
B、水的熔点低于冰的熔点,是因为水分子之间存在氢键。
C、碳元素的单质形式只有金刚石和石墨。
D、二氧化碳的分解过程是一个吸热的水解反应。
7、在一定条件下,下列反应不可能发生的是:A、钠与水反应生成氢氧化钠和氢气B、氧化铁与稀硫酸反应生成硫酸铁和水C、氢氧化钠与硫酸铜反应生成氢氧化铜和硫酸钠D、二氧化碳与氢氧化钠反应生成碳酸钠和水8、下列关于化学反应速率的叙述正确的是()A. 反应物浓度越大,反应速率一定越快B. 反应温度越高,反应速率一定越快C. 催化剂可以加快反应速率,但不影响化学平衡D. 增大压强可以加快气体反应的反应速率,但对液体和固体反应速率无影响9、下列反应中,哪一个属于置换反应?A.(2H2O→2H2+O2)B.(Fe+CuSO4→FeSO4+Cu)C.(CaCO3→CaO+CO2)D.(2Na+Cl2→2NaCl)10、下列物质中,属于离子化合物的是()A. 氯化氢(HCl)B. 氧化钙(CaO)C. 氧气(O2)D. 氮气(N2)11、下列关于物质性质与转化的说法中,正确的是()A. 硫酸的酸性比盐酸强,因此硫酸的pH值更低B. 氯气能与铁反应生成FeCl2,这表明氯气的氧化性比铁强C. 干冰(固态二氧化碳)升华时,二氧化碳分子中的共价键会被打破D. Fe在Cl2中燃烧生成FeCl3,这说明氯元素在反应中由-1价氧化为0价12、下列物质在常温常压下能导电的是:A、水(H2O)B、二氧化碳(CO2)C、氯化钠(NaCl,固体)D、硫酸(H2SO4,溶液)13、下列关于氧化还原反应的叙述中,正确的是()A、氧化还原反应中,氧化剂接受电子,还原剂失去电子。
九年级化学第三单元测试卷【含答案】专业课原理概述部分一、选择题(每题1分,共5分)1. 下列哪种物质是化合物?A. 氧气B. 水C. 铁锈D. 空气2. 在实验室中,通常用哪种物质来检验二氧化碳?A. 紫色石蕊试液B. 澄清石灰水C. 稀盐酸D. 碘酒3. 下列哪种变化是化学变化?A. 湿衣晾干B. 灯泡发光C. 木柴燃烧D. 冰融化4. 下列哪种物质属于有机物?A. 碳酸钙B. 甲烷C. 氯化钠D. 硫酸5. 下列哪种物质是酸?A. 氢氧化钠B. 硫酸C. 氯化钠D. 碳酸钠二、判断题(每题1分,共5分)1. 氧气是由两个氧原子组成的分子。
()2. 在化学反应中,质量守恒定律总是成立的。
()3. 酸性物质可以使紫色石蕊试液变蓝。
()4. 所有物质都是由原子组成的。
()5. 燃烧是一种物理变化。
()三、填空题(每题1分,共5分)1. 化学反应的基本特征是反应物和物的______发生变化。
2. 在化学方程式中,反应物写在箭头的______,物写在箭头的______。
3. 金属活动性顺序中,位于氢之前的金属能和______反应氢气。
4. 在实验室制取氧气时,通常使用的药品是______和______。
5. 二氧化碳能与水反应______。
四、简答题(每题2分,共10分)1. 简述质量守恒定律。
2. 什么是酸碱中和反应?3. 简述实验室制取氧气的原理。
4. 什么是催化剂?催化剂在化学反应中的作用是什么?5. 简述燃烧的条件。
五、应用题(每题2分,共10分)1. 实验室有10克盐酸,需要配制pH为2的溶液,计算需要加多少水?2. 在一定条件下,10克铁与5克硫酸反应,求的氢气质量。
3. 20克氢氧化钠溶液与10克盐酸完全反应,求的氯化钠质量。
4. 某化工厂排放的废水中含有硫酸,其浓度为5%,若要将其稀释至1%,需要加多少水?5. 有一瓶气体,可能是氧气或二氧化碳,如何鉴别?六、分析题(每题5分,共10分)1. 分析铁锈的形成过程,并说明如何防止铁制品生锈。
好教育云平台 一轮单元训练卷 第1页(共6页)好教育云平台 一轮单元训练卷 第2页(共6页) 好教育单元训练金卷·高三·化学卷(A ) 第三单元 化学物质及其变化 注意事项: 1.答题前,先将自己的姓名、准考证号填写在试题卷和答题卡上,并将准考证号条形码粘贴在答题卡上的指定位置。
2.选择题的作答:每小题选出答案后,用2B 铅笔把答题卡上对应题目的答案标号涂黑,写在试题卷、草稿纸和答题卡上的非答题区域均无效。
3.非选择题的作答:用签字笔直接答在答题卡上对应的答题区域内。
写在试题卷、草稿纸和答题卡上的非答题区域均无效。
4.考试结束后,请将本试题卷和答题卡一并上交。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Al-27 Si-28 Cl-35.5 Mn-55 Zn-65 一、选择题(每小题3分,共48分) 1.按纯净物、混合物、电解质和非电解质顺序排列的一组物质是 A .盐酸、空气、醋酸、干冰 B .冰醋酸、海水、硫酸钠、乙醇 C .蛋白质、油脂、烧碱、石灰石 D .胆矾、漂白粉、氯化钾、硫酸钡 2.下列有关电解质的叙述中错误的是 A .强电解质在水溶液里或熔融状态时的电离方式是一样的 B .弱电解质溶液可能比强电解质溶液的导电性强 C .HCl 是强电解质,它只能在水溶液里才能电离 D .电解质溶液导电过程中必然伴随化学变化 3.(2018·荆州中学质检)继科学家发现C 3O 2是金星大气成分之后,美国科学家通过“勇气”号太空车探测出水星大气中含有一种称为硫化羰(化学式为COS)的物质,已知硫化羰与二氧化碳的结构相似,但在氧气中会燃烧,下列有关C 3O 2与硫化羰的说法中不正确的是 A .C 3O 2与CO 一样可以在氧气中燃烧生成CO 2B .硫化羰在氧气中完全燃烧后的生成物是CO 2和SO 2C .COS 分子中所有原子都满足8电子稳定结构D .CO 、C 3O 2、CO 2都是碳的氧化物,它们互为同素异形体 4.下列关于胶体的叙述正确的是 A .胶体粒子不能透过滤纸 B .胶体和溶液的本质区别是胶体能产生丁达尔效应 C .胶体带电,故在电场作用下会产生电泳现象 D .用渗析的方法净化胶体时,使用半透膜只能让小分子和离子通过 5.我国古代文献中有许多化学知识的记载,如《梦溪笔谈》中的“信州铅山县有苦泉,……,挹其水熬之,则成胆矾,熬胆矾铁釜,久之亦化为铜”等,上述描述中没有涉及的化学反应类型是 A .复分解反应 B .化合反应 C .离子反应 D .氧化还原反应 6.下列一步转化中,一定要加入氧化剂才能实现的是 A .SiO 2―→Na 2SiO 3 B .Na 2O 2―→NaOH C .N 2―→NH 3 D .NH 3―→NO 7.下列化学方程式能用离子方程式2H ++CO 2-3===H 2O +CO 2↑表示的是 A .HCl +NaHCO 3===NaCl +H 2O +CO 2↑ B .2HCl +BaCO 3===BaCl 2+H 2O +CO 2↑ C .H 2SO 4+Na 2CO 3===Na 2SO 4+H 2O +CO 2↑ D .2CH 3COOH +Na 2CO 3===2CH 3COONa +H 2O +CO 2↑ 8.下列过程对应的离子方程式正确的是 A .NaHSO 3溶于水呈酸性:NaHSO 3===Na ++H ++SO 2-3 B .在Na 2S 2O 3溶液中滴加稀硫酸:2H ++S 2O 2-3===SO 2↑+S↓+H 2O C .浓盐酸与MnO 2反应制氯气:MnO 2+4HCl===Mn 2++2Cl 2↑+2H 2O D .工业冶炼Mg :2Mg 2++2O 2-2Mg +O 2↑ 9.水热法制备纳米颗粒Y(化合物)的反应为3Fe 2++2S 2O 2-3+O 2+a OH -===Y +S 4O 2-6+2H 2O 。
下列说法中,不正确的是 A .S 2O 2-3是还原剂 B .Y 的化学式为Fe 2O 3 C .a =4 D .每有1 mol O 2参加反应,转移的电子总数为4 mol 10.(2018·株洲质量检测)常温下,下列各组离子在指定溶液中一定能大量共存的是 A .能使石蕊显红色的溶液:K +、Mg 2+、HCO -3、SO 2-4 B .水电离出来的c (H +)=10-13 mol·L -1的溶液:NH +4、Fe 2+、NO -3、Cl - 此卷只装订不密封 班级姓名准考证号考场号座位号C.c(H+)c(OH-)=1012的溶液:K+、Fe3+、Cl-、SO2-4D.加入铝片能放出H2的溶液:Na+、CH3COO-、Cu2+、SO2-411.(2018·滕州中学模拟)N2O既是医学上的一种麻醉剂,又是一种常见的温室气体。
制取N2O的方法有很多,例如①NH4NO3===N2O↑+2H2O;②K2SO3+2NO===K2SO4+N2O↑;③2NH3+2O2===N2O↑+3H2O;④2NaNO3+(NH4)2SO4===2N2O↑+Na2SO4+4H2O下列说法正确的是A.反应①中NH4NO3既是氧化剂又是还原剂,H2O是氧化产物B.反应②中K2SO3是还原剂,N2O是氧化产物C.反应③中每生成1 mol N2O,转移8 mol电子D.反应④中NaNO3是还原剂,N2O既是氧化产物又是还原产物12.为检验某种钠盐溶液中含有的阴离子是SO2-4、CO2-3还是OH-、Cl-,下面设计的方案中合理的是A.检验CO2-3:向待测液中加入足量的盐酸产生气泡,将气体通入浓Ba(OH)2溶液有白色沉淀生成B.检验SO2-4:向待测液中加入盐酸至酸性,未见沉淀或气体生成,再加入BaCl2溶液出现白色沉淀C.检验OH-:向待测液中加入石蕊溶液,溶液变红色D.检验Cl-:向待测液中加入AgNO3溶液和稀盐酸的混合液,有白色浑浊物出现13.(2018福建厦门一模)某酸性废水中可能含有Fe2+、Fe3+、Al3+、Mg2+、Na+、K+、CO2-3、SO2-4中的两种或多种离子。
取废水样品分别进行如下图所示①~④四个实验。
下列推断正确的是A.废水中含有Na+,不含K+B.废水中含有SO2-4和CO2-3C.废水中不含Fe3+,可能含Fe2+D.废水中一定含有Na+、Al3+、SO2-414.LiAlH4是重要的储氢材料,其组成类似于Na3AlF6。
常见的供氢原理如下面两个化学方程式所示:①2LiAlH 42LiH+2Al+3H2↑,②LiAlH4+2H2O===LiAlO2+4H2↑。
下列说法正确的是A.若反应①中生成3.36 L氢气,则一定有2.7 g铝生成B.氢化锂也是一种储氢材料,供氢原理为LiH+H2O===LiOH+H2↑C.生成等质量的氢气,反应①、②转移电子数之比为4∶3D.LiAlH4是共价化合物,LiH是离子化合物15.下列离子方程式的书写及评价均合理的是16.某同学设计完成了以下两个实验:①向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。
继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色(生成了HIO3)。
②向盛有KBr溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成红棕色。
继续向试管中滴加氯水,振荡,CCl4层的颜色没有变化。
下列说法不正确的是A.实验①生成HIO3时发生的反应为I2+5Cl2+6H2O===2HIO3+10HClB.实验②中当CCl4层变成红棕色时可通过分液的方法获得Br2的CCl4溶液C.由实验得出Cl2、Br2、I2的氧化性由强到弱的顺序是Cl2>Br2>I2D.由实验得出Cl2、HIO3、HBrO3的氧化性由强到弱的顺序是HBrO3>Cl2>HIO3二、非选择题(5小题,共52分)17.甘肃马家窑遗址出土的青铜刀是我国最早冶炼的青铜器,由于时间久远,其表面有一层“绿锈”,“绿锈”俗称“铜绿”,是铜和空气中的水蒸气、CO2、O2作用产生的,化学式为[Cu2(OH)2CO3],“铜绿”能跟酸反应生成铜盐、CO2和H2O。
某同学利用以下反应实现了“铜―→铜绿―→……―→铜”的转化。
好教育云平台一轮单元训练卷第3页(共6页)好教育云平台一轮单元训练卷第4页(共6页)(1)从物质分类标准看,“铜绿”属于________(填字母)。
A.酸B.碱C.盐D.氧化物(2)写出B的化学式:________________。
(3)请写出铜绿与盐酸反应的化学方程式:_______________________________。
(4)上述转化过程中属于化合反应的是________,属于氧化还原反应的是________。
18.Ⅰ.现有Al3+、NH+4、CO2-3、HCO-3等离子,回答下列问题:(1)在强酸性条件下能够大量存在的离子是;(2)在强碱性条件下能够大量存在的离子是;(3)在强酸性和强碱性条件下都不能大量存在的离子是。
Ⅱ.由Na+、NH+4、Ba2+、Cu2+、OH-、Fe3+、SO2-4、Cl-八种离子中的六种两两组成的A、B、C 三种化合物(它们不含有相同离子,已知NH+4与OH-反应有碱性气体生成)。
①A、B、C均易溶于水,形成无色溶液;②将A、B、C三种物质的溶液相互作用时,发现A与B混合后产生有刺激性气味的气体,此气体使湿润的红色石蕊试纸变蓝,B与C混合产生白色沉淀,则:(1)A、B、C的化学式分别为、、。
(2)B与C反应的离子方程式为。
19.(2018·许昌三校联考)亚氯酸钠是(NaClO2)一种高效氧化剂、漂白剂。
在NaOH溶液中ClO2与H2O2反应可以得到亚氯酸钠。
(1)ClO2中氯元素的化合价是________;在制备亚氯酸钠的反应中ClO2作______(填“氧化剂”或“还原剂”);若反应中生成1 mol NaClO2,转移电子的物质的量为______。
(2)该反应的化学方程式为_____________________________________________。
(3)科学家经研究发现NaClO2也可用于制取自来水消毒剂ClO2。
在一定条件下,将Cl2通入填充有固体NaClO2的反应柱内二者反应可制得ClO2。
还原产物为________,当消耗标准状况下1.12 L Cl2时,制得ClO2________ g。
20.某工业废水中仅含下表离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为0.1 mol·L-1。
某同学欲探究废水的组成,进行了如下实验:①用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察)。