Lenzitesgibbosa锰过氧化物酶1基因启动子序列的克隆
- 格式:pdf
- 大小:1.37 MB
- 文档页数:4


偏肿革裥菌锰过氧化物酶酶学性质和染料脱色张玉龙;池玉杰;冯连荣【期刊名称】《林业科学》【年(卷),期】2017(53)9【摘要】[目的]研究白腐菌偏肿革裥菌(Lenzites gibbosa)所产锰过氧化物酶(MnP)纯酶的序列特征、酶学性质及其对染料的脱色能力,为其应用于木质素降解、染料脱色奠定基础.[方法]将纯化后的样品经SDS-PAGE检测后获得的唯一L.gibbosa MnP条带切割,采用Nano液相色谱-电喷雾串联质谱法联用(Nano LC-ESI-MS/MS)多肽测序技术对蛋白氨基酸序列进行测定.利用该SDS-PAGE图谱,建立蛋白分子量与迁移率的标准直线,从标准直线上求出MnP纯酶样品的表观分子量;参照酶活测定方法检测最适反应温度及温度稳定性、最适反应pH值及pH稳定性;采用lineweaver-Burk双倒数作图法求解米氏动力学常数Km值.研究L.gibbosa菌种培养液和MnP纯酶液对蒽醌类的茜素红、偶氮类的刚果红、杂环类的中性红和三苯基甲烷类的结晶紫等4种不同类型染料的脱色能力.[结果]串联质谱扫描出2条MnP的保守序列肽段,与克隆到的基因Lg-mnp1编码的Lg-MnP1(GenBank登录号:ACO92620)序列完全吻合,表明其所代表的酶蛋白Lg-MnP1就是唯一电泳带中主要的蛋白.Lg-MnP1的表观分子量为45.39 kDa,最适反应温度为35℃,在低于40℃的条件下都具有一定的催化能力,但温度超过50℃后迅速失活;其最适反应pH值为3.5,pH超过4.5反应程度就迅速下降,在pH为2~3时最稳定;在以2,6-DMP为底物时,在21℃条件下其米氏常数Km为6.124 mmol·L-1.L.gibbosa培养液对染料在1 h的脱色率分别为茜素红100%、中性红22.17%、刚果红19.09%,对结晶紫的脱色率很低,在36 h脱色率仅为0.018%.纯化后的Lg-MnP1溶液对染料的最大脱色率在2 h分别为中性红100%、刚果红95.55%、茜素红75.85%和结晶紫36.57%.[结论]SDS-PAGE得到的唯一一条电泳带中的MnP是Lg-MnP1.Lg-MnP1是一种中温性、偏酸性的酶,与2,6-DMP的亲和力较大.L.gibbosa含有菌丝的培养液对茜素红具有彻底的降解效果,但Lg-MnP1纯酶液对中性红、刚果红和结晶紫的降解效率要远高于同时含有菌丝、漆酶和MnPs 的培养液.%[Objective] In order to get a clear picture of the sequence signature,characteristics,and decolorizing ability to four types of dyes of the purified manganese peroxidase (MnP) produced by white-rot basidiomycete Lenzites gibbosa strain CB-1.[Method] A single MnP protein band detected in the SDS-PAGE electrophoresis of the purified sample was cut and sequenced by Nano LC-ESI-MS/MS peptide sequencing technology. The characteristics of the purified MnP were studied,the apparent molecular weight of the purified MnP was calculated by the standard curve of protein molecular weight and mobility according to SDA-PAGE pattern,the optimal reaction temperature and thermal stability,the optimal reaction pH and pH stability were determined by enzymatic activity measuringmethod ,Michaelis-constant Km was solved by lineweaver-Burk double bottom figure. The decolorization ability of culture fluid and purified MnP of L. gibbosa to four types s ofdyes,namely,alizarin red,neutral red,congo red,and crystal violet were studied,respectively.[Result] Two conserved amino acid sequences of MnP scanned by Tandem MS perfectly match with Lg-MnP1 ( GenBank Accession No. ACO92620 ) sequence, indicating that Lg-MnP1 represented by two conserved peptides is the main protein in the only electrophoresisband. The apparent molecular weight of Lg-MnP1 is 45. 39 kDa. Its optimal reaction temperature is about 35 ℃,it has some catalytic ability and stability during 40 ℃ but rapidly becomes inactivated beyond 50℃. Its optimal reaction pH value is 3. 5,its catakytic activity rapidly decreases when pH value is above 4. 5,and it is the most stable in pH 2-3 when it is kept for more than 10 hours. Its Michaelis-constant Km is 6. 124 mmol·L -1 at 21℃ with 2,6-DMP as substrate. The decolorization percent of culture fluid is 100% to alizarin,22. 17% to neutral red,and 19. 09% to congo red at 1 h,respectively,but low to crystal violet and only 0. 018% at 36 h,whereas that of the purified Lg-MnP1 solution at 2 h is 100% to neutral red,95. 55% to congo red,75. 85% to alizarin,and 36. 57% to crystal violet.[Conclusion] The MnP in the only band of SDS-PAGE is Lg-MnP1. Lg-MnP1 is a mesophile and partial acidic enzyme and with higher affinity to 2,6-DMP. The culture fluid with mycylia of L. gibbosa has a thoroughly decolorizing ability to anthraquinone dye,while the purified Lg-MnP1 has a higher decolorizing efficiency to neutral red,congo red,and crystal violet than the culture fluid with mycylia,laccases and MnPs.【总页数】8页(P73-80)【作者】张玉龙;池玉杰;冯连荣【作者单位】东北林业大学林学院哈尔滨 150040;东北林业大学林学院哈尔滨150040;东北林业大学林学院哈尔滨 150040;辽宁省杨树研究所盖州 115213【正文语种】中文【中图分类】S718.81【相关文献】1.偏肿革裥菌漆酶基因克隆及不同染料脱色研究 [J], 郑苗苗;池玉杰2.偏肿革裥菌锰过氧化物酶的分级纯化 [J], 张玉龙;池玉杰;冯连荣3.偏肿革裥菌降解木质素关键基因挖掘 [J], 赵清泉;池玉杰;张健;冯连荣4.偏肿革裥菌细胞色素P450基因在刚果红脱色条件下的差异表达 [J], Chi Yujie;Li Mengzhu;Zhang Jian;Li Chenyu;Wang Zehui5.偏肿革裥菌在木质环境下转录组构建与相关基因表达分析 [J], 赵清泉; 池玉杰; 张健; 冯连荣因版权原因,仅展示原文概要,查看原文内容请购买。


人锰超氧化物歧化酶基因在大肠杆菌中的表达凌敏;谢科;苏上贵【期刊名称】《广西医科大学学报》【年(卷),期】2004(21)4【摘要】目的:研究人锰超氧化物歧化酶(hMn-SOD)基因在不同大肠杆菌中的表达水平.方法:以人肝细胞株(L02)总RNA为模板,用RT-PCR扩增出hMn-SOD cDNA,构建重组质粒pSE380-MnSOD并分别转化至3种大肠杆菌DH5α、TOP10和BL21.采用SDS-PAGE和改良的连苯三酚法分别检测SOD酶蛋白及其活性.结果:hMn-SOD基因在3种大肠杆菌中都可以表达,表达量分别为菌体总蛋白质的11.9%、15.8%和30.2%.表达产物具有SOD酶活性,酶比活性分别为90.15 U/mg、114.06 U/mg和216.13 U/mg.结论:hMn-SOD基因在不同大肠杆菌中的表达水平明显不同,在BL21中表达量较高.【总页数】2页(P476-477)【作者】凌敏;谢科;苏上贵【作者单位】广西医科大学生物化学与分子生物学教研室,南宁,530021;广西医科大学生物化学与分子生物学教研室,南宁,530021;广西医科大学生物化学与分子生物学教研室,南宁,530021【正文语种】中文【中图分类】Q554+.6【相关文献】1.人胰岛素原基因在大肠杆菌中的可溶性表达及分离纯化研究 [J], 沈加斌;徐攀;李鑫雨;张立;郑海燕;雍彬2.α人心钠素基因在大肠杆菌两种表达载体系统中的高效表达 [J], 林缨;卢圣栋;梁植权3.麦迪霉素产生菌酮基还原酶基因在大肠杆菌中的表达 [J], 夏焕章;王以光4.人肥胖基因在pBV221中的克隆及在大肠杆菌中的表达 [J], 于雪梅;朱振宇5.人工合成人恶性疟原虫58肽抗原基因在大肠杆菌中的表达 [J], 马维芳;金福军;钟雄林;陈仕荣;王昌才;王启松;闵永洁因版权原因,仅展示原文概要,查看原文内容请购买。
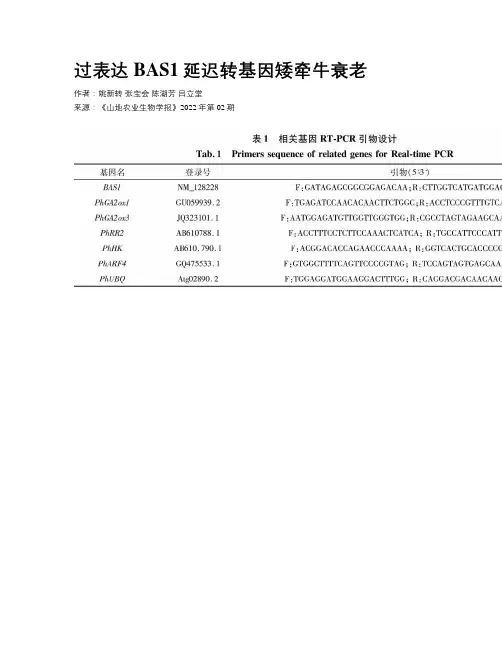
过表达BAS1延迟转基因矮牵牛衰老作者:姚新转张宝会陈湖芳吕立堂来源:《山地农业生物学报》2022年第02期摘要:油菜素类固醇(BRs)是必不可少的植物激素,在植物的生长、繁殖以及逆境响应中发挥重要作用。
为了验证该基因的功能,本文构建了植物遗传表达载体,利用农杆菌介导遗传转化法遗传转化矮牵牛,获得29 株转基因植株;转基因植物表现为节间缩短,分枝增多,生长后期表现出叶片延迟衰老;叶绿素含量、可溶性总糖含量、酶活明显高于野生型, MDA 含量明顯低于野生型;BAS1基因在矮牵牛中的超表达可以提高矮牵牛植株中衰老相关基因的表达,从而延缓了转基因矮牵牛的衰老。
因此,BAS1可用作调控植物花衰老和延长花寿命的潜在候选基因。
关键词:BAS1基因;矮牵牛;抗氧化酶活性;相关基因表达;衰老中图分类号:Q812文献标识码:A文章编号:1008-0457(2022)02-0038-006国际DOI编码:10.15958/ki.sdnyswxb.2022.02.006BAS1基因编码具有羟化酶活性的细胞色素P450单加氧酶,该酶催化油菜素固醇(BR)C-26的羟基羟化作用,导致BR生理活性的降低或丧失[1]。
作为成年植物,BR突变体基本上表现出缺少红光受体phyB突变体的相反表型。
BR突变体是深绿色,生长缓慢,叶片萎缩且茎短小。
另外,BAS1突变体表现出延迟衰老[2]。
过表达BAS1的转基因植物显著降低BR含量,从而导致叶片萎缩,叶片深绿和茎短[3-4]。
BAS1过表达诱导的叶片衰老与烟草植物中细胞分裂素过表达导致的表型非常相似。
异戊烯基转移酶(IPT)催化细胞分裂素合成的限速步骤。
Gan等[5]研究表明,通过精确控制IPT表达来引发特定的发育反应。
SAG12启动子仅在衰老开始时才激活IPT表达,这种激活导致衰老过程的抑制[5-6]。
通过IPT表达抑制叶片衰老导致衰老特异性启动子的减弱[7],从而防止了细胞分裂素的过量产生,干扰了发育的其他方面[8]。

大豆过氧化物酶基因的克隆及其表达载体的构建曾家豫;袁红霞;廖世奇;周思彤;梁琼【期刊名称】《食品科学》【年(卷),期】2010(031)005【摘要】大豆过氧化物酶(soybean peroxidase,sbp)基因的克隆及其表达载体的构建将有利于人们更深入的从分子生物学角度研究sbp基因的结构与功能.首先从大豆根中获取总RNA,通过RT-PCR获得sbp基因.再将sbp基因与表达载体pPICZα-A双酶切后连接,构建重组表达载体pPICZα-A-sbp.将pPICZα-A-sbp转化大肠杆菌筛选阳性克隆体并测序.结果表明:获得的sbp基冈序列与已报道的sbp[U51191(CanEpa1)]基因序列有92%的同源性.重组表达载体pPICZα-A-sbp 的成功构建为其在毕赤酵母中表达奠定了基础.【总页数】4页(P197-200)【作者】曾家豫;袁红霞;廖世奇;周思彤;梁琼【作者单位】西北师范大学生命科学学院,甘肃,兰州,730070;西北师范大学生命科学学院,甘肃,兰州,730070;甘肃省医学科学研究院,甘肃,兰州,730050;西北师范大学生命科学学院,甘肃,兰州,730070;西北师范大学生命科学学院,甘肃,兰州,730070【正文语种】中文【中图分类】Q785【相关文献】1.不结球白菜抗坏血酸过氧化物酶基因克隆及其原核表达载体构建 [J], 马成英;侯喜林;刘同坤;李俊星;张蜀宁;李英2.人过氧化物酶体增殖体激活受体γ2基因克隆及真核表达载体的构建与鉴定 [J], 代芳;王佑民;王长江;佘其美;周剑;时照明;胡红琳3.毛尖紫萼藓1-半胱氨酸过氧化物酶基因GpPER1的克隆、表达载体构建及序列分析 [J], 安洪雪;沙伟;张梅娟;刘博;宋璐4.大豆GmTTG1-like基因的克隆与分析及植物表达载体构建 [J], 陈蕾;董德坤;袁凤杰;朱丹华;金庆生5.大豆F-box基因Glyma08g11030启动子克隆及植物表达载体构建 [J], 张承琪;王怡;夏成林;于月华;倪志勇因版权原因,仅展示原文概要,查看原文内容请购买。


辛建增,唐婷,刘盛.PGC-lα调控畜禽肌肉脂肪生长代谢及其与肉品质研究进展[J].畜牧与兽医,2024,56(5):138-145.XINJZ,TANGT,LIUS.Progressinresearchonrelationshipbetweenregulationofperoxisomeproliferator-activatedreceptorγ-coactivator-1αongrowthandmetabolismofmuscleandfatandmeatqualityinlivestockandpoultry[J].AnimalHusbandry&VeterinaryMedicine,2024,56(5):138-145.PGC-lα调控畜禽肌肉脂肪生长代谢及其与肉品质研究进展辛建增1,唐婷1,刘盛2∗(1.烟台大学生命科学学院,山东烟台㊀264000;2.烟台大学药学院,山东烟台㊀264000)摘要:过氧化物酶体增殖物激活受体γ辅激活因子1α(PGC-lα)是一种具有广泛功能的转录调节因子,其在动物体内参与线粒体生物合成㊁肌纤维类型转化㊁脂肪分化㊁肌内脂肪沉积㊁糖脂代谢㊁能量代谢等多项生理过程,其中,肌纤维类型和肌内脂肪含量与肉品质密切相关㊂因此,在分子水平深入探究PGC-1α调控肌肉和脂肪的生长代谢过程将为改善肉品质提供新的研究思路㊂本文系统概述了PGC-lα的结构特点及PGC-1α调控肌肉线粒体增生㊁脂肪分化㊁能量代谢等过程的机制,重点介绍了PGC-lα调控肌纤维类型转化㊁肌内脂肪沉积㊁糖类代谢及其与肉品质形成之间的可能关系,以期为今后通过PGC-1α调控畜禽肌肉脂肪生长代谢,进而改善肉品质提供参考㊂关键词:过氧化物酶体增殖物激活受体γ辅激活因子1α;肌纤维类型;肌内脂肪沉积;能量代谢;肉品质中图分类号:S826㊀㊀㊀文献标志码:A㊀㊀㊀文章编号:0529-5130(2024)05-0138-08Progressinresearchonrelationshipbetweenregulationofperoxisomeproliferator-activatedreceptorγ-coactivator-1αongrowthandmetabolismofmuscleandfatandmeatqualityinlivestockandpoultryXINJianzeng1,TANGTing1,LIUSheng2∗(1.CollegeofLifeSciences,YantaiUniversity,Yantai264000,China;2.CollegeofPharmacy,YantaiUniversity,Yantai264000,China)Abstract:Peroxisomeproliferator-activatedreceptorγ(PPAR-γ)coactivator1α(PGC-lα)isaversatiletranscriptionalregulator.Thisregulatorisinvolvedinmanyphysiologicalprocessessuchasmitochondrialbiosynthesis,musclefibertypetransformation,adiposedifferenti⁃ation,intramuscularadiposedeposition,glycolipidmetabolism,andenergymetabolisminanimals.Musclefibertypeandintramuscularfatcontentarecloselyrelatedtomeatquality.Therefore,exploringtheregulationofPGC-1αonthegrowthandmetabolismofmuscleandfatatthemolecularlevelwillprovidenewresearchideasforimprovingmeatquality.Inthispaper,thestructuralcharacteristicsofPGC-lαandthemechanismofPGC-1αregulatingmusclemitochondria,adiposedifferentiationandenergymetabolismaresystematicallyreviewed.Theregu⁃lationofPGC-lαonmusclefibertypetransformation,intramuscularfatdeposition,carbohydratemetabolismanditspossiblerelationshipwiththeformationofmeatqualityareemphasized;whichprovidesreferenceforimprovingmeatqualitybyregulatingthegrowthandmetabo⁃lismofmuscleandfatbyPGC-1αinlivestockandpoultry.Keywords:PGC-1α;musclefibertype;intramuscularfatdeposition;energymetabolism;meatquality㊀㊀畜禽肉品质包括肉色㊁嫩度㊁系水力㊁风味㊁多汁性等多个方面㊂因此,肉品质性状是一个复杂的综合性状㊂肉品质受宰前和宰后多种因素的影响,例如遗传(品种㊁性别㊁年龄㊁基因)㊁营养水平㊁饲养管理㊁宰前运输㊁屠宰方式㊁宰后成熟方式等,其中㊀收稿日期:2023-05-25;修回日期:2024-03-20基金项目:烟台大学博士启动基金项目(SM20B113)第一作者:辛建增,男,博士,讲师∗通信作者:刘盛,讲师,研究方向为食品化学,E-mail:liush⁃eng87@126 com㊂遗传因素起决定性作用㊂然而,在饲养过程中,畜禽肌肉和脂肪的生长发育及代谢对肉品质的形成也起着至关重要作用㊂畜禽肌肉的生长发育及代谢是一个及其复杂的过程,由多种基因和信号通路在不同水平上参与调控,各调控因子与信号通路分工协作组成精细复杂的调控网络,有序调控肌肉的生长发育㊁肌纤维类型的转化㊁肌纤维的能量代谢等生物学过程㊂而脂肪组织是畜禽维持生命活动必不可少的组织,通常储存在皮下㊁内脏㊁肌肉等部位㊂与肉品质最相关的脂肪为肌内脂肪和肌间脂肪㊂其中肌内脂肪的含量与肉品质最为密切,是肉品领域的研究热点,肌内脂肪的含量会影响肉的系水力㊁风味㊁多汁性等品质㊂过氧化物酶体增殖物激活受体γ辅激活因子1α(PGC-1α)是肌肉和脂肪生长代谢过程中必需的转录共调节因子,它参与调控肌细胞线粒体生物合成㊁肌纤维类型的转化㊁肌细胞能量代谢等生物学过程㊂PGC-1α在脂肪的分化㊁沉积㊁合成㊁代谢等方面也发挥重要的调节作用㊂此外,PGC-1α还参与机体的适应性产热㊁肝脏的糖异生㊁血管生成㊁调控细胞中活性氧簇水平㊁调控机体的生物钟基因等生理过程㊂PGC-1α功能广泛,参与众多生理调节过程㊂本文将对PGC-1α分子结构特征,PGC-1α调控肌纤维能量代谢㊁肌纤维糖代谢㊁肌纤维类型转化㊁脂肪分化㊁肌内脂肪沉积㊁脂肪代谢及其与宰后肉品质的可能关系进行了系统阐述,并对相关可能的研究热点进行了展望㊂以期为更深入地探究PGC-1α信号通路及其靶基因调控畜禽肌肉脂肪生长代谢和提高肉品质提供参考㊂1㊀PGC-1α概述PGC-1α是由Spiegelman团队1998年最先在小鼠棕色脂肪组织中发现的一种转录共调节因子[1]㊂PGC-1α属于PGC-1家族,该家族共有3个成员,另外两个分别为过氧化物酶体增殖物激活受体γ(PPAR-γ)辅激活因子-1β(PGC-1β)和PGC-1相关辅活化因子(PRC),其家族成员蛋白长度存在着一定的差异,但存在着相应的保守序列㊂PGC-1家族的N端结构域均含有转录激活域,C端结构域均包含富含丝氨酸/精氨酸的RS域和RNA结合区域(RMM)[2]㊂PGC-1α与PGC-lβ同源性较高,而与PRC的同源性则相对较低㊂人的PGC-1α基因位于染色体4p15 1区域,全长为681kb,由13个外显子和12个内含子组成,其mRNA含有6908bp,编码一个包含798个氨基酸,分子量91kDa的蛋白质[3],其他常见畜禽的PGC-1α基因与蛋白质基本信息见表1(引自NCBI)㊂PGC-1α的蛋白结构域,其N端有一个富含酸性氨基酸的转录激活区(activationdomain,AD),该区内有一个LXXLL结构域(X:任意氨基酸;L:亮氨酸),此结构域是PGC-1α与配体依赖型核受体结合的基础㊂负调控元件和转录因子结合位点位于PGC-1α的中间区域,当转录因子与PGC-1α结合时,负调控元件就会暴露出来[4]㊂C末端是一个RNA结合基本序列RRM和富含丝氨酸/精氨酸的RS区域,这个区域可以与RNA聚合酶Ⅱ的C末端相互作用,处理新转录的RNA㊂PGC-1α上还有与细胞呼吸因子(NRF)㊁肌细胞特异性增强子2C(myocyteenhancerfactor2C,MEF2C)及PPARγ结合的位点[3]㊂因此,PGC-1α是作为转录因子的激活因子来调控其他基因的表达㊂表1㊀人与常见畜禽PGC-1α基因和蛋白质基本信息物种所处染色体基因长度/kbmRNA长度/bp内含子数外显子数蛋白肽链长度(氨基酸残基数量)蛋白质分子量/kDa人46816908121380392猪86966738121379690狗36415841131480391牛67156324121379690羊67186680121378789鸡43486615121380892鸭43619716121380892鸽子43644913121367077㊀㊀PGC-1α分子本身的促转录激活活性较低,只有被相应的受体募集后,其活性才显著增强㊂PGC-1α与核受体结合后,会导致PGC-1α构象发生改变,并与下游因子作用,发挥转录激活作用㊂PGC-1α不仅对PPARγ具有组织特异性的辅激活作用,而且也是类维生素AX受体(RXR)㊁肌细胞增强因子2c(myocyteenhancerfactor2C,MEF2C)㊁甲状腺激素受体(thyroidhormonereceptor,TR)㊁糖皮质激素受体(glucocorticoidreceptor,GR)㊁雌醇受体α(es⁃trogenreceptor,ERα)和PPARs等核受体(nuclearreceptor,NR)的辅激活因子[2,5-7]㊂PGC-1α的表达具有组织特异性,通常在线粒体含量丰富和氧化代谢活跃的器官或组织中高表达,如骨骼肌㊁心脏㊁棕色脂肪组织㊁肝脏㊁肾脏和大脑组织等,而在肺㊁小肠㊁结肠和胸腺中只有很少量的表达,在胎盘㊁脾和外周白细胞中未见表达[8]㊂前已述及,PGC-1α在肌肉脂肪的生长发育及代谢中发挥着重要调控作用,下面将针对其活性调控㊁肌肉脂肪生长代谢及其与肉品质和一些生理功能的相关作用进行论述㊂2㊀PGC-1α活性调控相关信号因子PGC-1α含有磷酸化㊁乙酰化㊁糖基化㊁甲基化㊁泛素化等翻译后修饰的位点,这些翻译后修饰对于其发挥作用时的精细化调控具有重要意义[9]㊂其中当前研究较多的为乙酰化和磷酸化修饰㊂沉默信息调节因2相关酶1(sirtuin1,SIRT1)和AMP依赖的蛋白激酶(adenosine5-monophosphate-activatedproteinkinase,AMPK)是调控PGC-1α去乙酰化和磷酸化的关键酶,此两种酶对于机体肌肉脂肪生长发育和能量代谢的精准调控和稳态维持具有重要的意义㊂SIRT1可以将乙酰化后的PGC-1α去乙酰化,从而提高PGC-1α的活性[10-11]㊂此外SIRT1是体内代谢的感受器,当机体处于能禁食或者饥饿等状态下,SIRT1会加速PGC-1α的去乙酰化,导致其活性上升,可增加线粒体的合成㊂而一些乙酰转移酶例如组蛋白乙酰化酶氨合成通用控制蛋白5(histoneacetyl⁃transferaseGCN5,GCN5)和核受体共激活因子-3(steroidreceptorcoactivator3,SRC-3)可以使PGC-1α发生乙酰化,从而抑制其活性[12-15]㊂此外,SIRT1的去乙酰化作用还是PGC-1α调控生物钟基因表达的重要事件㊂SIRT1与乙酰化酶协调作用,精细化调节PGC-1α发挥作用㊂AMPK是体内能量感受器,当机体能量处于缺乏状态时,AMPK可使PGC-1α磷酸化位点磷酸化,从而提高PGC-1α活性,激活与能量代谢相的通路,引起线粒体增生㊁脂肪酸氧化等生物学过程增加[14]㊂3㊀PGC-1α与肌肉生长代谢及肉品质3 1㊀PGC-1α与肌肉线粒体合成及肉品质线粒体是为骨骼肌生长发育提供能量的细胞器,它对骨骼肌发挥正常生理功能具有重要的意义,PGC-1α是调控线粒体生物合成和氧化磷酸化过程中的关键调节因子[15-16]㊂研究发现,PGC-1α可参与调控肌纤维中线粒体的生成,并且还能够调节线粒体的融合及分裂,在某些组织,如白色脂肪㊁肌肉㊁神经㊁心脏中超表达PGC-1α,都会促进线粒体的生成[15-17]㊂PGC-1α促进线粒体生成主要通过与转录因子结合发挥作用,常见的为核呼吸因子-1(nuclearrespiratoryfactor-1,NRF-1)和核呼吸因-2(nuclearrespiratoryfactor-2,NRF-2)㊂研究发现,PGC-1α与核呼吸因子结合后会刺激线粒体转录因子A(mitochondrialtranscriptionfactorA,mtTFA)的合成㊂这些因子直接影响线粒体生成,在线粒体内引起线粒体DNA的双向转录,实现了线粒体的增殖[18-19]㊂畜禽宰杀放血后,肌肉中的线粒体发生肿胀,最终结构破坏而破裂,但肉品质形成过程中,线粒体的生理代谢状态与肉嫩度㊁肉色㊁持水力等品质有着密切关系㊂研究表明,宰后初期肌肉线粒体耗氧率与肉品嫩度密切相关,高嫩度牛肉拥有更高的线粒体耗氧率[20]㊂宰后肌肉中线粒体影响肉色稳定性主要通过两种途径,一是线粒体与氧合肌红蛋白竞争氧气,使其转变为脱氧肌红蛋白状态,此情况过度发生可导致肉色变暗;另一方面,线粒体具有高铁肌红蛋白还原酶活性,可以将氧化的高铁肌红蛋白转化为还原态脱氧肌红蛋白,为鲜红色氧合肌红蛋白的生成提供还原态肌红蛋白[21-22]㊂肌肉持水力是肉品一个重要的品质,最近研究表明,牛肉宰后成熟过程中,线粒体脂肪成分的变化与肌肉持水力的变化密切相关[23]㊂PGC-1α已被证明其与畜禽生长和肉品质密切相关,且已被列为能够候选基因[24],然而未见PGC-1α调控肌肉中线粒体与宰后肉品质的相关研究,PGC-1α对肌肉中线粒体的调控及宰后肉品质的变化形成需要开展深入研究㊂3 2㊀PGC-1α与肌肉糖类代谢葡萄糖是肌肉组织主要的能源物质,糖类氧化供能为肌肉的各类生理活动提供能量㊂PGC-1α在体内糖代谢的过程中发挥重要调节作用,主要表现在以下几个方面:首先PGC-1α是糖异生过程的关键调节因子㊂在禁食情况下,PGC-1α会在肝细胞中大量表达,与其他相关调节因子配合在转录水平上激活糖异生关键酶组,如葡萄糖-6-磷酸酶㊁磷酸烯醇式丙酮酸羧激酶等,最终导致肝糖输出增加[25-26]㊂其次,葡萄糖进入肌肉细胞需要葡萄糖转运载体4(glucosetransporters4,GluT4)的转运,PGC-1α可与肌细胞增强子因子2(myocyteenhancerfactor2,MEF2)共同作用,刺激GluT4的表达,从而增加肌细胞内葡萄糖的水平㊂此外,PGC-1α在某些情况还可抑制肌细胞葡萄糖的氧化,其与雌激素相关受体(estrogen-relatedreceptorα,ERRα)结合后,刺激丙酮酸脱氢酶4表达,从而抑制葡萄糖氧化和增加葡萄糖吸收来补充肌糖原贮备,为下一次的肌肉运动做准备㊂肌肉中的糖原是宰后生成乳酸的原料,动物胴体在宰后冷藏排酸过程中,糖原转化为乳酸导致肌肉pH值下降,这是宰后肌肉排酸的原理㊂而宰后pH的下降幅度和速度影响肉品质形成,宰后肌肉pH值过高或过低都会形成异质肉㊂而PGC-1α对于肌肉糖代谢具有调控作用,宰前肌肉中PGC-1α的表达水平和活性对于宰后肌肉糖原水平㊁pH值变化及肉品质形成是否具有影响,未见相关报道,需要开展相应研究㊂3 3㊀PGC-1α与骨骼肌肌纤维类型转换及肉品质不同肌纤维类型对于肌肉发挥生理功能具有重要的作用,比较常见的例子是,动物不同部位的肌肉的肌纤维组成存在着明显差异,且肉品质也存着差别㊂肌肉纤维类型受遗传㊁运动㊁营养㊁和环境等多种因素的影响㊂PGC-1α是调控肌纤维类型转变的主要因子,PGC-1α基因高表达,可以提高与氧化型肌纤维有关的基因表达,提高细胞色素C和肌红蛋白的含量提高有氧呼吸能力与线粒体的数量,增强抗疲劳的能力等,主要为使酵解型肌纤维向氧化型肌纤维转化[27-28]㊂超表达PGC-1α的转基因小鼠,其骨骼肌中Ⅱ型肌纤维表现出Ⅰ型肌纤维的蛋白特性,其中TNN1蛋白㊁肌红蛋白和肌钙蛋白Ⅰ明显增加,Ⅱ型肌纤维逐步转化为Ⅰ型肌纤维[29]㊂人和动物的骨骼肌类型变化研究表明,PGC-1α的表达量与快肌纤维的含量成负相关,与慢肌纤维的含量成正相关[30-31]㊂相关研究已证实,寒冷可以刺激诱使鸡的胸肌部分从ⅡB型转化为ⅡA型,而PGC-1α的上调表达在其中发挥了关键的作用[32]㊂PGC-1α通过调节肌纤维类型影响畜禽肉品质已经被证实,但是其发挥作用的详细分子机制还不清晰,需要开展相应的深入研究㊂3 4㊀PGC-1α与肌肉中活性氧含量及肉品质PGC-1α可促进肌肉等组织中线粒体的合成,还能刺激线粒体呼吸链电子转运活性,从理论上讲,PGC-1α将导致细胞内活性氧(reactiveoxygenspecies,ROS)水平提高,但是实际上并非如此,在肌肉和棕色脂肪中,运动与寒冷环境的暴露均和ROS负面影响没有关联,这主要是PGC-1α可以增强很多抗氧化酶的表达[33-34]㊂即PGC-1α有两种能力,刺激线粒体电子转运的同时抑制ROS水平㊂这样,肌肉组织,棕色脂肪通过提升线粒体代谢应对外部环境变化的过程中,不会对自身造成氧化损伤㊂而ROS与宰后肉品的形成密切相关,动物在宰杀后,ROS主要来源于线粒体和脂肪的氧化,产生的ROS往往会对某些肉品质,肉色㊁嫩度㊁系水力等产生负面影响[23,35]㊂ROS与宰后肉品质形成一直是肉品科学领域研究的热点,PGC-1α已被证实是影响肉品质的候选基因之一,但是其调控宰后肌肉中ROS的作用机制及如何影响肉品质未见相关报道㊂4㊀PGC-1α与脂肪生长代谢及肉品质4 1㊀PGC-1α与脂肪细胞分化动物脂肪组织中大约1/3是脂肪细胞,其余的2/3是成纤维细胞㊁微血管㊁神经组织和处于不同分化阶段的前脂肪细胞㊂由前脂肪细胞分化为脂肪细胞的过程是一个涉及多个信号通路的复杂调控过程,该过程大致可为4个阶段,分别为生长抑制阶段㊁克隆扩增㊁早期分化和终末分化[36]㊂PPARs在动物脂肪发育分化的早期分化阶段开始发挥调控作用,它们与相应的因子协调作用,共同调节脂肪的增殖分化㊂PPARγ是PPARs家族成员,它是脂肪细胞分化的及其的重要因子,其通常可作为前体脂肪分化处于早期分化的标志基因,是脂肪细胞增殖分化过程中起决定性作用的基因㊂研究证实,PPARγ缺失的胚胎干细胞能够分化为多种细胞,但唯独不能分化为脂肪细胞㊂此外,PPARγ基因敲除的小鼠,在胚胎期10d左右就会死亡,且未在胚胎内检测到脂肪细胞,而正常小鼠在胚胎期10d即可检测到脂肪细胞的存在[36]㊂这说明PPARγ在脂肪分化形成过程中起关键作用,PPARγ发挥脂肪分化调控作用时,需要先与RXRα形成异源二聚体,然后与所调节基因启动子上游的过氧化物酶体增殖物反应元件(PPRE)结合才发挥转录调控作用,而PGC-1α作为PPARγ配体,能促进PPARγ与相应调控因子的结合[37]㊂很多哺乳动物体内存在着白色脂肪组织㊁米色脂肪组织和棕色脂肪组织三种,白色脂肪主要作用为贮存能量,米色脂肪具有贮存能量和非战栗产热的功能,棕色脂肪主要进行非战栗产热㊂在细胞结构和功能上,白色脂肪细胞拥有一个大脂滴用于存贮能量,而棕色脂肪细胞拥有多脂滴㊁多线粒体的结构㊂PGC-1α能够促进白色脂肪向棕色脂肪转化,它能够刺激白色脂肪中线粒体的大量生成,还能增加解偶联蛋白1(UCP1)等分子的生成,这些改变可使白色脂肪逐渐转化为棕色脂肪组织[38]㊂4 2㊀PGC-1α与脂肪氧化供能脂肪是畜禽体内重要的储能物质,在冷暴露㊁禁食㊁运动等情况下,可为机体提供能量,其中脂肪酸β氧化产能是其最为主要的供能方式㊂脂肪是也骨骼肌获取能量的重要物质㊂研究表明,过表达PGC-1α可增加骨骼肌线粒体的生物合成,也可使脂肪酸氧化相关酶含量上升或者活性增强,从而增加脂肪酸氧化供能[39-40]㊂在小鼠骨骼肌和猪前脂肪细胞过表达PGC-1α,可促进脂肪酸氧化过程中相关基因肉碱棕榈酰转移酶1β(CPT1β)㊁肝型脂肪酸结合蛋白(FABP1)㊁过氧化物酶酰基辅酶A氧化酶1(ACOX1)㊁中链酰基辅酶A脱氢酶(MCAD)㊁脂肪酸转位酶(CD36)等的表达,其中CPT1β是脂肪酸氧化过程中的限速酶[38-41]㊂CD36㊁FABP1是脂肪酸转运的重要蛋白,可将脂肪酸逐步转运至肌肉等组织,便于氧化供能㊂而ACOX1㊁MCAD是参与脂肪酸氧化过程中的关键酶㊂过表达PGC-1α还可促进氧化磷酸化相关基因ATPSynthase㊁CytC㊁COXⅢ等的表达[27]㊂而在PGC-1a敲除后的小鼠表现为心脏功能不全,肌肉耐力下降,轻度心动过缓,心肌脂肪酸氧化能力下降,能量产生减少[42-44]㊂以上研究说明PGC-1α在肌肉的脂肪酸氧化供能方面起重要的调节作用㊂4 3㊀PGC-1α与肌内脂肪沉积及肉品质肌内脂肪的沉积是一个涉及多种信号通路和代谢因子的复杂过程,PPARs家族成员㊁肌内脂肪转运相关因子等发挥了重要的作用㊂PGC-1α是PPARs家族某些因子的配体,其在肌肉脂肪代谢过程中发挥了重要作用㊂PGC-1α不仅能够增加肌肉脂肪的分解代谢(前已述及),而且还可增加肌细胞中脂肪的合成代谢㊂通过肌细胞培养实验和转基因小鼠试验证实,PGC-1α不仅能增加脂肪的分解代谢,还可以增加肌细胞内脂肪酸和磷脂等脂肪的合成代谢[45-46],且PGC-1α转基因小鼠的脂肪酸转运蛋白等脂质代谢相关蛋白也增加了[46]㊂PGC-1α对于肌内脂肪的双向调控作用,对于动物维持生命活动具有重要的意义,不仅能够保障机体对于能量的需求,还对机体后续的生命活动具有重要的意义㊂其发挥脂肪调控作用,还要取决于动物机体所处的状态㊂畜禽上的相关研究已经证实,PGC-1α与脂肪沉积及肉品质存在一定关联㊂在猪上的研究表明,PGC-1α参与猪脂肪沉积的基因,PGC-1α基因多态性与失水率㊁剪切力等肉品指标显著相关[47-49]㊂因此,PGC-1α已被列为猪脂肪沉积及肉品质的候选基因,且在藏猪上的研究表明PGC-1α与肌内脂肪沉积密切相关[36]㊂在鸡上的研究也证实,PGC-1α多态性与鸡腹部脂肪的沉积显著相关[50-51]㊂然而,在牛上的研究表明,肌内脂肪含量及嫩度等品质与PGC-1α存在一定的相关性,但是未达到显著水平[52]㊂以上研究表明由于遗传背景的差异,不同畜禽PGC-1α在调控肌肉脂质代谢方面可能存在着差异㊂但是当前研究大多停留在分析推测层面,并未对其作用的机理及信号通路作用方式进行深入研究,因此需要对PGC-1α调控肌肉代谢,尤其是调控脂肪代谢开展深入的研究,为优质肉品的生产提供研究基础㊂4 4㊀PGC-1α与机体的适应性产热适应性产热是机体应对外界刺激以产热的形式消耗能量的生理过程,对于动物在特定环境下,维持正常体温和生命活动是必须的,主要发生在骨骼肌和棕色脂肪组织㊂其中小型动物,如小鼠,大鼠等主要依靠棕色脂肪组织进行适应性产热,而畜禽则以肌肉适应性产热为主㊂棕色脂肪的分化形成需要PPARγ发挥作用,但其发挥作用需要PGC-1α的辅助,PGC-1α结合并激活PPARγ后才能刺激棕色脂肪细胞分化过程中基因的转录[15,53-54]㊂PGC-1α还可通过另外两个方面来加快适应性产热,首先是促进适应性产热原料的摄取,促进棕色脂肪和肌肉对产热原料,如葡萄糖和脂肪的摄取;促进适应性产热过程中关键因子的合成及表达,主要是为了适应性产热过程的顺利进行,如促进线粒体的生物合成,促进呼吸链相关基因的表达,促进氧化磷酸化相关基因的表达等[55-56]㊂当前未见PGC-1α调控畜禽适应性产热与肉品质的相关研究,但宰后迅速科学降低屠体的温度,防止肉品质因为过热而出现变质是当前肉品科学领域的一个重要的研究方向㊂5㊀PGC-1α与生物钟相互反馈调控畜禽骨骼肌代谢㊀㊀生物钟是生物机体生命活动的内在节律性㊂体温㊁血压㊁睡眠㊁内分泌㊁肝脏代谢㊁行为等重要生命活动均受到生物钟相关基因的调控[57-59],研究表明生物钟还可参与调控细胞周期[60]㊂其中昼夜节律及光照是调节生物钟基因表达的最常见的外部环境因素,这些因素的变化会影响畜禽的生长发育和动物性产品的质量㊂生物钟相关调控规律已在畜禽生产领域得到了应用,其可用于改善动物的生长,提高动物性产品的质量㊂Tao等[61]的研究表明,生物钟基因在蛋鸭卵巢的表达水平与产蛋量密切相关㊂光刺激可通过影响生物钟基因的表达,提高肉仔鸡生长期体重和胸肌产量,改善饲料转化率[62]㊂生物钟基因与奶山羊乳腺代谢密切相关,饲喂不同饲料可改变调生物钟基因表达,调控奶山羊的泌乳[63]㊂畜禽骨骼肌中存在着生物钟基因,骨骼肌的生命活动受到生物钟基因的调控,PGC-1α是连接生物钟和能量代谢的关键调控因子[64]㊂研究表明,PGC-1α在骨骼肌中的表达呈现明显的昼夜节律性,且PGC-1α敲除小鼠在能量代谢方面出现异常的生理节律㊂PGC-1α与生物钟基因形成反馈调节回路,首先PGC-1α是生物时钟基因的上游调节因子,PGC-1α能够诱导生物时钟关键基因的表达,如脑和肌肉芳香烃受体核转运样蛋白1基因(Bmal1)㊁时钟基因(Clock)和反向成红细胞增多症基因(Rev-erba)等㊂此外,PGC-1α还可以和视黄酸受体相关的孤儿受体(RORα/γ)协同作用,使染色质的局部结构活化,从而激活Bmal1的转录[65]㊂此外,SIRT1对PGC-1α的去乙酰化是导致Bmal1激活的关键事件[66]㊂其次,Clock1a:Bmal1b复合体又能参与调控PGC-1α的表达㊂在畜禽骨骼肌中生物钟基因与PGC-1α共同调节骨骼肌的糖脂和能量代谢等生命活动,对于畜禽骨骼肌的生长发育具有重要的意义㊂当前缺乏PGC-1α与生物钟基因联合作用调控畜禽肉品质的相关入研究,这可能会成为肉品领域新的研究方向㊂6 小结与展望综上所述,PGC-1α作为一种多效转录调控因子,除参与调控肌肉脂肪生长发育及能量代谢外,还参与骨骼肌脂肪的沉积㊁肌纤维类型转化等生理活动,不仅能够在转录水平上调控骨骼肌能量代谢,而且还与生物钟基因相互作用反馈调节肌肉脂肪的生长发育㊂近年来随着我国人民水平的提高和饮食结构的改善,对于肉品质提出了更高的要求,例如肉品嫩度㊁多汁性和大理石花纹等,这些品质与肌纤维类型和肌内脂肪含量密切相关㊂如何生产肌纤维类型比例合适㊁肌内脂肪适中的肉品,是当前动物营养领域和肉品科学领域的研究热点㊂这与骨骼肌和脂肪生长代谢显著相关,且PGC-1α在其中发挥了重要作用㊂尽管针对PGC-1α调节骨骼肌生长发育㊁肌纤维类型转换㊁脂肪沉积㊁能量代谢的分子机制,已进行了大量的系统研究,也取得了一些重大进展,但还存在许多问题,诸如PGC-1α如何精细调节肌内脂肪沉积,PGC-1α调控肌纤维转换和能量代谢的详细信号通路,以及PGC-1α与脂肪因子瘦素㊁脂联素㊁抵抗素等的相互激活转录机制,特别是如何通过有效地干预PGC-1α调控肌肉脂肪沉积及靶向控制PGC-1α介导肌纤维类型转换等㊂今后需对这些问题进行深入探索,以期通过PGC-1α调控畜禽肌肉的生长发育㊁脂肪代谢㊁能量代谢等生理过程来提高肉品质㊂参考文献:[1]㊀MITRAR,NOGEEDP,ZECHNERJF,etal.Thetranscriptionalcoactivators,PGC-1αandβ,cooperatetomaintaincardiacmito⁃chondrialfunctionduringtheearlystagesofinsulinresistance[J].JMolCellCardiol,2012,52(3):701-710.[2]㊀JANNIGPR,DUMESICPA,SPIEGELMANBM,etal.Regula⁃tionandbiologyofPGC-1α[J].Cell,2022,185(8):1444.[3]㊀ESTERBAUERH,OBERKOFLERH,KREMPLERF,etal.Humanperoxisomeproliferatoractivatedreceptorγcoactivator1(PPARGC1)gene:cDNAsequence,genomicorganization,chro⁃mosomallocalizationandtissueexpression[J].Genomics,1999,62(1):98-102.[4]㊀PUIGSERVERP,RHEEJ,LINJ,etal.Cytokinestimulationofenergyexpenditurethroughp38MAPkinaseactivationofPPARγco⁃activator-1[J].MolCell2001,8:971-982.[5]㊀TCHEREPANOVAI,PUIGSERVERP,NORRISJD,etal.Modu⁃lationofestrogenreceptor-αtranscriptionalactivitybythecoactivatorPGC-1[J].BiolChem,2000,275(21):16302-16308.㊀[6]㊀BHALLAS,OZALPC,FANGS,etal.Ligand-activatedpregnaneXreceptorinterfereswithhnf-4signalingbytargetingacommonco⁃activatorPGC-1α:functionalimplicationsinhepaticcholesterolandglucosemetabolism[J].BiolChem,2004,279(43):45139-45147.㊀[7]㊀RHEEJ,INOUEY,YOONJC,etal.RegulationofhepaticfastingresponsebyPPARγcoactivator-1α(PGC-1α):requirementforhepatocytenuclearfactor4αingluconeogenesis[J].ProcNatlAcadSciUSA,2003,100(7):4012-4017.[8]㊀马燕.藏羚羊和藏系绵羊PGC-1α基因编码区的克隆与分析[D].西宁:青海大学,2012.[9]㊀张林.超表达猪源PGC-1α促进小鼠和猪肌纤维类型转变的研究[D].武汉:华中农业大学,2014.[10]RODGERSJT,LERINC,HAASW,etal.Nutrientcontrolofglu⁃cosehomeostasisthroughacomplexofPGC-1αandSIRT1[J].Nature,2005,434(7029):113-118.[11]WANGW,WUD,DINGJ,etal.Modifiedrougandecoctionatten⁃uateshepatocyteapoptosisthroughamelioratingmitochondrialdys⁃functionbyupregulatedSIRT1/PGC-1αsignalingpathway[J].PoultSci,2023,102(10):1-19.[12]LERINC,RODGERSJT,KALUMEDE,etal.GCN5acetylrans⁃ferasecomplexcontrolsglucosemetabolismthroughtranscriptionalrepressionofPGC-1α[J].CellMetab,2006,3(6):429-438.[13]YEF,WUL,LIH,etal.SIRT1/PGC-1αisinvolvedinarsenic-inducedmalereproductivedamagethroughmitochondrialdysfunction,whichisblockedbytheantioxidativeeffectofzinc[J].EnvironPollut,2023,320:121084-121086.[14]NETOIVS,PINTOAP,MUNOZVR,etal.Pleiotropicandmulti-systemicactionsofphysicalexerciseonPGC-1αsignalingduringtheagingprocess[J].AgeingResRev,2023,87:101935-101954.㊀[15]PUIGSERVERP,WUZ,PARKCW,etal.Acold-inducibleco⁃activatorofnuclearreceptorslinkedtoadaptivethermogenesis[J].Cell,1998,92(6):829-39.[16]LIL,LUZ,WANGY,etal.Genisteinalleviateschronicheatstress-inducedlipidmetabolismdisorderandmitochondrialenergeticdys⁃functionbyactivatingtheGPR30-AMPK-PGC-1αsignalingpath⁃waysintheliversofbroilerchickens[J].PoultSci,2023,103(1):1-12.[17]GARNIERA,FORTIND,ZOLLJ,etal.Coordinatedchangesin。

偏肿革裥菌锰过氧化物酶的分级纯化张玉龙;池玉杰;冯连荣【期刊名称】《林业科学》【年(卷),期】2017(053)008【摘要】[目的]研究白腐菌偏肿革裥菌(Lenzites gibbosa)锰过氧化物酶(MnP)的分级纯化,以期得到 L.gibbosa MnP的纯品和进行后续酶学性质研究.[方法]在对 L. gibbosa所产 MnPs进行优化培养、获得大量 MnPs 粗酶液的基础上,通过硫酸铵(NH4)2SO4分级盐析、聚乙二醇(PEG)沉淀进行粗酶液浓缩、在起始缓冲液中进行透析、经DEAE-琼脂糖 CL-6B离子交换柱层析进行梯度洗脱和葡聚糖 G-75凝胶过滤柱层析等方法对 MnPs粗酶液进行纯化,并对分级纯化方法进行优化,对纯化浓缩后的纯酶样品采用 SDS-PAGE 方法进行酶纯度检验.[结果]在75%、80%和85%这3种(NH4)2SO4饱和度中,85%的(NH4)2SO4是沉淀 MnPs的适宜饱和度,在该饱和度下测得上清液中酶活为3.63 U·L -1,蛋白浓度为0.132 mg·mL -1,表明MnPs已基本沉淀完全;试管小试法确定离子交换柱层析中上样的最适缓冲体系为pH7的 Na2HPO4-NaH2PO4起始缓冲液;离子交换柱层析后收集的洗脱液检测到3个蛋白吸收峰,其中只在第2个蛋白吸收峰中检测出 MnP活性,该 MnP活性值变化曲线与蛋白吸光值一致.这个活性峰经凝胶过滤柱层析后,洗脱结果只出现1个明显的蛋白吸收峰,在其中检测出较高的 MnP 活性;浓缩后的冻干样品经 SDS-PAGE 电泳检测只在约40 kDa处有1条清晰的蛋白谱带,表明对 MnP的纯化已达到电泳纯.[结论]筛选出85%饱和度的(NH4)2SO4盐析法是初期沉淀与纯化 L. gibbosa 所产 MnPs的最适方法;PEG 浓缩法简便、易行、有效;初期浓缩后再经过离子交换柱层析和凝胶过滤柱层析可以得到电泳纯的 MnP纯化样品.%[Objective]Thisstudy aims to obtain pure manganese peroxidase produced by white-rot basidiomycete Lenzites gibbosa strain CB-1 and study its characterizations in enzymology. [Method]On the basis of optimizing the culture of L. gibbosa and obtaining massive crude manganese peroxidases (MnPs) solutions which were salted out by (NH4)2SO4,concentrated by polyethylene glycol (PEG) precipitation,and dialyzed against the initial buffer. The DEAE-Sepharose CL-6B ion exchange column chromatography,and Sephadex G-75 gel filtration column chromatography were used to purify MnP,and the purity of the purified MnP sample was detected by SDS-PAGE. [Result]Among the three(NH4)2SO4concentrations of 75%,80%,and 85%,85% (NH4)2SO4was the optimum saturation for precipitation of MnPs. With 85%(NH4)2SO4precipitation,the MnP activity and protein concentration in the supernatant were only 3.63 U·L -1and 0.132 mg·mL -1,respectively,indicating that most MnPs had been precipitated. The initial buffer of Na2HPO4-NaH2PO4(pH=7) was fixed to be the optimal buffer system by small test tube method. Two higher and one lower protein absorption peaks were detected in the samples after ion exchange column chromatography,and the MnP activity was detected only in the second higher peak. After the second higher peak sample went through Sephadex G-75 gel filtration column and was eluted,one distinct protein absorption peak was detected in which there was a high MnP activity. A single and distinct MnP protein band around 40 kDa in concentrated lyophilized sample was detected by SDS-PAGE,indicating that the purity of purifiedMnP had come up to the electrophoresis pure. [Conclusion]The salting out method with 85% (NH4)2SO4was the optimal method for precipitating and purifying MnPs produced by L. gibbosa in initial stage. PEG concentration method was proved simple,easy and effective. The purified MnP samples could be come up to the electrophoresis pure by the means of ion exchange chromatography and gel filtration chromatography after initial concentration.【总页数】7页(P64-70)【作者】张玉龙;池玉杰;冯连荣【作者单位】东北林业大学林学院哈尔滨150040;东北林业大学林学院哈尔滨150040;东北林业大学林学院哈尔滨150040;辽宁省杨树研究所盖州115213【正文语种】中文【中图分类】S718.81【相关文献】1.偏肿革裥菌锰过氧化物酶酶学性质和染料脱色 [J], 张玉龙;池玉杰;冯连荣2.偏肿革裥菌产漆酶活性的诱导 [J], 石亚攀;池玉杰;于存3.偏肿革裥菌降解木质素关键基因挖掘 [J], 赵清泉;池玉杰;张健;冯连荣4.偏肿革裥菌细胞色素P450基因在刚果红脱色条件下的差异表达 [J], Chi Yujie;Li Mengzhu;Zhang Jian;Li Chenyu;Wang Zehui5.偏肿革裥菌在木质环境下转录组构建与相关基因表达分析 [J], 赵清泉; 池玉杰; 张健; 冯连荣因版权原因,仅展示原文概要,查看原文内容请购买。

小鼠超高硫角蛋白基因启动子的克隆及其表达活性分析李昊;王春生;宁方勇;梁洋;朴善花;安铁洙【期刊名称】《中国实验动物学报》【年(卷),期】2010(18)6【摘要】目的筛选在小鼠毛囊中具有高表达活性的内源启动子,为建立小鼠被毛特异表达外源蛋白的转基因技术奠定基础.方法以小鼠基因组为模板,克隆得到超高硫角蛋白基因启动子超高硫角蛋白(UHS),将其分别与pβgal-Basic和pAcGFP1-N1载体连接,构建了重组真核表达载体.采用阳离子脂质体法转染胎鼠组织块,分析其表达活性.结果转染后48 h,在蓝光激发条件下可以检测到绿色荧光蛋白(GFP)在小鼠毛囊区高表达,转染96 h后,表达减弱;此外,转染后48 h,βgal染色结果显示在皮肤块的毛囊区存在蓝色点状区域.结论 UHS启动子在小鼠毛囊中具有表达特异性.【总页数】5页(P471-474,后插6)【作者】李昊;王春生;宁方勇;梁洋;朴善花;安铁洙【作者单位】东北林业大学生命科学学院,哈尔滨150040;东北林业大学生命科学学院,哈尔滨150040;东北林业大学生命科学学院,哈尔滨150040;东北农业大学动物科技学院,哈尔滨150030;东北林业大学生命科学学院,哈尔滨150040;东北林业大学生命科学学院,哈尔滨150040;东北林业大学生命科学学院,哈尔滨150040【正文语种】中文【中图分类】R349.64【相关文献】1.小鼠角蛋白10(K10)基因启动子的克隆及活性分析 [J], 张俊珍;刘彧;姬凯元;杨姗姗;胡帅鹏;刘学贤;范瑞文2.绵羊高硫角蛋白KAP1.3基因启动子活性分析 [J], 朱汇;张红琳;代蓉;万鹏程;郭洪;石国庆3.小鼠TIE2基因启动子的克隆及转录活性分析 [J], 陆俊佳;袁志刚;许淑茹;廖明;赖青鸟;畅荣妮;袁广之;侯伟;舒伟4.白桦BpGT14基因启动子克隆及表达活性分析 [J], 李蕾蕾;孙丰坤;李天宇;寇萍;詹亚光;曾凡锁5.小鼠超高硫角蛋白基因启动子的分子克隆及序列分析 [J], 郭旭东;侯冬霞;毛舒燕;旭日干因版权原因,仅展示原文概要,查看原文内容请购买。

链霉菌启动子DNA片断的克隆
Mano.,T.;黄威
【期刊名称】《国外医药:抗生素分册》
【年(卷),期】1989(010)004
【摘要】发展链霉菌宿主载体系统有可能进行抗生素耐药性,抗生素生物合成和各种酶基因的克隆。
由于这类微生物染色体DNA的G+C含量很高,引起了人们对被克隆基因转录调节区的极大兴趣。
为了克隆含有启动子的DNA片断,所以组建了许多启动子探针载体。
详细分析几种启动子,表明它们在—10区域存在着共同的碱基顺序。
【总页数】3页(P245-247)
【作者】Mano.,T.;黄威
【作者单位】不详;不详
【正文语种】中文
【中图分类】TQ465
【相关文献】
1.生米卡链霉菌启动子的克隆和表达 [J], 余柏松;肖勇立
2.变铅青链霉菌启动子活性片段的亚克隆及其顺序分析 [J], 蒋红;董可宁
3.林可链霉菌噬菌体φSL60启动子的克隆与鉴定 [J], 张长生
4.链霉菌高拷贝质粒pIJ101DNA的研究Ⅲ.在变铅青链霉菌中的启动子活性 [J], 邓子新;Tobiaskieser;DavidA.Hopwood
5.北里链霉菌(Streptomyces kitasatoensis 2488)启动子和柱晶白霉素抗性基因的克隆 [J], 肖勇立;袁丽蓉
因版权原因,仅展示原文概要,查看原文内容请购买。
第15卷第3期1999年6月中国生物化学与分子生物学报Ch inese Jou rnal of B i ochem istry and M o lecu lar B i o logyV o l.15,N o.3Jun.,19993 联系人 T el:(021)64374430,Fax:(021)64338357E2m ail:zhongyi@蒋太交,男,1970年3月生,博士收稿日期:1998205215,修回日期:1998208203辣根过氧化物酶同功酶C基因克隆及其在大肠杆菌中的表达蒋太交 吉鑫松 黄艳红 洪 民 吴祥甫 袁中一3(中国科学院上海生物化学研究所,上海 200031)摘要 无论从应用还是从理论研究角度,辣根过氧化物酶(HR P)是一种非常重要的酶.HR P基因克隆与表达将有利于更深入研究HR P的结构与功能.利用反转录PCR从天然植物辣根中分离和克隆编码辣根过氧化物酶同功酶C(HR P2C)一个c DNA,并测定其序列.结果发现,从基因推导出的氨基酸序列与W elinder报道的辣根过氧化物酶序列有9016%的同源性.将该基因连接到表达载体p ET224b上,利用抗HR P多克隆抗体进行W estern b lo t,检测有少量目标产物表达.在诱导表达过程中,没有发现细菌生长受抑制或受明显的毒害.关键词 辣根过氧化物酶同功酶C,克隆,表达Clon i ng of a cD NA Encod i ng Horserad ish Perox ida se Isozy m eC(HRP-C)and Its Expression i n E.coliJ I AN G T aijiao,J I X in song,HU AN G Yanhong,HON G M in,W U X iangfu,YU AN Zhongyi(S hang hai Institu te of bioche m istry,A cad e m ia S inica,S hang hai200031)Abstract Ho rseradish p erox idase(HR P)is of great i m po rtance from the theo retical and p ratical po in ts of view.T he clon ing and exp ressi on HR P gene w ill p rovide m uch of the info rm ati on on its m achan is m s and functi on.A c DNA encoding a m atu re ho rseradish p erox idase isozym e C had been cloned and the sequence w as analysed.T he deduced am ino acid sequence w as hom o logou s by 9016%to the HR P am ino acid sequence repo rted by W elinder.How ever,on ly six po ten tial N2gly2 co sylati on sites w ere found in the deduced am ino acid sequence.In oder to exp ress the c DNA effi2 cien tly in E.coli,it w as con structed in to p ET224b.W estern b lo t analysis show ed that s m all am oun t of target p ro tein w as recogn ised by po lyclonal an tibodies again st native HR P.N o influ2 ence of inducti on on the grow th of the exp ressed strain w as ob served.Key words Ho rseradish p erox idase isozym e C,C lone,Exp ressi on 过氧化物酶是一组含有血红素辅基金属酶.它广泛地存在植物、动物和微生物中[1].过氧化物酶家族的氨基酸序列具有很大的同源性,其中酵母细胞色素C过氧化物酶和辣根过氧化物酶(HR P)特别引人注目.在理论上HR P的结构和功能得到较为广泛和深入的研究,而且一直是许多科学家传统的研究素材.同时HR P在临床、酶联免疫分析和组织化学中作为蛋白的示踪剂得到了普遍应用[1].从植物中分离出来的HR P是一组糖蛋白,糖含量约占18%,有30多种同功酶形式[1].根据他们的等电点至少可分为5类[1,2]:酸性(HR P2A)、中性或微碱性(HR P2B,2C)和强碱性(HR P2D,2E).HR P2A为高糖含量,p I约为4,HR P2B,2C糖含量低,p I为5175~9163;HR P2D,2E糖含量亦低, p I1016~>12.植物中的HR P绝大部分为中性HR P(HR P2C).HR P2C含有308个氨基酸和8个糖链的单亚基糖蛋白,每分子HR P2C中有2分子Ca2+和一分子血红素,总分子量约为44kD.由于很难获得大量单一形式的同功酶,所以HR P结构与功能的关系没有被充分了解.分子生物学与蛋白质工程的发展,使重组单一特性的HR P 成为可能.这样可以更加透彻地了解电子转移的机制、多肽链与铁卟啉的关系和催化底物的结合.因此,HR P基因的克隆与表达对理论研究与应用都具有十分重要的意义.近几年来,好几家实验室进行了人工合成的辣根过氧化物酶基因表达[3~7].Am er2 sham In ternati onal p lc和B ritish B i o techno lygy L td 两个公司分别申请了合成编码HR P2C基因的专利.我们从天然植物辣根中克隆到编码HR P2C的基因,将其构建到p ET24b表达载体中,观察了HR P的表达情况.1 材料和方法111 材料11111 酶和试剂:D EPC为F luka公司产品;T aq DNA Po lym erase为祥龙公司产品;DNA限制性内切酶,修饰酶及c DNA合成试剂盒为G I BCO BRL 公司产品.天然辣根过氧化物酶多克隆抗体自备. 11112 菌种和质粒:pB lu scri p t+SK和p ET24b对应的宿主菌分别为T G1和BL21D E3.112 方法11211 天然辣根总RNA的提取:取新鲜辣根的侧根约1g置于-70℃过夜.总RNA的抽提参照文献[8].11212 c DNA合成的PCR体外扩增:c DNA合成按照试剂盒推荐的方法操作.PCR反应体系参照文献[9]进行.反应条件为:94℃变性45s,55℃退火1 m in,72℃延伸115m in,共40个循环,最后72℃保温10m in.11213 寡核苷酸合成:根据W elinder测定的HR P2 C的氨基酸顺序[10]的C端和N端,设计了如下专一性PCR引物:引物1 5′2T T GAA T TCA T GCA GCT TA CCCCT A CCT TC23′引物2 5′2TCGGA TCCTCAA GA GT T GGA GT T CA CCA CCCT23′11214 DNA测序:在AB I公司373A型DNA自动测序仪上测序.所用的模板为大量制备经PEG纯化的质粒p KS2HR P,利用M13正反向引物进行双向测序.11215 重组克隆与DNA酶切分析:细菌培养,质粒抽提制备,限制性内切酶反应,琼脂糖电泳,DNA 片段的回收,T4DNA连接酶反应,大肠杆菌转化等均按照文献[11]方法进行.11216 诱导表达HR P2C基因:将重组表达质粒p ET h rp转化大肠杆菌BL21(D E3),37℃平板培养过夜.接种转化的单克隆菌落于新鲜的LB培养液,摇床37℃培养过夜.次日接种2%过夜菌于新鲜的培养液中,37℃摇床生长至A600为016左右后,加IPT G至终浓度为1mm o l L诱导表达3~4h,离心收集诱导表达菌.取表达菌SD S2PA GE和W estern b lo t检测表达效率.11217 重组基因表达产物的检测:使用L aemm li 上样缓冲液[10]溶破诱导表达后的细菌,以A600值为011的菌20Λl量上样,直接进行全菌蛋白质的SD S2PA GE(15%胶)和考马斯亮蓝染色.通过诱导前后全菌蛋白质染色条带的对比检测出相应分子量的外源基因表达产物的条带.11218 W estern检测:制备的抗天然HR P的多克隆抗体没有进一步纯化,表达产物也没有进一步纯化,直接利用全菌蛋白质进行SD S2PA GE.SD S2PA GE方法见11217.只是上样量增加10倍,以A600值为1的20Λl量上样.其余步骤按照文献[11]进行.2 结 果211 HRP-C基因的克隆及序列用酸性异硫氰酸胍一步法从新鲜辣根侧根约1g 抽提总RNA,总RNA没有进一步纯化,以o ligo dT 为引物作逆转录,得到c DNA,然后用引物1和引物2体外扩增出约1kb大小的DNA片段,见F ig.1.F ig.1 A garo se gel electropho resis of PCR p roductPCR产物经酶切后克隆入pB luescri p t+SK 中,得到重组质粒p SKh rp,见F ig.2.利用重组质粒p SKh rp进行自动测序.获得的DNA序列见F ig.3.我们根据W elinder报道的氨基酸顺序设计了专一引物,克隆得到编码成熟蛋白部分基因.从上述基因推导出来的氨基酸序列与393第3期蒋太交等:辣根过氧化物酶同功酶C基因克隆及其在大肠杆菌中的表达 F ig .2 Constructi on of cloning vecto r pSKh rp and exp ressi on vecto r pET h rpW elinder 报道的HR P 2C 氨基酸的序列比较,两者有9016%的同源性,见F ig .3.212 HRP-C 基因在大肠杆菌中表达21211 表达质粒的构建 p ET 24b 是IPT G 诱导的表达载体,由T 7lac 强启动子驱动,且N 端融合了11个氨基酸T 7・T ag TM序列.p ET h rp 的构建见F ig .2.21212 表达产物的检测按照前述的表达条件进行表达.SD S 2PA GE 后考马斯亮蓝染色,发现诱导前后均没有明显的表达条带出现.利用诱导前后的全菌液进行W estern 检测,因为没有除去自备的抗天然HR P 多克隆抗体中能结合细菌蛋白的那些抗体,所以在诱导前后的菌液中都会W estern 检测到一些蛋白条带.但除此以外,结果还发现只有诱导后的菌液在约30kD 有较明显的蛋白条带产生,见F ig .4,可认为是表达的目标产物HR P .21213 细菌生长的监测B artonek 2Roxa 等人[2]认为天然HR P 基因在诱导表达过程中对细菌的生长有抑制和毒害作用,从而会导致蛋白表达效率低.为了验证HR P 2C 基因在诱导表达过程中对细菌的生长有无抑制和毒害作用.比较了p ET h rp 加与未加IPT G 的细菌生长状况,发现有无IPT G 的上述表达系统的细菌生长没有明显区别(数据未发表).这表明HR P 2C 基因在诱导表达过程中未对细菌的生长产生抑制和毒害作用.3 讨 论无论从应用还是从理论研究角度,HR P 的确是一种非常重要的酶.通常分离到并应用的天然HR P 是由多种同功酶组成.要充分了解HR P 的结构与功能,就必须得到大量单一组分的酶形式.HR P 基因克隆与表达为HR P 结构与功能的研究提供了新493中国生物化学与分子生物学报15卷F ig .3 N ucleo tide sequence of HR P isozym e C gene and comparison of thesequence of deduced am ino acid (HRPc 1)with the HR P 2C sequence cited from W elinder (HR Pc 0)593第3期蒋太交等:辣根过氧化物酶同功酶C 基因克隆及其在大肠杆菌中的表达F ig.4 W estern blo t of rcom binant HR P exp ressed inpET h rp1:mo lecular w eigh t standards;2,3:pET2h rp cell lysate w ithout IPT G inducti on;4,5:pET2h rp cell lysate induced by IPT G fo r3,4hoursrespectively的途径.目前世界上有许多家实验室从事HR P的分子生物学研究,他们普遍采用人工合成的基因[3~7].我们利用R T2PCR技术从天然植物辣根中克隆到一个HR P2C基因.从上述基因推导出来的氨基酸序列与W elinder测定的HR P2C氨基酸序列[10]比较,发现两者有9016%的同源性.与血红素辅基的配位有关的H is42和H is170及其附近的几个残基在两者之间几乎完全一致[13].同样,两者形成4对二硫键的8个Cys[10]、与催化机制有关的A rg38、Phe41及Phe45[13],和氢受体作用的残基A rg183、T yr185[14]均没有变化.就糖基化位点而言, W elinder认为[10],HR P有8个A sn2X2Ser T h r N 糖基化位点.然而,在我们克隆基因推导的氨基酸序列中,缺少相应的两个潜在的糖基化位点,即丧失了268和158位的两位潜在的糖基化位点.HR P2C基因表达本身是一项很有意义的工作. O rtlepp等发现人工合成的HR P2C在细菌中的表达水平很大程度依赖于其核苷酸序列[5].B artonek2 Roxa克隆到了辣根过氧化物酶家族的另一个中性辣根过氧化物酶(HR P2n)的c DNA,发现其在细菌中的表达过程中表现出明显的毒性和抑制细菌的生长,并确认为编码成熟蛋白N端的64个氨基酸的192个核苷酸序列,这段序列是酶活性部位的组成部分且在过氧化物酶家族中非常保守[2].为了观察克隆到的HR P2C基因在大肠杆菌中的表达,我们选择了p ET24b表达载体,观察克隆到的HR P2C在大肠杆菌中的表达.W estern检测到有约30kD较为明显的条带产生,见F ig.4.与别人报道的不同[2],没有发现诱导后细菌的生长明显受到抑制.除了选用表达载体p ET24b外,我们还选择了另外2个不同的表达载体pBLM VL2、p KK22323(结果未发表).这三个表达载体或启动子不同(即诱导的条件不同)或是否融合表达.pBLM VL2载体是一个温敏表达载体,由P L启动子控制外源基因的表达. p KK23323和p ET24b都是IPT G诱导的表达载体,前者由tac强启动子驱动,后者含T71ac启动子且在表达蛋白的N端融合了11个氨基酸T7・T ag TM 序列.所有上述三种质粒都已经成功用来表达多种外源基因.然而除了用W estern b lo t在p ETHR P载体中的表达可以检测到外,其它两个系统都没有发现有目标产物产生(结果未发表).这说明天然HR P 基因在细菌中的表达可能与编码成熟蛋白N端氨基酸的核苷酸序列有关.这三个表达体系中都没有发现诱导后细菌的生长明显受到抑制.因此HR P2C 基因表达效率低并非是诱导过程中细菌生长受到抑制的缘故.有活性的含4对二硫键的金属酶HR P成功地重组是一个难题.尽管人工合成的基因已在细菌中实现了表达,但必须通过重折叠才能得到有部分活性辣根过氧化物酶.因此,选择合适表达体系可以解决这个难题.人工合成的基因在S p od op tera f rug i2 p ord a细胞培养物[14]和酵母(S accha ro m y ces cere2 v isiae)[15]中都可以直接表达出有活性的HR P.我们正在探索HR P2C基因在甲醇酵母P ich ia中的表达,已经初步获得突破,实现了高效表达且可直接得到有活性的辣根过氧化物酶.References1 Everse J.P erox id ase in Che m istry and B iology,V o l.2.Boca R a2 ton:CRC P ress Inc,1991:2~242 Bartonek2Roxa E,E rik sson H.Exp ressi on of a neutral ho rseradish peroxidase in E scherich ia coli.J B iotechnol,1994, 37:133~1423 Sm ith A T,Santam a N,D aycey S,Edw ards M,B ray R C,T ho r2 neley R N F,Burke J F.Exp ressi on of a synthetic gene fo r ho rseradish peroxidase C in E scherich ia coli and fo lding and ac2 tivati on of the recom binant enzym e w ith Ca2+and hem e.J B i2 olog Che m,1990,265(22):13335~133434 Burke J,Sm ith A T,Santam a N,B ray R C,T ho rneley R N F,D aycey S,Edw ards M.Exp ressi on of recom binant ho rseradishperoxidase C in E scherich ia coli.B ioche m S oc T rans,1992,17: 1077~1078693中国生物化学与分子生物学报15卷5 O rtlepp S A,Po llard2Knigh t D,Ch is w ell D J.Exp ressi on andcharacterizati on of a p ro tein specified by a synthetic horseradishperoxidase gene in E scherich ia coli.J B iotechnol,1989,11:353~3646 Ego rov A M,Gazaryan I G,Savelyev S V,Fech ina V A,V ery2 ovk in A N,K i m B B.Ho rseradish peroxidasegene exp ressi on inE scherich ia coli.A nnals N e w Y ork A cad e my of S ciences,1991,646:35~407 Ego rov A M,Gazaryan I G,K i m B B,Do seyeva V V,Kapeljuch J L,V eyovk in A N,Fech ina V A.Ho rseradish peroxidase isozym e C a comparative study od native and recom binant en2 zym e p roduced by E.coli transfo rm ants.A nnals N e w Y ork A2 cad e my of S ciences,1994,721:73~818 P i o tr C.Single2step m ethod of RNA iso lati on by acid guanidini2 um th i ocyanate2pheno l2ch lo rofo rm extracti on.A nal B ioche m, 1987,162:156~1599 Scharf S J.C loning w ith PCR.In:PCR p rotocol:A Gu id e to M ethod and A pp lication,2nd ed.N ew Yo rk:A cadem ic P ress,199010 W elinder K J.Am ino acid sequence studies of Ho rseradish per2 oxidase.E u r J B ioche m,1979,96:483~50211 Sam brook J,F ritsch E F,M aniatist T.M olecu lar cloning:A lab2 oratory m anual,2nd ed.N ew Yo rk:Co ld Sp ring H arbo r L abra2 to ry P ress.198912 L aemm li U K.C leavage of structura p ro teins during the assem2 bly of the head of bacteri ophage T4.N atu re,1970,227:68013 W elinder K J.P lant peroxidase:their p ri m ary,secondary and teriary structures,and relati on to cytoch rom e c peroxidase.E u r J B ioche m,1985,151:497~45014 H artm ann C,M ontellano P.Baculovirus exp ressi on and charac2 terizati on of catalytically activeho rseradish peroxidase.A rchB ioche m B iop hy s,1992,297(1):61~7215 V lam is2Gardikas A,Sm ith A T,C lem ents J M.Exp ressi on of active ho rseradish peroxidase in S accharo my ces cerev isiae.B ioche m S oc T rans,1992,20:111S793第3期蒋太交等:辣根过氧化物酶同功酶C基因克隆及其在大肠杆菌中的表达 。
FAE1启动子的克隆和转γ-TMT基因大豆的获得张明;陈德富;王永芹;王绘砖;陈喜文【期刊名称】《南开大学学报(自然科学版)》【年(卷),期】2010(043)006【摘要】脂肪酸链延长酶组分1(FAE1)是广泛存在于植物中催化脂肪酸碳链延长的酮脂酰CoA合成酶,该反应是脂肪酸碳链延长的限速步骤,在油料种子胚中特异性表达.以拟南芥基因组DNA为模板,设计引物,扩增到该基因的启动子片段.序列分析表明,该片段长度为943 bp,与GenBank注册序列AF355982达99.5%同源,并含有与之完全相同的种子特异性表达元件,据此认定它具有种子特异性启动活性.将其与甘蓝型油菜γ-生育酚甲基转移酶(γ-TMT)基因连接,构建成表达载体pFAE1-TMT,通过农杆菌介导的方法转化大豆胚尖,获得28株卡那霉素抗性筛选植株,进一步PCR检测获得2株转γ-TMT基因植株.【总页数】7页(P35-41)【作者】张明;陈德富;王永芹;王绘砖;陈喜文【作者单位】南开大学生命科学学院,天津300071;南开大学生命科学学院,天津300071;南开大学生命科学学院,天津300071;南开大学生命科学学院,天津300071;南开大学生命科学学院,天津300071【正文语种】中文【中图分类】Q943【相关文献】1.水稻5.3 kb Gt1启动子克隆以及Gt1启动子引导优质大豆球蛋白Gy7基因表达载体构建 [J], 徐申中;顾婷玉;于洋;李建粤2.大豆GmCOL1和GmCOL13启动子和基因组基因的r克隆与生物信息学分析[J], 韩英英;陈福禄;傅永福;张晓玫3.甘蓝型油菜FAE1基因启动子的克隆和瞬时表达载体的构建及功能分析 [J], 胡浩;王茂华;刘绵学;杨毅4.甘蓝型油菜FAE1基因启动子的克隆和瞬时表达载体的构建及功能分析 [J], 胡浩; 王茂华; 刘绵学; 杨毅5.大豆β-伴大豆球蛋白基因启动子的克隆及功能分析 [J], 易新萍;喻德跃因版权原因,仅展示原文概要,查看原文内容请购买。
猴头菌锰过氧化物酶1基因在构巢曲霉的异源转化与表达尹立伟;池玉杰【期刊名称】《林业科学研究》【年(卷),期】2013(026)004【摘要】The recombinant plasmid pLB01/He-mnp1 which contains a gene encoding for manganese peroxidase (He-mnp1) from Hericium erinaceum CB1 was transformated into protoplasts of auxotrophic stain TN02A7 of Aspergillus nidulans by means of protoplast transformation method mediated by PEG/CaC12so as to enhance MnP production.A transformant stain TN02A7-He-mnp1 of A.nidulans was gained,the gene He-mnp1 was expressed under the control of alcohol dehydrogenase alcA (p) promoter.The transformant stain TN02A7-He-mnp1,auxotrophic stainTN02A7,wild stain of A.nidulans WJA01,and H.erinaceum CB1 were cultured under the same lignin condition and detected the MnP activity.The results showed that TN02A7-He-mnp1 could produce MnP activity in the absence and presence of heme,but the MnP activity was up to 38.31 U · L-1 on 96h with 0.05 g · L-1 heme which was 8.64 times higher than that without heme but less than that of H.erinaceum CB1,whereas TN02A7 and WJA01 could not produce MnP activity at any time,indicating that the gene He-mnp1 had been successfully transformed into TN02A7-He-mnp1 and expressed in lignin environment,and the heme was one of the restrictive factors for rescombinant mnp gene to express inA.nidulans.The study provides a new method to produce MnP and enhance MnP yield.%为提高猴头菌菌株CB1锰过氧化物酶(MnP)基因的表达产量,采用PEG/CaCl2介导的原生质体转化方法,将携带有He-mnp1的重组质粒pLB01/He-mnp1转入到构巢曲霉尿嘧啶尿苷营养缺陷菌株TN02A7的原生质体中,获得了转化子菌株TN02A 7-He-mnp1,并在乙醇脱氢酶启动子alcA(P)控制下实现了异源表达.将TN02A7-He-mnp1、TN02A7、构巢曲霉野生型菌株WJA01、猴头菌菌株CB1在相同的木质素环境下进行培养并检测MnP酶活性,结果表明:转化子菌株TN02A7-He-mnp1在0.05 g· L-1血红素的情况下、诱导96 h后酶活性最高为38.31 U·L-1,比不添加血红素的酶活力高8.64倍,但比猴头菌菌株CB1的酶活力低,而TN02A7与WJA01始终无MnP酶活性,说明基因He-mnp1已经成功地被转化到TN02A 7-He-mnp1中,并在木质素环境下得到表达,血红素是重组MnP基因异源表达的限制性因素之一.本文为生产MnP和提高MnP产量提供了新的途径.【总页数】8页(P480-487)【作者】尹立伟;池玉杰【作者单位】东北林业大学林学院,黑龙江哈尔滨150040;安庆师范学院生命科学学院,安徽安庆246011;东北林业大学林学院,黑龙江哈尔滨150040【正文语种】中文【中图分类】S718.8【相关文献】1.构巢曲霉转化子菌株产MnP条件优化及对3种染料的脱色 [J], 孙世娜;池玉杰;于存;李月2.偏肿革裥菌Lg-mnp2基因在构巢曲霉中的表达 [J], 胡美美;池玉杰3.构巢曲霉锰过氧化物酶转化子菌株对6种染料的脱色 [J], 张健;池玉杰;于存4.偏肿革裥菌MnP基因在构巢曲霉中转化方法的建立 [J], 胡美美; 池玉杰5.偏肿革裥菌 MnP基因在构巢曲霉中转化方法的建立1) [J],因版权原因,仅展示原文概要,查看原文内容请购买。