全国化学竞赛初赛模拟试卷(26)(01)
- 格式:doc
- 大小:275.00 KB
- 文档页数:9
全国化学竞赛初赛模拟试卷(时间:3小时满分:100分)一.(4分)黄绿色ClO2具有漂白、消毒作用,沸点9.90℃,制备ClO2的方法是:将湿润的KClO3和草酸(固体)混合加热到60℃即得。
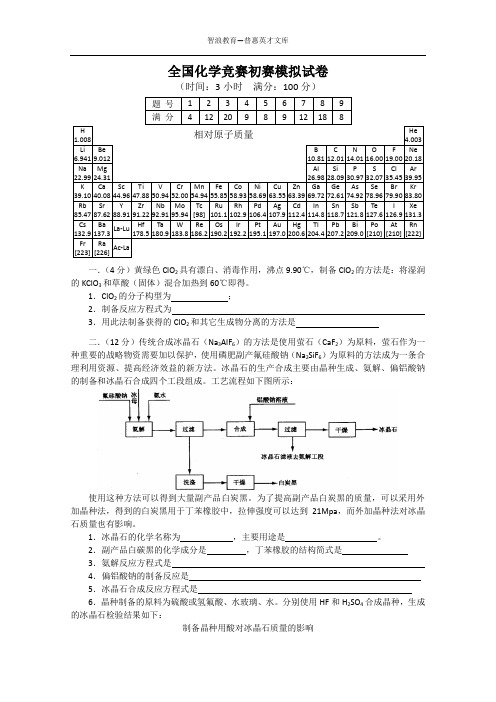
1.ClO2的分子构型为;2.制备反应方程式为3.用此法制备获得的ClO2和其它生成物分离的方法是二.(12分)传统合成冰晶石(Na3AlF6)的方法是使用萤石(CaF2)为原料,萤石作为一种重要的战略物资需要加以保护,使用磷肥副产氟硅酸钠(Na2SiF6)为原料的方法成为一条合理利用资源、提高经济效益的新方法。
冰晶石的生产合成主要由晶种生成、氨解、偏铝酸钠的制备和冰晶石合成四个工段组成。
工艺流程如下图所示:使用这种方法可以得到大量副产品白炭黑。
为了提高副产品白炭黑的质量,可以采用外加晶种法,得到的白炭黑用于丁苯橡胶中,拉伸强度可以达到21Mpa,而外加晶种法对冰晶石质量也有影响。
1.冰晶石的化学名称为,主要用途是。
2.副产品白碳黑的化学成分是,丁苯橡胶的结构简式是3.氨解反应方程式是4.偏铝酸钠的制备反应是5.冰晶石合成反应方程式是6.晶种制备的原料为硫酸或氢氟酸、水玻璃、水。
分别使用HF和H2SO4合成晶种,生成的冰晶石检验结果如下:制备晶种用酸对冰晶石质量的影响从实验结果看,使用 制晶种,合成的冰晶石质量较好,简述你的理由。
三.(20分)能源是当今社会发展的三大支柱之一,是制约国家经济发展的瓶颈。
目前,我国的能源结构主要是煤,还有石油、天然气、核能等,这些能源都是一次不可再生且污染环境的能源,研究和开发清洁而又用之不竭的能源是未来发展的首要任务。
科学家预测“氢能”将是未来21世纪最理想的新能源。
氢能是利用氢气的燃烧反应放热提供能量,即H 2+1/2O 2=H 2O +284 kJ 。
1.当今社会发展的三大支柱除能源外,还包括 和 。
2.试分析为什么“氢能”将是未来21世纪最理想的新能源?3.目前世界上的氢绝大部分是从石油、煤炭和天然气中制取。

全国化学竞赛初赛模拟试卷(01)第一题(7分)金属镁是银白色、有金属光泽的活泼金属,但镁带表面呈现灰黑色。
用砂纸磨下镁带表面固体粉末,在空气中强热,有水气生成;另取粉末,加入稀酸,产生气体导入澄清石灰水中,产生混浊。
如果将灰黑色灰黑色的镁条在纯氧中点燃,燃烧产物中有黑色物质生成。
1.预测:镁条表面的灰黑色物质的组成是 ;黑色燃烧产物是 。
(填名称)2.设计实验确定灰黑色物质的具体组成;3第二题(8分)有机物A (右图)主要用于制备菊酯类杀虫剂,新制备方法是以有机物B 为原料,用间接电氧化法合成,具体方法如下:A :O COOHB :O CH 3在电解槽的阴极区注入10% H 2SO 4溶液,阳极区注入Cr 2(SO 4)3-H 2SO 4混合液,电解;结束后将电解液转入反应器中,并加入有机物B 。
……1.系统命名法命名有机物A 和B ;2.写出电极反应方程式;3.写出电解液氧化B 的反应方程式和现象;4第三题(11分)单质A 和B 能反应生成C ,C 是无色不燃性气体;A 的氧化物和B 的氢化物也能反应生成C 和H 2O (①);C 在NaOH 溶液中反应生成D 和E ;A 的氧化物与NaOH 反应生成D ,而B 的氢化物与NaOH 反应不生成E ;E 在氨水中发生氨解生成A 的氧化物沉淀(②),所得溶液中加入NaAlO 2可生成晶体F (③),E 和F 的阴离子具有相同的空间构型。
1.写出A ~F 各物质的化学式;2.写出E 、F 的阴离子的空间构型;3.写出反应①、②、③的化学方程式;4第四题(10分)12子的杂化类型不同;智浪教育—普惠英才文库32示CN-;●表示Pd2+)。
指出结构基元的内容,并画出二维正当素格子(把此层状结构4个宽的吸收带,而在稀的CCl4溶液中,顺式异构体的这个谱带保持不变,而反第五题(10分)有A、B两种常见固体粉末,均能溶于盐酸,其中A释放出气体而B没有;取35.03g A和B混合均匀装入反应器,压实后密闭强热,恰好完全反应,生成C和D的混合物;将该混合物溶于足量盐酸,溶液颜色逐渐发生变化,至反应完全后消耗0.6mol HCl,还有12.71g不溶物D;如果将混合产物溶于足量稀硝酸中,则消耗1.4mol HNO3,并生成4.48L(标况)气体。

(精品)全国高中化学竞赛(初赛)模拟试题20套全国高中化学竞赛(初赛)模拟试题20套高中化学竞赛初赛模拟试卷(01)(时间:3小时满分:100分)题号满分 1 6 2 12 3 9 4 6 5 7 6 8 7 8 9 6 10 11 12 9 5 12 10 10 H He相对原子质量 1.008 4.003 Li Be B C N O F Ne 6.941 9.012 10.81 12.01 14.0116.00 19.00 20.18 Na Mg Al Si P S Cl Ar 22.99 24.31 26.98 28.09 30.97 32.07 35.45 39.95 K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr 39.10 40.08 44.96 47.88 50.94 52.00 54.94 55.85 58.93 58.69 63.55 65.39 69.72 72.61 74.92 78.96 79.90 83.80 Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe 85.47 87.62 88.91 91.22 92.91 95.94 [98] 101.1 102.9 106.4 107.9 112.4 114.8 118.7 121.8 127.6 126.9 131.3 Cs Ba La-Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn 132.9 137.3 Lu 178.5 180.9 183.8 186.2 190.2 192.2 195.1 197.0 200.6 204.4 207.2 209.0 [210] [210] [222] Fr Ra Ac-Rf Db Sg Bh Hs Mt Ds [223] [226] La La系 La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Tb Lu 138.9 140.1 140.9 144.2144.9 150.4 152.0 157.3 158.9 162.5 164.9 167.3 168.9 173.0 175.0 第一题(6分)锦上添花:(根据已有内容的规律进行增补) 1.填分子式:(1)①C2H6 ②C8H18 ③________ ④C80H162 (2)①________ ②MgO ③SO3 ④CuSO4(3)①Fe2O3 ② ③Na2O2 ④FeSO4・7H2O ⑤CuSO4・5H2O ⑥ 2.填化学方程式:①2Na+2H2O=2NaOH+H2↑ ②2C+SiO2=Si+CO↑③2H2S+O2=2S+2H2O ④____________________________。

全国高中学生化学竞赛初赛试题考试时间:二小时半一、(8分)单质和硝酸混合(1)反应生成相应硝酸盐的单质是、。
(2)反应生成最高价氧化物或含氧酸的单质是、。
(3)呈钝态的单质是、。
(4)不发生反应的单质是、。
二、(6分)酸雨主要是燃烧含硫燃料时释放二氧化硫造成的。
现每隔一定时间测定某份雨水样品的pH值。
测试时间(小时)0 1 2 4 8雨水的pH 4.73 4.62 4.56 4.55 4.55请说明在测定的时间里,雨水样品pH变小的原因。
三、(8分)为降低硫的氧化物对空气的污染,可把氧化钙或碳酸钙和含硫的煤混合后燃烧(这种方法叫做“钙基固硫”)。
请写出钙基固硫的反应方程式。
请从反应热角度讨论用氧化钙或碳酸钙的区别。
四、(1分)以无机物态存在于土壤中的磷,多半是和钙、铝、铁结合的难溶磷酸盐。
磷酸钙在酸性条件下溶解度增大,使磷的肥效增强;加入土壤中的磷酸钙久后则转变为磷酸铝、磷酸铁,导致磷的肥效降低。
请解释并回答下列问题。
(1)磷酸铝在酸性条件下其溶解量(和在近中性条件下的相比)(填入增大、持平或减小。
不同),在碱性条件下其溶解量。
因为:(2)磷酸铁在碱性条件下其溶解量。
因为:(3)作为磷肥,磷酸铁的肥效不高,但在水田中,其肥效往往明显增高。
因为:。
五、(4分)已知四种无机化合物在水中、液氮中的溶解度(克溶质/100克溶剂)为:写出上述几种化合物在水溶液和液氨溶液中发生复分解反应的方向六、(10分)从某些方面看,氨和水相当,NH4+和H3O+(常简写为H+)相当,NH2-和OH-相当,NH2-(有时还包括N3-)和O2-相当。
(1)已知在液氨中能发生下列二个反应NH4Cl+KNH2=KCl+2NH22NH4I+PbNH=PhI2+3NH3请写出能在水溶液中发生的与上二反应相当的反应方程式。
(2)完成并配平下列反应方程式(M为金属):M+NH3→MO+NH4Cl→M(NH2)2→七、(12分)已知:20(原子量;Ca,40.0;O,16.0;C,12.0;H,1.01)请用计算说明,当持续把二氧化碳(压强为0.982巴,下同)通入饱和石灰水,开始生成的白色沉淀会否完全“消失”?在多次实验中出现了下列现象,请解释。

全国化学竞赛初赛模拟试卷第一题(10分)根据信息写出化学反应方程式:1.cu2s以辉铜矿的形式存在于自然界。
赤热的cu2s与水蒸气反应可以得到金属铜和气体。
经分析,产生的气体和铁与浓硫*反应的气体相同。
2.fe2(so4)3溶液能氧化cu2s使之溶解,且在空气中可以重复使用fe2(so4)3溶液。
第四题(11分)2000年美国《科学》杂志报道,意大利科学家合成了一种新型氧分子,它由4个氧原子构成的o4分子,专家认为它液化后的能量密度比普通氧分子高得多。
1.o4分子可看作2个o2聚合得到。
试解释o2为什么能聚合成为o4?2.试判断o4的结构。
3.从结构的角度解释o4和o2分子的稳定*、氧化*强弱。
第五题(10分)脱水反应是化学反应的基本类型。
试根据下列问题回答:1.某物质a其摩尔质量是so3的三倍。
它可以看作硫*分子间脱水得到的。
试写出化学反应方程式,并确定a的结构。
ooo2.p4o10的结构为:oo,若将p4o10是**分子间脱水得到的,问**分子间如何脱水才能得到p4o10呢?3.硅*分子间如何脱水才能得到sio2呢?第八题(16分)a是一种不稳定的物质。
在低温下可以用clf与无水hno3发生取代反应制得。
1.试写出制备a的化学反应方程式。
2.在0℃时,a也可以用cl2o与n2o5反应制得。
试写出化学反应方程式。
3.指出a的结构特点。
4.在-300c时,a与icl3反应生成一种不稳定的物质b。
试写出化学反应方程式。
5.a能够与ch2=c(ch3)2发生反应。
试写出化学反应方程式。
第九题(9分)最近化学家对氙化学的研究表明:xef2蒸气能与cf3·自由基反应,生成一种具有挥发*的蜡状白*固体a,同时释放出f·自由基。
已知在等离子体中,c2f6能解离成cf3·自由基。
1.写出在等离子体中,xef2+c2f6→a的化学反应方程式。
2.在20℃时,a能够发生分解,重新生成xef2和碳原子数不固定的全*代烃(以fm表示)。

1、下列哪种物质在常温下是气体,且是构成地球大气层主要成分之一?A、二氧化碳B、氯化钠C、水D、金刚石解析:二氧化碳在常温下是气体,并且是地球大气层中的重要组成部分,对气候有着显著影响。
(答案)A2、下列哪个过程描述了化学变化?A、水结成冰B、铁生锈C、酒精挥发D、干冰升华解析:铁生锈是铁与氧气和水反应,生成了新的物质——铁锈,这是一个化学变化的过程。
(答案)B3、下列元素中,哪一种元素的原子序数最大?A、氢B、碳C、氧D、铁解析:原子序数即元素原子核中的质子数,氢的原子序数为1,碳为6,氧为8,铁为26,因此铁的原子序数最大。
(答案)D4、下列哪种物质在水溶液中能导电?A、蔗糖B、氯化钠C、酒精D、二氧化碳解析:氯化钠在水溶液中能电离成钠离子和氯离子,这些离子能在溶液中自由移动,因此氯化钠水溶液能导电。
(答案)B5、下列哪项描述了酸碱中和反应的实质?A、电子的转移B、质子的转移C、中子的转移D、原子的转移解析:酸碱中和反应的实质是氢离子(质子)从酸转移到碱,形成水,因此是质子的转移。
(答案)B6、下列哪种物质属于有机化合物?A、硫酸B、氯化钠C、甲烷D、氧化钙解析:有机化合物是含有碳元素的化合物,通常与生命活动有关。
甲烷是由碳和氢元素组成的,属于有机化合物。
(答案)C7、下列哪种现象是物理变化?A、纸张燃烧B、食物腐败C、冰融化成水D、金属生锈解析:冰融化成水只是物质状态的变化,没有新物质生成,因此是物理变化。
(答案)C8、下列哪种元素在自然界中通常以单质形式存在,并且是地壳中含量最高的金属元素?A、金B、银C、铝D、铁解析:铝是地壳中含量最高的金属元素,且由于其活泼性相对较弱,在自然界中能以单质形式存在,如铝土矿等。
(答案)C。
全国化学竞赛初赛模拟试卷(01)分)(时间:3小时 满分:100第一题(3分)气态物质的溶解度可用每升水中能溶解的气体的毫升数表示,它的大小与温度和该气体的压强有关。
已知0℃和1.01×105Pa时,氧气的溶解度为49.10 mL,氮气的溶解度是23.20 mL。
试计算该温度下空气(O2:21%,N2:78%)溶解在水中的氧气和氮气的体积比是1︰ 。
第二题(6分)光发动机是利用光能作动力直接把光能转变成机械能输出的装置。
其核心装置是化学反应室,室内密封着一种无色的化合物A。
在光照射时,A能接受光能发生化学反应,在无光作用下又发生逆反应,如此循环往复从而带动活塞的往复运动。
1.A是中学教材上的常见物质,它的化学式是2.写出A在密封室中的全部化学反应方程式;3.简单分析密封室活塞被驱动的原因。
第三题(7分)卟啉化合物是一类含氮杂环的共轭化合物,其中环上各原子处于一个平面内(结构如图1、图2)。
卟啉环中含有4个吡咯环,每2个吡咯环在2位和5位之间由一个次甲基桥连,在5,10,15,20位上也可键合4个取代苯基,形成四取代苯基卟啉。
图1 卟吩的结构 图2 取代四苯基卟啉1.如果卟吩与XCl3形成配合物,写出该配合物的化学式;2.预测卟啉环(卟吩)是否有芳香性,为什么?3.卟啉环能与哪些金属离子配位,列举三种金属离子。
第四题(8分)铝与三乙胺形成的单核配合物是电中性分子,实验测得其氢的质量分数为14.32%,画出它的立体结构,指出中心原子的氧化态和杂化类型。
要给出推理过程。
第五题(8分)某晶体的结构可看作由金原子和铜原子在一起进行(面心)立方最密堆积,它们的排列有序,没有相互代换的现象(即没有平均原子或统计原子),它们构成两种八面体空隙,一种由4个金原子和2个铜原子构成,另一种由2个金原子和4个铜原子一起构成,两种八面体的数量比是1︰1。
该晶体具有储氢功能,氢原子全部填充在由金、铜原子构成的四面体空隙中。
全国化学竞赛初赛模拟试卷和答案(一)全国化学竞赛初赛模拟试卷和答案2019年全国化学竞赛将于4月中旬进行,初赛是决定是否进入复赛的重要环节。
为了让同学们更好地备战初赛,我们为大家准备了一份全国化学竞赛初赛模拟试卷和答案,希望能帮助同学们进行针对性复习和调整。
一、选择题部分选择题部分共有30道,每题4分,答对得4分,答错不得分,未答得分为0。
这部分主要考察学生对化学知识的掌握能力和分析题目的能力。
二、非选择题部分非选择题部分共有5道,每题20分,答对得20分,答错得分为0。
这部分主要考察学生对于化学原理的理解和掌握,并能够将其应用于解决实际问题的能力。
其中:1、第一道非选择题为课内知识的应用题,主要考察同学们对于化学实验的掌握程度和实验中可能会遇到的问题的判断能力。
2、第二道非选择题为分析题,主要考察同学们对于数据处理的掌握和数据识别的能力。
3、第三道非选择题为计算题,主要考察同学们对于化学计算的能力和对于分析题的判断能力。
4、第四道非选择题为应用题,主要考察同学们对于实际情况的应用和解决问题的能力。
5、第五道非选择题为综合题,主要考察同学们对于化学知识的综合应对和问题解决的能力。
三、答案选择题部分答案1、B2、C3、D4、B5、A6、C7、D8、B9、A 10、C 11、D 12、B 13、A 14、C 15、B 16、D 17、A 18、B 19、C20、A21、C 22、D 23、B 24、C 25、B 26、A 27、B 28、D 29、C 30、A非选择题部分答案1、铁的质量为1.8g,恒化模式为Fe(NO3)2。
2、(1)Ni2+、Zn2+ (2)Ag2+、Pb2+3、E=-0.39V4、125gH2SO4和63gCa(OH)2,得到水和327gCaSO4。
5、答案不唯一,评分按规定进行。
希望这份模拟试卷和答案能够帮助同学们进行初赛复习和调整,祝同学们考试成功!。
“扬子石化杯”第26届全国高中生化学竞赛(江苏赛区)初赛试题可能用到的相对原子质量:H:1 C:12 N:14 O:16 Na:23 Al:27 S:32Cl:35.5 Cr:50 Mn:55 Fe:561.本试卷共22题,用2小时完成,共120分;2.可以使用计算器;3.用铅笔作答无效;4.不可以使用涂改液或修正带。
一、选择题(每小题有1~2个选项符合题意,每小题4分,共60分。
请将答案填写在下方题号123456789101112131415答案1.化学知识在环境保护中起关键作用。
下列叙述不正确的是A.在燃煤中加入适量的生石灰能有效减少二氧化硫的排放B.控制含磷洗涤剂的生产和使用有利于防止水体富营养化C.采用汽车尾气处理技术可将汽车尾气中的NO和CO转化为无害气体D.正常雨水呈中性,pH小于7的雨水是酸雨2.下列化学用语正确的是A.CO2的电子式是: B.硝基苯的结构简式:C.中子数为8的氮原子: D.模型可表示甲烷分子或四氯化碳分子3.下列实验操作或装置正确的是A.加热液体 B.制取并收集NH3 C.转移溶液 D.干燥H24.你认为下列数据可信的是A.某胶体粒子的直径是160nm B.某常见气体的密度为1.8g·cm-3 C.某反应的平衡常数是1 D.某元素的原子半径是0.160nm5.下列推断不合理的是A.乙烯能使酸性KMnO4溶液褪色,则丙烯也能使酸性KMnO4溶液褪色B.铁、铝在浓H2SO4中钝化,则镁在浓H2SO4中也钝化C.金属钠着火不能用CO2扑灭,则金属钾着火也不能用CO2扑灭D.将SO2通入品红溶液,溶液褪色后加热恢复原色;将SO2通入溴水,溴水褪色后加热也能恢复原色6.设N A为阿伏加德罗常数的值,下列叙述正确的是A.标准状况下,22.4LH2中含中子数为2N AB.常温常压下,氧气和臭氧的混合物16g中约含有N A个氧原子C.电解食盐水若产生2 g氢气,则转移的电子数目为2N AD.100mL 0.1mol·L-1的FeCl3溶液中含有Fe3+的个数为0.01N A7. X、Y、Z、M、W为五种短周期元素。
中国化学会第26 届全国高中学生化学竞赛(省级赛区)试卷2012 年9 月2 日共8 页 1中国化学会第26 届全国高中学生化学竞赛(省级赛区)试卷(2012 年9 月2 日9:00~12:00)题号 1 2 3 4 5 6 7 8 9 10 11 总分满分7 7 10 5 8 7 10 16 12 6 12 100得分评卷人签名·竞赛时间背面朝上放于桌面,立即起立离开考场。
·姓名、报名号和所属学校等必须写于首页左侧指定位置,写于其他位置者按废卷论处。
·所有解答必须写于卷面指定位置,写于其他位置者无效。
·凡要求计算的,须给出计算过程,无计算过程即使结果正确也不得分。
·用铅笔解答的部分·禁用涂改液和修正带。
否则,整个答卷无效。
·试卷已装订成册,不得拆散。
·附草稿纸一张,不得将任何纸张带入考场。
·允许使用非编程计算器以及直尺等文具。
·写有与试题内容无关的任何文字的答卷无效。
H 1.008 元素周期表He4.003Li Be B C N O F Ne 6.941 9.012 10.81 12.01 14.01 16.00 19.00 20.18 Na Mg Al Si P S Cl Ar 22.99 24.31 26.98 28.09 30.97 32.07 35.45 39.95 K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr 39.10 40.08 44.96 47.87 50.94 52.00 54.94 55.85 58.93 58.69 63.55 65.38 69.72 72.64 74.92 78.96 79.90 83.80 Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe 85.47 87.62 88.91 91.22 92.91 95.96 [98]101.07 102.91 106.42 107.87 112.41 114.82 118.71 121.76 127.60 126.90 131.29 Cs Ba La Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn 132.91 137.33 138.91 178.49 180.95 183.84 186.21 190.23 192.22 195.08 196.97 200.59 204.38 207.2 (209) (210) (222)208.98Fr Ra Ac Rf Db(223) 226.0 (227) (261) (262)Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu140.12 140.91 144.24 (145)150.36 151.96 157.25 158.93 162.50 164.93 167.26 168.93 173.05 174.97Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr232.04 231.04 238.03 237.05 (244) (243) (247) (247) (251) (254) (257) (256) (254) (257) 中国化学会第 26 届全国高中学生化学竞赛(省级赛区)试卷2012 年 9 月 2 日共 8 页 2第1 题(7 分)1-1 向硫酸锌水溶液中滴加适当浓度的氨水至过量,发生两步主要反应。
2005年全国化学竞赛初赛模拟试卷(26)(时间:3小时满分:100分)第一题(5分)我国是世界上最早用含汞物质治病的国家。
《本草纲目》卷九水银条下记有:“水银乃至阴之毒物,因火煅丹砂而出,加以盐(食盐)、矾(明矾)炼而为轻粉,加以硫黄升而为银朱。
”这段话将水银(Hg)、轻粉(Hg2Cl2)、银朱(HgS)等制备所用的化学原料、方法作了极为精辟的概括。
已知生成轻粉的反应中共有四种产物,产物还有中学阶段三种常见物质(分属两种物质类别)。
请写出上面这段文字所涉及的化学方程式。
第二题(8分)有机锂化合物是工业中重要的试剂。
1.甲基锂的团簇是处于高度对称构型,如果考虑四个锂原子处于一个正四面体的顶角上,请描述相对应的烃基最可能的空间位置,且在该晶体中烃基的空间排布构型为;2.工业上采用金属Li和卤代烷烃制备有机锂化合物,然后利用其和二元卤化物之间的复分解反应合成其他有机物,请以该思路在两步合成Si(CH3)4;请从电负性概念判断第二个反应发生的趋势。
第三题(7分)1.无水卤化物是无机合成中的常用起始物,它们的制备以及不纯工业卤化物的脱水就显示出实际重要性。
主要合成方法涉及金属与卤素的直接反应。
(1)有些情况下可以方便的使用卤素化合物合成金属卤化物。
例如在加热管中通过ZrO2与CCl4蒸气反应,该反应的Gibbs自由能较负是因为形成了C=O键。
结果表明氯元素在两种产物中质量相等。
请写出该反应的化学方程式;(2)无水卤化物可以通过水合金属卤化物脱水的方法制备,但是要在卤化氢气流中抑制水解,也可以引入亚硫酰氯取得良好效果,无水氯化铁就是通过后面这种方法制备得到,请写出其原理的化学方程式。
2.IF7与SbF5按照物质的量比值为1︰2反应得到离子化合物A,A继续和IF7反应,得到一种白色结晶,阳离子和阴离子的空间构型都是正八面体。
请写出A、B的化学式。
第四题(4分)高铁酸根(FeO42-)是比相应的高锰酸根或重铬酸根氧化性能更强的氧化剂。
它在整个pH范围内具有良好的氧化活性和选择性,其氧化产物是铁锈,对环境没有不良影响,所以在有机物的氧化合成中具有广阔的前景。
(1)FeO42-的空间构型;(2)右图是pH对FeO42-稳定性的影响图,能否提出一个化学方程式对右图曲线作出解释。
第五题(5分)晶须是一种丝状的单晶体,由于这种尺寸很小、杂质含量很低、晶体缺陷很少的丝状单晶体具有接近理论值的优异的力学性能和物理化学性能,因而引起了人们的极大兴趣。
利用晶须的优异的力学和物理性能,将其与陶瓷、玻璃、聚合物材料等进行复合,不仅可以提高基体材料的强度,改善其韧性,而且可以改变其物理化学性能,增加其功能性。
采用氧化铝和焦炭为原料在高纯氮气气氛条件下可以获得一种晶须材料,晶体结构如图所示:(1)该晶须材料的最简式应该为(2)如果原料配比约为Al2O3︰C=3︰1(质量比),则合成的化学方程式为。
第六题(7分)2005年继“苏丹红1号”事件后,5月又发“对位红”警告,此次发现的35种食品中均存在一种含“对位红”的辣椒酱,其含量尽管不足以对人体健康构成威胁,但消费者仍需对其采取谨慎态度。
“对位红”是一种常用的红色颜料,亦称对硝苯胺红,常温下呈固态。
根据牛津大学物理与理论化学实验室的化学品安全信息介绍,“对位红”对眼睛、皮肤和呼吸系统有刺激性,但其毒性尚在研究中,不甚明了。
对位红结构简式如右图:它以对硝基苯胺和萘为主要原料合成路线,请写出合成路线。
已知:第七题(6分)导致水体浑浊的悬浮物大多带有电荷(多数带负电荷),所以难以聚集成大的颗粒而重力下沉。
能使水体澄清的物质称净水剂,其作用原理有两种:一是中和悬浮物所带的电荷(电中和作用),二是通过强的分子间作用力与多颗悬浮物结合,导致重力下沉(架桥作用)。
回答下列问题:1.下列物质哪些不适宜作为净水剂使用,为什么?2.下列物质哪些净水作用主要通过电中和作用,哪些重要通过架桥作用?说明理由!酒精、AlCl3、FeCl3、Fe2(SO4)3、CCl4、C12H22O11(蔗糖)、H2C—CH2O(聚氧乙烯,可溶)、HC(CONH2)CH2(聚丙烯酰胺,可溶)第八题(4分)d区金属配合物一直是化学界研究颇多的课题。
四配位平面四方形配合物[IrCl(PMe3)3]与Cl2通过氧化加成反应得到两种六配位产物,31P-NMR光谱表明一个异构体中的P原子只有一个化学环境,而另一个异构体中的P原子有两种化学环境。
该产物的这两种异构体分别是?第九题(8分)(1)Mg3NF3的结构可以看作NaCl结构中,正离子位置上有1/4的空缺,请画出相应的晶胞;(2)右图是HPF6水合物晶体的晶体结构,属于立方晶系,下图中大球表示水分子,小球表示P原子,只存在于十四面体孔穴里,H、F没有画出,请写出该水合物的结构式。
第十题(8分)醋酸乙烯乳液应用范围广,粘胶性能好。
目前,已研制出满足不同需要的各种产品,但其生产的主要原料——醋酸乙烯价格高,所以研制了磷酸乳胶的新产品。
实验表明,该产品各种性能指标均优于市售其它类型的白乳胶,且成本低,无毒,是一种较好的代用白乳胶。
磷酸乳胶的合成反应机理如下:→A B C D→E F G1.写出A~G各物质的结构简式;2.写出反应中所用有机原料名称。
第十一题(14分)下面是有关Ni (II )系列实验:A (黄色)B (绿色)C (黄绿色沉淀)BD (绿色沉淀)E (蓝紫色溶液)F (紫红色)G (红色沉淀)H (黑色沉淀)1.该实验的目的是为了说明 2.写出A 、B 的化学式、中心离子杂化类型和空间构型; 3.已知F 为[Ni(en)3]2+,请画出其空间结构;4.已知配合常数E 为β6([Ni(NH 3)6]2+)=1.1×108,F 的β3([Ni(en)3]2+)=3.9×1018,G 的=4.17×1017。
⑧反应之所以能够发生,还需要______(填写一种物理量的字母)的数据进行计算验证,还可以判断该化合物中有 ,丁二酮肟的结构简式如右,已知它与F 生成的G 是一种中心离子呈平面四方型的化合物,画出G 的空间结构,并写出F 生成G 的离子方程式。
第十二题(12分)高温超导材料的研究是21世纪材料领域的热点问题,YBaCuO 体系一直是此领域的研究重点之一。
YBa 2Cu 3O 7-x (0<x <1)是一种90K 超导体,制备这种固体的一种方法是分解法,例如通过分解硝酸盐使必需的氧化物均匀混和,Ba 和Y 的氧化物也可以用草酸盐热分解产生,而草酸钡可由0.1mol/L BaCl 2溶液和0.1mol/L 草酸溶液沉淀产生。
1.确定超导体里Cu 的氧化态范围;2.试给出Y 、Ba 、Cu 的硝酸盐以及草酸钡热分解产生氧化物的化学方程式;3.通过计算说明草酸溶液0.1mol/L 里的草酸根离子浓度是否足够大,设沉淀是在理想条件下进行,并忽略稀释的影响。
(草酸钡pK sp =6.8;草酸pK 1、pK 2分别为1.2、4.3)4.YBa 2Cu 3O 7-x 中其实有Cu 3+和Cu 2+两种氧化态。
已知可用间接碘量法测出体系(Yba 2Cu 3O 7-x )中Cu 3+的质量分数,该法涉及化学反应有:4Cu 3++2H 2O =4Cu 2++O 2↑+4H +,2Cu 2++4I -=Cu 2I 2↓+I 2,2S 2O 32-+I 2=S 4O 62-+2I -现有两份质量都为m 的该氧化物,其中一份加过量的KI 固体,溶解后用浓度为0.1568mol/L 的Na 2S 2O 3溶液滴定至终点,消耗Na 2S 2O 3溶液的体积为30.26mL ;另一份先完全溶解,再加和第一份等量的KI 固体,用同样浓度的的Na 2S 2O 3溶液滴定至终点,消耗的体积为23.89mL ,该氧化物中Cu 3+的质量分数为多少?m 值为多少?CH 3CH 3N N OH O H第十三题(12分)1.光致变色材料在信息显示、智能传感元件、调光器件和高密度存储方面有广阔的应用前景。
近年来多酸及其盐的光化学研究取得了长足的进展,发现有相当多的多酸及其盐在紫外或可见光的照射下有光致变色特性。
1920年WuH发现用光化学的方法在乙醇中还原α-Keggin 结构钨磷酸H3[PW12O40 ],生成一种蓝色的物质(杂多蓝),但露置在空气中一会就恢复原来颜色。
已知反应中H3[PW12O40 ]和转移电子数目物质的量之比为2︰1,请用化学方程式表示该可逆变色反应的机理。
2.有机共轭分子中存在单键和双键交替排列的共轭体系,原子间形成由多个原子参加的离域π键。
当单、双键的共轭体系长到一定的程度,例如有十几个或几十个原子参加形成离域π键,这时HOMO和LUMO间的能级差,相当于可见波段的能量,这种分子就会产生颜色。
下图无色的有机物A也具有光致变色的特性,在紫外光辐射下变成橙色的结构B。
所以可用于印制防伪的商标。
请写出B的结构简式。
3.开关是以二进制为基础的电子计算机的主要器件之一,而要在分子水平上研制分子电子计算机,分子开关是断不可少的。
目前,欧美许多科学家把视线主要投放在光控、温控和电控等类型的分子开关的研制上。
迄今为止,分子开关的设计已有许多种方案,而其中构思最为巧妙的莫过于Sixl和Higelin所设计并合成的N-邻羟亚苄基苯胺光控分子开关。
N-邻羟亚苄基苯胺具有光致重排性质,将两条聚乙炔链与N-邻羟亚苄基苯胺相连,就可以制备成N-邻羟亚苄基苯胺光控分子开关。
请在下面文本框内画出相应的结构简式,要求左图中分子开关呈开启状态,右图中分子开关呈关闭状态。
N-邻羟亚苄基苯胺:HNCHO命题:陈凯2005年5月于南京晓庄学院化学系审稿:胡波2005年5月于浙江慈溪中学中学综合学科网版权所有,任何网站不得转载参考答案(0526)第一题(5分)(1)HgS+O2Hg+SO2(1分)(2)6Hg+2NaCl+2KAl(SO4)2+2O2=3Hg2Cl2+3Na2SO4+Al2O3+K2SO4(3分)(3)Hg+S=HgS(1分)第二题(8分)每三个Li构成一个面(正三角形),CH3分别处于该面中心的垂线上(2分,可画图)正四面体(1分)8Li+4CH3Cl=Li4(CH3)4+4LiCl Li4(CH3)4+SiCl4=4LiCl+Si(CH3)4(各2分)由于烃基形成的共价键强于离子键,因而倾向于选择电负性较大的元素;而卤素则与电负性较小的金属形成离子型化合物,简言之,烷基或芳基倾向于从电负性较低的元素向电负性较高的元素迁移。
(1分)第三题(7分)1.(1)ZrO2+2CCl4=ZrCl4+2COCl2(2分)(2)FeCl3·6H2O+6SOCl2=FeCl3+6SO2+12HCl(2分)2.A:[IF6]+[Sb2F11]-B:[IF6]+[S2F6]-(各1.5分)第四题(4分)正四面体(1分)4FeO42-+10H2O=4Fe(OH)3+3O2↑+8OH-(3分)第五题(5分)1.AlN(3分)2.Al2O3(s)+3C(s)+N2(g)=2AlN(s)+3CO(g)(2分)第六题(7分)O2N--NH2+NaNO2+2HCl→O2N--N2ClO2N--N2Cl+→+HCl第七题(6分)1.酒精、CCl4、C12H22O11(蔗糖)不宜,因为它们是非电解质而且分子量也不高;(2分)2.AlCl3、FeCl3、Fe2(SO4)3主要通过电中和作用,因为它们是强电解质能电离出Al3+、Fe3+H2C—CH2O(聚氧乙烯,可溶)、HC(CONH2)CH2(聚丙烯酰胺,可溶)(2分)可溶,是非电解质,但分子量大,分子链长,所以与悬浮物质间的分子间作用力强,改作用力与分子量相关,主要起架桥作用。