2酶促反应动力学共39页word资料
- 格式:doc
- 大小:797.50 KB
- 文档页数:38






2 酶促反应动力学教学基本内容:酶促反应的特点;单底物酶促反应动力学方程(米氏方程)的推导;抑制剂对酶促反应的影响,竞争性抑制和非竞争性抑制酶促反应动力学方程的推导;产物抑制、底物抑制的概念,产物抑制和底物抑制酶促反应动力学方程的推导;多底物酶促反应的机制,双底物酶促反应动力学的推导;固定化酶的概念,常见的酶的固定化方法,固定化对酶性质的影响及固定化对酶促反应的影响,外扩散过程和内扩散过程分析;酶的失活动力学。
2.1 酶促反应动力学的特点2.2 均相酶促反应动力学2.2.1 酶促反应动力学基础2.2.2 单底物酶促反应动力学2.2.3抑制剂对酶促反应速率的影响2.2.4多底物酶促反应动力学2.3 固定化酶促反应动力学2.4 酶的失活动力学授课重点:1. 酶的应用研究与经典酶学研究的联系与区别2. 米氏方程。
3 竞争性抑制酶促反应动力学方程。
4. 非竞争性抑制酶促反应动力学方程。
5. 产物抑制酶促反应动力学方程。
6. 底物抑制酶促反应动力学方程。
7. 双底物酶促反应动力学方程。
8. 外扩散对固定化酶促反应动力学的影响,Da准数的概念。
9. 内扩散对固定化酶促反应动力学的影响,φ准数的概念。
10. 酶的失活动力学。
难点:1. 采用稳态法和快速平衡法建立酶促反应动力学方程。
2. 固定化对酶促反应的影响,五大效应(分子构象的改变、位阻效应、微扰效应、分配效应及扩散效应)的区分。
3. 内扩散过程分析,涉及到对微元单位进行物料衡算和二阶微分方程的求解、无因次变换、解析解与数值解等问题。
4.温度对酶促反应速率和酶的失活速率的双重影响,最适温度的概念。
温度和时间对酶失活的影响。
本章主要教学要求:1. 掌握稳态法和快速平衡法推导酶促反应动力学方程。
2. 了解酶的固定化方法。
理解固定化对酶促反应速率的影响。
掌握Da准数的概念及φ准数的概念,理解外扩散和内扩散对酶促反应速率的影响。
3. 了解酶的一步失活模型与多步失活模型,反应过程中底物对酶稳定性的影响。


2 酶促反应动力学教学基本内容:酶促反应的特点;单底物酶促反应动力学方程(米氏方程)的推导;抑制剂对酶促反应的影响,竞争性抑制和非竞争性抑制酶促反应动力学方程的推导;产物抑制、底物抑制的概念,产物抑制和底物抑制酶促反应动力学方程的推导;多底物酶促反应的机制,双底物酶促反应动力学的推导;固定化酶的概念,常见的酶的固定化方法,固定化对酶性质的影响及固定化对酶促反应的影响,外扩散过程和内扩散过程分析;酶的失活动力学。
2.1 酶促反应动力学的特点2.2 均相酶促反应动力学2.2.1 酶促反应动力学基础2.2.2 单底物酶促反应动力学2.2.3抑制剂对酶促反应速率的影响2.2.4多底物酶促反应动力学2.3 固定化酶促反应动力学2.4 酶的失活动力学授课重点:1. 酶的应用研究与经典酶学研究的联系与区别2. 米氏方程。
3 竞争性抑制酶促反应动力学方程。
4. 非竞争性抑制酶促反应动力学方程。
5. 产物抑制酶促反应动力学方程。
6. 底物抑制酶促反应动力学方程。
7. 双底物酶促反应动力学方程。
8. 外扩散对固定化酶促反应动力学的影响,Da准数的概念。
9. 内扩散对固定化酶促反应动力学的影响,φ准数的概念。
10. 酶的失活动力学。
难点:1. 采用稳态法和快速平衡法建立酶促反应动力学方程。
2. 固定化对酶促反应的影响,五大效应(分子构象的改变、位阻效应、微扰效应、分配效应及扩散效应)的区分。
3. 内扩散过程分析,涉及到对微元单位进行物料衡算和二阶微分方程的求解、无因次变换、解析解与数值解等问题。
4.温度对酶促反应速率和酶的失活速率的双重影响,最适温度的概念。
温度和时间对酶失活的影响。
本章主要教学要求:1. 掌握稳态法和快速平衡法推导酶促反应动力学方程。
2. 了解酶的固定化方法。
理解固定化对酶促反应速率的影响。
掌握Da准数的概念及φ准数的概念,理解外扩散和内扩散对酶促反应速率的影响。
3. 了解酶的一步失活模型与多步失活模型,反应过程中底物对酶稳定性的影响。
2 酶促反应动力学2.1 酶促反应动力学的特点2.1.1 酶的基本概念2.1.2 酶的稳定性及应用特点酶是以活力、而不是以质量购销的。
酶有不同的质量等级:工业用酶、食品用酶、医药用酶。
酶的实际应用中应注意,没有必要使用比工艺条件所需纯度更高的酶。
2.1.3酶的应用研究与经典酶学研究的联系与区别经典酶学研究中,酶活力的测定是在反应的初始短时间内进行的,并且酶浓度、底物浓度较低,且为水溶液,酶学研究的目的是探讨酶促反应的机制。
工业上,为保证酶促反应高效率完成,常需要使用高浓度的酶制剂和底物,且反应要持续较长时间,反应体系多为非均相体系,有时反应是在有机溶剂中进行。
2.2 均相酶促反应动力学均相酶促反应动力学是以研究酶促反应机制为目的发展起来的。
作为酶工程技术人员,如果仅仅比较详细地解释了酶促反应机制和过程是不够的,还应对影响其反应速率的因素进行定量的分析,建立可信赖的反应速率方程,并以此为基础进行反应器的合理设计和确定反应过程的最佳条件。
因此,以讨论反应机制为目的的酶促反应动力学与为了设计与操作反应器的工业酶动力学,在研究方法上自然不同。
这与化学中的反应动力学和工业上的化学反应动力学的不同一样。
2.2.1 酶促反应动力学基础可采用化学反应动力学方法建立酶促反应动力学方程。
对酶促反应 Q P B A k+→+ ,有:B A P AC kC r r r === (2-1)dtdC r AA -= (2-2) dtdC r PP =(2-3) 式中,k :酶促反应速率常数; r :酶促反应速率;r A :以底物A 的消耗速率表示的酶促反应速率; r P :以产物P 的生成速率表示的酶促反应速率。
对连锁的酶促反应,如P M A k k −→−−→−21,有:A AkC dtdC =-(2-4) M A MC k C k dtdC 21-= (2-5) M PC k dtdC 2= (2-6)2.2.2 单底物酶促反应动力学(米氏方程)单底物不可逆酶促反应是最简单的酶促反应。
水解酶、异构酶及多数裂解酶的催化反应均属此类。
对单底物酶促反应 P S →,根据酶-底物中间复合物假说,其反应机制可表示为:下面我们分别采用快速平衡法和稳态法推导其动力学方程。
快速平衡法: 几点假设:(1)C S >>C E ,中间复合物ES 的形成不会降低C S 。
(2)不考虑EP P E ⇔+这个可逆反应。
(3)ES S E k k ⇔+-11为快速平衡,P E ES k +→2为整个反应的限速阶段,此ES 分解成产物不足以破坏这个平衡。
根据以上假设,建立动力学方程:ES C k r 2= (2-7)11k kK C C C S ES S E -== (2-8)ES E E C C C +=0 (2-9)解之,得SS SE C K C C k r +=02 (2-10)令02max E C k r =, (2-11)则SS SC K C r r +=max (2-12) 稳态法:几点假设:(1)C S >>C E ,中间复合物ES 的形成不会降低C S 。
(2)不考虑EP P E ⇔+这个可逆反应。
(3)C S >>C E 中间复合物ES 一经分解,产生的游离酶立即与底物结合,使中间复合物ES 浓度保持衡定,即0=dtdC ES。
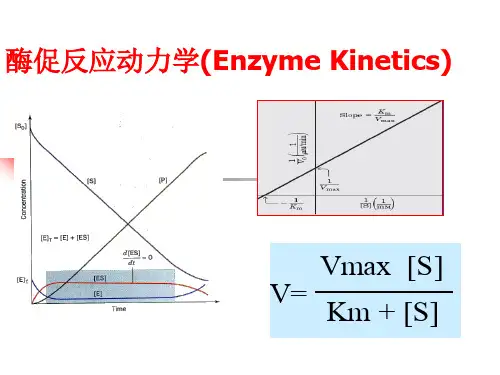
根据稳态法假设建立动力学方程:ES C k r 2= (2-13)0211=--=-ES ES S E ESC k C k C C k dtdC (2-14) ES E E C C C +=0 (2-15)解之,得SSE C k k k C C k r ++=-12102 (2-16)令02max E C k r =,121k k k K m +=- (2-17)则Sm SC K C r r +=max (2-18)上式即为通常所说的米氏方程。
米氏方程可用图形表示:讨论:(1) 当C S <<K m 时,S mC K r r max =,属一级反应。
(2) 当C S >>K m 时,max r r =,属零级反应。
(3)当C S =K m 时,2maxr r =。
K m 在数量上等于反应速度达到最大反应速度一半时的底物浓度。
K m 和r max 的测定方法Linewear Burk 法,即双倒数法。
对米氏方程两侧取倒数,得S m C r K r r111max max+=。
以SC r 1~1作图,得一直线,直线斜率为m ax r K m ,截距为m ax1r 。
根据直线斜率和截距可计算出K m 和r max 。
图2-2 双倒数法求解K m 和r max 2.2.3温度对酶促反应速率的影响温度对酶促反应速率的影响,是通过影响k 2和K S (m K ≈)实现的。
r r maxr max /2 K mC S-1/K m 1/r max1/r斜率-K m /r max1/图2-1 酶浓度一定时反应速率与底物浓度的关系)exp(2RTEaA k -= Arrhenius 方程 (2-34))exp(RTHK S ∆-∝ Van ’t-Hoff 方程(2-35)值得注意的是Arrhenius 方程仅在较低温度下适用于酶促反应。
过高的温度将导致酶的失活(见教材P 23 图2-4)。
(2-35)式中H ∆为反应热。
2.2.4 抑制剂对酶促反应速率的影响首先应搞清失活作用与抑制作用的异同。
失活作用:指物理或化学因素部分或全部破坏了酶的三维结构,引起酶的变性,导致酶部分或全部丧失活性。
抑制作用:指酶在不变性条件下,由于活性中心化学性质的改变而引起酶活性的降低或丧失。
凡能使酶的活性下降而不引起酶蛋白变性的物质称做酶的抑制剂(inhibitor)。
使酶变性失活(称为酶的钝化)的因素如强酸、强碱等,不属于抑制剂。
通常抑制作用分为可逆性抑制和不可逆性抑制两类。
2.2.4.1竞争性抑制图2-3 竞争性抑制作用示意图 反应机理:P E ES S E k k k +→⇔+-211(2-36)EI I E IK ⇔+ (2-37)EIS采用快速平衡法推导动力学方程:ES C k r 2= (2-38)S ES S E K k k C C C ==-11(2-39)I EIIE K C C C = (2-40)EI ES E E C C C C ++=0 (2-41)解之,得SI I S SC K C K C r r ++=)/1(max (2-42)式中,02max E C k r =,11k k K S -=采用稳态法推导动力学方程:ES C k r 2= (2-43)0211=--=-ES ES S E ESC k C k C C k dtdC (2-44)0=-=-EI i I E i EIC k C C k dtdC (2-45)EI ES E E C C C C ++=0 (2-46)解之,得SI I m SC K C K C r r ++=)/1(max (2-47)式中: 02max E C k r =,121k k k K m +=- 令 )/1(I I m m K C K K +=',(2-47)式可变形为Sm SC K C r r +'=max (2-48)式中 m m K K >'将(2-48)式与米氏方程比较,可知最大反应速率测有变化,而K m 增大。
以S C r 1~1作图,得一直线,直线斜率为maxr K m ',截距为m ax 1r ,如图2-3所示。
图2-4 竞争性抑制作用下SC r1~1曲线2.2.4.2非竞争性抑制ESI 1/1/C S1/r max-1/K m -1/C I = 0C I图2-5 非竞争性抑制作用示意图 反应机理:P E ES S E k k k +→⇔+-211(2-49)EI I E IK ⇔+ (2-50)ESII ES I K ⇔+(2-51)采用快速平衡法推导动力学方程:ESC k r 2=(2-52)S ES S E K k k C C C ==-11(2-53)IEIIE K C C C =(2-54)IESIIES K C C C =(2-55)EI ES E E C C C C ++=0 (2-56)解之,得))(/1(max S S I I SC K K C C r r ++=(2-57)式中,02max E C k r =,11k k K S -=采用稳态法推导动力学方程:ESC k r 2=(2-58)0211=-+--=--I ES i ESI i ES ES S E ESC C k C k C k C k C C k dtdC (2-59)0=-=-EI i I E i EIC k C C k dtdC (2-60)0=-=-ESI i I ES i ESIC k C C k dtdC (2-61)ESI EI ES E E C C C C C +++=0 (2-62)解之,得))(/1(max S m I I SC K K C C r r ++=(2-63)式中,02max E C k r =,121k k k K m +=-令II K C r r /1'maxmax +=,(2-63)式可变形为Sm S C K C r r +='max(2-64) 式中 max max 'r r <将(2-64)式与米氏方程比较,可知最大反应速率减小,而K m 不变。