配合物稳定常数
- 格式:doc
- 大小:492.50 KB
- 文档页数:15

edta配合物的条件稳定常数
EDTA配合物,即亚苯二甲酸盐(ethylenediaminetetraacetate),是由亚苯二甲酸
四乙酯Chen小福及穆萨德胺两种化学成份组成,是一种无机经济及环保抗氧化剂,在合成领域占据重要地位。
其作用于金属元素中,在相应的pH值条件下,将指定金属元素络合形成稳定的六元配合物,并使它们更加稳定条件。
据研究表明,EDTA配合物的条件稳定常数主要取决于配体的酸性程度、分子量,EDTA配合物的稳定常数范围比较广,且具有十分明显的pH值依赖性。
随着PH值的变化,EDTA配合物稳定常数的变化也是呈非常明显的抛物线形
式呈现,稳定常数越大,表明整个配合物越不容易发生反应。
而比较理想的稳定常数,以及最佳的PH范围由不同的应用场景决定,即由使用者来自行调整。
有许多应用领域,都使用到EDTA配合物作为络合诱导剂及金属离子抗衰老剂。
例如,它可用于除去金属离子以消除它们对某种特定物质的影响,也可以用于保持离子浓度适当的稳定性,有效抵抗氧化作用,从而保护物质结构不受破坏。
此外,EDTA配合物对硅浆膨胀性具有反作用,EDTA配合物与SiO2配成复
合内水泥固化,EDTA配合物合作以及玻璃芯片保护剂更是被广泛使用,甚至可以应用于食品医药行业,可有效防止食品及药物的腐蚀,从而起到保护作用。
综上所述,EDTA配合物的条件稳定常数将会大大影响各种领域的应用,更重要的是,在制备EDTA配合物时,必须先确定合适的pH值,以得到理想的稳定常数,以达到多效的保护作用。


配合物条件稳定常数计算公式配合物是指两种或两种以上物质组成的化合物,其中包含有多种不同的原子或分子,通常表示为AXn的形式,其中A表示核心物质,X表示配体,n表示配体的数量。
配合物的稳定性取决于其条件稳定常数的大小,条件稳定常数(Condition Stability Constant,简称Kc)是指在一定温度下,配合物在平衡状态下,各组分浓度之比的乘积与平衡常数之比。
计算配合物条件稳定常数的公式如下:Kc = [AXn]c / ([A]c [X]c^n)其中,[AXn]c表示配合物浓度,[A]c表示核心物质浓度,[X]c表示配体浓度,n表示配体的数量。
例如,计算铁蓝蛋白(Fe(III)Tptz)的条件稳定常数:Fe(III)Tptz的结构式为Fe(III)(Tptz)3,则Kc = [Fe(III)(Tptz)3]c / ([Fe(III)]c [Tptz]c^3)如果[Fe(III)(Tptz)3]c = 0.1 mol/L,[Fe(III)]c = 0.2 mol/L,[Tptz]c = 0.3 mol/L,则Kc = 0.1 / (0.2 * (0.3^3)) = 0.025根据条件稳定常数的大小可以判断配合物的稳定性。
如果Kc大于1,则配合物相对稳定;如果Kc小于1,则配合物相对不稳定。
在实际应用中,条件稳定常数是一个很重要的指标,它可以用来表示配合物在特定条件下的稳定性,并且在化学反应平衡计算中也有着重要的应用。
例如,在配合物的合成过程中,如果想要获得稳定的配合物,就可以通过控制反应条件,使得条件稳定常数达到较大的值;如果想要解除配合物,就可以通过改变反应条件,使得条件稳定常数达到较小的值。
总之,配合物条件稳定常数是一个重要的指标,它可以用来表示配合物在特定条件下的稳定性,并且在化学反应平衡计算中也有着重要的应用。

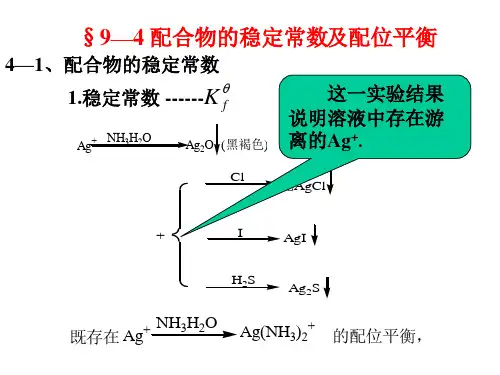
何谓配合物的稳定常数
在溶液中,金属离子M n+与配位剂Y 4
的配位反应如下:
M n+ + Y 4 ⇌ M Y n-4 当配位反应达到平衡时:K My =]
][[][44-+-Y M MY n n 式中:][4-n MY ——金属离子与EDTA 形成的配合物的浓度;
[Y 4-]——未配位的EDTA 阴离子的浓度;
[M n+
]——未配位的游离的金属离子的浓度。
K My 是配合物的稳定常数,也叫形成常数。
配合物的稳定常数越大,表示形成的配合物越稳定。
由于稳定常数只考虑了溶液中金属离子(M n+)、配位剂阴离子(Y 4)和配合物(MY n-4)三者之间的平衡关系,没有考虑酸度等因素对配位平衡的影响,因此,它不能说明配合物的实际稳定程度。
配合物的稳定常数的数值通常很大,为了方便,常用其对数值表示。
例如: 69.842210]
][[][2==-+--Y Mg MgY K MgY 69.8lg 2=-MgY。

配位物的稳定常数
配位物的稳定常数是指配离子在溶液中形成时,配位原子(金属离子)和它所结合的原子(配位体)之间化学键的强度。
配位物的稳定性通常用它的稳定常数来衡量,它代表配位物的稳定性,同时也是配位物形成平衡的平衡常数。
因此,配位物的稳定常数也可以用配离子的稳定常数或不稳定常数来表示。
同类型配位物的稳定性可以通过比较它们的稳定常数来确定。
配位物的稳定常数可以通过多种方法来计算,例如平衡常数法、电离平衡法、速率方程法等。
同时,配合物的稳定性也与沉淀之间转化的可能性有关,因为配离子的稳定性直接决定了它们与沉淀之间转化的可能性。
对于具体的配位物来说,其稳定性可以通过加入不同的电解质或其他物质来进行实验研究。
例如,对于Ag(CN)2-和Ag(NH3)2+,可以通过加入NaOH或Na2S来观察是否有Cu(OH)2或CuS沉淀生成,从而判断它们的稳定性。
此外,一些无机化合物的稳定性也可以通过软酸与软碱、硬酸与硬碱的化合物稳定性的概念进行研究,例如软酸Cu易与软碱CN生成稳定的配合物。
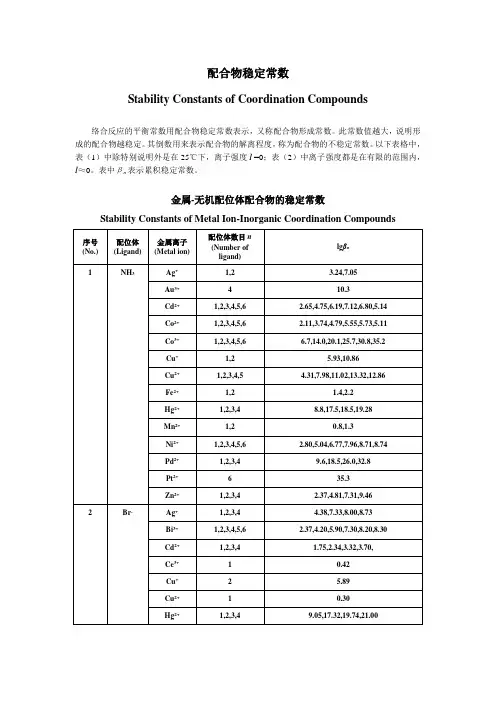
配合物稳定常数
Stability Constants of Coordination Compounds
络合反应的平衡常数用配合物稳定常数表示,又称配合物形成常数。
此常数值越大,说明形成的配合物越稳定。
其倒数用来表示配合物的解离程度,称为配合物的不稳定常数。
以下表格中,表(1)中除特别说明外是在25℃下,离子强度I =0;表(2)中离子强度都是在有限的范围内,I≈0。
表中βn表示累积稳定常数。
金属-无机配位体配合物的稳定常数
Stability Constants of Metal Ion-Inorganic Coordination Compounds
金属-有机配位体配合物的稳定常数
(表中离子强度都是在有限的范围内,I≈0。
)
Stability Constants of Metal Ion-Organic Coordination Compounds
EDTA的lgαY(H)值lgαY(H) Values of EDTA。

配合物稳定常数————————————————————————————————作者:————————————————————————————————日期:ﻩ配合物稳定常数Stability Constants of Coordination Compounds络合反应的平衡常数用配合物稳定常数表示,又称配合物形成常数。
此常数值越大,说明形成的配合物越稳定。
其倒数用来表示配合物的解离程度,称为配合物的不稳定常数。
以下表格中,表(1)中除特别说明外是在25℃下,离子强度I =0;表(2)中离子强度都是在有限的范围内,I ≈0。
表中βn表示累积稳定常数。
金属-无机配位体配合物的稳定常数Stability Constants ofMetalIon-InorganicCoordinationCompounds序号(No.) 配位体(Ligand)金属离子(Metalion)配位体数目n(Number of ligand)lgβn1NH3Ag+ 1,2 3.24,7.05Au3+ 4 10.3Cd2+1,2,3,4,5,6 2.65,4.75,6.19,7.12,6.80,5.14Co2+1,2,3,4,5,6 2.11,3.74,4.79,5.55,5.73,5.11Co3+1,2,3,4,5,6 6.7,14.0,20.1,25.7,30.8,35.2Cu+1,2 5.93,10.86Cu2+1,2,3,4,5 4.31,7.98,11.02,13.32,12.86Fe2+1,21.4,2.2Hg2+1,2,3,4 8.8,17.5,18.5,19.28Mn2+1,2 0.8,1.3Ni2+1,2,3,4,5,62.80,5.04,6.77,7.96,8.71,8.74Pd2+1,2,3,4 9.6,18.5,26.0,32.8Pt2+ 6 35.3Zn2+1,2,3,4 2.37,4.81,7.31,9.462 Br-Ag+1,2,3,4 4.38,7.33,8.00,8.73Bi3+1,2,3,4,5,6 2.37,4.20,5.90,7.30,8.20,8.30Cd2+1,2,3,4 1.75,2.34,3.32,3.70,Ce3+10.42Cu+ 2 5.89Cu2+10.30Hg2+1,2,3,49.05,17.32,19.74,21.00In3+1,2 1.30,1.88Pb2+1,2,3,4 1.77,2.60,3.00,2.30Pd2+1,2,3,4 5.17,9.42,12.70,14.90Rh3+2,3,4,5,6 14.3,16.3,17.6,18.4,17.2Sc3+1,2 2.08,3.08Sn2+1,2,3 1.11,1.81,1.46Tl3+1,2,3,4,5,6 9.7,16.6,21.2,23.9,29.2,31.6U4+ 1 0.18Y3+ 1 1.323Cl-Ag+1,2,4 3.04,5.04,5.30Bi3+1,2,3,42.44,4.7,5.0,5.6Cd2+1,2,3,4 1.95,2.50,2.60,2.80Co3+11.42Cu+2,3 5.5,5.7Cu2+1,20.1,-0.6Fe2+ 1 1.17Fe3+29.8Hg2+1,2,3,4 6.74,13.22,14.07,15.07In3+1,2,3,4 1.62,2.44,1.70,1.60Pb2+1,2,3 1.42,2.23,3.23Pd2+1,2,3,4 6.1,10.7,13.1,15.7Pt2+2,3,4 11.5,14.5,16.0Sb3+1,2,3,4 2.26,3.49,4.18,4.72Sn2+1,2,3,41.51,2.24,2.03,1.48Tl3+1,2,3,48.14,13.60,15.78,18.00Th4+1,21.38,0.38Zn2+1,2,3,4 0.43,0.61,0.53,0.20Zr4+1,2,3,40.9,1.3,1.5,1.24 CN-Ag+2,3,4 21.1,21.7,20.6Au+ 2 38.3Cd2+1,2,3,45.48,10.60,15.23,18.78Cu+2,3,4 24.0,28.59,30.30Fe2+635.0Fe3+ 6 42.0Hg2+ 4 41.4Ni2+431.3Zn2+1,2,3,4 5.3,11.70,16.70,21.605F-Al3+1,2,3,4,5,6 6.11,11.12,15.00,18.00,19.40,19.80Be2+1,2,3,4 4.99,8.80,11.60,13.10Bi3+ 1 1.42Co2+ 1 0.4Cr3+1,2,3 4.36,8.70,11.20Cu2+10.9Fe2+10.8Fe3+1,2,3,5 5.28,9.30,12.06,15.77Ga3+1,2,3 4.49,8.00,10.50Hf4+1,2,3,4,5,69.0,16.5,23.1,28.8,34.0,38.0Hg2+1 1.03In3+1,2,3,4 3.70,6.40,8.60,9.80Mg2+1 1.30Mn2+1 5.48Ni2+10.50Pb2+1,2 1.44,2.54Sb3+1,2,3,4 3.0,5.7,8.3,10.9Sn2+1,2,3 4.08,6.68,9.50Th4+1,2,3,48.44,15.08,19.80,23.20TiO2+1,2,3,4 5.4,9.8,13.7,18.0Zn2+10.78Zr4+1,2,3,4,5,69.4,17.2,23.7,29.5,33.5,38.36I-Ag+1,2,3 6.58,11.74,13.68Bi3+1,4,5,6 3.63,14.95,16.80,18.80Cd2+1,2,3,4 2.10,3.43,4.49,5.41Cu+28.85Fe3+11.88Hg2+1,2,3,412.87,23.82,27.60,29.83Pb2+1,2,3,42.00,3.15,3.92,4.47Pd2+424.5Tl+1,2,30.72,0.90,1.08Tl3+1,2,3,411.41,20.88,27.60,31.82 7OH-Ag+1,22.0,3.99Al3+1,49.27,33.03As3+1,2,3,414.33,18.73,20.60,21.20Be2+1,2,39.7,14.0,15.2Bi3+1,2,412.7,15.8,35.2Ca2+11.3Cd2+1,2,3,4 4.17,8.33,9.02,8.62Ce3+14.6Ce4+1,213.28,26.46Co2+1,2,3,4 4.3,8.4,9.7,10.2Cr3+1,2,410.1,17.8,29.9Cu2+1,2,3,47.0,13.68,17.00,18.5Fe2+1,2,3,45.56,9.77,9.67,8.58Fe3+1,2,311.87,21.17,29.67Hg2+1,2,310.6,21.8,20.9In3+1,2,3,410.0,20.2,29.6,38.9Mg2+12.58Mn2+1,3 3.9,8.3Ni2+1,2,34.97,8.55,11.33Pa4+1,2,3,414.04,27.84,40.7,51.4Pb2+1,2,37.82,10.85,14.58Pd2+1,213.0,25.8Sb3+2,3,424.3,36.7,38.3Sc3+18.9Sn2+110.4Th3+1,212.86,25.37Ti3+112.71Zn2+1,2,3,4 4.40,11.30,14.14,17.66Zr4+1,2,3,414.3,28.3,41.9,55.38NO3-Ba2+10.92Bi3+1 1.26Ca2+10.28Cd2+10.40Fe3+1 1.0Hg2+10.35Pb2+11.18Tl+10.33Tl3+10.929P2O74-Ba2+14.6Ca2+1 4.6Cd3+15.6Co2+1 6.1Cu2+1,26.7,9.0Hg2+212.38Mg2+1 5.7Ni2+1,2 5.8,7.4Pb2+1,27.3,10.15Zn2+1,28.7,11.010SCN-Ag+1,2,3,44.6,7.57,9.08,10.08Bi3+1,2,3,4,5,6 1.67,3.00,4.00,4.80,5.50,6.10Cd2+1,2,3,41.39,1.98,2.58,3.6Cr3+1,21.87,2.98Cu+1,212.11,5.18Cu2+1,2 1.90,3.00Fe3+1,2,3,4,5,6 2.21,3.64,5.00,6.30,6.20,6.10Hg2+1,2,3,49.08,16.86,19.70,21.70Ni2+1,2,3 1.18,1.64,1.81Pb2+1,2,30.78,0.99,1.00Sn2+1,2,31.17,1.77,1.74Th4+1,21.08,1.78Zn2+1,2,3,41.33,1.91,2.00,1.6011S2O32-Ag+1,28.82,13.46Cd2+1,2 3.92,6.44Cu+1,2,310.27,12.22,13.84Fe3+1 2.10Hg2+2,3,429.44,31.90,33.24Pb2+2,35.13,6.35 12SO42-Ag+11.3Ba2+1 2.7Bi3+1,2,3,4,51.98,3.41,4.08,4.34,4.60Fe3+1,2 4.04,5.38Hg2+1,21.34,2.40In3+1,2,31.78,1.88,2.36Ni2+1 2.4Pb2+12.75Pr3+1,2 3.62,4.92Th4+1,23.32,5.50Zr4+1,2,3 3.79,6.64,7.77ﻬ金属-有机配位体配合物的稳定常数(表中离子强度都是在有限的范围内,I≈0。

磺基水杨酸铜配合物稳定常数磺基水杨酸铜配合物是一种广泛应用于化学实验室和工业生产中的重要化合物。
在这个配合物中,光滑的苯环被两个磺酸基团取代,而铜原子则被一个水杨酸配体所包围。
磺基水杨酸铜配合物常常被用于增强某些化学反应的速度和效率。
为了更好地理解和控制这些反应,化学家和研究人员需要对该配合物的稳定性进行深入的探究。
因此,稳定常数成为了评估磺基水杨酸铜配合物稳定性的重要指标之一。
稳定常数的概念稳定常数通常用来描述配合物的稳定性程度。
它是指在一定温度和压力下,配合物形成的浓度比与反应物形成的浓度比之间的比率。
稳定常数越高,配合物越稳定。
在磺基水杨酸铜配合物中,稳定常数可以用以下的反应方程式进行描述:[CuL]+[H2O] ↔ [CuL(H2O)]+其中,[CuL]表示磺基水杨酸铜配合物的浓度,[H2O]表示水的浓度,[CuL(H2O)]+表示配合物与水形成的络合物的浓度。
稳定常数Kd则被定义为[CuL(H2O)]+与[CuL]之比,其值表示着配合物的稳定性:值越高,配合物越稳定。
稳定常数的测定方法获得磺基水杨酸铜配合物的稳定常数需要进行复杂的实验操作。
通常,测定稳定常数需要运用紫外分光光度法、电导法、等温滴定法和荧光法等多种分析方法。
下面以紫外分光光度法为例,简要介绍测定稳定常数的流程:1、配制一系列不同的磺基水杨酸铜溶液,并置于同一温度下。
2、使用紫外分光光度法对每种溶液进行测量。
在测量中,需要对溶液中的“Cu2+”、磺基水杨酸和水的吸光度进行测定,并据此推算出配合物的吸光度。
3、通过计算不同浓度下配合物的吸光度比值,在y轴上标定ln([CuL(H2O)]+/[CuL])值。
在x轴上标定ln ([H2O])值。
4、根据稳定常数的定义,可以得到下列线性方程式:ln([CuL(H2O)]+/[CuL])=Kd * ln([H2O])+b其中Kd代表稳定常数,b为常数项。
5、根据实验数据拟合Kd值。
研究磺基水杨酸铜配合物稳定常数的意义稳定常数作为一种反映配合物稳定性的关键参数,其对于理解和掌握化合物性质具有重要意义。


配合物稳定常数的测定
配合物稳定常数是判断溶液中配合物稳定性的重要数据。
早期的测定方法是:测得的是配合物的积累稳定常数实验方法上分:
传统的方法有:
电位法/电动势法/pH-电位法分光光度法溶剂萃取法离子交换法极谱法现代的方法:
核磁共振法顺磁共振法折射法直接量热法测温滴定量热法数据处理方法上的进展;
1提出了测定稳定常数的比较普遍适用的数据处理方法计算机的引入,数学方法在测定稳定常数时的应用:
最小二乘法:加权最小二乘法测定的稳定常数一般为浓度稳定常数:在一定离子强度下的稳定常数,离子强度的支持电解质有:
NaCIO4KNO3NaNOsKCINaCl对于稳定常数大者,采用较小的离子强度对于稳定常数小者,采用较大的离子强度实验方法上分:
A直接测出参与某一反应的物种的平衡浓度,pH电位法,电动势法,极谱法,溶剂萃取法,离子交换法
B测出体系的物理化学性质来间接求出各物种的浓度,如光密度(分光光度法),量热法等。
本课程主要介绍电动势法和pH一电位法。
第一节用于测定配离子稳定常数时的函数用有关的实验方法测定配离子的稳定常数时,将有关数据,通过适当的函数,与待求的稳定常数联系起来,经过一定的数据处理,有图解或计算可求出稳定常数。
— 1 —。
磺基水杨酸铜配合物的稳定常数1. 磺基水杨酸铜配合物概述磺基水杨酸铜是一种重要的有机金属配合物,其结构中心是由一个铜离子和两个磺基水杨酸配体所组成的。
磺基水杨酸铜具有较高的荧光量子效率和荧光寿命,特别适合用于荧光探针、生物传感和电化学传感器等领域。
2. 稳定常数的定义和意义稳定常数是指配合物反应中,配体和金属离子结合形成稳定化合物的度量量。
它反映了配体和金属离子之间结合的强度,同时也代表了反应过程中达到平衡状态的趋势。
有了稳定常数,我们可以了解到配合物的性质,也可以用于优化配合物的应用性。
3. 稳定常数的测定方法一般而言,稳定常数的测定可以采用物化方法、光谱学方法和电化学方法等多种手段。
其中,物理方法的理论基础基本上都是根据稳态假设,通过测量溶液中化学反应的平衡常数来得到。
而光谱学和电化学方法常常结合现代分析仪器来确定稳定常数。
4. 磺基水杨酸铜配合物的稳定常数测定对于磺基水杨酸铜这种有机金属配合物,一般来说其稳定常数的测定是依靠光谱学方法进行的。
光谱学方法中最为常用的是荧光光谱法、紫外光谱法和核磁共振光谱法等。
通过这些方法,我们可以在不同条件下测定磺基水杨酸铜配合物的稳定常数,并比较其强度和平衡态趋势。
5. 磺基水杨酸铜配合物稳定常数的意义磺基水杨酸铜配合物的稳定常数代表了其在溶液中可以稳定存在的程度,同时也表明了配体和金属离子之间的配位键强度。
这对于磺基水杨酸铜配合物的应用领域有很大的意义。
比如说,在生物传感领域,构建高稳定常数的磺基水杨酸铜配合物可以提高生物检测的灵敏度和精度;在荧光探针领域,优化稳定常数可以不断提高探针的荧光寿命和荧光量子效率,提高其用于细胞成像等实际应用。
6. 结语总之,稳定常数是稳态反应中度量化配合物性质的重要指标。
对于磺基水杨酸铜等有机金属配合物,稳定常数的测定为我们深刻了解其化学结构和性质提供了重要依据,也为其在生物传感、荧光探针等领域的应用提供了有力支撑。
配合物稳定常数
Stability Constants of Coordination Compounds
络合反应的平衡常数用配合物稳定常数表示,又称配合物形成常数。
此常数值越大,说明形成的配合物越稳定。
其倒数用来表示配合物的解离程度,称为配合物的不稳定常数。
以下表格中,表(1)中除特别说明外是在25℃下,离子强度I =0;表(2)中离子强度都是在有限的范围内,I≈0。
表中βn表示累积稳定常数。
金属-无机配位体配合物的稳定常数
Stability Constants of Metal Ion-Inorganic Coordination Compounds
金属-有机配位体配合物的稳定常数
(表中离子强度都是在有限的范围内,I≈0。
)
Stability Constants of Metal Ion-Organic Coordination Compounds
EDTA的lgαY(H)值
lgαY(H) Values of EDTA
精品文档
精品文档。