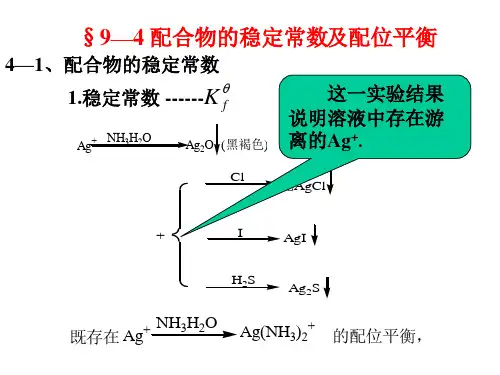
配合物的不稳定常数和稳定常数
- 格式:ppt
- 大小:3.30 MB
- 文档页数:24




配合物的组成和不稳定常数的测定(物理化学 李俊)一、目的要求1. 掌握用分光光度法测定配合物组成及稳定常数的基本原理和方法。
2. 通过实验,掌握测量原理和分光光度计的使用方法, 二、实验原理1,用等摩尔连续递变法测定配合物的组成“递变法” 实际上是一种物理化学分析方法。
可用来研究当两个组分混合时, 是否发生化 合,配合,缔合等作用,以及测定两者之间的化学比。
其原理是 :在保持总浓度不变的前提 下,依次逐渐改变体系中两个组分的比值,并测定不同摩尔分数时的某一物理化学参量。
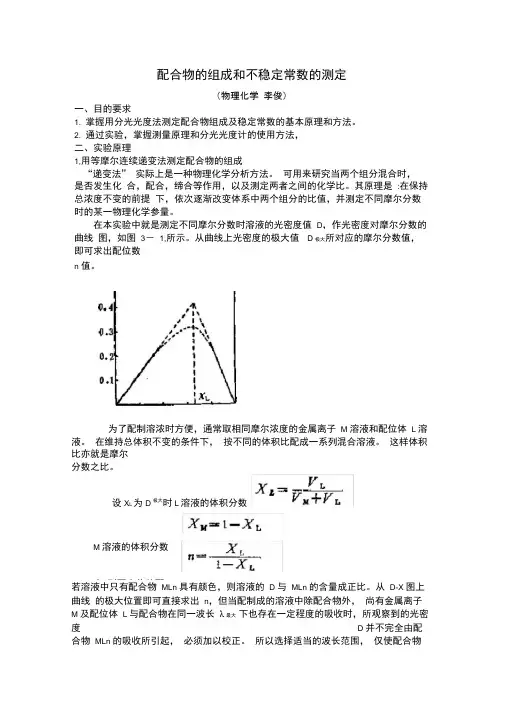
在本实验中就是测定不同摩尔分数时溶液的光密度值 D ,作光密度对摩尔分数的曲线 图,如图 3- 1,所示。
从曲线上光密度的极大值 D 极大所对应的摩尔分数值,即可求出配位数n 值。
为了配制溶浓时方便,通常取相同摩尔浓度的金属离子 M 溶液和配位体 L 溶液。
在维持总体积不变的条件下, 按不同的体积比配成一系列混合溶液。
这样体积比亦就是摩尔 分数之比。
若溶液中只有配合物 MLn 具有颜色,则溶液的 D 与 MLn 的含量成正比。
从 D-X 图上曲线 的极大位置即可直接求出 n ,但当配制成的溶液中除配合物外, 尚有金属离子 M 及配位体 L 与配合物在同一波长 λ最大 下也存在一定程度的吸收时,所观察到的光密度 D 并不完全由配 合物 MLn 的吸收所引起, 必须加以校正。
所以选择适当的波长范围, 仅使配合物设X L 为D极大时L 溶液的体积分数M 溶液的体积分数为 则配合物的配MLn 有吸收,M 和L 都不吸收或极少吸收。
2.配合物平衡常数的测定假定配合物中心离子浓度不变,而渐增加配位体浓度,随着配位体浓度的改变,中心离子被配成MLn ,溶液的光密度值 D 不断升高。
当中心离子被完全配合后,如继续增加配位体的浓度,则溶液的光密度值 D 趋于恒定,如图3-2。
设配合物在稀溶液中有如下解离平衡存在:最初浓度平衡浓度式中,n-配位数,已由实验确定;a-解离度:C-配合物未解离时的浓度(在本实验中亦为M 完全配合时的配合物浓度)。
配合物的组成和不稳定常数的测定一、目的要求1.掌握用分光光度法测定配合物组成及稳定常数的基本原理和方法。
2.通过实验,掌握测量原理和分光光度计的使用方法,二、实验原理a,用等摩尔连续递变法测定配合物的组成“递变法”实际上是一种物理化学分析方法。
可用来研究当两个组分混合时,是否发生化合,配合,缔合等作用,以及测定两者之间的化学比。
其原理是:在保持总浓度不变的前提下,依次逐渐改变体系中两个组分的比值,并测定不同摩尔分数时的某一物理化学参量。
在本实验中就是测定不同摩尔分数时溶液的光密度值D,作光密度对摩尔分数的曲线图,如图3-1,所示。
从曲线上光密度的极大值D极大所对应的摩尔分数值,即可求出配位数n值。
为了配制溶浓时方便,通常取相同摩尔浓度的金属离子M溶液和配位体L溶液。
在维持总体积不变的条件下,按不同的体积比配成一系列混合溶液。
这样体积比亦就是摩尔分数之比。
设X L为D极大时L溶液的体积分数:M溶液的体积分数为:则配合物的配位数为:若溶液中只有配合物MLn具有颜色,则溶液的D与MLn的含量成正比。
从D-X图上曲线的极大位置即可直接求出n,但当配制成的溶液中除配合物外,尚有金属离子M及配位体L 与配合物在同一波长λ最大下也存在一定程度的吸收时,所观察到的光密度D并不完全由配合物MLn的吸收所引起,必须加以校正。
所以选择适当的波长范围,仅使配合物MLn有吸收,M和L都不吸收或极少吸收。
2.配合物平衡常数的测定假定配合物中心离子浓度不变,而渐增加配位体浓度,随着配位体浓度的改变,中心离子被配成MLn,溶液的光密度值D不断升高。
当中心离子被完全配合后,如继续增加配位体的浓度,则溶液的光密度值D趋于恒定,如图3-2。
设配合物在稀溶液中有如下解离平衡存在:最初浓度平衡浓度式中,n-配位数,已由实验确定;a-解离度:C-配合物未解离时的浓度(在本实验中亦为M完全配合时的配合物浓度)。
式中Dm是M完全被配合时溶液的光密度值,Dn是L与M摩尔比为n时溶液的光密度,此时虽达平衡,但M未被完全配合。

化学五大平衡常数化学五大平衡常数是指酸解离常数、碱解离常数、水解常数、金属离子配合物稳定常数、氧化还原电极电位常数。
这些常数经常出现在化学反应的研究中,相应的数值反映了不同平衡反应的强度和趋势。
下面将就这些平衡常数逐一展开阐述。
1. 酸解离常数(Ka)酸解离常数是指为了溶解H+离子而发生的酸溶解反应,其平衡常数表达式为 Ka=[H+][A-]/ [HA]。
在一定温度和溶剂中,Ka越大,酸性就越强,说明酸越容易给出H+离子,溶液的pH值会降低。
而Ka值越小,则说明酸性越弱,酸解离反应越难发生。
2. 碱解离常数(Kb)碱解离常数是指为了溶解OH-离子而发生的碱溶解反应,其平衡常数表达式为Kb=[OH-][BH+]/ [B]。
同样地,在一定温度和溶剂中,Kb越大,碱性就越强,说明碱越容易给出OH-离子,溶液的pH值会升高。
而Kb值越小,则说明碱性越弱,碱解离反应越难发生。
3. 水解常数(Kw)水解常数是指水在溶液中自身发生水解反应,平衡常数表达式为Kw=[H+][OH-]。
其中,Kw在25℃下大约为1.0×10^-14,是温度不变的常数。
当溶液中酸性强时,[H+]大,[OH-]小,反之亦然。
这方面比较特殊的情况是在中性溶液下,[H+]=[OH-]=1.0×10^-7,pH=7。
4. 金属离子配合物稳定常数(Kf)金属离子与配位体反应生成配合物时,稳定常数Kf反映了这种反应的强度和趋势。
金属离子配合物稳定程度越高,Kf值就越大,反之亦然。
配合物对某些应用如化学分析和工业化学等方面也比较重要。
5. 氧化还原电极电位常数(E)氧化还原电极的电位可以用氧化还原电极电位来描述,其表达式为:E=E°- (RT/nF)lnQ。
其中,E°是氧化还原反应在标准状态下的电极电位,R为气体常数,T为温度(K),n为电子数,F为法拉第常数,Q为反应物浓度的乘积。
通常来说,当E>0,则反应趋势为氧化,是氧化反应;当E<0,则反应趋势为还原,是还原反应。



配合物稳定常数
Stability Constants of Coordination Compounds
络合反应的平衡常数用配合物稳定常数表示,又称配合物形成常数。
此常数值越大,说明形成的配合物越稳定。
其倒数用来表示配合物的解离程度,称为配合物的不稳定常数。
以下表格中,表(1)中除特别说明外是在25℃下,离子强度I =0;表(2)中离子强度都是在有限的范围内,I≈0。
表中βn表示累积稳定常数。
金属-无机配位体配合物的稳定常数
Stability Constants of Metal Ion-Inorganic Coordination Compounds
金属-有机配位体配合物的稳定常数
(表中离子强度都是在有限的范围内,I≈0。
)
Stability Constants of Metal Ion-Organic Coordination Compounds
EDTA的lgαY(H)值
lgαY(H) Values of EDTA
精品文档
精品文档。