金属配位稳定常数
- 格式:doc
- 大小:281.50 KB
- 文档页数:5

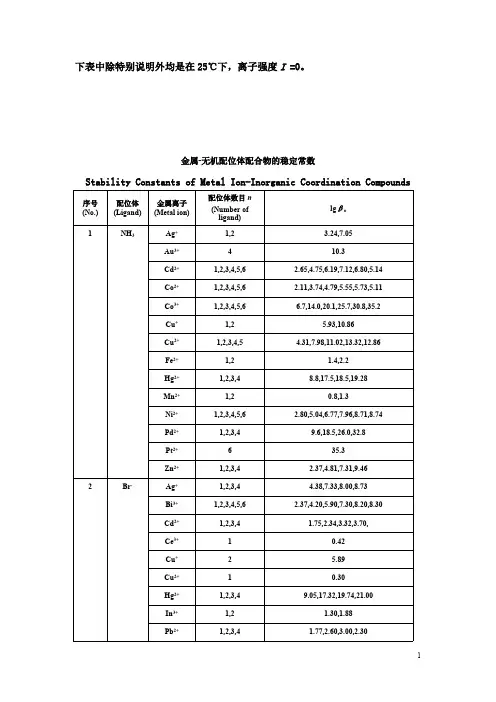

图1 摩尔比法图示实验 邻菲啰啉铁配合物组成及稳定常数的测定一、实验目的1. 学习和掌握分光光度计的使用;2. 掌握摩尔比法和等摩尔连续变化法测定配合物组成及稳定常数的基本原理和实验方法。
二、 实验原理分光光度法是研究配合物组成和测定配合物稳定的一种十分有效的有效的方法。
如果金属离子M 和配体L 形成配合物,配位反应为M + nL == ML n式中,n 为配合物的配位数,可用摩尔比法或等摩尔连续变化法测定。
1. 摩尔比法配制一系列溶液,维持各溶液的金属离子浓度、酸度、离子强度、温度不变,只改变配位体的浓度,在配合物的最大吸收波长处测定各溶液的吸光度A ,以吸光度A对摩尔比R (M L C C R =,L C 为配位体浓度,M C 为金属离子浓度)作图得到图1所示的曲线。
由图可见,当n R <时,配位体L 全部转变为n ML ,吸光度A 随L 浓度增大而增高,并与R 呈线性关系。
当n R >时,金属离子M 全部转变为n ML ,继续增加L ,吸光度不再增高。
将曲线的线性部分延长,相交于一点,该点所对应的R 即为配合物的配位数n 。
摩尔比法要求在选定的波长下,除配合物外,配位体无明显的吸收,而且只能生成一种配合物。
摩尔比法虽然简单、快速,但仅适用于离解度小的配合物。
如果曲线的转折点很不明显,就难以确定配合物的组成。
2.等摩尔连续变化法(Job’s plot )配制一系列溶液,在实验条件相同的情况下,保持溶液的总浓度不变,即MC和L C 之和为常数,只改变溶液中M C 和L C 的比值。
在选定的波长下,测定溶液的吸光度A ,将A 对)C (C C L M M +作图,如图2所示。
当体系中只生成一种配合物时,曲线有一最高点,对应于该点的M L C C 即为该配合物的配位数n 。
如果配合物的稳定性好,曲线的最高点很明显。
如果配合物部分离解,曲线的最高点附近比较圆滑,可将曲线的线性部分延长,找出其交点。

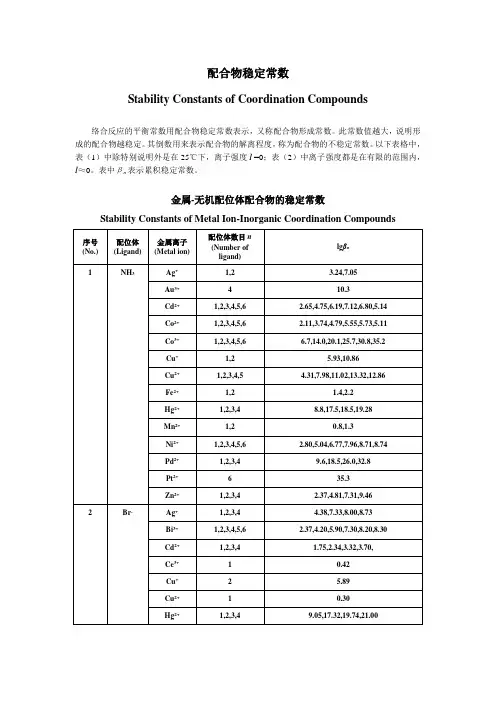
配合物稳定常数
Stability Constants of Coordination Compounds
络合反应的平衡常数用配合物稳定常数表示,又称配合物形成常数。
此常数值越大,说明形成的配合物越稳定。
其倒数用来表示配合物的解离程度,称为配合物的不稳定常数。
以下表格中,表(1)中除特别说明外是在25℃下,离子强度I =0;表(2)中离子强度都是在有限的范围内,I≈0。
表中βn表示累积稳定常数。
金属-无机配位体配合物的稳定常数
Stability Constants of Metal Ion-Inorganic Coordination Compounds
金属-有机配位体配合物的稳定常数
(表中离子强度都是在有限的范围内,I≈0。
)
Stability Constants of Metal Ion-Organic Coordination Compounds
EDTA的lgαY(H)值lgαY(H) Values of EDTA。

金属离子与氨羧配位剂的配合物稳定常数对于理解化学反应和预测化学平衡非常重要。
本文将介绍金属离子与氨羧配位剂的配合物稳定常数的定义、影响因素以及计算方法。
一、金属离子与氨羧配位剂的配合物稳定常数的定义金属离子与氨羧配位剂通过配位键形成配合物,配合物稳定常数(K)是定量描述配合物形成的程度的常数。
金属离子与氨羧配位剂形成的配合物可以用如下的化学方程式表示:Mn+ + L ⇌ MLn+其中Mn+代表金属离子,L代表氨羧配位剂,MLn+代表金属离子与氨羧配位剂形成的配合物。
配合物稳定常数K的定义如下:K = [MLn+]/([Mn+][L])其中[MLn+]、[Mn+]和[L]分别代表配合物、金属离子和氨羧配位剂的浓度。
配合物稳定常数K的值越大,表示配合物形成的程度越高;反之,K的值越小,表示配合物形成的程度越低。
二、金属离子与氨羧配位剂的配合物稳定常数的影响因素1. 金属离子的电荷:金属离子的电荷越大,与氨羧配位剂形成的配合物稳定常数K越大。
2. 氨羧配位剂的性质:不同的氨羧配位剂有不同的配位能力,影响金属离子与氨羧配位剂形成配合物稳定常数K的大小。
3. 溶剂的性质:不同溶剂对金属离子与氨羧配位剂形成的配合物稳定常数K有不同的影响。
4. 温度:温度的升高通常会使金属离子与氨羧配位剂形成的配合物稳定常数K增大。
三、金属离子与氨羧配位剂的配合物稳定常数的计算方法金属离子与氨羧配位剂的配合物稳定常数可以通过不同的实验方法来测定,如紫外-可见光谱法、电化学法、核磁共振法等。
通过实验测定得到的数据可以计算配合物稳定常数K的值。
还可以通过计算方法来估算配合物稳定常数K的值,常用的计算方法有理论计算、量子化学计算等。
金属离子与氨羧配位剂的配合物稳定常数是描述配合物形成程度的重要物理化学常数,对于理解化学反应和应用化学平衡有着重要的意义。
通过实验测定和计算方法可以得到金属离子与氨羧配位剂的配合物稳定常数的数值,进而更深入地理解金属离子与氨羧配位剂的配合物形成规律。




实验⼋配位化合物的配位系数及稳定常数的测定实验⼋配位化合物的配位系数及稳定常数的测定⼀、实验⽬的1.学习了解分光光度法测定配位化合物组成及其稳定常数的原理和⽅法;2.学习掌握721型分光光度计的使⽤⽅法。
⼆、实验原理磺基⽔杨酸与Fe3+可形成稳定的配位化合物。
本实验⽤等物质的量数连续变化法。
配合物的表观稳定常数K可有以下平衡关系导出:ML ≒ M + L起始浓度: c 0 0平衡浓度:c–ca ca caK稳(表观)={c(ML)}/{c(M)c(L)}=(1-a)/(ca2)校正后得:K(稳)=K稳(表观)×1010.297三、实验仪器和试剂721型分光光度计;50ml烧杯;80ml烧杯;100ml容量瓶;10ml移液管。
⾼氯酸 HClO4(0.100mol/L pH2.0);磺基⽔杨酸(0.100mol/L);硫酸⾼铁铵NH4Fe(SO4)2(0.100mol/L)。
四、实验步骤1、配制0.0010mol/L Fe3+溶液⽤移液管吸取0.0100mol/L Fe3+溶液10.00ml,注⼊100ml容量瓶中,⽤0.0100mol/L HClO4溶液稀释⾄刻度,摇匀备⽤。
2、配制0,001mol/L磺基⽔杨酸溶液⽤移液管吸取0.0100mol/L磺基⽔杨酸溶液10.00ml,注⼊100ml容量瓶中,⽤0.0100mol/L HClO4溶液稀释⾄刻度,摇匀备⽤。
3、浓⽐递变法测定有⾊配位离⼦的吸光度⽤3⽀吸量管安下表吸取各溶液配制下列⼗⼀组溶液,摇匀。
⽤721分光光度计测定。
五、实验数据记录及处理配位数n = 1 其离⼦组成为1:1 即FeRa =(A’- A)/ A’ =(0.445-0.35)/0.445 = 0.213K稳(表观)= c(ML) /( c(M) ·c(L) ) = (1-a)/(c·a2)= 0.787/(0.001x 0.2132) = 1.74 x 104K稳= K稳(表观)·1010.297 = 3.44 x 1014。

配合物稳定常数
Stability Constants of Coordination Compounds
络合反应的平衡常数用配合物稳定常数表示,又称配合物形成常数。
此常数值越大,说明形成的配合物越稳定。
其倒数用来表示配合物的解离程度,称为配合物的不稳定常数。
以下表格中,表(1)中除特别说明外是在25℃下,离子强度I =0;表(2)中离子强度都是在有限的范围内,I≈0。
表中βn表示累积稳定常数。
金属-无机配位体配合物的稳定常数
Stability Constants of Metal Ion-Inorganic Coordination Compounds
金属-有机配位体配合物的稳定常数
(表中离子强度都是在有限的范围内,I≈0。
)
Stability Constants of Metal Ion-Organic Coordination Compounds
EDTA的lgαY(H)值
lgαY(H) Values of EDTA
精品文档
精品文档。