金属配位稳定常数
- 格式:doc
- 大小:200.00 KB
- 文档页数:6




金属离子与氨羧配位剂的配合物稳定常数对于理解化学反应和预测化学平衡非常重要。
本文将介绍金属离子与氨羧配位剂的配合物稳定常数的定义、影响因素以及计算方法。
一、金属离子与氨羧配位剂的配合物稳定常数的定义金属离子与氨羧配位剂通过配位键形成配合物,配合物稳定常数(K)是定量描述配合物形成的程度的常数。
金属离子与氨羧配位剂形成的配合物可以用如下的化学方程式表示:Mn+ + L ⇌ MLn+其中Mn+代表金属离子,L代表氨羧配位剂,MLn+代表金属离子与氨羧配位剂形成的配合物。
配合物稳定常数K的定义如下:K = [MLn+]/([Mn+][L])其中[MLn+]、[Mn+]和[L]分别代表配合物、金属离子和氨羧配位剂的浓度。
配合物稳定常数K的值越大,表示配合物形成的程度越高;反之,K的值越小,表示配合物形成的程度越低。
二、金属离子与氨羧配位剂的配合物稳定常数的影响因素1. 金属离子的电荷:金属离子的电荷越大,与氨羧配位剂形成的配合物稳定常数K越大。
2. 氨羧配位剂的性质:不同的氨羧配位剂有不同的配位能力,影响金属离子与氨羧配位剂形成配合物稳定常数K的大小。
3. 溶剂的性质:不同溶剂对金属离子与氨羧配位剂形成的配合物稳定常数K有不同的影响。
4. 温度:温度的升高通常会使金属离子与氨羧配位剂形成的配合物稳定常数K增大。
三、金属离子与氨羧配位剂的配合物稳定常数的计算方法金属离子与氨羧配位剂的配合物稳定常数可以通过不同的实验方法来测定,如紫外-可见光谱法、电化学法、核磁共振法等。
通过实验测定得到的数据可以计算配合物稳定常数K的值。
还可以通过计算方法来估算配合物稳定常数K的值,常用的计算方法有理论计算、量子化学计算等。
金属离子与氨羧配位剂的配合物稳定常数是描述配合物形成程度的重要物理化学常数,对于理解化学反应和应用化学平衡有着重要的意义。
通过实验测定和计算方法可以得到金属离子与氨羧配位剂的配合物稳定常数的数值,进而更深入地理解金属离子与氨羧配位剂的配合物形成规律。


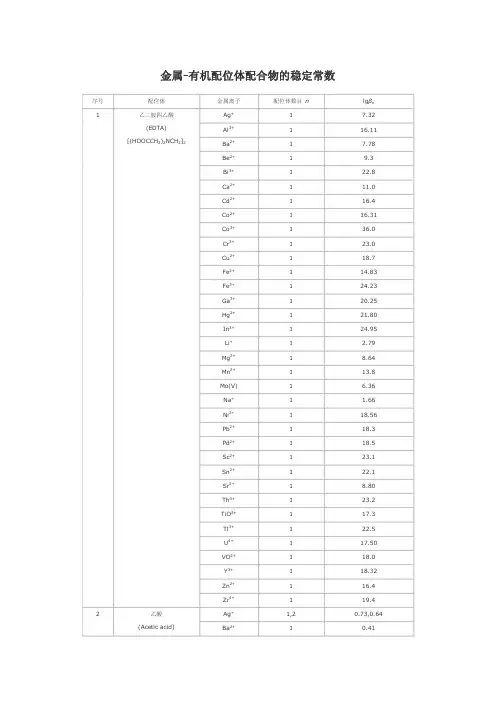
金属有机配位体配合物的稳定常数序号 配位体 金属离子配位体数目 nlg βn Ag + 1 7.32 Al 3+ 1 16.11 Ba 2+ 1 7.78 Be 2+ 1 9.3 Bi 3+ 1 22.8 Ca 2+ 1 11.0 Cd 2+ 1 16.4 Co 2+ 1 16.31 Co 3+ 1 36.0 Cr 3+ 1 23.0 Cu 2+ 1 18.7 Fe 2+ 1 14.83 Fe 3+ 1 24.23 Ga 3+ 1 20.25 Hg 2+ 1 21.80 In 3+ 1 24.95 Li + 1 2.79 Mg 2+ 1 8.64 Mn2+ 1 13.8 Mo(V)1 6.36 Na + 1 1.66 Ni 2+ 1 18.56 Pb 2+ 1 18.3 Pd 2+ 1 18.5 Sc 2+ 1 23.1 Sn 2+ 1 22.1 Sr 2+ 1 8.80 Th 4+ 1 23.2 TiO 2+ 1 17.3 Tl 3+ 1 22.5 U 4+ 1 17.50 VO 2+ 1 18.0 Y 3+ 1 18.32 Zn 2+ 1 16.4 1乙二胺四乙酸 (EDTA)[(HOOCCH 2)2NCH 2]2Zr4+ 1 19.4 Ag + 1,2 0.73,0.64 2 乙酸 (Acetic acid)Ba2+ 10.41Ca 2+ 1 0.6 Cd 2+ 1,2,3 1.5,2.3,2.4 Ce 3+ 1,2,3,4 1.68,2.69,3.13,3.18Co 2+ 1,2 1.5,1.9 Cr 3+ 1,2,3 4.63,7.08,9.60 Cu 2+ (20℃)1,2 2.16,3.20 In 3+1,2,3,4 3.50,5.95,7.90,9.08Mn 2+ 1,2 9.84,2.06 Ni 2+ 1,2 1.12,1.81 Pb 2+ 1,2,3,4 2.52,4.0,6.4,8.5 Sn 2+ 1,2,3 3.3,6.0,7.3 Tl 3+ 1,2,3,46.17,11.28,15.10,18.3Zn2+ 1 1.5 Al 3+ (30℃) 1,2 8.6,15.5 Cd 2+1,2 3.84,6.66 Co 2+ 1,2 5.40,9.54 Cr 2+ 1,2 5.96,11.7 Cu 2+ 1,2 8.27,16.34 Fe 2+ 1,2 5.07,8.67 Fe 3+ 1,2,3 11.4,22.1,26.7Hg 2+ 2 21.5 Mg 2+ 1,2 3.65,6.27 Mn 2+ 1,2 4.24,7.35 Mn 3+ 3 3.86Ni 2+ (20℃) 1,2,3 6.06,10.77,13.09Pb 2+2 6.32 Pd 2+ (30℃)1,2 16.2,27.1 Th 4+1,2,3,4 8.8,16.2,22.5,26.7 Ti 3+ 1,2,3 10.43,18.82,24.90 V 2+ 1,2,3 5.4,10.2,14.7 Zn 2+ (30℃)1,2 4.98,8.81 3 乙酰丙酮 (Acetyl acetone) CH 3COCH 2CH 3Zr4+1,2,3,48.4,16.0,23.2,30.1Ag + 1 2.41 Al 3+ 1,2,3 7.26,13.0,16.3Ba 2+ 1 2.31 Ca 2+ 1 3.0 Cd 2+ 1,2 3.52,5.77 Co 2+ 1,2,3 4.79,6.7,9.7 Cu 2+ 1,2 6.23,10.27 4 草酸 (Oxalic acid) HOOCCOOHFe2+ 1,2,32.9,4.52,5.22Fe 3+ 1,2,3 9.4,16.2,20.2Hg 2+ 1 9.66 Hg 2 2+ 2 6.98 Mg 2+ 1,2 3.43,4.38 Mn 2+ 1,2 3.97,5.80 Mn 3+ 1,2,3 9.98,16.57,19.42 Ni 2+ 1,2,3 5.3,7.64,~8.5 Pb 2+ 1,2 4.91,6.76Sc 3+ 1,2,3,46.86,11.31,14.32,16.70Th 4+ 4 24.48 Zn 2+ 1,2,3 4.89,7.60,8.15 Zr4+ 1,2,3,49.80,17.14,20.86,21.15Ba 2+ 1 0.64 Ca 2+ 1 1.42 Cd 2+ 1 1.70 Co 2+ 1 1.90 Cu 2+ 1,2 3.02,4.85Fe 3+ 1 7.1 Mg 2+ 1 1.37 Mn 2+ 1 1.43 Ni 2+ 1 2.22 Pb 2+ 1,2 2.40,3.80Sc 2+ 1 5.2 Th 4+ 1 5.5 5 乳酸 (Lactic acid) CH 3CHOHCOOHZn2+ 1,2 2.20,3.75 Al 3+ 1 14.11 Cd 2+ 1 5.55 Co 2+ 1,2 6.72,11.42 Cr 2+ 1,2 8.4,15.3 Cu 2+ 1,2 10.60,18.45 Fe 2+ 1,2 6.55,11.25 Mn 2+ 1,2 5.90,9.80 Ni 2+ 1,2 6.95,11.75 Th 4+ 1,2,3,44.25,7.60,10.05,11.60TiO 2+ 1 6.09 V 2+ 1 6.3 6 水杨酸 (Salicylic acid) C 6H 4(OH)COOHZn2+ 1 6.85Al 3+ (0.1mol/L) 1,2,3 13.20,22.83,28.89Be 2+ (0.1mol/L) 1,2 11.71,20.81 7 磺基水杨酸 (5sulfosalicylicacid)Cd 2+ (0.1mol/L)1,216.68,29.08Co 2+ (0.1mol/L) 1,2 6.13,9.82 Cr 3+ (0.1mol/L) 1 9.56 Cu 2+ (0.1mol/L) 1,2 9.52,16.45 Fe 2+ (0.1mol/L) 1,2 5.9,9.9 Fe 3+ (0.1mol/L) 1,2,3 14.64,25.18,32.12Mn 2+ (0.1mol/L) 1,2 5.24,8.24 Ni 2+ (0.1mol/L) 1,2 6.42,10.24 Zn 2+ (0.1mol/L)1,2 6.05,10.65Ba 2+2 1.62 Bi 3+3 8.30 Ca 2+ 1,2 2.98,9.01Cd 2+ 1 2.8 Co 2+ 1 2.1Cu 2+ 1,2,3,43.2,5.11,4.78,6.51Fe 3+ 1 7.49 Hg 2+ 1 7.0 Mg 2+ 2 1.36 Mn 2+ 1 2.49 Ni 2+ 1 2.06 Pb 2+ 1,3 3.78,4.7 Sn 2+ 1 5.2 8 酒石酸 (Tartaric acid) (HOOCCHOH)2Zn2+ 1,2 2.68,8.32 Ba 2+ 1 2.08 Be 2+ 1 3.08 Ca 2+ 1 2.0 Cd 2+ 1 2.2 Co 2+ 1 2.22 Cu 2+ 1 3.33 Fe 3+ 1 7.49 Hg 2+ 2 7.28 Mg 2+ 1 1.20 Mn 2+ 1 2.26 Ni 2+ 1 2.36 Pb 2+ 1 2.8 9 丁二酸(Butanedioic acid) HOOCCH 2CH 2COOHZn2+ 1 1.6 Ag + 1,2 7.4,13.1 Bi 3+ 6 11.9 Cd 2+ 1,2,3,4 0.6,1.6,2.6,4.6 Cu + 3,4 13.0,15.4 10 硫脲 (Thiourea) H 2NC(═S)NH 2Hg2+ 2,3,422.1,24.7,26.8Ag + 1,2 4.70,7.70 Cd 2+ (20℃)1,2,3 5.47,10.09,12.09 Co 2+1,2,3 5.91,10.64,13.94 Co 3+ 1,2,3 18.7,34.9,48.69Cr 2+ 1,2 5.15,9.19 Cu + 2 10.8 Cu 2+ 1,2,3 10.67,20.0,21.0 Fe 2+ 1,2,3 4.34,7.65,9.70 Hg 2+ 1,2 14.3,23.3 Mg 2+ 1 0.37 Mn 2+ 1,2,3 2.73,4.79,5.67 Ni 2+ 1,2,3 7.52,13.84,18.33Pd 2+ 2 26.90 V 2+ 1,2 4.6,7.5 11 乙二胺(Ethyoenediamine) H 2NCH 2CH 2NH 2Zn2+ 1,2,3 5.77,10.83,14.11Ag + 1,2 1.97,4.35 Cd 2+ 1,2,3,4 1.40,1.95,2.27,2.50Co 2+ 1,2 1.14,1.54 Cu 2+ 1,2,3,42.59,4.33,5.93,6.54Fe 2+ 1 0.71 Hg 2+ 1,2,3 5.1,10.0,10.4 Mn 2+ 1,2,3,4 1.92,2.77,3.37,3.50 12 吡啶 (Pyridine) C 5H 5NZn2+ 1,2,3,4 1.41,1.11,1.61,1.93Ag + 1,2 3.41,6.89 Ba 2+ 1 0.77 Ca 2+ 1 1.38 Cd 2+ 1,2 4.74,8.60 Co 2+ 1,2,3 5.23,9.25,10.76 Cu 2+ 1,2,3 8.60,15.54,16.27Fe 2+ (20℃) 1,2 4.3,7.8 Hg 2+1,2 10.3,19.2 Mg 2+ 1,2 3.44,6.46 Mn 2+ 1,2 3.6,6.6 Ni 2+ 1,2,3 6.18,11.14,15.0Pb 2+ 1,2 5.47,8.92 Pd 2+ 1,2 9.12,17.55 13 甘氨酸 (Glycin) H 2NCH 2COOHZn2+ 1,2 5.52,9.96 Cd 2+ 1,2,3 9.00,9.00,16.6014 2甲基8羟基喹啉 (50%二噁烷)Ce3+ 17.71Cu 2+ 1,2 12.48,24.00 Fe 2+ 1,2 8.75,17.10 Mg 2+ 1,2 5.24,9.64 Mn 2+ 1,2 7.44,13.99 Ni 2+ 1,2 9.41,17.76 Pb 2+ 1,2 10.30,18.50 UO2 2+ 1,2 9.4,17.0 Zn 2+ 1,2 9.82,18.72。



配合物稳定常数
Stability Constants of Coordination Compounds
络合反应的平衡常数用配合物稳定常数表示,又称配合物形成常数。
此常数值越大,说明形成的配合物越稳定。
其倒数用来表示配合物的解离程度,称为配合物的不稳定常数。
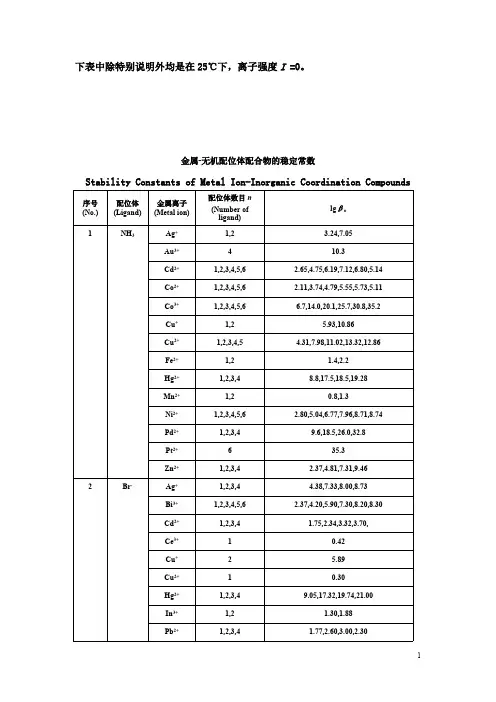
以下表格中,表(1)中除特别说明外是在25℃下,离子强度I =0;表(2)中离子强度都是在有限的范围内,I≈0。
表中βn表示累积稳定常数。
金属-无机配位体配合物的稳定常数
Stability Constants of Metal Ion-Inorganic Coordination Compounds
金属-有机配位体配合物的稳定常数
(表中离子强度都是在有限的范围内,I≈0。
)
Stability Constants of Metal Ion-Organic Coordination Compounds
EDTA的lgαY(H)值
lgαY(H) Values of EDTA
精品文档
精品文档。
溶解度与配位化合物的稳定常数溶解度是指在特定温度下溶液中最大可溶解的物质的量,通常以摩尔溶解度表示。
而配位化合物指的是由中心金属离子与配位体形成的具有特定结构和性质的化合物。
溶解度与配位化合物的稳定常数之间存在一定的关联,本文将通过分析这一关联来探讨它们之间的相互影响。
一、溶解度的影响因素溶解度受溶质与溶剂之间相互作用力的影响,主要与以下因素有关:1. 构成物质的特性:溶质的化学性质、分子结构以及离子半径大小等都会影响其在特定条件下的溶解度。
2. 温度:溶解度随温度的升高而增大,因为在较高温度下,溶质分子具有更大的热运动能力,更易克服溶剂的吸引力而溶解。
3. 压强:对于气体溶解于液体的情况,Henry定律可以描述气体溶解度与压强之间的关系。
溶液中溶解度随压强的增大而增大。
二、配位化合物的稳定常数配位化合物的稳定常数(K)是描述配位反应的平衡性质,定义为配位物稳定形成配合物的速率常数与离解配合物的速率常数之比。
稳定常数越大,配合物的稳定性越强。
1. 配位物与反应物的浓度关系:在一定条件下,稳定常数可以用反应物的浓度比来表示,即K = [配合物]/[反应物]。
浓度比越大,稳定常数越大,表示配合物形成的速率相对较快。
2. 金属离子的价态和配体的性质:配位化合物的稳定性与金属离子的价态和配体的性质密切相关。
通常来说,价态较高的金属离子形成的配合物较稳定。
而配体的性质如配体中的氧原子数量、配体的电荷等因素也会影响配合物的稳定常数。
三、溶解度与配位化合物的关联1. 离解平衡反应与溶解度:对于某些配位化合物在水溶液中的溶解过程,其离解平衡反应与溶解度之间存在关联。
溶解度较大的化合物,在水中离解形成的离子浓度较高;而溶解度较小的化合物,在水中离解形成的离子浓度较低。
2. 配位离解平衡与稳定常数:配位离解平衡反应是指配位物中配体与金属离子之间的配位键断裂。
稳定常数与配位离解平衡常数(Kd)成反比。
稳定常数越大,配合物越稳定,离解平衡越难发生,溶解度越小。
络合物稳定常数一览表络合物稳定常数是指在一定温度下,化合物中金属离子和配体结合形成络合物时,反应达到平衡时的稳定程度。
络合物是指金属离子和一个或多个配位基团形成的化合物,通常以MLn的形式表示,其中M表示金属离子,L表示配位基团,n表示配位基团的数目。
络合物稳定常数通常表示为Kf,它是一个无量纲的数值。
它的大小取决于金属离子和配位基团之间的亲和力以及它们结合的平衡。
络合物稳定常数越大,表示金属离子和配位基团形成的络合物更为稳定。
以下是一些常见的金属离子与配位基团形成的络合物的稳定常数及其相关参考内容:1. 铁离子与1,10-邻菲罗啉络合物稳定常数-Kf = 10^20.9参考内容:Inorganic Chemistry, Fourth Edition, Catherine Housecroft and Alan G. Sharpe.2. 铜离子与乙二胺四乙酸络合物稳定常数-Kf = 10^18.7参考内容:Chemistry: The Central Science, Twelfth Edition, T. L. Brown, et al.3. 镍离子与乙二胺四乙酸络合物稳定常数-Kf = 10^16.7参考内容:Advanced Inorganic Chemistry, Sixth Edition, F. A. Cotton and G. Wilkinson.4. 钙离子与乙二胺四乙酸络合物稳定常数-Kf = 10^10.6参考内容:Chemistry: The Molecular Nature of Matter and Change, Sixth Edition, M. S. Silberberg.5. 镧系金属离子与EDTA络合物稳定常数-Kf = 10^18-27参考内容:Inorganic Chemistry, Fifth Edition, Gary L. Miessler, et al.6. 银离子与氰化物络合物稳定常数-Kf = 10^16.5参考内容:Chemistry, Fifth Edition, John E. McMurry and Robert C. Fay.络合物稳定常数对于理解金属离子和配位基团之间的相互作用非常重要。