溴酸钾-溴化钾标准溶液
- 格式:doc
- 大小:19.50 KB
- 文档页数:1

溴酸钾标准溶液的配制与标定配制:c(1/6KBrO3)=0.1mol/l称取3g溴酸钾,溶于1000ml水中,摇匀标定方法及计算同溴标准溶液的标定及计算碘标准溶液的配制与标定配制:c(1/2b)=0.1mol/l称取13g碘及25g碘化钾,溶于100ml水中,稀释至1000ml,摇匀,保存于棕色具塞瓶中。
称取0.15g预先在硫酸干燥器中干燥至恒重的基准三氧化二砷,称准至0.0001g。
置于碘量瓶中,加4ml氢氧化钠溶液[C(NaOH)=1.0mol/l]溶解,加50ml水,加2 滴酚酞指示剂,用硫酸溶液[C(1/2H2SO4)=1.0mol/l]中和,加3g碳酸氢钠及3ml5g/l 淀粉指示剂,用配好的碘溶液c(1/212)=0.1mol/l滴定至溶液呈浅蓝色。
同时作空白试验。
计算:C(1/2I2)=硫酸标准溶液配制与标定配制:量取规定体积的硫酸,缓缓注入1000mL水中,冷却,摇匀称取上述规定定量的于270-300 C灼烧至恒重的基准无水碳酸钠,称准至0.0001g。
溶于50ml水中,加10滴溴甲酚绿-甲基红混合指示剂,用配好的硫酸溶液滴定至溶液由绿色变为暗红色,煮沸2mi n,冷却后继续滴定至溶液再呈暗红色。
同样做空白试验,计算:C(1/2H2SO4)=m/[(V1-V2 ) *0.05299)]V1 ------- 硫酸之用量,mlV2 ------- 空白试验硫酸之用量,ml0.05299——于1.0000ml硫酸标准溶液相当的以克表示的无水碳酸钠的质量比较方法:量取30.00-35.00ml上述规定浓度的氢氧化钠标准溶液,加50ml无二氧化碳的水及2滴酚酞指示剂(10g/l),用配好的硫酸溶液滴定,近终点时加热至80度,继续滴定至溶液呈粉红色。
计算:C(1/2H2SO4)=V1*C1/VV1 ------- 氢氧化钠标准溶液之用量,mlV --------- 硫酸之用量,mlC1 --------- 氢氧化钠标准溶液之物质的量浓度,mol/l氢氧化钠标准溶液的配制与标定配制:称取100g氢氧化钠,溶于100ml水中,摇匀,注入聚乙烯容器,密闭放置至溶液清亮,用塑料管虹吸下述规定体积的上层清液,注入1000ml无二氧化碳的水称取上述规定的量于105-110C烘至恒重的基准邻苯二甲酸氢钾,称准至0.0001g。

【溴酸钾-溴化钾的性质】溴酸钾:溴酸钾是无色三角晶体,比重3.27 ,熔点370゜C ,溶于水,用作氧化剂和分析试剂。
溴化钾:溴化钾是白色稍具潮解性的晶体,比重2.75,熔点730゜C ,溶于水。
【配制溴酸钾-溴化钾溶液的方法】(以配制0.1mol.L-1溴酸钾-溴化钾标准滴定溶液为例)用台秤称取1.5g溴酸钾和12.5g溴化钾,将所称取溴酸钾和溴化钾倒入1000ml烧杯中,分别加入蒸馏水使溴酸钾和溴化钾完全溶解,再稀释至500ml,搅拌均匀,把配制好的溴酸钾-溴化钾溶液移入棕色试剂瓶中,贴上标签,待标定。
【溴酸钾-溴化钾标准滴定溶液浓度的标定原理】溴酸钾-溴化钾标准溶液的浓度可用碘量法标定。
在酸性溶液中,BrO3- + 6I - + 6H+ = Br- + 3I2 + 3H2O析出I2可用硫代硫酸钠标准溶液标定,用淀粉作指示剂,当溶液蓝色消失即为终点。
I2 + 2Na2S2O3 = Na2S4O6 + 2NaI【溴酸钾-溴化钾标准滴定溶液物质的量浓度结果计算】其中:C ——待标定溴酸钾-溴化钾标准滴定溶液的浓度mol.L-1C1 ---- 硫代硫酸钠标准滴定溶液的浓度mol.L-1V1 ---- 滴定所耗Na2S2O3的体积mlV2 ---- 空白试验所耗Na2S2O3的体积mlV ----- 量取溴酸钾-溴化钾标准滴定溶液的体积ml【溴酸钾-溴化钾标准滴定溶液的应用】1.溴酸钾法主要用于测苯酚的含量。
2.溴酸钾法主要用于测定Sb3+,在酸性溶液中,以甲基橙作指示剂,可用溴酸钾-溴化钾标准滴定溶液直接滴定Sb3+ :由于溴酸钾法有如下缺点: ①溴酸钾滴定液的标定比较麻烦; ②标定及测定含量时均需控制温度在18~25℃; ③标定中所用的碘化钾可能含有微量碘酸盐影响标定结果; ④滴定中指示剂在滴定前加入,会使终点提前达到。
由于溴酸钾法有如上缺点标题滴定液附录序号附录ⅩⅤ内容全文 F. 滴定液乙二胺四醋酸二钠滴定液(0.05mol/L)C10H14N2Na2O8·2H2O=372.2418.61g→1000ml【配制】取乙二胺四醋酸二钠19g,加适量的水使溶解成1000ml,摇匀。
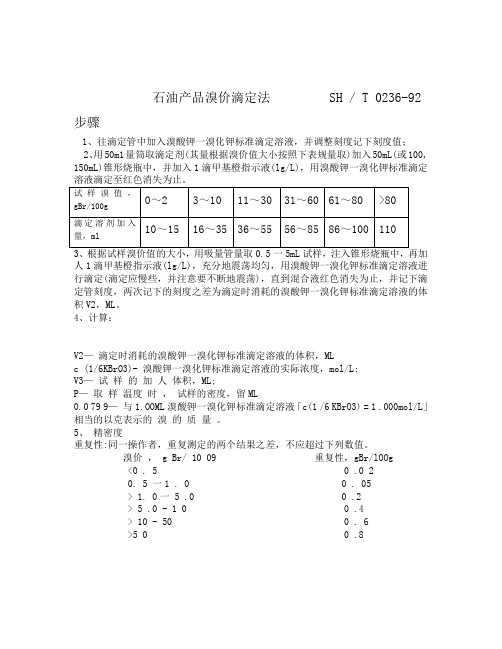
石油产品溴价滴定法 SH / T 0236-92 步骤1、往滴定管中加入溴酸钾一溴化钾标准滴定溶液,并调整刻度记下刻度值;2、用50m1量筒取滴定剂(其量根据溴价值大小按照下表规量取)加入50mL(或100,150mL)锥形烧瓶中,并加入1滴甲基橙指示液(lg/L),用溴酸钾一溴化钾标准滴定溶液滴定至红色消失为止。
试样溴值,0~2 3~10 11~30 31~60 61~80 >80gBr/100g滴定溶剂加入10~15 16~35 36~55 56~85 86~100 110量,ml3、根据试样溴价值的大小,用吸量管量取0.5一5mL试样,注入锥形烧瓶中,再加人1滴甲基橙指示液(lg/L),充分地震荡均匀,用溴酸钾一溴化钾标准滴定溶液进行滴定(滴定应慢些,并注意要不断地震荡),直到混合液红色消失为止,并记下滴定管刻度,两次记下的刻度之差为滴定时消耗的溴酸钾一溴化钾标准滴定溶液的体积V2,ML。
4、计算:V2—滴定时消耗的溴酸钾一溴化钾标准滴定溶液的体积,MLc (1/6KBrO3)- 溴酸钾一溴化钾标准滴定溶液的实际浓度,mol/L;V3—试样的加人体积,ML;P—取样温度时,试样的密度,留ML0.0 79 9—与1.OOML溴酸钾一溴化钾标准滴定溶液「c(1 /6 KBrO3) = 1 .000mol/L」相当的以克表示的溴的质量。
5、精密度重复性:同一操作者,重复测定的两个结果之差,不应超过下列数值。
溴价, g Br/ 10 09 重复性,gBr/lOOg<0 . 5 0 .0 20. 5 一1 . 0 0 . 05> 1. 0一 5 .0 0 .2> 5 .0 - 1 0 0 .4> 10 - 50 0 . 6>5 0 0 .8。

浅谈溴酸钾—溴化钾标准溶液的稳定性作者:温新红来源:《中国化工贸易·中旬刊》2018年第02期摘要:实验室使用标准溶液的准确与否,将直接影响分析结果的准确性。
溴酸钾-溴化钾溶液比较稳定,其在酸性环境中会生成易挥发的溴单质。
该溶液虽然稳定,但是在存放过程中发现偶尔会有絮状沉淀,对溶液的稳定性造成了威胁。
根据实验方法,通过对溶液配制方法、试剂纯度、溶剂选择、储存环境等因素进行探讨,得到溴酸钾-溴化钾标准溶液稳定的条件和稳定的时间节点。
关键词:溴酸钾-溴化钾;絮状沉淀;稳定性0 前言在溶液存放过程中,溴酸钾-溴化钾标准溶液偶尔发现有絮状沉淀,标准溶液管理规定中对溶液外观有明确要求:无变色无沉淀。
车间现用的有四种浓度的溴酸钾-溴化钾标准溶液,分别是:石油产品溴值测定法(SH/T 0236-1992(2004))(0.1和0.5mol/L)、石油馏分及工业脂肪族烯烃溴值的测定电位滴定法(GB/T 11135-2013)(0.25 mol/L)、石油烃类溴指数测定法(电位滴定法)(GB/T 11136-89(2004))(0.05 mol/L)。
通过观察,0.5mol/L和0.25mol/L的溴酸钾-溴化钾标准溶液出现絮状沉淀的概率偏高,溶液储存温度在15-25度之间,溶液存储环境基本是一个稳定的状态,是什么因素影响了溶液的稳定性呢?而且还不是固定出现,偶尔会出现。
这种絮状沉淀对溶液浓度有没有影响,如标准溶液的浓度发生变化直接影响分析数据的准确度,必须查找原因并予以消除,从准确度和外观上符合对标准溶液的要求。
1 配制方法表1-1中对四种浓度的溴酸钾-溴化钾标准溶液配制过程进行比较:由表1-1可以看出,在配制过程中试剂的用量基本保持一致,但石油产品溴值测定法中使用的溶剂是煮沸后冷却的蒸馏水配制,并且需要过滤,说明溴酸钾-溴化钾溶液在配制过程中有干扰存在。
将水煮沸冷却的目的有去除二氧化碳和微生物的作用,过滤是为了除去溶液中的固体杂质,由此需对试剂纯度进行考量。

溴酸钾容量法测定砷含量砷的测定溴酸钾容量法测定范围:0.10~2.00%1、方法提要试样用硝酸、氯酸钾分解。
在6mol/L HCl溶液中,以溴化钾为催化剂,用硫酸肼将五价砷还原成三价砷,用蒸馏法将三氯化砷与其它元素分离。
三氯化砷用水吸收后,以甲基橙作指示剂,用溴酸钾标准溶液滴定砷。
2、试剂与仪器溴化钾硫酸肼氯酸钾盐酸硝酸硫酸:1+1甲基橙指示剂:0.1%砷标准溶液:称取0.264g三氯化二砷(预先在100~105℃烘1h,置于干燥器中冷至室温)置于250ml烧杯中,加10ml氢氧化钠溶液(20%),低温加热至完全溶解,加50ml水,2滴酚酞(0.1%乙醇溶液),用盐酸(1+1)中和至红色刚褪并过量2滴,移入1000ml溶量瓶中,用水稀至刻度,混匀。
此溶液1ml 含砷200μg。
溴酸钾标准溶液:c(1/6KBrO3)=0.005mol/L:称取0.74g溴酸钾,3.7g溴化钾置于250ml烧杯中,加少量水,加热溶解,稍冷,移入试剂瓶中,用水稀至5000ml,混匀。
标定:移取三份20.00ml砷标准溶液分别置于250ml烧杯中,用水稀至100 ml,加入15ml盐酸,加热至40~60℃,加入2滴甲基橙指示剂,用溴酸钾标准溶液滴定至红色消失为终点。
随同标定做空白。
按下式计算T=C×V2/(V1-V0)×10-6式中:T---与1.00ml溴酸钾标准溶液相当的以克表示的砷的质量;C---砷标准溶液的浓度;μg/ml;V1--消耗溴酸钾标准溶液的体积ml;V2—所取砷标准溶液的体积ml;V0---空白消耗溴酸钾标准溶液的体积ml;三次标定结果的极差值应不大于0.000001g/ml.3、分析步骤称取试样0.5000g(如果砷含量大于1.00,则称取0.1000克),置于250ml 烧杯中,加入10--15ml硝酸,分次加入0.30---0.50克氯酸钾,至试样完全溶解,取下,稍冷,用水吹洗杯壁,加5ml硫酸(1+1),加热至冒浓烟,取下,稍冷。

挥发酚的测定根据酚类能否与水蒸气一起蒸出,分为挥发酚和不挥发酚。
挥发酚通常是指沸点在230℃以下的酚类,通常属一元酚。
1方法选择当水样中挥发酚浓度低于0.5mg/L时采用4-氨基安替比林萃取光度法,浓度高于0.5mg/L时采用4-氨基安替比林直接光度法,高浓度含酚废水可采用溴化容量法。
2 水样的保存用玻璃仪器采样。
水样采集后应及时检查有无氧化剂存在。
如有发现,必要时加入过量硫酸亚铁,立即加磷酸酸化至PH 4.0,并加适量硫酸铜(1g/L)以抑制微生物对酚类的生物氧化作用,同时应将样品冷藏(5-10℃),在采集后24h内进行测定。
3 预蒸馏水样中挥发酚经过蒸馏以后,可以消除颜色、浑浊度等干扰。
但当水样中含氧化剂、油、硫化物等干扰物时,应在蒸馏前先做适当的预处理。
3.1干扰物质的消除3.1.1氧化剂(如游离氯):当水样经酸化后滴于碘化钾—淀粉试纸上出现蓝色时,说明存在氧化剂。
遇此情况,可加入过量的硫酸亚铁。
3.1.2 硫化物:水样中含有少量硫化物时,用磷酸把水样PH调至4.0(用甲基橙或PH 计指示),加入适量硫酸铜(1g/L)使生成硫化铜而被除去;当含量较高时,则应将磷酸酸化的水样置于通风柜内进行搅拌曝气,使其生成硫化氢逸出。
3.1.3 油类:将水样移入分液漏斗中,静置分离出浮油后,加粒状氢氧化钠调节至PH12~12.5。
用四氯化碳萃取(每升样品用40mL四氯化碳萃取二次),弃去四氯化碳层,萃取后的水样移入烧杯中,在通风柜中于水浴上加温以除去残留的四氯化碳,用磷酸调节至PH4.0。
当石油类浓度较高时,用正己烷处理较四氯化碳为佳。
3.1.4 甲醛、亚硫酸钠等有机物或无机还原性物质:可分取适量水样于分液漏斗中,加硫酸溶液使水样呈酸性,分次加入50mL,30mL,30mL乙醚或二氯甲烷萃取酚,合并二氯甲烷或乙醚层于另一分液漏斗中,分次加入4mL,3mL,3mL10%氢氧化钠进行反萃取,使酚类转入氢氧化钠溶液中。
室内空气臭氧的测定靛蓝二磺酸钠分光光度法1. 原理空气中的臭氧在磷酸盐缓冲溶液条件下,是吸收液中蓝色的电缆二磺酸钠褪色,生成靛红二磺酸钠。
根据颜色减弱的程度比色定量。
2. 试剂和材料注:本法中所用试剂除特别说明外均为分析纯,试验用水为重蒸馏水。
2.1 硫酸溶液(1+6)。
2.2 淀粉指示剂(2.0g/L)。
2.3 硫代硫酸钠标准溶液[c(Na2S2O3)=0.0100mol/L]。
2.4 溴酸钾标准溶液[c(1/6KBrO3)=0.1000mol/L]:准确称取1.3918g溴酸钾(优级纯,经180℃烘2h)溶于水,稀释至500ml。
2.5 溴酸钾-溴酸钾标准溶液[c(1/6KBrO3)=0.0100mol/L]:吸取10.00ml溴酸钾标准溶液于100ml容量瓶中,加入1.0g溴化钾,用水稀释至刻度。
2.6 磷酸盐缓冲溶液[c(KH2PO4-Na2HPO4)=0.050mol/L]:称6.80g磷酸二氢钾(KH2PO4)、7.10g无水磷酸氢二钠(Na2HPO4)溶于水,稀释至1L,此溶液ph=6.8。
2.7 靛蓝二磺酸钠标准贮备液:称取0.25g靛蓝二磺酸钠溶于水,稀释至500ml 棕色容量瓶,在室温处存放24h后标定。
标定后的溶液在冰箱内可稳定1个月。
标定方法:准确吸取20.00ml靛蓝二磺酸钠贮备液于250ml碘量瓶中,加入20.00ml溴酸钾-溴酸钾溶液,再加入50ml水。
在(19.0±0.5)℃水浴中放置至溶液温度与水浴温度平衡时加入5.0ml硫酸溶液,立即盖塞混匀并开始计时,水浴中暗处放置30min。
加入1.0g碘化钾,立即盖塞轻轻摇匀至溶解,暗处放置5min,用硫代硫酸钠溶液滴定至棕色刚好褪去呈淡黄色,加入5ml淀粉指示剂,继续滴定至蓝色消褪,终点为亮黄色。
重复上述滴定,2次误差应小于0.05ml。
按式(1)计算贮备液中臭氧浓度。
ρ(O3)=[(c1V1-c2V2)×M]/(V3×4)×1000(1)式中:ρ—臭氧的质量浓度,单位为微克每毫升(µg/ml);c1—溴酸钾-溴化钾标准溶液的浓度,单位为摩尔每升(mol/L);V1—加入溴酸钾-溴化钾标准溶液的体积,单位为毫升(ml);c2—滴定时所用硫代硫酸钠标准溶液的浓度,单位为摩尔每升(mol/L);V2—滴定时所用硫代硫酸钠标准溶液的体积,单位为毫升(ml);M—臭氧的摩尔质量,数值为48,单位为克每摩尔(g/mol);V3—靛蓝二磺酸钠贮备液吸取量,单位为毫升(ml);4—化学计量因数。
石油产品溴值测定法SH/0236-92代替SY2123-77(88)1.主题内容与适应范围本标准规定了测定试样溴值的方法。
本标准适用于石油产品。
2.方法概要将试样溶解于滴定溶剂中,以甲基橙为指示剂,用溴酸钾-溴化钾标准滴定溶液滴定至红色消失为止。
用100g试样所消耗的溴的克数表示溴值。
3.仪器3.1锥形烧瓶:50,100,150mL。
3.2吸量管:2,5,10mL。
3.3微量滴定管:2.5ml,分度为0.02mL。
3.4量筒:50mL。
3.5碘量瓶:250mL。
3.6容量瓶:1L。
4.试剂4.1溴酸钾:分析纯。
4.2溴化钾:分析纯。
4.3硫代硫酸钠:分析纯,配成c(Na2S2O3)为0.1和0.5mol/L标准滴定溶液。
4.4冰乙酸:分析纯。
4.5硫酸:分析纯,配成26%(m/m)溶液。
4.6盐酸:分析纯,配成19%(m/m)溶液。
4.7甲醇:分析纯。
4.895%乙醇:分析纯。
4.9四氯化碳:分析纯。
4.10氯化汞:分析纯,配成100g/L指示液。
4.11甲基橙指示剂:配成1g/L指示液。
4.12淀粉:新配制的5g/L指示液。
5准备工作5.1滴定溶剂的配制用冰乙酸、硫酸溶液(26%(m/m))、甲醇、四氯化碳、氯化汞乙醇溶液(100g/L)按体积比73:3:7:15:2混合均匀。
5.2溴酸钾-溴化钾标准滴定溶液的配制和标定。
5.2.1c(1/6KBrO3)=0.1mol/L溴酸钾-溴化钾标准滴定溶液5.2.1.1配制:称取3g固体溴酸钾和25g溴化钾,均放入1L容量瓶中,用经煮沸后冷却的蒸馏水稀释至刻度。
充分的震荡,待全部溶解后,过滤于棕色瓶中,摇匀。
5.2.1.2标定:用吸量管取上述配制的溶液10mL于碘量瓶中,加入2g碘量瓶和5 mL盐酸溶液(19%(m/m)),摇匀,盖好塞子,并用水封闭,然后加入25mL水稀释。
用c(Na2S2O4)=0.1mol/L硫代硫酸钠标准滴定溶液滴定至浅黄色时,加入1ml淀粉指示剂(5g/L),继续滴定到溶液无色为止。
氢氧化钠标准溶液配制与标定一、配制:将氢氧化钠配成饱和溶液,注入塑料桶中密闭放置至溶液清亮,使用前以塑料管虹吸上层清液。
浓度氢氧化钠饱和溶液注入不含CO2的水0.1mol/L量取5ml1000中摇匀0.2mol/L量取10ml1000中摇匀0.5mol/L量取26ml1000中摇匀1.0mol/L量取52ml1000中摇匀二、标定:1、原理: KHC8H4O4+NOH→KNaC8H4O4+H2O酸式酚酞碱式酚酞HIn→In-+H+(无色)(红色)酚酞为一有机弱酸,在酸性溶液中为无色,当碱色离子增加到一定浓度时,溶液即呈粉红色。
2、仪器:滴定管50ml;三角瓶250ml。
3、标定过程0.1mol/LNOH标准溶液称取0.4-0.6克;0.2mol/L称1-1.2克;0.5mol/L称取3克于105-110℃烘至恒重的苯二甲酸氢钾,称准至0.0002克,分别溶于50ml;80ml不含二氧化碳水中,加2滴1%酚酞指示剂,用配好的待标定溶液至溶液呈粉红色与标准色相同。
同时作空白试验。
4、计算:C(NaOH)=m / (V1-V2)*0.2042C(NaOH)---氢氧化钠溶液浓度 m——苯二甲酸氢钾之质量(克)V1——氢氧化钠溶液用量(毫升) V2——空白氢氧化钠溶液用量(毫升)0.2042——与1.000mol/LNOH标准溶相当的以克表示的当量苯二甲酸氢钾之质量5、注意事项:1、为使标定的浓度准确,标定后应用相应浓度盐酸对标。
2、液溶有效期2个月。
3、氢氧化钠饱和溶液之配制:于1000硬质容器中,加70毫升水,逐渐加入700克氢氧化钠。
随加随搅拌,使溶解完全冷却后移入盛氢氧化钠饱和液之试药瓶中,以胶塞密塞,静置7天以上,使含之碳酸钠沉淀完全。
取澄清之氢氧化钠饱和液少1.1.配制 C(1/2Br2)=0.1 mol/L 称取3克溴酸钾及25克溴化钾,于1000ml水中,摇均。
1.2. 标定量取35.00ml--40.00ml配置好的溴溶液,置于碘量瓶中,溶于25毫升水,加2克碘化钾及5毫升盐酸溶液(20%),摇均,于暗处放置5分钟,加150毫升水(15℃--20℃)用0.1mol/L硫代硫酸钠标准滴定液滴定,近终点时加2毫升淀粉指示液(10g/L),继续滴定至溶液蓝色消失。