江苏恒瑞医药股份有限公司关于获得美国FDA批准文号的公告
- 格式:pdf
- 大小:140.96 KB
- 文档页数:2


首仿药系列:1、恒瑞医药(600276)奥沙利柏、多西他赛、伊利替康;2、恩华医药(002262)齐拉西酮,原研厂家辉瑞;3、白云山(000522)福泰(仿达菲);4、海药(000566)紫杉醇注射液、头孢西丁钠;5、信立泰(002294)泰嘉(硫酸氢氯吡格雷);6、医药(601607)仿达菲;7、海正药业(600267)达菲中间体;8、堂(600085)3个仿制品种已进入审批生产程序;9、双鹤药业(600062)2009年3月27日正式推出了公司最新仿制药研发成果—“冠爽通用名:匹伐钙”;10、高新(000661)艾塞那肽产品在国首家通过国家食品药品监督管理局的审批,该药被国际糖尿病专家列为四大潜力药物之首;11、康芝药业(300086)瑞芝清(尼美利颗粒)。
独家中药系列:1、白药(000538)白药系列,国家绝密配方,国家一类中药保护品种;2、片子癀(600436)片子癀系列,国家绝密配方,国家一类中药保护品种;3、沃华医药(002107)心可舒片,国家中药保护品种;4、东阿阿胶(000423)阿胶系列,国家首批非物质文化遗产扩展项目名录;5、精华制药(002349)王氏保赤丸、季德胜蛇药片,国家中药品种;6、中恒集团(600252)血栓通注射液;7、千金药业(600479)妇科千金片;8、中新药业(600329)速效救心丸,国家级中药品种;9、药业(600332)消渴丸;10、马应龙(600993)麝香痔疮膏;11、独一味(002219)独一味系列;12、金陵药业(000919)脉络宁注射液;13、天士力(600535)复方丹参滴丸;14、华润三九(000999)999感冒灵、皮炎平、正天丸、胃泰,华蟾注射液,国家配;15、九芝堂(000989)驴胶补血冲剂、乙肝宁冲剂,国家二级中药保护品种。
赤丹退黄颗粒,国家配方;16、堂(600085)六味地黄丸;17、太极集团(600129)急支糖浆;18、桐君阁(000590)桂枝合剂、四君子合剂、驱虫消食片,国家中药保护品种;19、海药(000566)枫蓼肠胃康颗粒剂,国家中药保护品种;20、嘉应制药(002198)双料喉风散;21、三金(002275)三金片,西瓜霜系列;22、奇正藏药(002287)奇正消痛贴膏,国家中药保护品种,国家品种;23、药业(600211)诺迪康系列;24、羚锐制药(600285)通络去痛膏、壮骨麝香止痛膏;25、美罗药业(600297)伤科接骨片、鱼鳞病片、珠珀安神丹,国家中药保护品种;26、亚宝药业(600351)丁桂脐贴;27、康缘药业(600557)热毒宁注射液、痛安注射液;28、康恩贝(600572)可达灵,国家中药保护独家品种。

恒瑞医药:市场对“卡培他滨”预期过高王志球【期刊名称】《股市动态分析》【年(卷),期】2013(000)052【总页数】2页(P58-59)【作者】王志球【作者单位】【正文语种】中文2009年,信立泰上市,市场为之沸腾,半年之内涨幅超过3倍。
市场狂热的背后逻辑是信立泰独家拥有重磅仿制药硫酸氢氯吡格雷(俗称泰嘉),与原研药厂赛诺菲垄断国内市场。
现在,投资者憧憬着这一幕在恒瑞医药(600276)身上重演。
公司一直以来都是国内医药行业领头羊,日前再出利好:国家食药监总局的信息显示卡培他滨即将获批,而公司也做好了产品生产与市场投放的准备,有望成为国内首仿,快速分食原研药厂罗氏的市场。
受此消息剌激,公司在二级市场上的股价自6月底以来持续走强,涨幅超过50%,近一月涨幅超20%,居医药行业前列。
然而,《股市动态分析》周刊记者发现,由于泰嘉与卡培他滨时空背景迥异,两者对公司的业绩的催化作用完全不可同日而语。
一个不可忽视的典型事实是,泰嘉在上市多年后直至现在未遇到国内药企的竞争,但卡培他滨可能会在未来几年就会陷入“诸侯混战”的局面。
而且,该药几个亿的销售增长相对公司营业收入达到60亿的体量来讲,杠杆效应十分有限。
换言之,市场对卡培他滨的预期明显过高。
卡培他滨是原研药厂罗氏的重磅药卡培他滨由瑞士罗氏原研,1998年9月获得美国FDA批准入市,用于治疗对紫杉醇和多柔比星等蒽环类药物化疗无效的晚期原发性或转移性乳腺癌的进一步治疗,2001年FDA又批准卡培他滨用于转移性结直肠癌的治疗,目前已广泛应用于乳腺癌、直肠癌、结肠癌、肝癌、胃癌、食道癌、宫颈癌、胰腺癌等癌症的单药或联合临床治疗,具备无细胞毒性、疗效好、安全性高、口服用药方便等优良特性。
得益于此,卡培他滨在全球市场增长较快(参见图1)。
就国内市场来说,卡培他滨于2004年进入国家医保目录乙类(限晚期乳腺癌、大肠癌),2009年医保目录解除了适应症限制。
数据显示,2012年,卡培他滨全球销售收入达到16亿美元左右,国内医院终端规模超过20亿元,同比增长15%以上,是国内抗肿瘤药销售规模第5大品种,罗氏也籍此成为中国肿瘤药市场第二大药企。

国家药监局批准富马酸泰吉利定注射液上市
佚名
【期刊名称】《中国处方药》
【年(卷),期】2024(22)4
【摘要】近日,国家药品监督管理局批准江苏恒瑞医药股份有限公司申报的1类创新药富马酸泰吉利定注射液上市,适用于腹部手术后中重度疼痛。
此次获批是基于恒瑞医药进行的SHR8554-301研究所取得的积极结果。
SHR8554-301是一项Ⅲ期临床研究,旨在评估富马酸泰吉利定注射液在腹部手术后镇痛中的有效性和安全性。
研究主要疗效指标包括在开始输注负荷剂量试验药物后24 h内静息状态下疼痛强度差异的时间加权和(SPID24)。
【总页数】1页(PI0001-I0001)
【正文语种】中文
【中图分类】F42
【相关文献】
1.国家药监局批准佩索利单抗注射液上市
2.国家药监局附条件批准伊基奥仑赛注射液上市
3.国家药监局批准托莱西单抗注射液上市
4.国家药监局批准仑卡奈单抗注射液上市
5.国家药监局附条件批准纳鲁索拜单抗注射液上市
因版权原因,仅展示原文概要,查看原文内容请购买。

2019年终惊喜:江苏恒瑞“甲苯磺酸瑞马唑仑”获批上市!展开全文2019年12月27日,江苏恒瑞化药1.1类新药品种“甲苯磺酸瑞马唑仑”,历经近10年时间开发,终获批上市!国内精麻市场增添又一重磅新药,患者再添又一重要临床用药选择。
图1:甲苯磺酸瑞马唑仑~获批上市讯息甲苯磺酸瑞马唑仑简介药渡数据收录,瑞马唑仑(GSK公司设计/Paion公司开发),为一种短效GABAa受体激动剂,结构属苯二氮卓类药物;而甲苯磺酸瑞马唑仑,由江苏恒瑞开发,是瑞马唑仑的盐型,相比瑞马唑仑具有更高的稳定性;本次获批的适应症为常规胃镜检查的镇静。
2013年4月,甲苯磺酸瑞马唑仑获得中国化药1.1类临床批件;2018年4月,CFDA将此药纳入优先审评(第28批);2019年6月,在中国的NDA申请获CDE承办。
PS:国内主要竞品,宜昌人福的“苯磺酸瑞马唑仑”,已于2018年11月进入到NDA阶段(早于恒瑞)。
图2:甲苯磺酸瑞马唑仑化学结构头号竞品~苯磺酸瑞马唑仑上述“苯磺酸瑞马唑仑”,在中国的研发权利授权给宜昌人福药业(人福医药子公司),韩国地区研发权利授权给Hana Pharm,加拿大的研发权利授权给PENDOPHARM,俄罗斯、土耳其、中东和北非的研发权利授权给R-Pharma;为恒瑞甲苯磺酸瑞马唑仑的头号竞品。
且,注册时间、优先审批时间、进入NDA时间,均早于恒瑞。
可以说,对于苯磺酸瑞马唑仑和甲苯磺酸瑞马唑仑这两个品种,只要有一方的新闻出现,另一方必被提及!图3:两个盐型的化学结构瑞马唑仑的临床数据瑞马唑仑的适用范围非常广泛,包括:1)门诊操作性检查前单次给药镇静;2)操作时追加给药镇静;3)和阿片类药物联合应用作为静脉全麻药,用于诱导和维持;4)ICU镇静。
在美国进行的Ⅰ、Ⅱ期临床试验中,瑞马唑仑对操作性镇静表现出较好的安全性和有效性。
与目前临床常用镇静麻醉药咪达唑仑和丙泊酚不同,瑞马唑仑不经过器官代谢,其代谢产物也无活性。

证券代码:600276证券简称:恒瑞医药公告编号:2020-102江苏恒瑞医药股份有限公司关于许可韩国HLB Life Science公司在韩国开发和销售马来酸吡咯替尼片的公告本公司董事会及全体董事保证本公告内容不存在任何虚假记载、误导性陈述或者重大遗漏,并对其内容的真实性、准确性和完整性承担个别及连带责任。
江苏恒瑞医药股份有限公司(以下简称“恒瑞”或“公司”)与韩国HLB Life Science Co., Ltd.公司(以下简称“HLB-LS公司”)达成协议,将具有自主知识产权的抗肿瘤药品马来酸吡咯替尼片(以下简称“吡咯替尼”)项目有偿许可给韩国HLB-LS公司。
一、许可产品基本信息吡咯替尼为恒瑞自主研发且具有知识产权的口服表皮生长因子受体(EGFR)/人表皮生长因子受体2(HER2)/人表皮生长因子受体4(HER4)酪氨酸激酶抑制剂。
2017年7月公司向江苏省食品药品监督管理局提交药品注册申请并获受理。
2018年8月吡咯替尼在中国有条件批准上市,适应症为“联合卡培他滨,适用于治疗表皮生长因子受体2(HER2)阳性、既往未接受或接受过曲妥珠单抗的晚期或转移性乳腺癌患者”。
使用本品前患者应接受过蒽环类或紫杉类化疗。
2020年7月,吡咯替尼修订说明书的补充申请获批,吡咯替尼联合卡培他滨,适用于治疗表皮生长因子受体2(HER2)阳性、接受过曲妥珠单抗的复发或转移性乳腺癌患者的适应症转为完全批准。
截至目前,该产品已投入研发费用约为84,363万元人民币。
二、同类药品市场情况经查询,国外已上市的同类产品有Tykerb®(lapatinib)、Gilotrif®(afatinib)Nerlynx®(neratinib)、Vizimpro®(dacomitinib)和Tukysa®(tucatinib)。
Tykerb®由GlaxoSmithKline公司开发,最早于2007年3月获美国食品药品监督管理局批准,规格为250mg/片,国内已进口上市。

米内网专稿(研究员吴俊杰)8月24日,先声药业在其官网公布,其自主研发的新药艾拉莫德片(商品名:艾得辛)正式获得国家食品药品监督管理局(S FDA)国家一类新药证书及药品注册批文。
批准文号为国药准字H20110084,剂型为片剂,规格25mg,先声药业同时获得艾拉莫德的原料药批文。
据介绍,艾得辛是全球第一个上市的艾拉莫德制剂,也是一个全新结构类型的DMARDS(Disease Modifying Anti-rheumatic Drugs,疾病修饰抗风湿药)药物,其主要适应症为活动性类风湿性关节炎,可显著改善类风湿性关节炎患者的疾病症状和炎症指标,减轻患者的痛苦。
从米内网-化学药临床用药竞争格局了解到,我国治疗类风湿性关节炎药物主要有氨基葡萄糖、鹿瓜多肽、氟比洛芬、塞来昔布等,市场格局如下图。
今年以来,有多个一类新药获批,相关情况如下表:
药名公司详情
盐酸埃克替尼片贝达药业一类新药盐酸埃克替尼上市艾瑞昔布片恒瑞医药一类新药艾瑞昔布获批注射用重组人尿激酶原上海天士力药业二季度多个一类新药获生产批文注射用头孢曲松钠舒巴坦钠湘北威尔曼
艾拉莫德片先声药业。

减轻化学治疗引起的恶心与呕吐新药--盐酸罗拉吡坦陈本川【摘要】盐酸罗拉吡坦(rolapitant hydrochloride)由美国 Tesaro 制药公司开发,是神经激肽(NK)1受体拮抗药。
癌症患者化学治疗会引起恶心和呕吐,持续的恶心与呕吐还能使患者体质量减轻、脱水和营养不良。
严重影响患者的生活质量,并可能导致药物减量或治疗停止。
NK1受体拮抗药通过阻断大脑内刺激呕吐反射物质而起作用。
美国食品药品管理局(FDA)于2015年9月1日批准盐酸罗拉吡坦上市,商品名 Varubi,用于与其他止吐药联用,预防成人患者化学治疗引起的延迟性恶心和呕吐。
该文对盐酸罗拉吡坦的非临床和临床药理毒理学、临床研究、适应证、剂量与用法、用药注意事项、不良反应及知识产权状态和国内外研究进展等进行介绍。
【期刊名称】《医药导报》【年(卷),期】2016(035)005【总页数】5页(P547-551)【关键词】罗拉吡坦;神经激肽受体;癌症;化学治疗;恶心;呕吐【作者】陈本川【作者单位】湖北丽益科技有限公司,武汉 430205【正文语种】中文【中图分类】R975.4;R969恶心和呕吐是癌症患者在化学治疗(化疗)期间最常见的不良反应之一,多数发生于化疗开始阶段的24~120 h,并能持续一段时间。
一旦时间过长,可影响患者接受化疗的依从性,打乱患者的治疗节奏,导致药物减量或治疗停止。
严重的恶心呕吐不仅影响患者生活质量,还可能使患者脱水、电解质紊乱、营养不良,甚至导致严重的并发症。
Rolapitant hydrochloride(暂译名盐酸罗拉吡坦),代号SCH-619734,中文化学名为3(5S,8S)-8- { [(1R)-1-[3,5-双(三氟甲基)苯基] 乙氧基]甲基-苯基}-8-苯基-1,7-二氮杂螺[4.5]癸烷-2-酮盐酸盐一水合物。
盐酸罗拉吡坦是神经激肽(neurokinin,NK)1受体拮抗药,通过阻断大脑内刺激呕吐反射物质而起到抑制作用。

非布索坦市场调查2020-11-25一基本信息中文名:非布索坦/非布司他中文别称:非布索坦-A晶型| 2-(3-氰基-4-异丁氧基苯基)-4-甲基噻唑-5-羧酸外文名:Febuxostat英文别称:2-(3-Cyano-4-(2-methylpropoxy)phenyl)-4-methylthiazole-5-carboxylic acid分子式:C16H16N2O3S分子量:316.37CAS号:144060-53-7结构式:剂型:片剂类别:抗痛风药商品名:Adenuric®(Ipsen公司)规格:80mg、120mg适应症:用于治疗痛风的慢性高尿酸血证。
HS#:2934100090物理参数密度:1.31g/cm3沸点:536.6°C at 760 mmHg闪点:278.3°C蒸汽压:2.41E-12mmHg at 25°C药理作用:痛风的发生是由于体内产生尿酸过多及肾脏清除能力下降,尿酸体内蓄积,导致尿酸盐结晶在关节及各脏器沉积。
因此,痛风的治疗通常采取的手段是:促进尿酸排泄和抑制尿酸生成,并采用适当措施改善相关症状。
体内尿酸的生成与嘌呤代谢有关,在嘌呤代谢的最后步骤中,次黄嘌呤在黄嘌呤氧化还原酶(XOR)的作用下生成黄嘌呤,再进一步生成尿酸,抑制该酶的活性可以有效的减少尿酸的生成。
非布索坦为目前世界上最新研制的XOR抑制剂,其通过高度选择性地作用于该氧化酶,减少体内尿酸合成,降低尿酸浓度,从而有效治疗通风疾病。
食物中的嘌呤核苷酸主要被黄嘌呤氧化酶分两步氧化为尿酸,非布索坦的作用比较直接,可以直接抑制黄嘌呤氧化酶的活性,减少尿酸的生成。
因此非布索坦是一种长期服用的缓解用药,与秋水仙碱不一样,不适用于急性症状的缓解。
药代动力学:非布索坦口服后>80%可快速且广泛的吸收,tmax约为1.0~1.8小时。
非布索坦每天口服单剂量多次给药后体内无蓄积。

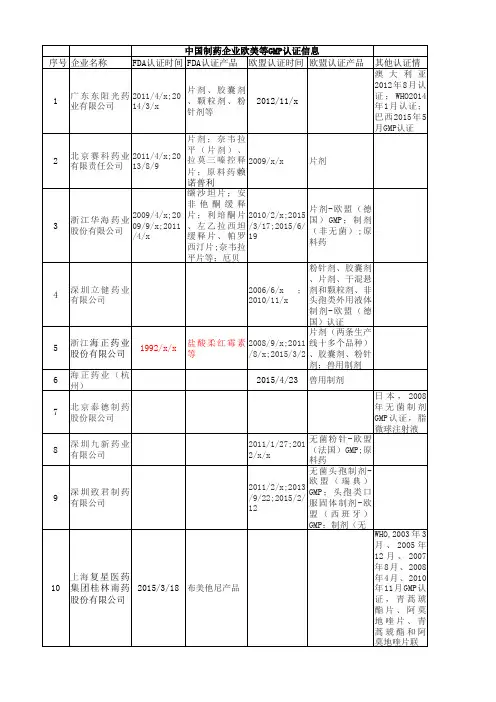
备注:发布时间:2012年4月23日发布部门:中国医药企业管理协会、中国医药保健品进出口商数据统计:其中通过美国G M P 认证的企业有4家,通过欧盟国家G M P 认证的企业有11家,通过W H O 和日本G M P 认证的企业各1家。
剂型方面,口服固定制剂企业12家,注射剂企业6家。
第二批通过制剂国际认证的15家企业名单企业名称认证类型认证时间制剂 无锡凯夫制药有限公欧盟(瑞典)GMP 2010年3月注射剂中国医药国际化制剂认证企业第一批先导性15家企业名单企业名称认证类型剂型北京赛科药业有限责任公司 欧盟(德国)GMP, 美国cGMP片剂深圳九新药业有限公司 欧盟(法国) GMP 粉针深圳立健药业有限公司 欧盟(德国) GMP 粉针、胶囊、片剂、干混悬剂和颗粒剂,非头孢类外用液体制剂深圳致君制药有限公司 欧盟(瑞典) GMP 粉针 浙江海正药业股份有限公司欧盟(英国、德国)GMP 胶囊剂,片剂,粉针浙江华海药业股份有限公司 美国cGMP, 欧盟(德国)GMP 片剂北京泰德制药股份有限公司日本 GMP 无菌注射剂北京悦康药业集团有限公司欧盟(德国) GMP 片剂、胶囊上海复兴医药产业发展有限公司桂林南药股份有限公司WHO 认证 片剂、注射剂 石药集团欧意药业有限公司美国 cGMP 片剂山东新华制药股份有限公司欧盟(英国)GMP 片剂浙江金华康恩贝生物制药有限公司欧盟(德国)GMP 片剂、胶囊杭州民生药业有限公司 美国cGMP 片剂 浙江京新药业股份有限公司欧盟(德国)GMP 片剂安徽华益药业 欧盟(英国)GMP 片剂司大连美罗大药厂澳大利亚TGA2005年9月片剂广东东阳光药业股份有限公司欧盟(德国)GMP、美国cGMP2007年7月(德国)、2011年4月(FDA)片剂、胶囊剂、颗粒剂、粉针剂等安士制药(中山)有限公司美国cGMP2010年5月片剂扬子江药业集团有限公司欧盟(德国)GMP2010年10月片剂、胶囊剂华北制药股份有限公司北元分厂WHO2010年6月无菌粉针剂、片剂、胶囊江苏恒瑞医药股份有限公司欧盟(英国、荷兰、西班牙)GMP、美国cGMP2011年7月(欧盟)、2011年12月(FDA)注射剂浙江华立南湖制药有限公司WHO2006年2月片剂先声药业有限公司欧盟(芬兰)GMP2011年4月散剂海南普利制药有限公司WHO2012年7月注射剂石家庄以岭药业股份有限公司欧盟(英国等)GMP2009年9月片剂常州四药制药有限公司美国cGMP2009年8月胶囊剂人福普克药业(武汉)有限公司美国FDA2010年3月至2011年11月片剂、胶囊剂、外用软膏齐鲁天和惠世制药有限公司欧盟(德国)GMP2012年6月冻干粉针剂齐鲁制药有限公司澳大利亚TGA2012年8月无菌头孢粉针、小容量注射剂备注:发布时间:2012年10月26日发布部门:中国医药企业管理协会、中国医药保健品进出口商第三批通过制剂国际认证的9家企业名单企业名称认证类型认证时间剂型亚宝药业集团股份有限公司美国cGMP2013年12月固体制剂常州制药厂有限公司欧盟GMP(德国)2012年7月固体制剂华北制药河北华民药业有限责任公司英国MHRA、日本GMP2014年4月、2014年1月无菌粉针制剂江苏豪森医药集团有限公司美国cGMP2013年5月注射剂珠海联邦制药股份有限公司美国cGMP2012年10月无菌粉针制剂山东绿叶制药有限公司欧盟GMP(德国)2013年11月固体制剂上海禾丰制药有限公司澳大利亚TGA2010年3月小容量注射液深圳市海滨制药有限公司欧盟GMP(德国)2012年5月无菌粉针制剂天津天士力圣特制药有限公司英国MHRA2012年2月固体制剂备注:发布时间:2014年6月25日发布部门:中国医药企业管理协会、中国医药保健品进出口商补充:数据来源:新闻通过美国FDA认证的中国制剂企业制剂名称企业名称备注奈韦拉平(片剂)、拉莫三嗪控释片(治疗癫痫病药物)等9个制剂产品和年产100亿片制剂生产线浙江华海药业股份有限公司抗艾滋病2013.8.9固体制剂美罗药业口服固体制剂车间和维生素C、维生素C钠原料药石药集团口服固体制剂苏州爱美津制药有限公司2011.10甲泼尼龙片剂天津金耀集团天药股份公司2013.7生物固体制剂生产线北京亚宝生物有限公司2013年12月1个无菌粉针制剂、5个无菌原料药、6个非无菌原料药共12个品种联邦制药珠海公司伊立替康注射剂江苏恒瑞医药股份有限公司。
“恒瑞药品”的国际升级2013-08-02 医学界杂志2013年5月17日,美国食品药品管理局(FDA)通知,恒瑞医药生产的来曲唑片通过美国FDA认证, 该产品在2012年年底已通过欧盟认证,这是恒瑞第三个通过国外规范市场认证的制剂产品,也是恒瑞医药首个获得FDA和欧盟的双料认证的口服制剂,标志着恒瑞的国际化再下一城。
FDA认证和欧盟认证,是药品进入美国和欧盟市场进行销售的通行证。
美国食品药品管理局简称FDA,它是由医生、律师、微生物学家、药理学家、化学家和统计学家等专业人士组成的致力于保护、促进和提高国民健康的政府卫生管制监控机构,美国FDA认证非常严格,已经是全球公认的药品及医疗设备安全有效的标准,成为被许多国家借鉴的标准。
是美国专门从事食品与药品管理的最高执法机关,是国际知名度和权威度最高的药品监管机构。
其职责是确保美国本国生产或进口的食品、药品、生物制剂、医疗设备等的安全性和有效性,认证范围涵盖生产、质量等六大系统。
获得FDA认证,意味着该产品取得世界上几乎所有国家的认同。
欧盟GMP认证要求对药品生产和物流的全过程必须验证。
通过欧盟GMP 认证不仅是对制药企业的生产实力的认可,同时也是对其产品质量可信赖的认可。
我国新版GMP认证就是参照欧盟GMP标准进行设置的,旨在拉近与欧盟国家的质量标准,有利于国内药企走向国际化。
化学制剂要走出去目前我国高端药物市场基本被外资企业占据,国外医药产品的价格较高成为医疗费用高的原因之一,要真正让百姓得实惠,就得把控好本国的医药市场主体地位。
我国是原料药生产大国,化学原料出口额较大,但是通过国际市场注册和认证的产品却不多,绝大部分产品仍以化工产品形式进入国际市场,因技术含量较低,而国外标准的苛刻,特别是欧盟、美国等门槛的高企,使得国内一部分企业把目标锁定在发展中国家,虽然这些国家或地区的门槛和标准都远远低于发达国家,但同时国内企业能取得的利润也非常少。
反之技术含量相对较高,毛利率较高的制剂药却多从国外进口,制剂出口就更难。
中国目前已通过美国FDA认证的原料药/企业汇总(转)中国目前已通过美国FDA认证的原料药/企业汇总,欢迎大家补充,更新!中国目前已通过美国FDA认证的原料药/企业汇总,希望这些信息能对大家有用.(注:只有DMF号,没有cGMP检查合格批准信的,不在统计范围内只通过欧洲cos认证,但没有通过FDA认证的,也不在统计范围内)序号原料药名称生产商备注1. 强力霉素Deoxycyline 昆山市东方制药厂抗生素2. 强力霉素一水物Deoxycyline Monohydrate 昆山市东方制药厂抗生素3. 盐酸四环素Tetracycline hydrocloride 宁夏启元药业有限公司抗生素4. 盐酸林可霉素Lincomycin hydrochloride 苏州第四制药厂抗生素5. 克林霉素磷酸酯Clindamycin Phosphate 苏州第四制药厂抗生素6. 盐酸克林霉素Clindamycin 重庆凯林制药公司抗生素7. 青霉素钾Penicillin Potassium 江西东风药业股份有限公司抗生素8. 土霉素Oxytetracycline 赤峰制药抗生素9. 盐酸土霉素Oxytetracycline Hydrocloride 赤峰制药抗生素10. 盐酸阿霉素Adriacin Hydrocloride 浙江海正药业股份有限公司抗生素11. 盐酸柔红霉素Daunomycin hydrochloride 浙江海正药业股份有限公司抗生素12. 丝裂霉素Mitomycin 浙江海正药业股份有限公司抗生素13. 妥布霉素碱Tobramycin Base 浙江海正药业股份有限公司抗生素14. 依维菌素Ivermectin 浙江海正药业股份有限公司抗生素15. 硫酸博莱霉素Bleomycin Sulphate 浙江海正药业股份有限公司抗生素16. 氟苷Fluorouracil Deoxyriboside 浙江海正药业股份有限公司抗病毒药,抗肿瘤药17. 异环磷酰胺Ifosfamide 江苏恒瑞医药股份有限公司抗肿瘤药18. 足叶乙甙Etoposide 江苏恒瑞医药股份有限公司抗肿瘤药19. 美司那Mesnaum, Sodium 2-mercaptoethanesulphonate 江苏恒瑞医药股份有限公司抗肿瘤药20. 噻替哌Thiophosphoramide 江苏恒瑞医药股份有限公司抗肿瘤药21. 长春瑞宾酒石酸Vinorelbine tartrate 江苏豪森药业股份有限公司抗肿瘤药22. 金刚烷胺Amantadine 东北制药抗病毒药23. Ramantadine 东北制药抗肿瘤药24. 盐酸左旋咪唑(levamisole hydrochloride) 桂林制药厂抗肿瘤药,驱虫药25. 阿昔洛韦Aciclovir 浙江车头药业有限公司抗病毒药26. 利巴韦林Ribavirin 广东肇庆星湖生物科技股份有限公司星湖生物化学制药厂抗病毒药27. SM2(磺胺二甲嘧啶)西南合成制药股份有限公司抗菌药上海三维制药有限公司北京第二制药厂浙江新赛科药业有限公司28. SM2Na(磺胺二甲嘧啶钠)西南合成制药股份有限公司抗菌药上海三维制药有限公司29. TMP(甲氧苄啶)西南合成制药股份有限公司抗菌药30. SMZ(磺胺甲恶唑sulfamethoxazolum)西南合成制药股份有限公司抗菌药31. SD(磺胺嘧啶sulfadiazine)西南合成制药股份有限公司抗菌药上海三维制药有限公司32. 磺胺喹噁啉Sulfaquinoxaline(SQ), 上海三维制药有限公司抗菌药33. 磺胺喹噁啉钠Sulfaquinoxaline Sodium 上海三维制药有限公司抗菌药34. 磺胺甲基嘧啶钠Sulfamerazine Sodium (SM1-Na) 上海三维制药有限公司抗菌药35. 磺胺噻唑Sulfathiazole 上海三维制药有限公司抗菌药36. 奥美普啉Ormetoprim (OMP), 上海三维制药有限公司抗菌药37. 氟苯尼考Florfenicol (FFC) 上海三维制药有限公司抗菌药38. 酮洛芬Ketoprofen 西南合成制药股份有限公司消炎镇痛药39. 布洛芬Ibuprofen 巨化集团公司制药厂消炎镇痛药新华制药40. 萘普生Naproxen 浙江车头药业有限公司消炎镇痛药41. 保泰松Butylpyridin 上海华氏制药有限公司(十五制药厂)消炎镇痛药42. 重酒石酸去甲肾上腺素Noradrenalini bitartras 武汉武药制药有限公司拟肾上腺素药43. 麻黄素Ephedrini hydrochloride 赤峰制药肾上腺素受体激动剂44. 麻黄浸膏粉Ephedrine Extract powder 赤峰制药肾上腺素受体激动剂45. 氯氮平Clozapine 上海华氏制药有限公司(十五制药厂)安定药广东惠州东江制药厂46. 茶碱Therophylline 新华制药利尿药,心脏兴奋药,平滑肌松弛药47. 布美他尼Bumetanide 桂林制药厂利尿药48. 赖诺普利Lisinopril 浙江华海药业有限公司降压药49. 卡托普利Captopril 山东潍坊制药厂有限公司降压药50. 盐酸二甲双胍Deltamine 上海华氏制药有限公司(十五制药厂)降血糖药51. 维库溴铵Vecuronium 浙江仙居制药股份有限公司肌松药52. 硫糖铝Sucralfate 东北制药抗溃疡抗酸药53. 愈创木酚甘油醚Guaifenesin 天药股份天津新新制药厂止咳化痰药54. 美索巴莫Methocarbamol 天药股份天津新新制药厂止咳化痰药55. 泼尼松Prednisone 天津天药药业股份有限公司糖皮质激素56. 氢化可的松Hydrocortisone 新华制药肾上腺皮质激素类药57. 环孢素(Cyclosporin A)福建科瑞药业有限公司免疫抑制剂58. 盐酸格拉司琼湖北百科药业肿瘤化疗止吐药59. 磷酸氟达拉滨湖北百科药业抗肿瘤药60. 多个品种(不明)乐山三九长征药业股份有限公司抗生素61. 两性霉素B(Amphotericin B)华药集团华胜公司抗生素62. 美托拉宗(Metolazone) 西安力邦制药有限公司利尿、降压药64. 盐酸左旋咪唑(levamisole hydrochloride) 陕西汉江制药厂抗肿瘤药,驱虫药。
备注:发布时间:2012年4月23日发布部门:中国医药企业管理协会、中国医药保健品进出口商数据统计:其中通过美国G M P 认证的企业有4家,通过欧盟国家G M P 认证的企业有11家,通过W H O 和日本G M P 认证的企业各1家。
剂型方面,口服固定制剂企业12家,注射剂企业6家。
第二批通过制剂国际认证的15家企业名单企业名称认证类型认证时间制剂中国医药国际化制剂认证企业第一批先导性15家企业名单企业名称认证类型剂型北京赛科药业有限责任公司 欧盟(德国)GMP, 美国cGMP片剂深圳九新药业有限公司 欧盟(法国) GMP 粉针深圳立健药业有限公司 欧盟(德国) GMP 粉针、胶囊、片剂、干混悬剂和颗粒剂,非头孢类外用液体制剂深圳致君制药有限公司 欧盟(瑞典) GMP 粉针 浙江海正药业股份有限公司欧盟(英国、德国)GMP 胶囊剂,片剂,粉针浙江华海药业股份有限公司 美国cGMP, 欧盟(德国)GMP 片剂北京泰德制药股份有限公司日本 GMP 无菌注射剂北京悦康药业集团有限公司欧盟(德国) GMP 片剂、胶囊上海复兴医药产业发展有限公司桂林南药股份有限公司WHO 认证 片剂、注射剂 石药集团欧意药业有限公司美国 cGMP 片剂山东新华制药股份有限公司欧盟(英国)GMP 片剂浙江金华康恩贝生物制药有限公司欧盟(德国)GMP 片剂、胶囊杭州民生药业有限公司 美国cGMP 片剂 浙江京新药业股份有限公司欧盟(德国)GMP 片剂安徽华益药业 欧盟(英国)GMP 片剂无锡凯夫制药有限公司欧盟(瑞典)GMP2010年3月注射剂大连美罗大药厂澳大利亚TGA2005年9月片剂广东东阳光药业股份有限公司欧盟(德国)GMP、美国cGMP2007年7月(德国)、2011年4月(FDA)片剂、胶囊剂、颗粒剂、粉针剂等安士制药(中山)有限公司美国cGMP2010年5月片剂扬子江药业集团有限公司欧盟(德国)GMP2010年10月片剂、胶囊剂华北制药股份有限公司北元分厂WHO2010年6月无菌粉针剂、片剂、胶囊江苏恒瑞医药股份有限公司欧盟(英国、荷兰、西班牙)GMP、美国cGMP2011年7月(欧盟)、2011年12月(FDA)注射剂浙江华立南湖制药有限公司WHO2006年2月片剂先声药业有限公司欧盟(芬兰)GMP2011年4月散剂海南普利制药有限公司WHO2012年7月注射剂石家庄以岭药业股份有限公司欧盟(英国等)GMP2009年9月片剂常州四药制药有限公司美国cGMP2009年8月胶囊剂人福普克药业(武汉)有限公司美国FDA2010年3月至2011年11月片剂、胶囊剂、外用软膏齐鲁天和惠世制药有限公司欧盟(德国)GMP2012年6月冻干粉针剂齐鲁制药有限公司澳大利亚TGA2012年8月无菌头孢粉针、小容量注射剂备注:发布时间:2012年10月26日发布部门:中国医药企业管理协会、中国医药保健品进出口商第三批通过制剂国际认证的9家企业名单企业名称认证类型认证时间剂型亚宝药业集团股份有限公司美国cGMP2013年12月固体制剂常州制药厂有限公司欧盟GMP(德国)2012年7月固体制剂华北制药河北华民药业有限责任公司英国MHRA、日本GMP2014年4月、2014年1月无菌粉针制剂江苏豪森医药集团有限公司美国cGMP2013年5月注射剂珠海联邦制药股份有限公司美国cGMP2012年10月无菌粉针制剂山东绿叶制药有限公司欧盟GMP(德国)2013年11月固体制剂上海禾丰制药有限公司澳大利亚TGA2010年3月小容量注射液深圳市海滨制药有限公司欧盟GMP(德国)2012年5月无菌粉针制剂天津天士力圣特制药有限公司英国MHRA2012年2月固体制剂备注:发布时间:2014年6月25日发布部门:中国医药企业管理协会、中国医药保健品进出口商补充:数据来源:新闻通过美国FDA认证的中国制剂企业制剂名称企业名称备注奈韦拉平(片剂)、拉莫三嗪控释片(治疗癫痫病药物)等9个制剂产品和年产100亿片制剂生产线浙江华海药业股份有限公司抗艾滋病2013.8.9固体制剂美罗药业口服固体制剂车间和维生素C、维生素C钠原料药石药集团口服固体制剂苏州爱美津制药有限公司2011.10甲泼尼龙片剂天津金耀集团天药股份公司2013.7生物固体制剂生产线北京亚宝生物有限公司2013年12月1个无菌粉针制剂、5个无菌原料药、6个非无菌原料药共12个品种联邦制药珠海公司伊立替康注射剂江苏恒瑞医药股份有限公司。
证券代码:600276 证券简称:恒瑞医药公告编号:临2020-099江苏恒瑞医药股份有限公司关于获得药物临床试验批准通知书的公告本公司董事会及全体董事保证本公告内容不存在任何虚假记载、误导性陈述或者重大遗漏,并对其内容的真实性、准确性和完整性承担个别及连带责任。
江苏恒瑞医药股份有限公司(以下简称“公司”或“恒瑞医药”)及子公司上海恒瑞医药有限公司近日收到国家药品监督管理局(以下简称“国家药监局”)核准签发的关于苹果酸法米替尼胶囊及马来酸吡咯替尼片的《药物临床试验批准通知书》,并将于近期开展临床试验。
现将相关情况公告如下:一、药品基本情况(一)苹果酸法米替尼胶囊1、药物的基本情况药品名称:苹果酸法米替尼胶囊剂型:胶囊剂申请事项:临床试验受理号:CXHL2000326、CXHL2000327审批结论:根据《中华人民共和国药品管理法》及有关规定,经审查,2020年6月26日受理的苹果酸法米替尼胶囊符合药品注册的有关要求,同意开展临床试验。
具体为:注射用卡瑞利珠单抗联合苹果酸法米替尼胶囊或安慰剂与培美曲塞和卡铂一线治疗晚期或转移性非鳞状非小细胞肺癌患者的随机、双盲、对照、多中心III 期临床研究(方案编号:SHR-1210-III-324)。
2、药物的其他情况苹果酸法米替尼胶囊是公司创新研发的小分子多靶点酪氨酸激酶抑制剂。
经查询,苹果酸法米替尼目前国内外有索拉非尼、舒尼替尼、培唑帕尼等多种同类产品获批上市。
索拉非尼由拜耳公司开发,于2005年在美国获批上市;舒尼替尼由辉瑞公司开发,于2006年在美国获批上市;培唑帕尼由诺华研发,于2009年在美国获批上市。
目前三款多靶点抑制剂均已在国内获批上市。
经查询,索拉非尼、舒尼替尼、培唑帕尼的2019年全球销售额约为21.59亿美元。
截至目前,该产品累计已投入研发费用约为12,304万元。
根据我国药品注册相关的法律法规要求,药物在获得药物临床试验批准通知书后,尚需开展临床试验并经国家药监局审评、审批通过后方可生产上市。
证券代码:600276 证券简称:恒瑞医药公告编号:临2018-035
江苏恒瑞医药股份有限公司
关于获得美国FDA批准文号的公告
本公司董事会及全体董事保证本公告内容不存在任何虚假记载、误导性陈述或者重大遗漏,并对其内容的真实性、准确性和完整性承担个别及连带责任。
江苏恒瑞医药股份有限公司(以下简称“恒瑞医药”或“公司”)于近日收到美国食品药品监督管理局(以下简称“FDA”)通知,恒瑞医药向FDA申报的磺达肝癸钠注射液简略新药申请(ANDA,即美国仿制药申请,申请获得美国FDA审评批准,意味着申请者可以生产并在美国市场销售该产品)已获得批准。
现将相关情况公告如下:
一、药品基本情况
1、药品名称:磺达肝癸钠注射液
剂型:注射液
规格:2.5mg/0.5mL、5mg/0.4mL、7.5mg/0.6mL、10mg/0.8mL
申请人:江苏恒瑞医药股份有限公司
申请事项:ANDA
ANDA号:206812
2、药品的其他相关情况
磺达肝癸钠能选择性抑制抗凝血酶III(ATIII)介导的因子Xa,显现抗凝血效应,适用于预防髋骨骨折手术(包括延长预防),髋关节置换手术,膝关节置换手术或腹部手术的患者的深静脉血栓形成(DVT),以及联合华法林治疗DVT或急性肺栓塞。
磺达肝癸钠注射液由美国公司MYLAN IRELAND LTD.开发,最早于2001年12月7日获得FDA批准上市销售。
2009年英国Glaxo Group Ltd的ARTIXTRA(安卓)在中国获批上市,于2015年变更为爱尔兰Aspen Notre Dame de Bondeville公司的的ARTIXTRA(安卓)。
除恒瑞医药外,国内另有正大天晴、天津红日、信泰制药、辽宁海思科等多家企业提交了6类申请,目前暂无国内企业获批。
经查询IMS数据库,2017年磺达肝癸钠注射液在中国市场销售额约为294万美元,美国市场销售额约为6,953万美元,全球市场销售额约为1.9亿美元。
截至目前,公司在该项目上已投入研发费用约为7,900万元人民币。
二、风险提示
本次磺达肝癸钠注射液获得美国FDA批准文号标志着公司具备了在美国市场销售该产品的资格,将对公司拓展美国市场带来积极影响。
公司将积极推动该产品在美国市场的上市准备。
药品的生产销售容易受到海外市场政策环境变化、汇率波动等因素的影响,敬请广大投资者谨慎投资,注意防范投资风险。
特此公告。
江苏恒瑞医药股份有限公司董事会
2018年5月18日。