澄清度检查法通则
- 格式:doc
- 大小:22.50 KB
- 文档页数:2

2020版《中国药典》溶液澄清度与颜⾊检验操作规程⼀、⽬的:制订详尽的⼯作程序,规范检验操作,保证检验数据的准确性。
⼆、范围:本标准适⽤于样品溶液澄清度与颜⾊的检查。
三、职责:1、检验员:严格按操作规程操作,认真、及时、准确地填写检验记录;2、化验室负责⼈:监督检查检验员执⾏本操作规程。
四、内容:1、溶液颜⾊检查法:1.1定义:本法系将药物溶液的颜⾊与规定的标准⽐⾊液⽐较,或在规定的波长处测定其吸光度。
品种项下规定的“⽆⾊”系指供试品的颜⾊相同于⽔或所⽤溶剂,“⼏乎⽆⾊”系指供试品溶液的颜⾊不深于相应⾊调0.5号标准⽐⾊液。
1.2仪器:纳⽒⽐⾊管(25ml),全⾃动⾊差计1.3第⼀法除另有规定外,取各品种项下规定量的供试品,加⽔溶解,置于25ml的纳⽒⽐⾊管中,加⽔稀释⾄10ml。
另取规定⾊调和⾊号的标准⽐⾊液10ml,置于另⼀25ml纳⽒⽐⾊管中,两管同置⽩⾊背景上,⾃上向下透视;或同置⽩⾊背景前,平视观察,供试品管呈现的颜⾊与对照管⽐较,不得更深。
如供试品管呈现的颜⾊与对照管的颜⾊深浅⾮常接近或⾊调不完全⼀致,使⽬视观察⽆法辨别两者的深浅时,应改⽤第三法(⾊差计法)测定,并将其测定结果作为判定依据。
1.3.1⽐⾊⽤重铬酸钾溶液:精密称取在120℃⼲燥⾄恒重的基准重铬酸钾0.4000g,置500ml量瓶中,加适量⽔溶解并稀释⾄刻度,摇匀,即得。
每lml溶液含0.800mg的K2Cr207。
1.3.2⽐⾊⽤硫酸铜溶液:取硫酸铜约32.5g,加适量的盐酸溶液(1→40)使溶解成500ml;精密量取10ml,置碘量瓶中,加⽔50ml、醋酸4ml与碘化钾2g,⽤硫代硫酸钠滴定液(0.1mol/L)滴定,⾄近终点时,加淀粉指⽰液2ml,继续滴定⾄蓝⾊消失。
每lml硫代硫酸钠滴定液(0.1mol/L)相当于24.97mg的CuS04·5H20。
根据上述测定结果,在剩余的原溶液中加适量的盐酸溶液(1→40),使每lml溶液中含62.4mg的CuS04·5H20,即得。

本法系将一定浓度的供试品溶液与浊度标准液分别置于配对的比浊用玻璃管(内径15~16mm,平底,具塞,以无色、透明、中性硬质玻璃制成)中,液面的高度为40mm,在浊度标准液制备后5分钟,同置黑色背景上,在漫射光下,从比浊管上方向下观察、比较;或垂直置于伞棚灯下,照度为1000lx,从水平方向观察、比较;用以检查溶液的澄清度或其浑浊程度。
正文中规定的“澄清”,系指供试品溶液的澄清度相同于所用溶剂,或未超过0.5号浊度标准液。
浊度标准贮备液的制备称取硫酸肼1.00g,置100ml量瓶中,加水适量使溶解,必要时可在40℃的水浴中温热溶解,并用水稀释至刻度,摇匀,放置4~6小时;取此溶液与等容量的10%乌洛托品溶液混合,摇匀,于25℃避光静置24小时,即得。
本液置冷处避光保存可在两个月内使用,用前摇匀。
浊度标准原液的制备取浊度标准贮备液15.0ml,置1000ml量瓶中,加水稀释至刻度,摇匀,即得。
本液应在24小时内使用,用前摇匀。
浊度标准液的制备取浊度标准原液与水,按下表配制,即得。
本液应临用时制备,使用前充分摇匀。
────────┬────┬────┬────┬────┬────级号│0.5 │ 1 │ 2 │ 3 │4 │││││────────┼────┼────┼────┼────┼────浊度标准原液,ml │ 2.50 │ 5.0 │ 10.0 │30.0 │50.0 ────────┼────┼────┼────┼────┼────水, ml │ 97.50 │ 95.0 │ 90.0 │70.0 │50.0 ────────┴────┴────┴────┴────┴────。

药品溶液澄清度检查法一目的:制定溶液澄清度检查法,规范溶液澄清度的测定的操作。
二适用范围:适用于溶液澄清度的测定。
三责任者:品控部。
四正文1 简述澄清度是检查药品溶液的浑浊程度,即浊度。
药品溶液中如存在细微颗粒,当直射光通过溶液时,可引致光散射和光吸收的现象,致使溶液微显浑浊;所以澄清度可在一定程度上反映药品的质量和生产工艺水平。
澄清度检查法(中国兽药典2005年版一部附录83页)是用规定级号的浊度标准溶液与供试品溶液比较,以判定药品溶液的澄清度或其浑浊程度。
2 仪器与用具2.1 比浊用玻璃管内径15~16mm,平底,具塞,以无色硬质中性玻璃制成,要求供试品管与标准管的内径、标线刻度(距管底为40mm)一致。
2.2 伞棚灯用澄明度检查装置(见注射剂标准操作规程中的澄明度检查法项下),照度为1000lx。
3 试药与试液3.1 硫酸肼和乌洛托品均应符合中国兽药典规定。
3.2 浊度标准贮备液的制备称取于105℃干燥至恒重的硫酸肼1.00g,置100ml量瓶中,加水适量使溶解,必要时可在40℃的水浴中温热溶解,并用水稀释至刻度,摇匀,放置4~6小时;取此溶液与等量的10%乌洛托品溶液混合,摇匀,于25℃避光静置24小时,即得。
本液置冷处避光保存,可在两个月内使用,用前摇匀。
3.3 浊度标准原液的制备取浊度标准贮备液15.0ml,置1000ml量瓶中,加水稀释至刻度,摇匀,取适量,置1cm吸收池中,照分光光度法(《按紫外分光光度法》执行),在550nm的波长处测定,其吸收度应在0.12~0.15范围内。
本液应在48小时内使用,用前摇匀。
3.4 浊度标准液的制备取浊度标准液与原液与水,按下表配制,即得。
本液应临用时制备,使用前充分摇匀。
4 操作方法4.1 除另有规定外,将一定浓度的供试品溶液与该药品项下规定的浊度标准液,分别置于配对的比浊用玻璃管中,液面高度为40mm,在浊度标准液制备5分钟后,同置黑色背景上,在漫射光下从比色管上方向下观察,比较,或置于伞棚灯下,照度为1000lx,从水平方向观察比较,用以检查溶液的澄清度或其浑浊程度。
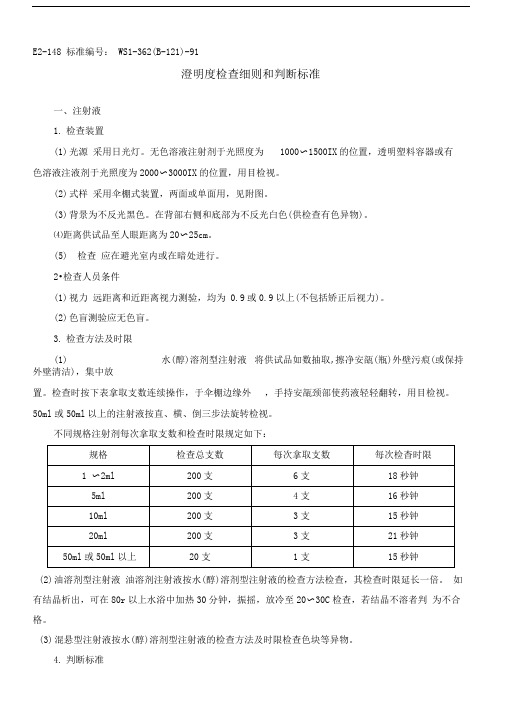
E2-148 标准编号: WS1-362(B-121)-91澄明度检查细则和判断标准一、注射液1.检查装置(1)光源采用日光灯。
无色溶液注射剂于光照度为1000〜1500IX的位置,透明塑料容器或有色溶液注液剂于光照度为2000〜3000IX的位置,用目检视。
(2)式样采用伞棚式装置,两面或单面用,见附图。
(3)背景为不反光黑色。
在背部右侧和底部为不反光白色(供检查有色异物)。
⑷距离供试品至人眼距离为20〜25cm。
(5)检查应在避光室内或在暗处进行。
2•检查人员条件(1)视力远距离和近距离视力测验,均为 0.9或0.9以上(不包括矫正后视力)。
(2)色盲测验应无色盲。
3.检查方法及时限(1)水(醇)溶剂型注射液将供试品如数抽取,擦净安瓿(瓶)外壁污痕(或保持外壁清洁),集中放置。
检查时按下表拿取支数连续操作,于伞棚边缘外,手持安瓿颈部使药液轻轻翻转,用目检视。
50ml或50ml以上的注射液按直、横、倒三步法旋转检视。
不同规格注射剂每次拿取支数和检查时限规定如下:(2)油溶剂型注射液油溶剂注射液按水(醇)溶剂型注射液的检查方法检查,其检查时限延长一倍。
如有结晶析出,可在80r以上水浴中加热30分钟,振摇,放冷至20〜30C检查,若结晶不溶者判为不合格。
(3)混悬型注射液按水(醇)溶剂型注射液的检查方法及时限检查色块等异物。
4.判断标准按以上装置及方法检查,除特殊规定品种外,未发现有异物或仅带微量白点者作合格论。
注射剂在出厂检验时,其不合格率不得过5% .贮存期的注射剂不合格率不得过 7.5%(属麻醉药品管理范围的注射剂,不得过10%)。
如检查结果超过规定时,则加倍抽样复试,应符合规定符合上述规定的药品,在使用时仍应注意挑选,不合格品不准应用。
5.特殊品种(1)葡萄糖酸钙注射液除带少量白点外,应符合规定。
(2)胰岛素注射液除带少量白点及短小纤维状物外,应符合规定。
(3)右旋糖酐类注射液除带轻微乳光及微量白点外,应符合规定。

澄清度检查法操作规程1 目的建立澄清度检查法操作规程,使其规范化、合理化。
2 范围适用于澄清度检查法的检验操作。
3 职责3.1 质量控制部检验人员对具体操作负责;3.2 质量保证部负责监督本规程的执行。
4 定义4.1 澄清:指供试品溶液的澄清度与所用溶剂相同,或不超过0.5号浊度标准液的浊度。
4.2 几乎澄清:指供试品溶液的浊度介于0.5号至1号浊度标准液的浊度之间。
5 内容5.1 概述与原理澄清度检查法系将药品溶液与规定的浊度标准液相比较,用以检查溶液的澄清程度,是利用药物与杂质在特定溶剂中溶解性能的差异而设计的检查项目,主要用于原料药与注射剂的质量控制。
浊度是一种光学效应,是光线与溶液中的悬浮颗粒相互作用的结果,它表征光线透过水层时受到障碍的程度。
5.2 仪器与用具5.2.1 比浊用玻璃管:内径15~16mm,平底,具塞,以无色、透明、中性硬质玻璃制成,要求供试品管与标准管的内径、标线刻度(距管底为40mm) 一致。
5.2.2 伞棚灯用可见异物检查法标准操作规范中第一法灯检法项下的检查装置,照度为1000 Lx。
5.3 试药与试液5.3.1 浊度标准贮备液的制备:称取于105℃干燥至恒重的硫酸肼1.00g置l00ml 量瓶中,加水适量使溶解,必要时可在40℃的水浴中温热溶解,并用水稀释至刻度,摇匀,放置4~6小时;取此溶液与等容量的10%乌洛托品溶液混合,摇匀,于25℃避光静置24小时,即得。
该溶液置冷处避光保存,在两个月内使用,用前摇匀。
5.3.2 浊度标准原液的制备:取浊度标准贮备液15.0ml,置l000ml量瓶中,加水稀释至刻度,摇匀,取适量,置lcm吸收池中,照紫外一可见分光光度法(SOP-QC-00-001-00)在550nm的波长处测定,其吸光度应在0.12~0.l5范围内。
本液应在48h内使用,用前摇匀。
5.3.3 浊度标准液的制备:取浊度标准原液与水,按下表配制,即得。
本液应临5.4 操作方法5.4.1 除另有规定外,将一定浓度的供试品溶液与该品种项下规定的浊度标准液,分别置于配对的比浊用玻璃管中,液面高度为40mm,在浊度标准液制备5min 后,于暗室内垂直同置于伞棚灯下,照度为1000 lx,从水平方向观察比较,用以检查溶液的澄清度或其浑浊程度。
澄清度检查法澄淸度检查法系将药品溶液与规定的浊度标准液相比较,用以检查溶液的澄清程度。
除另有规定外,应采用第一法进行检测。
品种项下规定的“澄清”,系指供试品溶液的澄清度与所用溶剂相同,或不超过0.5号浊度标准液的浊度。
“几乎澄淸”,系指供试品溶液的浊度介于0.5号至1号浊度标准液的浊度之间。
第一法(目视法)除另有规定外,按各品种项下规定的浓度要求,在室温条件下将用水稀释至一定浓度的供试品溶液与等量的浊度标准液分别置于配对的比浊用玻璃管(内径15〜16mm,平底,具塞,以无色、透明、中性硬质玻璃制成)中,在浊度标准液制备5分钟后,在暗室内垂直同置于伞棚灯下,照度为1000lx,从水平方向观察、比较。
除另有规定外,供试品溶解后应立即检视。
第一法无法准确判定两者的澄清度差异时,改用第二法。
浊度标准贮备液的制备:取于105°C干燥至恒重的硫酸肼1.00g,置100ml量瓶中,加水适量使溶解,必要时可在40°C的水浴中温热溶解,并用水稀释至刻度,摇匀,放置4〜6小时;取此溶液与等容量的10%乌洛托品溶液混合,摇匀,于25°C避光静置24小时,即得。
该溶液置冷处避光保存,可在2个月内使用,用前摇匀。
浊度标准原液的制备:浊度标准贮备液15.0ml,置1000ml量瓶中,加水稀释至刻度,摇匀,取适量,置lcm吸收池中,照紫外-可见分光光度法(通则0401),在550nm的波长处测定,其吸光度应在0.12〜0.15范围内。
该溶液应在48小时内使用,用前摇匀。
浊度标准液的制备:取浊度标准原液与水,按下表配制,即得。
浊度标准液应临用时制备,使用前充分摇匀。
供试品溶液的浊度用浊度仪测定。
溶液中不同大小、不同特性的微粒物质包括有色物质均可使人射光产生散射,通过测定透射光或散射光的强度,可以检查供试品溶液的浊度。
仪器测定模式通常有三种类型,透射光式、散射光式和透射光-散射光比较测量模式(比率浊度模式)。
澄明度检查细则和判断标准一、注射液1.检查装置(1) 光源采用日光灯。
无色溶液注射剂于光照度为1000~1500Ix的位置,透明塑料容器或有色溶液注液剂于光照度为2000~3000Ix的位置,用目检视。
(2) 式样采用伞棚式装置,两面或单面用,见附图。
(3) 背景为不反光黑色。
在背部右侧和底部为不反光白色(供检查有色异物)。
(4) 距离供试品至人眼距离为20~25cm。
(5) 检查应在避光室内或在暗处进行。
2.检查人员条件(1) 视力远距离和近距离视力测验,均为0.9或0.9以上(不包括矫正后视力)。
(2) 色盲测验应无色盲。
3.检查方法及时限(1) 水(醇)溶剂型注射液将供试品如数抽取,擦净安瓿(瓶)外壁污痕(或保持外壁清洁),集中放置。
检查时按下表拿取支数连续操作,于伞棚边缘外,手持安瓿颈部使药液轻轻翻转,用目检视。
50ml或50ml以上的注射液按直、横、倒三步法旋转检视。
不同规格注射剂每次拿取支数和检查时限规定如下:━━━━━━━┯━━━━━┯━━━━━━┯━━━━━━规格│检查总支数│每次拿取支数│每次检查时限─────┼───────┼──────┼──────1~2ml │ 200支│ 6支│ 18秒钟5ml │ 200支│ 4支│ 16秒钟10ml │ 200支│ 3支│ 15秒钟20ml │ 200支│ 3支│ 21秒钟50ml或50ml以上│ 20支│ 1支│ 15秒钟━━━━━━━┷━━━━━┷━━━━━━┷━━━━━━(2) 油溶剂型注射液油溶剂注射液按水(醇)溶剂型注射液的检查方法检查,其检查时限延长一倍。
如有结晶析出,可在80℃以上水浴中加热30分钟,振摇,放冷至20~30℃检查,若结晶不溶者判为不合格。
(3) 混悬型注射液按水(醇)溶剂型注射液的检查方法及时限检查色块等异物。
4.判断标准按以上装置及方法检查,除特殊规定品种外,未发现有异物或仅带微量白点者作合格论。
注射剂在出厂检验时,其不合格率不得过5%.贮存期的注射剂不合格率不得过7.5%(属麻醉药品管理范围的注射剂,不得过10%)。
文件编号执行日期澄清度检查法SOP-ZL-069 2014.05.01起草人审核人批准人起草日期审核日期批准日期版本号00 原文件有效期分发部门质量保证部质量控制实验室目的:制订溶液的澄清度检查法的检验操作规程。
适用范围:液体制剂。
责任人:检验员、实验室主任、质量保证部部长。
内容:澄清度检查法系将药品溶液与规定的浊度标准液相比较,用以检查溶液的澄清程度。
品种项下规定的“澄清”,系指供试品溶液的澄清度与所用溶剂相同,或不超过0.5号浊度标准液的浊度。
“几乎澄清”,系指供试品溶液的浊度介于0.5号至1号浊度标准液的浊度之间。
一、第一法(目视法)除另有规定外,按各品种项下规定的浓度要求,在室温条件下将用水稀释至一定浓度的供试品溶液与等量的浊度标准液分别置于配对的比浊用玻璃管(内径15~16mm,平底,具塞,以无色、透明、中性硬质玻璃制成)中,在浊度标准液制备5分钟后,在暗室内垂直同置于伞棚灯下,照度为1000lx,从水平方向观察、比较。
除另有规定外,供试品溶解后应立即检视。
第一法无法准确判定二者的澄清度差异时,改用第二法进行测定并以其测定结果进行判定。
浊度标准贮备液的制备称取于105℃干燥至恒重的硫酸肼1.00g,置100ml量瓶中,加水适量使溶解,必要时可在40℃的水浴中温热溶解,并用水稀释至刻度,摇匀,放置4~6小时;取此溶液与等容量的10%乌洛托品溶液混合,摇匀,于25℃避光静置24小时,即得。
该溶液置冷处避光保存,可在2个月内使用,用前摇匀。
浊度标准原液的制备取浊度标准贮备液15.0ml,置1000ml量瓶中,加水稀释至刻度,摇匀,取适量,置1cm吸收池中,照紫外-分光光度法(附录IV A),在550nm的波长处测定,其吸光度应在0.12~0.15范围内。
该溶液应在48小时内使用,用前摇匀。
浊度标准液的制备取浊度标准原液与水,按下表配制,即得。
浊度标准液应临用时制备,使用前充分摇匀。
级号0.5 1 2 3 4浊度标准原液/ml 2.50 5.0 10.0 30.0 50.0水/ml 97.50 95.0 90.0 70.0 50.0二、第二法(仪器法)供试品溶液的浊度可采用仪器法测定。
1、目的
规范QC实验室对样品澄清度的检测,以确保检测结果的准确性和规范性。
2、范围
本规程适用于QC实验室样品澄清度的检测。
3、职责
QC理化室负责该文件的起草和修订;质量保证部负责该文件的审核、分发、收回、撤销、复制、销毁、存档;理化室主管负责该规程的贯彻实施,实验室员工应严格按照规程要求进行样品澄清度的检测。
4、内容
4.1.简述
4.1.1 本法是检查药品溶液的浑浊程度,即浊度。
药品溶液中如存在细微颗粒,当直射光通过溶液时,可引致光散射和光吸收的现象,致使溶液显浑浊;所以澄清度可在一定程度上反映药品的质量和生产水平。
澄清度检查法(《中国药典》2010年版二部附录ⅨB)是用规定级号的浊度标准液与供试品溶液比较,以判定药品溶液的澄清度或浑浊度。
4.2 仪器与用具
4.2.1 比浊用玻璃管内径15-16mm,平底,具塞,以无色、透明、中性硬质玻璃制成,要求供试品管与标准管的内径、标线刻度(距管底40mm)一致。
4.2.2 伞棚灯用可见异物检查法标准操作规范中第一法灯检法项下的检查装置,照度为1000Lx。
4.3 试药与试液
4.3.1浊度标准储备液的制备称取于105℃干燥至恒重的硫酸肼1.00g置100ml量瓶中,加水适量使溶解,必要时可在40℃的水浴中温热溶解,并用水稀释至刻度,摇匀,放置4-6h;取此溶液与等量的10%乌洛托品溶液混合,摇匀,于25℃避光静置24h,即得。
本液置冷处避光保存,可在两个月内使用,用前摇匀。
4.3.2浊度标准原液的制备取浊度标准贮备液1
5.0ml,置1000ml量瓶中,加水稀释至刻度,摇匀,取适量、置1cm吸收池中,照紫外-可见分光光度法(《中国药典》2010年版二部附录ⅣA)在550nm的波长处测定,其吸光度应在0.12-0.15范围内。
本液应在48h内使用,用前摇匀。
4.3.3 浊度标准液的制备取浊度标准原液与水,按下表配制,即得。
本液应临用新制,
用前摇匀。
级号0.5 1 2 3 4
2.5 5.0 10.0 30.0 50.0
浊度标准原
液(ml)
水(ml)97.5 95.0 90.0 70.0 50.0
4.4 操作方法
4.4.1除另有规定外,将一定浓度的供试品溶液与该品种项下规定的浊度标准液,分别置于配对的比浊用玻璃管中,液面高度为40mm,在浊度标准液制备5min后,于暗室内垂直同置于伞棚灯下,照度为1000Lx,从水平方向观察比较,用以检查溶液的澄清度或其浑浊程度。
4.4.2在进行比较时,如供试品溶液管的浊度接近标准管时,应将比浊管交换位置后在进行观察。
5、注意事项
5.1制备澄清度检查用的浊度标准贮备液、原液和标准液,均应用澄清的水(可用0.45um 孔径滤膜或G5垂熔玻璃漏斗滤过而得)
5.2 浊度标准贮备液、浊度标准原液、浊度标准液,均应规定制备、使用,否则影响结果。
5.3 用于配制供试品溶液的水,均应为注射用水或新煮沸放冷的澄清水。
5.4供试品溶液配制后,应在5min内进行检视。
6、计算与记录
6.1应记录供试品溶液制备方法,浊度标准液的级号、比较结果等。
7、判定标准
比较结果,如供试品溶液管的浊度浅于或等于0.5级号的浊度标准液,即为澄清;如浅于或等于该品种项下规定级号的浊度标准液,判为符合规定;如浓于规定级号的浊度标准液,则判为不符合规定。