氮在自然界中的存在方式及绪论..共86页
- 格式:ppt
- 大小:12.10 MB
- 文档页数:86




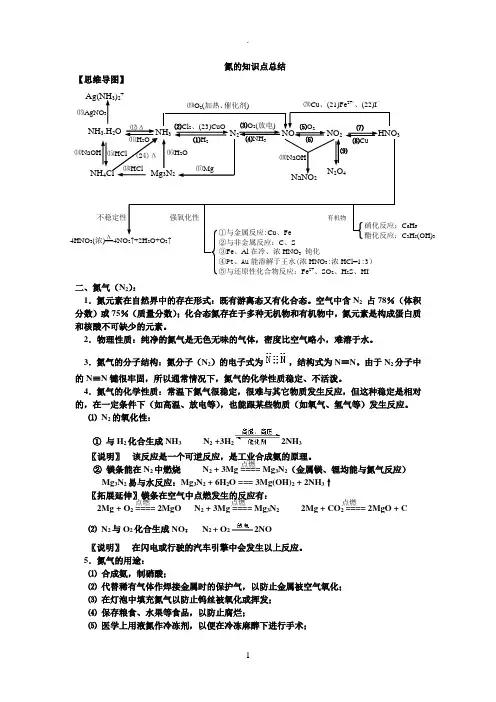
氮的知识点总结【思维导图】二、氮气(N 2):1.氮元素在自然界中的存在形式:既有游离态又有化合态。
空气中含N 2 占78%(体积分数)或75%(质量分数);化合态氮存在于多种无机物和有机物中,氮元素是构成蛋白质和核酸不可缺少的元素。
2.物理性质:纯净的氮气是无色无味的气体,密度比空气略小,难溶于水。
3.氮气的分子结构:氮分子(N 2)的电子式为,结构式为N ≡N 。
由于N 2分子中的N ≡N 键很牢固,所以通常情况下,氮气的化学性质稳定、不活泼。
4.氮气的化学性质:常温下氮气很稳定,很难与其它物质发生反应,但这种稳定是相对的,在一定条件下(如高温、放电等),也能跟某些物质(如氧气、氢气等)发生反应。
⑴ N 2的氧化性:① 与H 2化合生成NH 3 N 2 +3H 22NH 3〖说明〗 该反应是一个可逆反应,是工业合成氨的原理。
② 镁条能在N 2中燃烧 N 2 + 3Mg ==== Mg 3N 2(金属镁、锂均能与氮气反应)Mg 3N 2易与水反应:Mg 3N 2 + 6H 2O === 3Mg(OH)2 + 2NH 3↑〖拓展延伸〗镁条在空气中点燃发生的反应有: 2Mg + O 2 ==== 2MgO N 2 + 3Mg ==== Mg 3N 2 2Mg + CO 2 ==== 2MgO + C ⑵ N 2与O 2化合生成NO : N 2 + O 22NO〖说明〗 在闪电或行驶的汽车引擎中会发生以上反应。
5.氮气的用途:⑴ 合成氨,制硝酸;⑵ 代替稀有气体作焊接金属时的保护气,以防止金属被空气氧化;⑶ 在灯泡中填充氮气以防止钨丝被氧化或挥发;⑷ 保存粮食、水果等食品,以防止腐烂;⑸ 医学上用液氮作冷冻剂,以便在冷冻麻醉下进行手术;⒆O 2(加热、催化剂) 4HNO 3(浓)==4NO 2↑+2H 2O+O 2↑ 强氧化性 不稳定性 HNO 3 NaNO 2 ⑽NaOH ⒄Mg N 2O 4 ⒃H 2O NH 3.H 2O NH 3 N 2 NO NO 2 Ag(NH 3)2+ NH 4Cl ⒀AgNO 3 ⒁NaOH ⒂HCl ⑿Δ ⑾H 2O Mg 3N 2 ⑵Cl 2、(23)CuO ⑴H 2 ⑶O 2(放电) ⑷NH 3 ⑸O 2 ⑹ ⑺ ⑻Cu ⒅HCl ⒇Cu 、(21)Fe 2+、、(22)I — ①与金属反应:Cu 、Fe ②与非金属反应:C 、S ③Fe 、Al 在冷、浓HNO 3 钝化④Pt 、Au 能溶解于王水(浓HNO 3:浓HCl=1:3) ⑤与还原性化合物反应:Fe 2+、SO 2、H 2S 、HI 有机物 硝化反应:C 6H 6 酯化反应:C 3H 5(OH)3 ⑼ Δ (24)Δ 点燃 点燃 点燃 点燃⑹ 利用液氮制造低温环境,使某些超导材料获得超导性能。

氮气的性质和用途①合成氨,制硝酸;②代替稀有气体作焊接金属时的保护气,以防止金属被空气氧化;⑧在灯泡中填充氮气以防止钨丝被氧化或挥发;④保存粮食、水果等食品,以防止腐烂;⑤医学上用液氮作冷冻剂,以便在冷冻麻醉下进行手术;⑥利用液氮制造低温环境,使某些超导材料获得超导性能。
氮元素在自然界中的存在形式既有游离态又有化合态。
空气中含N278%(体积分数)或75%(质量分数);化合态氮存在于多种无机物和有机物中,氮元素是构成蛋白质和核酸不可缺少的元素•氮气的物理性质和化学性质:(1)物理性质:纯净的氮气是无色气体,密度比空气略小,氮气在水中的溶解度很小,在常压下101kPa,-195.8℃氮气变成无色液体,-209.9℃变成雪花状固体。
氮气的分子结构:氮分子(N2)的电子式为,结构式为N≡N,由于N2分子中的N≡N 键很牢固,所以通常情况下,氮气的化学性质稳定、不活泼。
(2)化学性质:氮分子化合价为0价,既可以升高也可以降低,说明氮气既有氧化性又有还原性。
①N2与H2化合生成NH3:说明:该反应是一个可逆反应,是工业合成氨的原理。
②N2与金属反应(Mg Ca Sr Ba)反应:③N2与O2化合生成NO:说明:在闪电或行驶的汽车引擎中会发生以上反应。
1.氮气(1)氮的固定使空气中游离态的氮转化为化合态氮的过程。
(2)氮气的性质①物理性质纯净的N2是一种无色无味的气体,难溶于水,在空气中约占总体积的4/5。
②化学性质通常情况下,N2化学性质很稳定,只在高温、放电、催化剂等条件下才能发生一些化学反应。
a.与H2反应:N2+3H2高温、高压催化剂2NH3。
b.与O2反应:N2+O2放电或高温2NO。
2.氮的氧化物氮有多种价态的氧化物:N2O、NO、N2O3、NO2、N2O4、N2O5等。
完成NO和NO2的比较表:特别提醒(1)氮的氧化物都是大气污染物。
(2)空气中NO2是造成光化学烟雾的主要因素。
(4)NO2:既有氧化性又有还原性,以氧化性为主。

氮在自然界中的存在形式氮是一种重要的化学元素,在自然界中以多种形式存在。
以下是氮在自然界中的一些主要存在形式:1. **大气中的氮气**:氮气是大气中最主要的成分之一,约占大气的 78%。
氮气是一种无色、无味、无臭的气体,通常不活泼,不易与其他物质发生反应。
2. **硝酸盐和亚硝酸盐**:硝酸盐和亚硝酸盐是氮的化合物,常见于土壤、水体和生物体中。
它们可以通过氮的硝化和反硝化过程形成,对植物的生长和生态系统的氮循环起着重要作用。
3. **蛋白质和氨基酸**:氮是组成蛋白质和氨基酸的重要元素。
蛋白质是生物体的重要组成部分,存在于动物、植物和微生物体内。
氨基酸则是构成蛋白质的基本单位。
4. **氨**:氨是一种具有刺激性气味的气体,在自然界中可以通过生物过程或化学反应产生。
氨在一些生态系统中起着重要的作用,但高浓度的氨可能对环境和生物造成危害。
5. **氮化物**:氮可以与其他元素形成各种氮化物,如氯化铵、硝酸铵等。
这些氮化物在农业、化工和工业领域有广泛的应用。
6. **生物体中的核酸**:核酸,如 DNA 和 RNA,也含有氮。
氮在核酸中的存在对于遗传信息的传递和生物体的正常功能具有关键意义。
7. **土壤中的有机氮**:土壤中含有各种有机氮化合物,这些化合物是土壤肥力的重要指标之一。
它们可以来自动植物残体、排泄物和分解过程。
氮在自然界中的存在形式多样,并且在生态系统的氮循环中起着关键作用。
氮的转化和流动受到生物、化学和环境因素的影响,对维持生态平衡和生物的生存至关重要。
此外,人类活动,如农业施肥、工业生产和化石燃料燃烧等,也对氮在自然界中的分布和循环产生重要影响。
了解氮的存在形式有助于我们更好地理解生态系统和环境问题,并采取相应的措施来保护和管理氮资源。

3.2 氮的循环一、自然界中氮的循环:1.氮的存在形态氮是地球上含量丰富的一种元素,以游离态的形式存在于大气中,以化合态的形式存在于动植物体、土壤和水体中。
2.氮在自然界中的循环➢在自然界中豆科植物根部的根瘤菌把空气中的氮气转变为硝酸盐等含氮的化合物。
➢在放电条件下,空气中少量的N2与O2化合生成NO,NO和O2迅速生成NO2并随水进入土壤和水体。
➢人们通过化学方法把空气中的N2转化为NH3,再根据需要进一步转化成各种含氮化合物(如HNO3、氮肥等)。
二、氮气:1.物理性质➢色味态:无色无味气体➢溶解性:难溶于水➢密度:比空气略小2.化学性质放电2NO➢与氧气:N2+O2=====➢与氢气:N2+3H22NH3➢与镁:N2+3Mg点燃Mg3N23.用途➢氮气是合成氨,制硝酸的重要原料➢氮气因为性质稳定,经常用作保护气,比如用于焊接金属➢液氮可用作冷冻剂,应用于医学领域4、氮的固定(1) 概念:使空气中游离态的氮转化为含氮化合物的过程(2) 分类:➢自然固氮:主要包括生物固氮和高能固氮➢人工固氮:主要包括合成氨固氮和仿生固氮三、氮的氧化物:12. 注意事项:➢酸酐的问题:N2O3是亚硝酸的酸酐,N2O5是硝酸的酸酐➢颜色的问题:只有NO2是红棕色气体,其余均为无色气体➢污染的问题:氮的氧化物都具有毒性,而且都是大气污染物,3. NO和NO2(1)物理性质➢色味态:NO是无色无味气体,NO2是红棕色有刺激性气味的气体➢溶解性:NO难溶于水,NO2易溶于水➢密度:NO比空气略小,NO2比空气大(2) 相互转换➢NO→NO2:2NO+O2====2NO2➢NO2→NO:3NO2+ H2O====2HNO3 + NO(3)影响➢NO:是传递神经信息的“信使分子”,但容易与血红蛋白结合而使人体缺氧。
➢NO2:能损坏多种织物和尼龙制品,对金属和非金属材料有腐蚀作用。
四、氨气:1.物理性质(1)NH3是无色、有刺激性气味、极易溶于水的气体,常温时,1体积水大约溶解700体积的氨气。

氮元素由海洋到林木的过程
氮元素在自然界中通过氮循环的过程在海洋和陆地上发生着。
首先,氮气通过大气中的氮气固定作用,被一些细菌转化为氨或硝
酸盐,然后被降雨带入海洋。
在海洋中,氮元素被吸收和利用,成
为海洋生物体内蛋白质和核酸等生物大分子的重要组成部分。
海洋
中的氮元素还可以通过生物固氮作用,由一些特定的微生物将氮气
转化为有机氮化合物,进一步丰富了海洋生态系统中的氮资源。
当海洋生物死亡或排泄时,其中的有机氮化合物会进入海水中,一部分被微生物分解成氨或硝酸盐,然后被植物吸收利用。
此外,
海洋中的氮元素也可以通过潮汐和海浪的作用,被带到海岸,进入
陆地生态系统。
在陆地上,植物通过根系吸收土壤中的氮元素,将
其转化为蛋白质等有机物质,并成为食物链的起点。
动物通过食用
植物摄入氮元素,然后将其积累在自己的体内。
当动植物死亡时,其中的有机氮化合物会被分解为无机氮化合物,然后返回到土壤中。
在土壤中,一部分氮元素被微生物分解释
放为氮气,重新进入大气,完成了氮气的固氮作用。
另一部分则被
植物吸收利用,继续循环在陆地生态系统中。
此外,一部分氮元素
也可能被冲刷到河流,最终流入海洋,参与海洋中的氮循环。
总的来说,氮元素在自然界中通过海洋和陆地上的氮循环过程不断地在不同的生态系统中转化和循环,为生物体提供了必要的营养物质,维持了生态系统的平衡和稳定。

氮气的存在形式和分布氮气(N2)是地球大气中最主要的成分之一,占据了大气的约78%。
它在大气中以不同的形式存在,并参与了许多重要的地球化学过程,对地球生态系统的平衡起着重要作用。
首先,我们可以看到氮气以分子态(N2)的形式存在于大气中。
氮气是由两个氮原子(N)通过三键结合形成的稳定分子。
这些氮气分子以高度稀薄的形式存在于大气中,可以被吸入我们的肺部。
虽然氮气在人类活动中并没有直接的用途,但它对维持地球生态系统的平衡至关重要。
此外,氮气还以其他形式存在,比如在大气中的颗粒物中。
这些颗粒物包含固态或液态的氮化物化合物,如氨(NH3)和氮氧化物(NOx)。
这些颗粒物不仅来自自然过程,比如火山爆发和海洋生物排泄物的分解,也来自人类活动,比如化石燃料燃烧和工业排放。
这些氮化物颗粒物往往是对人类健康和环境有害的,因为它们可以造成酸雨和大气污染。
另外,氮气还以大气中的亚硝酸盐(NO3-)和铵盐(NH4+)的形式存在。
这些化合物通常来自于大气中的氮气分子的氧化和还原反应。
大气中的闪电和太阳辐射可以将氮气转化为亚硝酸盐和铵盐。
这些化合物进一步以形成了植物生长必需的氮素形式。
在土壤中,氮素被植物吸收,并成为植物生长和发育的关键营养元素。
随着植物的生长和死亡,氮素也会重新输入到土壤中。
此外,氮气还以氨或亚甲基胺的形式存在于全球大气中。
这些氨化合物主要来自于农业活动,比如肥料的施用和动物排泄物的分解。
氮气的这种存在形式对农作物生产至关重要,但是它也可能导致水体的富营养化现象,对水体生态系统产生负面影响。
总之,氮气以分子态(N2)的形式是地球大气中最常见的组分之一,同时它还以亚硝酸盐、铵盐、氨等形式存在于大气中。
这些不同的形式和分布使得氮气参与了大量的地球化学过程,包括植物生长和发育、大气污染和水体富营养化等。
对于地球生态系统的平衡和人类的生存,深入了解氮气的存在形式和分布是十分重要的。
土壤中的氮氮是自然界一种很活跃的元素,它以不同形态存在与大气、土壤和生物有机体之间,它们之间经常互相进行交换。
大气中的氮是以分子形态存在,同时也有氮的某些化合物,大气中游离氮不能直接为高等植物吸收利用,但能为固氮微生物固定,变成结合态氮进入植物-土壤体系。
大气中的氮除了通过生物途径固定之外,也可以通过物理化学作用进入土壤。
氮的氧化物与水一起产生亚硝态氮和硝态氮,并随着降雨而进入土壤,氨及铵离子也随着降雨而进入土壤。
土壤中无机态氮可以为植物吸收进入生物圈,也可以通过挥发作用或反硝化作用变成气态氮而进入大气。
自然界的氮素循环如图(图6-1见相册图片)。
●6.1土壤中的氮一、土壤中氮的形态及其含量土壤中的氮由90%左右是有机态的,而无机态氮占总氮不到10%。
土壤中的无机氮主要包括NO3-、NO2-、交换性NH4+、非交换性NH4+。
NO3-和交换性NH4+时植物吸收的主要形态,二者常常只占全氮的1%左右,而且处于经常变化之中。
而非交换性NH4+,虽然不易被植物所吸收,其含量却较前二者来得高,一般都在总氮的5%以上,非交换性NH4+在氮素肥力中的作用愈来愈受到重视(Mengel,1985)。
土壤中的有机态氮大部分是与无机矿物结合在一起的。
迄今为此,分析土壤有机态氮的组成分还是基于用6N的盐酸水解,继而分析水解液中的有机态氮(表6-1)。
土壤中的各种有机态氮,也是处于不断的转化之中,土壤无机氮的是放量是这些有机态氮相互转化过程的综合效应。
表6-1酸解条件下土壤有机氮的分级(Stevenson,1982)_________________________________________________________形态定义和方法含量(占总氮百分比)—————————————————————————————酸不精酸水解后残溶性氮存在土壤中的氮 20~35(土壤总氮-土壤酸解性总氮)—————————————————————————————氨态氮用氧化镁蒸馏酸解液而得到的氮 20~35—————————————————————————————氨及糖氮用磷酸-硼砂的缓冲液蒸馏的氮 5~10量减氨态氮—————————————————————————————氨基用茚三酮-NH3法酸态氮分析酸解液而得到的氮 30~45—————————————————————————————酸解-未知态氮酸解性总氮减去氨态氮、氨基糖氮和氨基酸态氮 10~20后的量__________________________________________________________土壤中氮的含量变化很大,高的可达0.4%,低的只有0.04%。
氮元素在自然界中的存在形式
一、氮元素在自然界中的存在形式
氮元素是自然界中最丰富和最重要的元素之一,是生命的重要组成部分,它在自然界中存在着多种形式。
它可以以气体、液体、固体、水溶质等各种形式存在,也可以以氨基酸、核酸、蛋白质和其他有机物等多种形式存在。
1、氮的气体形式
地球大气中的氮气占大气总量的大约78%,是大气中最丰富的气体。
氮气中含有氮原子和N2分子,但也可以发生氧化反应,形成NO2、NO3等氮氧化物,以及形成氨和氮氧化物离子,这些物质都是制造肥料等的原料。
2、氮的液体形式
大气中的氮气也可以形成液体。
由于温度的降低,氮气中的气体可以降解为液态氮,液态氮的温度较低,状态稳定,很难转变为气态,因此可以作为超低温冷冻设备的冷却剂,在医学、农业等领域有重要的应用。
3、氮的固体形式
还有一些重要的氮固体,包括氮酸、氰化物、氧化物等,它们的稳定性都很强,可以用作某些医药、杀虫剂等的原料,也可以用作肥料的添加剂,改善土壤的肥力,使农作物得到正常的生长。
4、氮的水溶质形式
在土壤和水体中,氮的水溶物形式也有着重要的地位,它们可以
是氮的氧化物,如硝酸根、硝酸铵、亚硝酸根和亚硝酸铵,也可以是有机氮,如氨基酸和氨基苯甲酸等,它们可以提供植物所需要的氮元素,并参与氮循环的生物链中。
5、氮的有机形式
在水环境中,氮可以以多种有机形式存在,如氨基酸、核酸、蛋白质和其他有机物等,这些物质是植物和动物的重要组成部分,也是其生命活动的基础。
植物除了可以直接从土壤中吸收外,还可以从水中以有机形式吸收,这是植物在生长和生存中不可缺少的重要要素。