氮在自然界中的存在方式及绪论..共88页
- 格式:ppt
- 大小:12.14 MB
- 文档页数:88
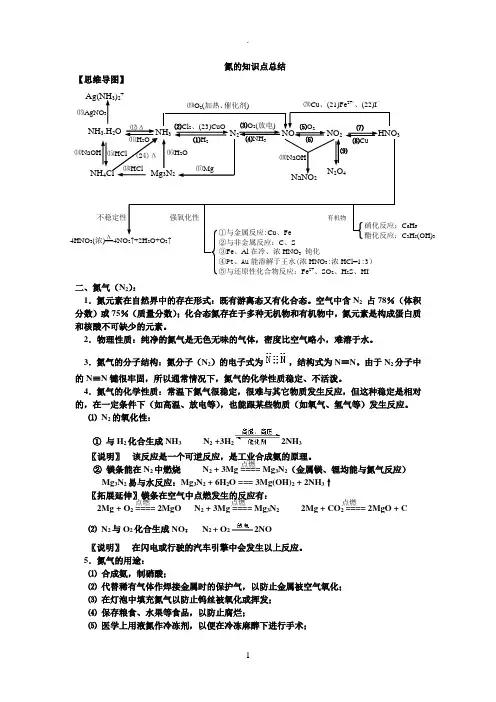
氮的知识点总结【思维导图】二、氮气(N 2):1.氮元素在自然界中的存在形式:既有游离态又有化合态。
空气中含N 2 占78%(体积分数)或75%(质量分数);化合态氮存在于多种无机物和有机物中,氮元素是构成蛋白质和核酸不可缺少的元素。
2.物理性质:纯净的氮气是无色无味的气体,密度比空气略小,难溶于水。
3.氮气的分子结构:氮分子(N 2)的电子式为,结构式为N ≡N 。
由于N 2分子中的N ≡N 键很牢固,所以通常情况下,氮气的化学性质稳定、不活泼。
4.氮气的化学性质:常温下氮气很稳定,很难与其它物质发生反应,但这种稳定是相对的,在一定条件下(如高温、放电等),也能跟某些物质(如氧气、氢气等)发生反应。
⑴ N 2的氧化性:① 与H 2化合生成NH 3 N 2 +3H 22NH 3〖说明〗 该反应是一个可逆反应,是工业合成氨的原理。
② 镁条能在N 2中燃烧 N 2 + 3Mg ==== Mg 3N 2(金属镁、锂均能与氮气反应)Mg 3N 2易与水反应:Mg 3N 2 + 6H 2O === 3Mg(OH)2 + 2NH 3↑〖拓展延伸〗镁条在空气中点燃发生的反应有: 2Mg + O 2 ==== 2MgO N 2 + 3Mg ==== Mg 3N 2 2Mg + CO 2 ==== 2MgO + C ⑵ N 2与O 2化合生成NO : N 2 + O 22NO〖说明〗 在闪电或行驶的汽车引擎中会发生以上反应。
5.氮气的用途:⑴ 合成氨,制硝酸;⑵ 代替稀有气体作焊接金属时的保护气,以防止金属被空气氧化;⑶ 在灯泡中填充氮气以防止钨丝被氧化或挥发;⑷ 保存粮食、水果等食品,以防止腐烂;⑸ 医学上用液氮作冷冻剂,以便在冷冻麻醉下进行手术;⒆O 2(加热、催化剂) 4HNO 3(浓)==4NO 2↑+2H 2O+O 2↑ 强氧化性 不稳定性 HNO 3 NaNO 2 ⑽NaOH ⒄Mg N 2O 4 ⒃H 2O NH 3.H 2O NH 3 N 2 NO NO 2 Ag(NH 3)2+ NH 4Cl ⒀AgNO 3 ⒁NaOH ⒂HCl ⑿Δ ⑾H 2O Mg 3N 2 ⑵Cl 2、(23)CuO ⑴H 2 ⑶O 2(放电) ⑷NH 3 ⑸O 2 ⑹ ⑺ ⑻Cu ⒅HCl ⒇Cu 、(21)Fe 2+、、(22)I — ①与金属反应:Cu 、Fe ②与非金属反应:C 、S ③Fe 、Al 在冷、浓HNO 3 钝化④Pt 、Au 能溶解于王水(浓HNO 3:浓HCl=1:3) ⑤与还原性化合物反应:Fe 2+、SO 2、H 2S 、HI 有机物 硝化反应:C 6H 6 酯化反应:C 3H 5(OH)3 ⑼ Δ (24)Δ 点燃 点燃 点燃 点燃⑹ 利用液氮制造低温环境,使某些超导材料获得超导性能。


氮气的性质和用途①合成氨,制硝酸;②代替稀有气体作焊接金属时的保护气,以防止金属被空气氧化;⑧在灯泡中填充氮气以防止钨丝被氧化或挥发;④保存粮食、水果等食品,以防止腐烂;⑤医学上用液氮作冷冻剂,以便在冷冻麻醉下进行手术;⑥利用液氮制造低温环境,使某些超导材料获得超导性能。
氮元素在自然界中的存在形式既有游离态又有化合态。
空气中含N278%(体积分数)或75%(质量分数);化合态氮存在于多种无机物和有机物中,氮元素是构成蛋白质和核酸不可缺少的元素•氮气的物理性质和化学性质:(1)物理性质:纯净的氮气是无色气体,密度比空气略小,氮气在水中的溶解度很小,在常压下101kPa,-195.8℃氮气变成无色液体,-209.9℃变成雪花状固体。
氮气的分子结构:氮分子(N2)的电子式为,结构式为N≡N,由于N2分子中的N≡N 键很牢固,所以通常情况下,氮气的化学性质稳定、不活泼。
(2)化学性质:氮分子化合价为0价,既可以升高也可以降低,说明氮气既有氧化性又有还原性。
①N2与H2化合生成NH3:说明:该反应是一个可逆反应,是工业合成氨的原理。
②N2与金属反应(Mg Ca Sr Ba)反应:③N2与O2化合生成NO:说明:在闪电或行驶的汽车引擎中会发生以上反应。
1.氮气(1)氮的固定使空气中游离态的氮转化为化合态氮的过程。
(2)氮气的性质①物理性质纯净的N2是一种无色无味的气体,难溶于水,在空气中约占总体积的4/5。
②化学性质通常情况下,N2化学性质很稳定,只在高温、放电、催化剂等条件下才能发生一些化学反应。
a.与H2反应:N2+3H2高温、高压催化剂2NH3。
b.与O2反应:N2+O2放电或高温2NO。
2.氮的氧化物氮有多种价态的氧化物:N2O、NO、N2O3、NO2、N2O4、N2O5等。
完成NO和NO2的比较表:特别提醒(1)氮的氧化物都是大气污染物。
(2)空气中NO2是造成光化学烟雾的主要因素。
(4)NO2:既有氧化性又有还原性,以氧化性为主。

3.2 氮的循环一、自然界中氮的循环:1.氮的存在形态氮是地球上含量丰富的一种元素,以游离态的形式存在于大气中,以化合态的形式存在于动植物体、土壤和水体中。
2.氮在自然界中的循环➢在自然界中豆科植物根部的根瘤菌把空气中的氮气转变为硝酸盐等含氮的化合物。
➢在放电条件下,空气中少量的N2与O2化合生成NO,NO和O2迅速生成NO2并随水进入土壤和水体。
➢人们通过化学方法把空气中的N2转化为NH3,再根据需要进一步转化成各种含氮化合物(如HNO3、氮肥等)。
二、氮气:1.物理性质➢色味态:无色无味气体➢溶解性:难溶于水➢密度:比空气略小2.化学性质放电2NO➢与氧气:N2+O2=====➢与氢气:N2+3H22NH3➢与镁:N2+3Mg点燃Mg3N23.用途➢氮气是合成氨,制硝酸的重要原料➢氮气因为性质稳定,经常用作保护气,比如用于焊接金属➢液氮可用作冷冻剂,应用于医学领域4、氮的固定(1) 概念:使空气中游离态的氮转化为含氮化合物的过程(2) 分类:➢自然固氮:主要包括生物固氮和高能固氮➢人工固氮:主要包括合成氨固氮和仿生固氮三、氮的氧化物:12. 注意事项:➢酸酐的问题:N2O3是亚硝酸的酸酐,N2O5是硝酸的酸酐➢颜色的问题:只有NO2是红棕色气体,其余均为无色气体➢污染的问题:氮的氧化物都具有毒性,而且都是大气污染物,3. NO和NO2(1)物理性质➢色味态:NO是无色无味气体,NO2是红棕色有刺激性气味的气体➢溶解性:NO难溶于水,NO2易溶于水➢密度:NO比空气略小,NO2比空气大(2) 相互转换➢NO→NO2:2NO+O2====2NO2➢NO2→NO:3NO2+ H2O====2HNO3 + NO(3)影响➢NO:是传递神经信息的“信使分子”,但容易与血红蛋白结合而使人体缺氧。
➢NO2:能损坏多种织物和尼龙制品,对金属和非金属材料有腐蚀作用。
四、氨气:1.物理性质(1)NH3是无色、有刺激性气味、极易溶于水的气体,常温时,1体积水大约溶解700体积的氨气。

氮的循环一、氮在自然界中循环1、氮的固定使空气中游离态的氮转化为含氮化合物的过程叫氮的固定,简称固氮。
正是通过氮的固定,开始了氮在自然界中的循环,氮的固定有自然固氮和人工固氮两种方式。
2、自然固氮(1)生物固氮:大豆、蚕豆等豆科植物的根部含有根瘤菌,能把空气中的N2转变为硝酸盐,被植物吸收。
故豆类植物不需要施用氮肥,这种固氮方式占整个自然固氮的90%。
(2)高能固氮:通过闪电等高能量途径把N2固定的方式为高能固氮。
涉及到的反应主要有:N2+O22NO 2NO+O2=2NO2 3NO2+H2O=2HNO3+NO可知,N2最终变成HNO3,即正常的雨水略呈酸性。
HNO3与土壤中的矿物作用,得到硝酸盐,被植物吸收,这就是“雷雨发庄稼”的科学道理。
3、人工固氮人们在工业生产中把N2转化为氮的化合物的方法为人工固氮,又叫工业固氮。
常见的方法有:(1)N2与H2合成NH3:,该反应为工业制HNO3的基础反应。
(2)仿生固氮:用某些金属有机化合物做催化剂,实现常温、常压固氮,这些金属有机物类似于根瘤菌,故又叫仿生固氮,这是目前科学界较为关注的研究性课题。
4、氮在自然界中的循环人们在生产活动中也涉及到了氮的循环,其中主要是利用N2与H2合成工业中重要的生产原料——NH3,即人工固氮。
涉及到两种很重要的物质:NH3、HNO3。
二、氮循环中的重要物质及其变化1、氮气,常况下是一种无色无味的气体,难溶于水,通常无毒。
氮气占空气体积总量的78.12%,是空气的主要成份。
氮气的化学性质很不活泼,只在特殊条件下,才能以下反应。
①与氧气反应:通常状况下氮气和氧气不反应,但在放电条件下,却可以直接化合生成NO。
反应的化学方程式为:★N2+O2闪电2NO②与氢气反应:在高温、高压、催化剂作用下,氮气和氢气可以反应制得氨气。
反应的化学方程式为:★N2 + 3H22NH3 此反应是工业合成氨的反应③与金属镁反应:金属镁可以在氮气中燃烧,生成氮化镁。

高一化学必修二氮知识点归纳氮是化学元素周期表中的第7号元素,原子序数为7,符号为N,它是自然界中广泛存在的元素之一。
氮具有多种化合价,可以形成丰富的化合物,对于我们的生活以及工业生产都有着重要的作用。
接下来,我们将对高一化学必修二的氮知识点进行归纳,以便更好地理解和掌握相关的知识。
一、氮的性质1. 物理性质氮是一种无色、无臭、无味的气体,密度较空气略大,极不溶于水,并不支持动物的呼吸。
由于氮气的稳定性较高,能够稳定地存在于大气中,占据空气的78%。
2. 化学性质氮是一种相对惰性的元素,不易与其他元素发生反应。
它在常温常压下,不与大部分金属和非金属直接反应,但它能够与一些高活性的金属(如锂、铝等)和氧气在高温高压下反应生成相应的氮化物。
3. 物理性质在高温高压下,氮能够与氢气反应生成氨气(NH3)。
氨气是一种无色气体,具有刺激性气味,能够溶于水,形成氨水溶液,呈碱性。
二、氮的存在形式及重要化合物1. 氮的存在形式氮主要存在于空气中,占据空气的78%。
此外,在土壤中也存在着大量的氮,通过植物吸收和生物循环,进入到生物体中。
氮还以无机形式存在于水体中,例如硝酸盐(NO3-)和铵离子(NH4+)。
2. 氮的重要化合物氮与氧气反应可生成氮氧化物,其中最常见的是一氧化氮(NO)和二氧化氮(NO2)。
这两种氮氧化物对于空气质量影响较大,可引发酸雨等环境问题。
另外,氨(NH3)是氮的重要化合物之一。
氨广泛用于农业中的肥料生产,也用于工业上的合成反应。
此外,硝酸(HNO3)和硫酸(H2SO4)是含氮的酸性氧化物,用于制备氮酸盐和肥料。
三、氮的应用1. 农业应用氮是植物所需的重要营养元素之一,对植物的生长发育具有重要影响。
因此,在农业生产中,善于利用氮肥可以提高作物产量和质量。
例如,尿素是一种常用的氮肥,可有效地为植物提供氮元素。
2. 工业应用氮在工业领域有着广泛的应用。
气体氮可以作为惰性气体用于包装、保护和储存易氧化的物质。
通过上一节的学习,我们知道,在一百多种元素中,组成单质及化合物种类最多的元素是碳元素。
那么,你知道地球上含量最丰富的一种元素是什么元素吗?那就是氮元素,氮元素广泛存在于大气、水体、动植物体以及土壤中。
那么,你知道这些氮元素是如何循环的吗?氮元素的循环对我们的环境和地球上的生命又有什么意义呢?研习教材重难点研习点1 氮在自然界中的循环1.自然界中氮元素循环示意图2.主要形式(1)游离态→化合态①是豆科植物根部的根瘤菌,把氮气转变为硝酸盐等含氮化合物;②放电条件下,与氧气结合为氮氧化合物,并随降水进入水体中;③合成氨工厂、汽车发动机都可以将一部分氮气转化成化合态。
(2)化合态→游离态:硝酸盐在某些细菌作用下转化成氮气。
(3)化合态→化合态:化石燃料燃烧、森林和农作物枝叶燃烧所产生的氮氧化合物通过大气进入陆地和海洋,进入氮循环。
【领悟·整合】氮是维持高等动植物生命活动的必须元素,因此,氮的循环涉及到地球上生物圈的各个方面。
人类活动也在逐渐的影响到氮循环。
所以,认识氮的循环,就把我们将要学习的物质置于“氮的循环”这个大的背景下,将会更有利于同学们掌握氮及其化合物的性质。
3.氮气与氮的固定(1)氮气的物理性质:无色无味气体,难溶于水,与空气密度相近。
(2)氮气的化学性质:【知识·链接】氮气属于双原子分子,两个氮原子之间的作用非常强。
因此,氮气分子稳定,化学性质不活泼,但要注意,N 2一旦吸收能量变为N 原子则性质较活泼。
在高温或放电时可与某些物质反应,N 表现为既有氧化性,又有还原性。
①与O 2的反应在放电条件下,氮气跟氧气能直接化合生成无色的一氧化氮(NO )。
反应式为:N 2+O 22NO说明:在雷雨天气,汽车的发动机中均可以发生该反应。
在该反应中,N 2表现出还原性。
②与H 2反应N 2+3H 2高温、高压催化剂2NH 3说明:a 该反应是工业上合成氨的反应原理,具有非常重要的现实意义。


氮(化学元素)详细资料大全氮是一种化学元素,它的化学符号是N,它的原子序数是7。
氮是空气中最多的元素,在自然界中存在十分广泛,在生物体内亦有极大作用,是组成胺基酸的基本元素之一。
氮及其化合物在生产生活中套用广泛。
基本介绍•中文名:氮•外文名:nitrogen•元素符号:N•原子量:14.0067•元素类型:非金属单质•原子序数:7•发现人:卡尔·威尔海姆·舍勒发现简史,含量分布,同位素,理化性质,物理性质,化学性质,制备方法,套用领域,工业套用,生理作用,元素固定,对植物影响,营养平衡,注意事项, 发现简史1772年由瑞典药剂师舍勒发现,后由法国科学家拉瓦锡确定是一种元素。
氮气1787年由拉瓦锡和其他法国科学家提出,氮的英文名称nitrogen,是"硝石组成者“的意思。
中国清末化学家启蒙者徐寿在第一次把氮译成中文时曾写成“淡气”,意思是说,它“冲淡”了空气中的氧气。
元素名来源于希腊文,原意是“硝石”。
含量分布氮在地壳中的含量很少,自然界中绝大部分的氮是以单质分子氮气的形式存在于大气中,氮气占空气体积的百分之七十八。
氮的最重要的矿物是硝酸盐。
元素性质数据氮在地壳中的重量百分比含量是0.0046%,总量约达到4×10 12吨。
动植物体中的蛋白质都含有氮。
土壤中有硝酸盐,例如KNO 3。
在南美洲智利有硝石矿(NaNO 3),这是世界上唯一的这种矿藏,是少见的含氮矿藏。
宇宙星际已发现含氮分子,如NH 3、HCN等。
氮的丰度1.8×10占16位。
自然界的氮有两种同位素,分别为99.63%、0.365%。
同位素Z(p)N(n)质量(u)半衰期原子核自旋相对丰度相对丰度的变化量7 3 10.04165(43) 200(140)×10s [2.3(16) MeV] (2-) 7 4 11.02609(5) 590(210)×10s [1.58(+75-52) MeV] 1/2+ 740(60) keV 6.90(80)×10s 1/2- 7 5 12.0186132(11) 11.000(16) ms 1+ 7 6 13.00573861(29) 9.965(4) min 1/2- 7 7 14.0030740048(6) 稳定1+ 0.99636(20) 0.99579-0.99654 7 8 15.0001088982(7) 稳定1/2- 0.00364(20) 0.00346-0.00421 7 9 16.0061017(28) 7.13(2) s 2- 7 10 17.008450(16) 4.173(4) s 1/2- 7 11 18.014079(20) 622(9) ms 1- 7 12 19.017029(18) 271(8) ms (1/2)- 7 13 20.02337(6) 130(7) ms 7 14 21.02711(10) 87(6) ms 1/2-# 7 15 22.03439(21) 13.9(14) ms 7 1623.04122(32)# 14.5(24) ms [14.1(+12-15) ms] 1/2-# 7 1724.05104(43)# <52 ns 7 18 25.06066(54)# <260 ns 1/2-# 理化性质物理性质在室温下不与空气,碱,水反应,加热到3273K时,只有0.1%分解,因此,N 2是化学特性物质,氮的最重要的矿物是硝酸盐。

氮元素在自然界中的存在形式
一、氮元素在自然界中的存在形式
氮元素是自然界中最丰富和最重要的元素之一,是生命的重要组成部分,它在自然界中存在着多种形式。
它可以以气体、液体、固体、水溶质等各种形式存在,也可以以氨基酸、核酸、蛋白质和其他有机物等多种形式存在。
1、氮的气体形式
地球大气中的氮气占大气总量的大约78%,是大气中最丰富的气体。
氮气中含有氮原子和N2分子,但也可以发生氧化反应,形成NO2、NO3等氮氧化物,以及形成氨和氮氧化物离子,这些物质都是制造肥料等的原料。
2、氮的液体形式
大气中的氮气也可以形成液体。
由于温度的降低,氮气中的气体可以降解为液态氮,液态氮的温度较低,状态稳定,很难转变为气态,因此可以作为超低温冷冻设备的冷却剂,在医学、农业等领域有重要的应用。
3、氮的固体形式
还有一些重要的氮固体,包括氮酸、氰化物、氧化物等,它们的稳定性都很强,可以用作某些医药、杀虫剂等的原料,也可以用作肥料的添加剂,改善土壤的肥力,使农作物得到正常的生长。
4、氮的水溶质形式
在土壤和水体中,氮的水溶物形式也有着重要的地位,它们可以
是氮的氧化物,如硝酸根、硝酸铵、亚硝酸根和亚硝酸铵,也可以是有机氮,如氨基酸和氨基苯甲酸等,它们可以提供植物所需要的氮元素,并参与氮循环的生物链中。
5、氮的有机形式
在水环境中,氮可以以多种有机形式存在,如氨基酸、核酸、蛋白质和其他有机物等,这些物质是植物和动物的重要组成部分,也是其生命活动的基础。
植物除了可以直接从土壤中吸收外,还可以从水中以有机形式吸收,这是植物在生长和生存中不可缺少的重要要素。

氮在自然界中的存在形式氮是一种重要的化学元素,在自然界中以多种形式存在。
以下是氮在自然界中的一些主要存在形式:1. **大气中的氮气**:氮气是大气中最主要的成分之一,约占大气的 78%。
氮气是一种无色、无味、无臭的气体,通常不活泼,不易与其他物质发生反应。
2. **硝酸盐和亚硝酸盐**:硝酸盐和亚硝酸盐是氮的化合物,常见于土壤、水体和生物体中。
它们可以通过氮的硝化和反硝化过程形成,对植物的生长和生态系统的氮循环起着重要作用。
3. **蛋白质和氨基酸**:氮是组成蛋白质和氨基酸的重要元素。
蛋白质是生物体的重要组成部分,存在于动物、植物和微生物体内。
氨基酸则是构成蛋白质的基本单位。
4. **氨**:氨是一种具有刺激性气味的气体,在自然界中可以通过生物过程或化学反应产生。
氨在一些生态系统中起着重要的作用,但高浓度的氨可能对环境和生物造成危害。
5. **氮化物**:氮可以与其他元素形成各种氮化物,如氯化铵、硝酸铵等。
这些氮化物在农业、化工和工业领域有广泛的应用。
6. **生物体中的核酸**:核酸,如 DNA 和 RNA,也含有氮。
氮在核酸中的存在对于遗传信息的传递和生物体的正常功能具有关键意义。
7. **土壤中的有机氮**:土壤中含有各种有机氮化合物,这些化合物是土壤肥力的重要指标之一。
它们可以来自动植物残体、排泄物和分解过程。
氮在自然界中的存在形式多样,并且在生态系统的氮循环中起着关键作用。
氮的转化和流动受到生物、化学和环境因素的影响,对维持生态平衡和生物的生存至关重要。
此外,人类活动,如农业施肥、工业生产和化石燃料燃烧等,也对氮在自然界中的分布和循环产生重要影响。
了解氮的存在形式有助于我们更好地理解生态系统和环境问题,并采取相应的措施来保护和管理氮资源。
氮的多种存在形式氮是地球上最常见的元素之一,它在自然界中以多种不同的形式存在。
这些不同的形式对于地球的生态系统和人类的生活都具有重要的影响。
本文将介绍氮的多种存在形式及其在环境中的作用。
1. 氮气氮气是氮的最常见形式,占地球大气的78%。
氮气是由两个氮原子结合而成的稳定分子,化学式为N2。
由于氮气的化学键非常稳定,大部分生物体无法直接利用氮气进行生命活动。
然而,一些特定的微生物,如一些细菌和蓝藻,具备固氮能力,可以将氮气转化为可供其他生物利用的形式。
2. 氨氨是氮的一种溶解形式,化学式为NH3。
它在气态下具有强烈的刺激气味,是一种有毒气体。
然而,在水中,氨可以与水分子结合形成氨水(NH4OH)。
氨水是一种碱性溶液,在工业生产和农业中有广泛的应用。
例如,氨水被用作肥料和清洁剂。
3. 亚硝化物和硝化物亚硝化物(NO2-)和硝化物(NO3-)是氮的氧化形式。
它们是细菌在氮循环中产生的中间产物。
亚硝化物和硝化物在土壤中起着重要的作用,可以被植物吸收并用作营养物质。
此外,硝化作用还有助于将土壤中过量的氨转化为硝酸盐,从而减少土壤中的氮污染。
4. 有机氮有机氮是指以氮为组成元素的有机物。
它们包括蛋白质、核酸、氨基酸等生物体中常见的有机分子。
有机氮在生物体的构建和代谢过程中扮演重要的角色。
当有机物分解或燃烧时,有机氮会释放出来,并进入环境中。
5. 氮化合物氮化合物是指氮与其他元素形成化合物。
例如,硝酸盐(NO3-)和铵盐(NH4+)是常见的氮化合物。
硝酸盐可以溶解在水中,并在高浓度下对水生生物带来危害。
铵盐被广泛用作肥料,提供植物所需的氮元素。
总结:氮以多种形式存在于环境中,包括氮气、氨、亚硝化物、硝化物、有机氮和氮化合物。
这些不同形式的氮在地球的生态系统中发挥着重要的作用,如为植物提供营养、促进氮循环以及调节水体中的氮含量等。
了解氮的多种存在形式有助于我们更好地管理和保护地球的生态环境。
(注:本文所介绍的氮的多种存在形式及其作用仅为举例,实际上氮还存在其他形式和作用。
氮元素的形态-概述说明以及解释1.引言1.1 概述氮是自然界中常见的元素之一,作为生命体和生态系统中不可缺少的组成部分,氮元素的存在形态和循环方式对地球生态系统的平衡具有重要影响。
本文将对氮元素的形态、在自然界中的循环以及对环境的影响进行深入探讨,旨在揭示氮元素在生态环境中扮演的重要角色。
通过对氮元素的研究,可以更好地认识和利用自然界中的资源,同时也有助于保护生态环境的可持续发展。
1.2 文章结构文章结构:本文将首先介绍氮元素的存在形态,包括氮气、氨、硝酸盐等形式,然后探讨氮元素在自然界中的循环过程,包括氮的固氮、腐解、硝化、还原等过程,最后分析氮元素对环境的影响,包括对水体、土壤和大气的影响。
通过对氮元素形态和循环过程的全面了解,可以更好地认识氮元素在自然界中的作用和对环境的影响,为环境保护和可持续发展提供科学依据。
1.3 目的目的部分的内容应该明确阐述本文的写作目的,即对氮元素的形态进行深入的探讨和分析,包括氮元素存在的不同形态、在自然界中的循环过程以及其对环境的影响。
通过本文的阐述,读者可以更全面地了解氮元素在自然界中的存在形态和重要性,促进人们对氮元素的认识和理解,以便更好地保护环境和促进可持续发展。
2.正文2.1 氮元素的存在形态氮元素在自然界中存在着多种形态,主要包括氮气(N2)、氨(NH3)、硝酸盐(NO3-)、亚硝酸盐(NO2-)、氮化合物和有机氮。
其中,氮气是大气中最主要的氮形态,占据了大气中78的成分,是地球上最丰富的元素之一。
氮元素的有机形态主要存在于植物和动物的生物体内,以及土壤中的有机物中。
此外,氮元素还以无机形式存在于土壤中的氨、硝酸盐和亚硝酸盐等形式。
这些形态的存在对于生物体和生态系统的生长和营养具有重要意义。
2.2 氮元素在自然界中的循环氮元素在自然界中的循环是一个复杂而重要的过程。
氮元素主要以气体氮的形式存在于大气中,占据了大气中78的成分。
在自然界中,氮元素通过氮固定、氮硝化、氮化还原等过程不断循环。
氮气的存在形式和分布氮气(N2)是地球大气中最主要的成分之一,占据了大气的约78%。
它在大气中以不同的形式存在,并参与了许多重要的地球化学过程,对地球生态系统的平衡起着重要作用。
首先,我们可以看到氮气以分子态(N2)的形式存在于大气中。
氮气是由两个氮原子(N)通过三键结合形成的稳定分子。
这些氮气分子以高度稀薄的形式存在于大气中,可以被吸入我们的肺部。
虽然氮气在人类活动中并没有直接的用途,但它对维持地球生态系统的平衡至关重要。
此外,氮气还以其他形式存在,比如在大气中的颗粒物中。
这些颗粒物包含固态或液态的氮化物化合物,如氨(NH3)和氮氧化物(NOx)。
这些颗粒物不仅来自自然过程,比如火山爆发和海洋生物排泄物的分解,也来自人类活动,比如化石燃料燃烧和工业排放。
这些氮化物颗粒物往往是对人类健康和环境有害的,因为它们可以造成酸雨和大气污染。
另外,氮气还以大气中的亚硝酸盐(NO3-)和铵盐(NH4+)的形式存在。
这些化合物通常来自于大气中的氮气分子的氧化和还原反应。
大气中的闪电和太阳辐射可以将氮气转化为亚硝酸盐和铵盐。
这些化合物进一步以形成了植物生长必需的氮素形式。
在土壤中,氮素被植物吸收,并成为植物生长和发育的关键营养元素。
随着植物的生长和死亡,氮素也会重新输入到土壤中。
此外,氮气还以氨或亚甲基胺的形式存在于全球大气中。
这些氨化合物主要来自于农业活动,比如肥料的施用和动物排泄物的分解。
氮气的这种存在形式对农作物生产至关重要,但是它也可能导致水体的富营养化现象,对水体生态系统产生负面影响。
总之,氮气以分子态(N2)的形式是地球大气中最常见的组分之一,同时它还以亚硝酸盐、铵盐、氨等形式存在于大气中。
这些不同的形式和分布使得氮气参与了大量的地球化学过程,包括植物生长和发育、大气污染和水体富营养化等。
对于地球生态系统的平衡和人类的生存,深入了解氮气的存在形式和分布是十分重要的。
氮在大自然中的作用
氮是大自然中的一种重要的无机元素,它可以在多种形式中存在,包括氮气,尿素,硝酸盐和氨等。
它在许多生物过程中起着重要的作用,并且在自然界中具有广泛的应用。
其次,氮在动物体内也起着重要作用。
动物吸收土壤中的氮以满足其生长和发育所需的营养,这些氮可以是氨或尿素等氮的化合物。
氮不仅是蛋白质的重要组成部分,还可以被利用来合成脂肪,碳水化合物,核酸等物质。
此外,氮也是动物体内激素的重要组成部分,激素可以调节生长,发育和代谢等多种生理过程。
最后,氮在生态系统中也起着重要作用。
氮是植物生长和发育的重要营养物质之
一,植物会将土壤中摄入的氮转化为蛋白质,脂肪和碳水化合物等物质。
而动物则可以通过食用植物来获取氮,从而满足其生长和发育所需的营养要求。
氮的循环也可以推动生态系统的发展和稳定,保持生态系统的多样性和平衡性。
总之,氮在大自然中扮演着重要的角色,它可以被植物和动物利用来满足其生长和发育的营养需求,也可以促进生态系统的发展和稳定。
因此,我们应该重视氮的重要性,珍惜大自然中所赋予我们的氮福利。