电镜切片样品制作步骤
- 格式:docx
- 大小:20.63 KB
- 文档页数:2

透射电镜生物样本制备流程及注意事项透射电镜(Transmission Electron Microscope,简称TEM)是一种使用电子束而不是光束进行成像的显微镜。
它可以提供高分辨率的图像,因此被广泛应用于生物样本的观察和研究。
然而,由于其特殊的工作原理和生物样本的复杂性,透射电镜生物样本的制备过程需要注意一些关键的步骤和细节。
下面将逐步介绍透射电镜生物样本制备流程及注意事项。
一、样品固定1.选择合适的固定剂:固定剂的选择应根据所研究的样本类型和要观察的细胞结构而定。
常用的固定剂包括戊二醛(glutaraldehyde)、乙酰化亚胺(acrolein)、纤维蛋白素(formaldehyde)等。
2.采取合适的固定时间和固定温度:固定时间和温度应根据固定剂的要求和样本的特性进行优化。
通常情况下,固定时间为数小时至数天,温度在4℃至25℃之间。
3.注意透射电镜样品的固定深度:样品应保持较小的厚度以便透射电子束的穿透。
二、样品剖解1.剖解细胞膜:通常采用超声波振荡或冷冻断裂等方法来剖解细胞膜。
超声波振荡可用于含有细胞膜的细胞或组织,而冷冻断裂则适用于脆弱细胞和膜脂体系。
2.剖解细胞核:利用离心裂解法可以将细胞核分离出来。
离心裂解可分为机械法和渗透法两种,机械法利用高速离心的作用将细胞核分离,而渗透法则是通过渗透剂将细胞核溶胀并破碎。
三、样品固化1.脱水:样品在固定后需要进行脱水处理,以便在后续的步骤中更好地渗透和浸透。
常用的脱水剂有乙醇、丙酮和乙醚等,脱水过程往往需要进行多次重复。
2.浸透:在脱水后,样品需要在树脂中进行浸透,使其固化为坚硬的样品。
通常采用环氧树脂或比较稳定的丙烯酸树脂来进行浸透。
这一步骤通常需要较长时间,如数小时甚至数天。
3.树脂填充:浸透后的样品需要在模具中进行树脂填充,并在适当的温度下进行固化。
树脂填充的过程需要注意排除气泡和避免过度填充。
四、样品切片1.选择合适的切割工具和方法:样品通常使用切片机和切片刀进行切割。

样品处理步骤:
样品包埋
1、将组织切成
的小快儿,立即投入3%的戊二醛固定液
中,抽气直到组织块完全进入固定液,4摄氏度固定过夜。
2、经PBS充分洗涤(离心管中洗10次,每次15分钟),用0.1%
的锇酸后固定,25摄氏度,2小时
3、换离心管用0.1M PBS充分洗涤(洗10次,每次15min),乙醇
系列脱水,每次10min;纯丙酮过度,3次,每次10min。
4、浸透,0、5ml Spurr树脂+5滴丙酮
5、包埋:70摄氏度聚合
6、制超薄切片
7、切片捞在100目0.3%Formvar膜覆盖的镍网上。
染色
用2%的醋酸铀25摄氏度染色10min,用重蒸水洗3次,每次20min 再用柠檬酸铅25摄氏度染色5min,用重蒸水洗三次,每次20min。
电镜观察。

TEM电镜样品制作程序一、试剂1.磷酸缓冲液(Milloning p buffer)A液:2.53%NaH2PO4.2H2O水溶液41.5mlB液:2.52%NaOH水溶液8.5ml (0.3M, 50ml, pH7.3)2. 固定液1). 戊二醛(4%):25%戊二醛原液16ml+DDW 50ml,摇匀后加p buffer 50ml,终pH7.0~7.42).锇酸(四氧化锇):配原液:1g+50ml DDW 2%配固定液:2%原液/p buffer=1/13.4. 染色液1).醋酸铀饱和乙醇溶液:醋酸铀5g,乙醇50ml2).柠檬酸铅染液:硝酸铅1.33g,柠檬酸钠1.76g,DDW 30ml二、常规操作步骤【第一天】取材取各组小白鼠♀♂各一只,处死后立即取小肠(消化管取材不应斜切,剪开管腔使之成片状,平铺,黏膜面朝上,最好将其四边固定,用生理盐水漂洗黏膜表面『注意:快,准,轻,小,冷』固定(前固定)戊二醛固定3~4h(可在戊二醛中长期保存--几周甚至1~2个月)『注意:固定液的酸碱度必须与被固定的组织的酸碱度基本保持一致,大多数动物组织酸碱度的平均值是7.4』用p buffer洗一次,共3次,后过夜【第二天】固定(后固定)向样品中加入0.2ml p buffer和0.2ml锇酸(共0.4ml,可事先在通风厨内配好),2h后用p buffer清洗样品(在通风厨内操作)『样品可在p buffer中保存』配包埋剂(大约需1h,每加入一种试剂需搅拌15min)脱水(丙酮系列)30%,50%,70%,80%,90%(各一次,15min/次),无水丙酮(2次,10min/次)『注意:脱水要彻底;若当天不能完成浸透、包埋操作,应将样品停留在4℃,70%乙醇或丙酮中过夜;脱水动作尽量要快,特别是100%脱水剂,更要注意样品块不要在空气中停留时间过长,否则会造成样品干燥』配下一步浸透用的丙酮/树脂(1/1,1/2)浸透(丙酮-树脂)丙酮/树脂=1/1,浸透1h(0.2ml,0.2ml)丙酮/树脂=1/2,浸透1h(0.2ml,0.2ml+0.2ml)纯树脂,浸透(2h后即可包埋,也可隔夜再包埋)包埋树脂加满样品槽,呈凸面,标签纸放中间,样品放两边『注意:包埋剂用前不能搅拌,以免产生气泡。

透射电镜样品制备步骤透射电镜是一种重要的材料表征技术,它利用电子的波动性和微粒性来观察材料的结构和性质。
为了能够使用透射电镜观察样品,首先需要对样品进行制备。
透射电镜样品制备步骤如下:1.选择合适的样品:透射电镜样品可以是固体、液体、薄膜或纳米颗粒等。
根据研究目的和样品性质选择合适的样品。
2.样品预处理:根据样品性质的不同,进行必要的预处理。
例如,对于固体样品,可以选择切割、抛光或电解抛光等方法来得到平滑的表面。
3.样品固定:将样品固定到透射电镜样品架上。
不同的样品有不同的固定方法。
例如,对于固体样品,可以使用导电胶将其固定在样品架上。
4.薄层制备:对于厚度过大的样品,需要将其制备成透明的薄层以便透射电镜观察。
常用的方法有机械研磨、电子束刻蚀或离子束刻蚀等。
5.样品清洁:将样品放入超声波清洗机中进行清洗,以去除可能附着在样品表面的杂质或污染物。
6.特殊处理:如果需要对样品进行特殊处理,例如加热、冷冻处理或受到特定环境气氛的影响等,根据需要进行相应的处理。
7.样品干燥:将样品放入真空或氮气环境中,以确保样品干燥。
避免样品受到水汽的污染。
8.获得薄片:使用切片机将固态样品切割成适当厚度的薄片。
为了获得高质量的薄片,可以选择特殊的切片工具和技术,例如离子束切片或低速钻磨切片。
9.薄片形状整理:使用不同的研磨和抛光方法,将薄片的形状和表面进行调整,以确保样品的平滑度和一致性。
10.网格制备:将薄片粘贴在透射电镜网格上。
网格可以增强样品的稳定性和保护,同时提供用于定位和标识的标记。
11.后续处理:根据研究目的和透射电镜分析的要求,可以对样品进行进一步处理。
例如,可以进行染色、脱膜、溅射或腐蚀等处理。
以上是透射电镜样品制备的一般步骤。
不同样品和研究目的可能会有所不同。
因此,根据具体的研究需求和样品特点,制备过程可以做相应的调整和优化。

A 悬浮培养的细胞、细菌、血细胞、精子等;细胞使用PBS或无血清培养基离心漂洗1~2次以去除血清,离心转速依据不同离心机、不同样品自定,总时间控制在5min内;细胞团根据预设浓度在适量2.5%戊二醛吹悬,滴加在预先置入青霉素小瓶中的托盘,4℃静置沉降2~3天,在托盘周围加入PBS,以防止样品干燥。
B贴壁培养的细胞:在培养皿中预先加入盖玻片,使细胞贴附于盖玻片上;PBS或无需请培养基漂洗后,放置在培养板室温固定1h,4℃3 h,注意放置干燥,自行转入青霉素小瓶中,加满PBS送检。
SEM标本处理必须使用玻璃容器,需明确所用盖玻片尺寸可以放入青霉素瓶。
C组织取材样品观察表面可达8~10mm2,高度小于5mm左右;样品表面在固定前必须清洁:使用生理盐水或PBS冲洗掉表面的灰尘以及不需要观察的蛋白、粘液等。
能够明确标识标本的观察面。
消化道、呼吸道、血管、生殖器官、泌尿等官腔内表面,尤其要注意先清洗再固定。
如需要观察脏器内结构,应依照不同的实验目的,决定目的脏器是否需要灌注清洗;固定2.5%戊二醛浸没标本,室温1h,4℃固定3h以上,换PBS送检。
附:2.5%戊二醛的配制Step 1:0.2M磷酸缓冲液的配制:---------------------磷酸二氢钠(NaH2PO4.H2O) 2.6克磷酸氢二钠(Na2HPO4.12H2O)29克双蒸馏水加至500毫升pH调至7.4Step 2:戊二醛固定液的配制:---------------------25% 戊二醛1ml双蒸馏水4ml0.2mol/L磷酸缓冲液5ml戊二醛最终浓度 2.5%pH值7.3-7.4一、培养细胞✧本方法适用于贴壁、悬浮培养的细胞;细菌;精子;血细胞等。
1.细胞数量:106或6孔板一孔的细胞达到生长面积的80%或以上。
2.离心收集:消化或用细胞刮刮下细胞。
如细胞状态一般或漂浮物较多,建议更换新培养基;如观察自噬,建议刮下细胞。
3.离心速度、时间依据不同离心机、不同样本自行定义,时间在5min内;4.细胞团大小:细胞最厚处约0.5~1.5mm,或者参照1元硬币的厚度;5.细胞离心成团后去除上清,加2.5%电镜用戊二醛500μl固定,切勿吹悬,室温1h,4℃3 h后,去除戊二醛加满PBS后4℃放置或送检。

透射电镜细胞样品制备流程以透射电镜细胞样品制备流程为标题,我们来介绍一下这个过程。
透射电镜(Transmission Electron Microscope,TEM)是一种高分辨率的显微镜,可以用来观察非常微小的细胞结构和内部细节。
为了获得高质量的透射电镜图像,样品的制备非常重要。
下面我们将详细介绍透射电镜细胞样品制备的流程。
第一步,收集细胞样品。
可以选择不同类型的细胞样品,如动物细胞、植物细胞或微生物细胞。
细胞样品可以从生物实验室中获得,也可以通过培养细胞来获取。
第二步,固定细胞样品。
固定是为了保持细胞在制备和观察过程中的形态和结构。
常用的固定剂有乙醛、戊二醛等。
将细胞样品与固定剂混合,使细胞膜和细胞器固定在原位,停止细胞内部的生化反应。
第三步,脱水样品。
将固定的细胞样品通过一系列浓度递增的乙醇溶液进行脱水处理。
脱水的目的是去除细胞内外的水分,使样品适合后续的浸渍和包埋。
第四步,浸渍和包埋样品。
将脱水后的细胞样品置于透明的有机溶剂中,如丙酮或环氧树脂。
浸渍的目的是使样品与嵌入剂之间充分接触,逐渐将有机溶剂替换为嵌入剂。
然后将样品转移到嵌入剂中,使细胞样品被完全包裹在固体嵌入剂中。
第五步,切片样品。
使用超薄切片机将包埋的细胞样品切成非常薄的切片,一般为50-100纳米。
切片的过程需要非常小心和精确,以确保切片的质量和一致性。
第六步,上膜样品。
将切好的细胞样品转移到透明的膜上,如碳膜或铜膜。
上膜的目的是增强样品的稳定性和导电性,以便在透射电镜中观察。
第七步,染色样品。
可以使用染色剂来增加样品的对比度和可见度。
常用的染色剂有重金属盐(如铋盐)和阴离子染料(如尼格罗红)。
染色的过程需要小心操作,以避免染料的过度使用或样品的损坏。
第八步,干燥样品。
将上膜和染色后的样品放置在通风设备中,使其自然干燥。
干燥后的样品可以储存在干燥剂中,以保持其稳定性和保存时间。
将制备好的样品放入透射电镜中进行观察。
通过透射电镜,我们可以获得高分辨率和高对比度的细胞图像,从而更好地研究细胞的结构和功能。



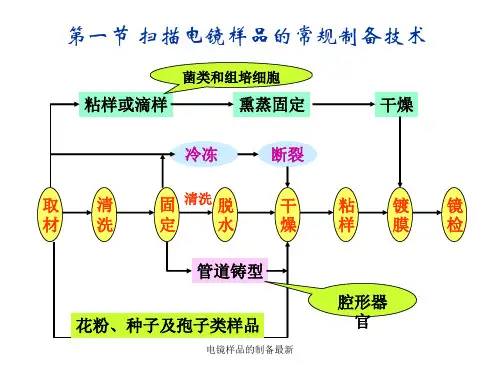
实验四电镜切片制作与观察实验目的了解扫描电镜生物样品的常规制备技术,重点掌握样品的表面处理方法,临界点干燥仪和离子溅射仪的结构与工作原理。
了解生物样品超薄切片的一般制备技术,重点掌握包埋与聚合、玻璃刀的制作、修块、铜网及其支持膜、切片厚度判断等。
了解H-7000透射电镜的结构及其工作原理,重点是镜筒系统。
实验原理1、电子束的特点穿透能力有限,不超过100nm。
2、电子成像机制电子成像的反差主要源于样品散射电子能力的差异。
3、生物样品的特点含水量高、质地柔软、对热和电子束敏感,散射电子的能力弱且差异小。
4、扫描电镜及常规扫描电镜生物样品制备技术(1)扫描电镜扫描电镜是一种利用电子束扫描样品表面从而获得样品信息的电子显微镜。
扫描电镜由三大部分组成:真空系统,电子束系统以及成像系统。
(2)扫描电镜样品制备要求扫描电镜以观察样品的表面形态为主。
扫描电镜样品的制备,必须满足以下要求:保持完好的组织和细胞形态;充分暴露欲观察的部位;良好的导电性和较高的二次电子产额;保持充分干燥的状态。
(3)扫描电镜样品制备流程某些含水量低且不易变形的生物材料,可以不经固定和干燥而在较低加速电压下直接观察,如动物毛发、昆虫、植物种子、花粉等。
对大多数的生物材料,则应首先采用化学或物理方法固定、脱水和干燥,然后喷镀碳与金属以提高材料的导电性和二次电子产额。
具体步骤包括:取材、清洗、固定、脱水、干燥(置换)、粘托、导电处理等。
5、透射电镜及超薄切片制备技术(1)透射电镜透射电镜是利用透射电子成像的电子显微镜。
透射式电子显微镜的总体结构包括镜体和辅助系统两大部分,镜体部分包含:照明系统(电子枪和聚光镜)、成像放大系统(样品室、物镜、中间镜和投影镜)、观察记录系统(观察室、照相室)。
辅助系统包含:真空系统(机械泵、扩散泵和真空阀)、电路系统(电源变换和调整控制)、水冷系统。
(2)透射电镜样品制备要求样品彻底干燥、要提高样品反差、样品要薄。

电镜检测流程引言:电子显微镜(electron microscope,简称EM)是一种利用电子束代替光束进行成像的显微镜。
相比光学显微镜,电子显微镜具有更高的放大倍数和更高的分辨率,因此在各个领域都有广泛的应用。
本文将介绍电镜检测的基本流程,以及常见的几种电子显微镜的类型。
一、样品制备在进行电镜检测之前,首先需要对待检样品进行制备。
样品制备的目的是使样品具备透射电镜或扫描电镜观察的条件。
1. 透射电镜样品制备:透射电镜需要制备非常薄的样品,通常要求样品厚度在100纳米以下。
常用的样品制备方法包括切片、薄膜法、冷冻法等。
切片法是将样品切成薄片,然后使用特殊的工具将薄片转移到铜网或碳膜上。
薄膜法是通过蒸发或溅射等方法在网格或碳膜上制备一层薄膜,然后将样品放置在薄膜上。
冷冻法是将样品冷冻至极低温,然后通过切片机将样品切成薄片。
2. 扫描电镜样品制备:扫描电镜对样品的制备要求相对较低,通常只需要将样品固定在导电底座上,并进行金属镀膜以增加导电性。
常用的固定方法包括化学固定、冻干法和浸渍法。
金属镀膜通常使用金或金-铂合金进行镀膜。
二、电镜操作步骤电镜检测的操作步骤包括样品安装、对焦调节、电子束参数设置、图像获取等。
1. 样品安装:将样品安装在电镜样品台上,并确保样品与电子束的路径对齐。
透射电镜需要将样品安装在透明的网格或碳膜上,而扫描电镜则将样品安装在导电底座上。
2. 对焦调节:通过调节透射电镜的对焦环,或者调节扫描电镜的工作距离,使样品处于最佳对焦状态。
对焦时需要根据样品的特点和检测要求进行调节。
3. 电子束参数设置:根据样品的性质和检测要求,设置透射电镜或扫描电镜的电子束参数。
透射电镜的参数包括透射电镜的加速电压、聚焦电流和透射电镜的模式等;扫描电镜的参数包括扫描电镜的加速电压、孔径和扫描速度等。
4. 图像获取:根据样品的特点和检测要求,选择合适的检测模式,并进行图像获取。
透射电镜可以通过透射模式获取样品的内部结构信息,而扫描电镜可以通过扫描模式获取样品表面的形貌信息。
电镜样品处理流程电镜样品处理流程可以分为以下几个步骤:1. 采集样品:根据需要,选择合适的样品进行采集。
样品可以是细胞、组织、材料等。
2. 传统固定:将样品进行固定处理,以保持其形态和结构的稳定性。
常用的固定剂有冰乙酸、乙醛、戊二醛等。
3. 脱水:将固定后的样品通过浓度递增的酒精溶液进行脱水处理,以去除组织中的水分。
常用的脱水溶液有30%,50%,70%,95%,100%的酒精。
4. 渗透:将脱水后的样品通过有机溶剂(如丙烯酸甲酯,或Epon等)进行渗透,使其逐渐转变为切片时易于切割和观察的坚硬物质。
5. 嵌包:将渗透后的样品置于嵌包物(如丙烯酮),并放入模具中固定,以形成坚硬的嵌包样品块。
6. 切片:将嵌包样品块进行切片处理,常用的切片工具有超薄切片机。
7. 上网:将切片后的样品片置于网状金属网底上,并使用适当的胶水或聚合物将其固定在网上。
8. 吐壳:将样品上的嵌包剂和其他杂质去除,使样品表面清晰可见。
可以使用酶解等方法。
9. 染色:根据需要,对样品进行染色处理,以增加对比度和观察效果。
常用的染色剂有重金属盐、酸性着色剂等。
10. 干燥:将染色后的样品片在通风处晾干,以去除残留的溶剂和水分。
11. 金属蒸镀:将样品片放置于金属蒸镀设备中,进行金属蒸镀处理,以增加样品的导电性,以便观察。
12. 观察和拍摄:将样品片放置在电子显微镜中,利用电子束对样品进行观察,可以通过摄像机等设备进行图像记录。
13. 分析和解释:根据观察到的图像和结构,进行分析和解释,得出相关结论。
14. 保存和归档:将样品片进行妥善保管,以备将来的研究和参考之用。
电镜切片样品制作步骤1.样品固定:首先需要选择适当的固定剂将待观察的样品固定在其中一种状态下。
常用的固定剂有冷冻醇、甲醛、醋酸乙烯等。
固定剂的选择需根据待观察的样品性质和研究目的进行确定。
2.洗涤:固定后的样品需要进行洗涤以去除固定剂和不需要的杂质。
常见的洗涤液包括磷酸盐缓冲液(PBS)和磷酸盐缓冲液。
洗涤的步骤和次数根据样品和实验要求可以有所不同。
3.电镜样品预备:电镜切片样品制作需要将洗涤后的样品处理成合适的状态。
通常情况下,样品需要进行脱水和浸渍。
脱水是将样品逐渐从水中转移到乙醇或丙酮中,以保持样品在固定状态。
浸渍是将样品浸入浸渍剂,使得样品透明并易于切片。
4.树脂包埋:将经过脱水和浸渍的样品置于树脂中浸泡,待树脂浸透后,进行树脂包埋。
这一步骤的目的是使样品更加稳定,并得到均匀的切片。
5.切片:经过树脂包埋后,使用超薄切片机进行切片。
切片机通常配备钻石刀,可以切割出纳米尺度的切片。
切片过程需要控制多个参数,如切片角度、速度、厚度等,以获取最佳的切片切面。
6.切片品质检查:将切片放置在显微镜下观察,检查切片的品质。
如果切片有较多的损伤、断裂或不透明的区域,可以重新进行切片。
7.网格染色:切片制备完成后,进行网格染色以提高对比度和观察的清晰度。
常用的网格染色方法有使用庞氏染色剂或重金属染色剂。
8.显影:将染色后的切片放入显影剂中进行显影,增强对比度和细节。
9.气相金属喷镀:一些样品需要进行气相金属喷镀以提高导电性。
将样品放入金属喷镀仪器中,通过高温蒸发金属薄膜,在样品表面形成导电薄膜。
10.观察和记录:将制备好的切片放置在电镜台上,使用透射电子显微镜进行观察。
在观察的同时,及时记录所见到的现象和数据。
综上所述,电镜切片样品制作是一个复杂的过程,需要经过固定、洗涤、预备、包埋、切片、染色、显影、喷镀等多个步骤。
每个步骤都需要合适的条件和操作技巧,才能得到理想的样品,为电镜观察提供准确、可靠的数据基础。
透射电镜细胞样品制备技术和观察方法(一)原理透射电子显微镜(transmission electron microscope,TEM)是利用阴极发射的电子,通过阳极中央的微孔形成的电子束穿透样品获得样品的电子信号,经物镜、中间镜和投影镜等多级电子放大至数百至数千万倍,最后成像在荧光屏上便可即时观察,或是投射到照相底片感光片上作为永久记录。
由于标本必须置于高真空中进行电镜观察,所以电镜观察的生物标本必须特殊制备,不能含水,离体的生物标本要迅速加以固定,以防产生结构改变。
另外,电子的穿透力很弱,这就需要把样品制成50nm~100nm厚的超薄切片(一个细胞切成100~200片)。
为了使柔软的生物组织能够制成这样薄的切片,并使切片耐受高真空和电子轰击,所以在切片前要进行包埋。
超薄切片技术是透射电镜观察成功的关键。
超薄切片制作样品过程大体分为取材、固定、漂洗、脱水、渗透包埋与聚合、切片、染色等。
细胞超薄切片技术中如何把细胞完整无损地从培养瓶皿壁上包埋下来是最大的难题。
新的定型产品无菌聚苯乙烯塑料薄膜的使用解决了这个难题,把薄膜放在培养瓶皿中,让细胞直接长在塑料薄膜上,不仅细胞生长效果好,而且可与细胞一起包埋切片,省去了许多麻烦。
(二)超薄切片基本操作步骤试剂和器具准备:(1)0.2 mol/L PBSA液:磷酸氢二钠(Na2HPO4·2H2O)35.61g加双蒸水溶解至1000ml。
B液:磷酸二氢钠(NaH2PO4·2H2O)31.21g加双蒸水溶解至1000ml。
(2)2.5%戊二醛(C5H8O2)固定液:25%戊二醛10ml,0.2mol/L PBS 50ml,加双蒸水40ml。
(3)1%四氧化锇(OsO4)固定液1)2%储存液:取1g OsO4 安瓿泡酸48h,冲洗48h,双蒸水漂洗30mins。
干后用玻璃刀刻划1或2道痕,置入棕色磨口瓶,加双蒸水50ml,用力摇动使安瓿破碎。
静止48h OsO4溶解后备用。
A 悬浮培养的细胞、细菌、血细胞、精子等;
细胞使用PBS或无血清培养基离心漂洗1~2次以去除血清,离心转速依据不同离心机、不同样品自定,总时间控制在5min内;细胞团根据预设浓度在适量2.5%戊二醛吹悬,滴加在预先置入青霉素小瓶中的托盘,4℃静置沉降2~3天,在托盘周围加入PBS,以防止样品干燥。
B贴壁培养的细胞:
在培养皿中预先加入盖玻片,使细胞贴附于盖玻片上;PBS或无需请培养基漂洗后,放置在培养板室温固定1h,4℃3 h,注意放置干燥,自行转入青霉素小瓶中,加满PBS送检。
SEM标本处理必须使用玻璃容器,需明确所用盖玻片尺寸可以放入青霉素瓶。
C组织取材
样品观察表面可达8~10mm2,高度小于5mm左右;
样品表面在固定前必须清洁:使用生理盐水或PBS冲洗掉表面的灰尘以及不需要观察的蛋白、粘液等。
能够明确标识标本的观察面。
消化道、呼吸道、血管、生殖器官、泌尿等官腔内表面,尤其要注意先清洗再固定。
如需要观察脏器内结构,应依照不同的实验目的,决定目的脏器是否需要灌注清洗;
固定2.5%戊二醛浸没标本,室温1h,4℃固定3h以上,换PBS送检。
附:2.5%戊二醛的配制
Step 1:
0.2M磷酸缓冲液的配制:
---------------------
磷酸二氢钠(NaH2PO4.H2O) 2.6克
磷酸氢二钠(Na2HPO4.12H2O)29克
双蒸馏水加至500毫升
pH调至7.4
Step 2:
戊二醛固定液的配制:
---------------------
25% 戊二醛1ml
双蒸馏水4ml
0.2mol/L磷酸缓冲液5ml
戊二醛最终浓度 2.5%
pH值7.3-7.4
一、培养细胞
✧本方法适用于贴壁、悬浮培养的细胞;细菌;精子;血细胞等。
1.细胞数量:106或6孔板一孔的细胞达到生长面积的80%或以上。
2.离心收集:消化或用细胞刮刮下细胞。
如细胞状态一般或漂浮物较多,建议更换新培养
基;如观察自噬,建议刮下细胞。
3.离心速度、时间依据不同离心机、不同样本自行定义,时间在5min内;
4.细胞团大小:细胞最厚处约0.5~1.5mm,或者参照1元硬币的厚度;
5.细胞离心成团后去除上清,加2.5%电镜用戊二醛500μl固定,切勿吹悬,室温1h,4℃
3 h后,去除戊二醛加满PBS后4℃放置或送检。
✧注意:固定细胞不需要吹悬,细胞不宜过多,过多会导致固定液无法迅速渗透到底部细
胞;
二、生物组织
迅速剪下/切下相应位置,在2.5%戊二醛中,依据不同组织和实验目的,用刀片修成1mm3的小块或__mm2×2mm长条或薄片状。
在2.5%戊二醛室温1h,4℃3 h,去除戊二醛加满PBS,4℃放置或送检。
标本固定时,尽量修饰成合适的形状,对于需要定位的标本,离开实验室者后比较难以确认所需要的位置。
使用2ml圆底或尖底的EP管,勿用500μl以下的EP管。
✧块状标本基本包含的组织类型:脑、肾、肝、肺、心肌;
✧长条状、薄片状标本基本包括:
骨骼肌、平滑肌:肌纤维方向与标本长轴平行或垂直(送样时说明方向)
皮肤、毛囊:皮肤角质层与长轴平行;
神经、直径在2mm内的小血管:其长轴与标本块长轴平行的长条
消化道、大血管:长条片状,一侧是上皮、内皮细胞面,或依据目的去除无用的分层脑皮质、海马、耳蜗等:具有方向性或需横切或纵切面或需要组织中某一特定位置的标本;
具体到某些组织,可能会有不同的要求,如观察海马CA1区,建议标本取片状或近似三角形的片状或梯形(比较好)。
直观的说,小块直径约为1元硬币厚度;长度的短轴约为1元硬币的厚度;具体大小根据标本会有相应的调整,但都已小尺寸为佳。