胱抑素C及其临床应用
- 格式:ppt
- 大小:29.00 KB
- 文档页数:10

胱抑素C的临床应用及研究进展2楚雄彝族自治州人民医院 675000摘要:血清胱抑素C(cystatin C,CysC)因其具有稳定的内源性标志物特性,越来越受到研究人员和临床关注。
除了已成熟应用于肾脏功能损害评估外,研究发现其在心血管病、糖尿病、甲状腺疾病以及Alzheimer病等多种疾病的诊断、疗效监测及预后评估中,同样具有较好应用前景。
本文就CysC与上述疾病的临床应用及研究进展综述如下。
关键词:胱抑素C;临床应用;研究进展1CysC的生物学特征CysC由有核细胞恒速合成,它在人体组织和体液中广泛分布,是一种由人有核细胞产生的低分子的非糖基化蛋白。
CysC对包括组织蛋白酶家族在内的半胱氨酸肽酶具有主要的保护作用,在参与多种生理和病理生理过程,如抗原的加工和呈递,以及炎症和癌变过程[1]。
在调节细胞外蛋白分解中过程中,血清CysC浓度的异常可能提示有病理学意义。
CysC作为反映早期肾功能不全的敏感指标已得到普遍应用,近年来,在糖尿病肾病早期,高血压肾病,心血管疾病和甲状腺疾病等疾病中作为相关标记物不断得到深入研究。
2 CysC与肾脏疾病肾脏功能对机体内环境平衡十分重要,如肾功能损伤会对机体产生严重影响。
临床早期肾功能损害若能够及时进行治疗,可逆转发生细胞外基质增生、肾小球基底膜增厚等病理变化从而避免损伤肾小球血管。
如未能及早治疗会发展为终末期肾脏疾病。
CysC是肾功能辅助诊断理想的生物标志物,它恒速产生,自由过滤,并最终分解代谢。
患者肾功能损伤后CysC在血液中的含量会随肾小球滤过功能变化而变化。
在发展成肾衰竭时,血清CysC含量可高于正常水平的10倍。
最新研究表明,CysC不仅可以评估肾小球滤过率(GFR,glomerular filtrationrate),还可以预测肾损伤。
Herget-Rosenthal等人研究发现,血清 CysC作为一种有用的急性肾损伤检测标志物优于肌酐和肾小球滤过率来评估肾功能的有效性[1]。

胱抑素C和视黄醇结合蛋白在早期肾损伤的临床应用胱抑素C和视黄醇结合蛋白是两种在早期肾损伤中起着重要作用的蛋白。
它们可以通过临床检测来预测并监测患者的肾功能状况,为早期肾损伤的诊断和治疗提供了重要依据。
本文将从这两种蛋白的生物学特性、临床应用以及未来发展方向等方面进行介绍和讨论。
1. 胱抑素C和视黄醇结合蛋白的生物学特性胱抑素C(Cystatin C)是一种分子量为13kDa的蛋白质,由核磁共振结构测定显示其成果析状态是一个单一的蛋白质,并且其分子结构成果动态显示无二级结构具有无定型特点。
胱抑素C主要由肾小管上皮细胞合成,而且其不受肝脏功能的影响,因此更能准确地反映肾小球滤过率。
近年来,研究发现胱抑素C不仅对早期肾损伤有较高的敏感性,而且对于预测肾功能的下降也有较高的准确性。
视黄醇结合蛋白(Retinol-binding protein,RBP)是一种血浆蛋白,主要由肝脏合成。
其主要功能是结合视黄醇,使其转运到细胞内进行代谢所需。
RBP与胱抑素类似,可作为早期肾功能损伤的标志物。
近年来的研究表明,RBP与肾功能的下降密切相关,因此在临床上也得到了广泛的应用。
(1)早期诊断:胱抑素C和视黄醇结合蛋白可以用来进行早期肾损伤的诊断。
研究表明,这两种蛋白的浓度在肾损伤发生前就会发生变化,因此可以作为早期诊断肾功能异常的生物标志物。
(2)监测疾病进展:对于慢性肾脏疾病患者来说,胱抑素C和视黄醇结合蛋白的测定可以帮助医生监测疾病的进展情况,及时调整治疗方案。
(3)评估治疗效果:在肾损伤的治疗过程中,胱抑素C和视黄醇结合蛋白的检测可以帮助医生评估治疗的效果,指导下一步的治疗方案。
随着临床医学的不断发展和技术的进步,胱抑素C和视黄醇结合蛋白在早期肾损伤的应用将会更加广泛。
我们可以通过建立更加完善的检测方法来提高这两种蛋白的检测准确性和灵敏性。
我们可以将这两种蛋白与其他生物标志物相结合,建立多项指标联合检测的方法,提高早期肾损伤的诊断和监测水平。

一文了解胱抑素C的临床应用胱氨酸蛋白酶抑制剂的超家族在1981年明确了人类胱抑素C(Cystatin C)的氨基酸系列,但它没有显示与当时已知的任何超家族蛋白系列的同源性,事实证明它属于一个新的蛋白超家族。
图1. 人类胱抑素C的氨基酸系列和结构示意图阴影区域是木瓜蛋白酶——类似半胱氨酸蛋白酶的抑制位点,它与由Asn残基组成的legumain抑制位点不重叠;箭头所示Leu残基,在脑出血时,它被Gln残基代替产生胱抑素C的变异体;星号所示Pro3残基,被部分羟基化。
图2. (A) 根据胱抑素C二聚体推出的胱抑素C的单体(B)在胱抑素C的结晶体中发现人类胱抑素C分子是八聚体胱抑素C的氨基酸序列是胱抑素家族中第一个被检测的系列,但直到两年后,只有当研究者检测了鸡胱抑素的结构,并发现此两种蛋白44%的氨基系列相同,才确定胱抑素C的功能――半胱氨酸蛋白酶的抑制剂。
又经二十年的研究,发现了另外十种人类半胱氨酸蛋白酶的抑制剂,并且发现它们与胱抑素C和鸡胱氨酸蛋白酶抑制剂有很强的同源性。
因此,它们都属于人胱抑素超家族。
人胱抑素家族目前由11种已明确的蛋白组成。
胱抑素家族1由胱蛋白酶抑制剂A和B组成,是唯一的细胞内蛋白;胱抑素家族2由胱抑素C,D,E,F,S,SA和SN组成,它们主要是细胞外和/或细胞间转运蛋白;胱抑素家族3由高和低分子量的激肽原(Kininogen)组成,它们主要是血管内蛋白,除了是半胱氨酸蛋白酶的抑制剂外,它们也参与凝结过程和血管活性肽的产生。
表1. 人胱抑素超家族胱氨酸蛋白酶抑制剂的超家族胱抑素C除了是木瓜蛋白酶——类似半胱氨酸蛋白酶的抑制剂外,最近被证实,它还能抑制半胱氨酸蛋白酶的其它家族成员,比如人legumain肽酶家族C13一种经典酶。
同时也发现这两个抑制点是不重叠的(图1),所以一个胱抑素C 分子能同时抑制半胱氨酸蛋白酶的不同类型。
最近还发现胱抑素C在动脉粥样硬化中,抗原呈递中都起一定作用,并且是中性干细胞的生长因子。




胱抑素C的生物学特性及临床应用·胱抑素C(Cystatin C,Cys C),又名γ2痕迹碱性蛋白或后γ球蛋白,是半胱氨酸蛋白酶抑制剂蛋白质中的一种。
编码Cys C的基因能在所有的有核细胞内以恒定速度持续转录与表达,无组织特异性,故Cys C可在体内以恒定速度产生,并存在于各种体液之中,尿液中最低,不受年龄、性别、体重、炎症等因素影响,(研究表明Cys C自1岁后到60岁前在血液中浓度恒定)。
其分子量小(13KD),等电点(PI)为9.3,生理条件下带正电荷,能自由从肾小球滤过,完全被肾小管上皮细胞重吸收并于细胞内降解,不重新回到血液中;同时肾小管上皮细胞也不分泌Cys C至管腔内。
因此,其血清浓度主要由GFR决定(Cys C理所当然的成为反映肾小球滤过情况的重要指标)。
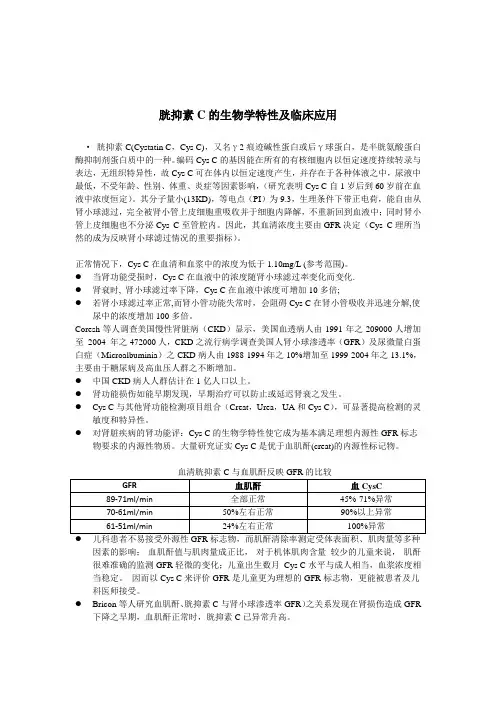
正常情况下,Cys C在血清和血浆中的浓度为低于1.10mg/L (参考范围)。
●当肾功能受损时,Cys C在血液中的浓度随肾小球滤过率变化而变化.●肾衰时, 肾小球滤过率下降,Cys C在血液中浓度可增加10多倍;●若肾小球滤过率正常,而肾小管功能失常时,会阻碍Cys C在肾小管吸收并迅速分解,使尿中的浓度增加100多倍。
Coresh等人调查美国慢性肾脏病(CKD)显示,美国血透病人由1991年之209000人增加至2004 年之472000人,CKD之流行病学调查美国人肾小球渗透率(GFR)及尿微量白蛋白症(Microalbuminia)之CKD病人由1988-1994年之10%增加至1999-2004年之13.1%,主要由于糖尿病及高血压人群之不断增加。
●中国CKD病人人群估计在1亿人口以上。
●肾功能损伤如能早期发现,早期治疗可以防止或延迟肾衰之发生。
●Cys C与其他肾功能检测项目组合(Creat,Urea,UA和Cys C),可显著提高检测的灵敏度和特异性。
●对肾脏疾病的肾功能评:Cys C的生物学特性使它成为基本满足理想内源性GFR标志物要求的内源性物质。



胱抑素C检测及其在肾脏相关疾病中的应用胱抑素C(Cystatin C)是一种由核糖体合成的无糖蛋白,主要存在于细胞核和胞浆中,是一种非甘氨酸蛋白酶抑制剂。
它在体内含量较低,主要通过肾脏滤过排泄,故而被认为是肾小球滤过率的良好指标。
胱抑素C检测已经成为评估肾功能的重要指标之一,也被广泛应用于肾脏相关疾病的诊断和治疗过程中。
一、胱抑素C检测的原理及意义1. 原理胱抑素C是一种由核糖体合成的无糖蛋白,主要存在于细胞核和胞浆中。
正常情况下,胱抑素C主要通过肾小球滤过排泄,不再被肾小管再吸收,因此肌酐清除率的测定可以比较客观地反映肾小球滤过功能。
而当肾小球滤过率下降时,由于肾脏滤过率以肌酐的清除率为代表的现有指标的局限性,导致可能低估肾小球滤过率。
而胱抑素C并无在肾小管重吸收,能更加全面地反映肾脏功能。
2. 意义胱抑素C检测的主要意义在于它能够更准确地反映肾小球滤过功能,是诊断与监测肾功能损害的重要指标,尤其在肾小球滤过率较高或低的情况下,胱抑素C能提供更准确的肾功能评估。
胱抑素C与肌酐和尿酸等传统指标相比,对肾功能的变化更为敏感,能够更早地发现肾脏损害。
1. 慢性肾病慢性肾脏病是一种常见的疾病,在临床上往往被忽视,临床表现不典型,而且易被其他疾病所掩盖。
胱抑素C的检测可以更早地发现慢性肾脏病的发生,提高治疗效果,在慢性肾脏病患者中,肌酐清除率的测定结果受到许多因素的影响,如年龄、肌肉量和膳食摄入量,胱抑素C尤其适用于老年患者和肌肉量不足的患者,同时可以识别出约20%的慢性肾脏病早期患者,帮助做出早期干预。
2. 急性肾损伤急性肾损伤是肾功能急剧下降的临床综合征,胱抑素C的检测可以更快地发现急性肾损伤,有助于早期诊断和治疗。
在感染、手术、药物中毒等导致急性肾损伤的患者中,胱抑素C的升高可以更早地发现肾功能的改变,指导临床治疗。
3. 糖尿病肾病糖尿病肾病是糖尿病患者常见的并发症之一,易导致肾功能的不全甚至肾功能衰竭。
血清胱抑素C肾功能血清胱抑素C(Cystatin C)是一种蛋白质,其浓度可以反映肾功能的状态。
近年来,人们对血清胱抑素C作为评估肾功能的指标越来越关注。
本文将重点讨论血清胱抑素C在肾功能评估中的应用。
一、胱抑素C与肾功能的关系血清胱抑素C是由全身的核糖体产生,在正常情况下会通过肾小球滤过,而没有被肾小管重吸收或分泌。
因此,血清胱抑素C的水平可以反映肾小球滤过功能的状态。
二、血清胱抑素C的优势相比于传统的肌酐指标,血清胱抑素C有一些明显的优势。
首先,血清胱抑素C受到生理因素的干扰较少,不受肌肉质量、性别和年龄等因素影响,更加准确地反映肾功能。
其次,血清胱抑素C的测量简便快捷,不需要考虑肌肉质量和身高等因素的修正。
三、血清胱抑素C的临床应用1. 早期慢性肾脏疾病的筛查由于血清胱抑素C对肾小球滤过率的敏感性较高,可以在早期发现肾小球滤过率下降,从而帮助筛查潜在的慢性肾脏疾病患者。
2. 糖尿病肾病的监测糖尿病肾病是糖尿病患者最常见的并发症之一,通过监测血清胱抑素C的水平,可以及早评估糖尿病患者的肾功能状态,指导治疗和预防糖尿病肾病的进展。
3. 药物剂量调整的参考指标一些药物的排泄依赖于肾功能,例如肌酐清除率常用于调整肾脏调整剂量。
而血清胱抑素C可以更准确地评估肾小球滤过功能,因此对于一些需要调整剂量的药物,血清胱抑素C可以作为参考指标。
4. 肾移植术后监测肾移植术后,监测受者的肾功能状态非常关键。
血清胱抑素C作为一种敏感指标,可以及时反映出受者的肾功能恢复情况,为及时调整免疫抑制剂剂量等提供参考。
综上所述,血清胱抑素C作为一种新的肾功能指标,可以为肾功能的评估和监测提供更准确的信息。
然而,血清胱抑素C的使用还需要进一步的研究和验证,以确保其具有更广泛的应用前景。
希望本文可以为读者对血清胱抑素C肾功能的认识提供一定的帮助。
- 完 -。
人胱抑素C检测试剂盒的研发及相关临床应用的开题报告一、选题背景人胱抑素C(Cystatin C,Cys C)是一种小分子量的非糖化性蛋白质,由细胞合成并分泌。
Cys C严格地由肾小球滤过并完全被肾小管回吸收,因此其血浆水平完全依赖于肾小球滤过率(GFR)的改变。
与肾小球滤过率密切相关的肾功能的评价指标如肌酐等有其自身固有的局限性,肌酐的代谢受到年龄、性别、肌肉量等因素的影响,不能准确反映肾小球滤过率的变化。
相比之下,Cys C的血清水平受年龄、性别、肌肉质量等因素的影响较小,适用于广泛的人群。
因此,Cys C成为现今被认为最优的无肌肉质量偏差的肾功能评价指标,也被纳入美国和欧洲肾脏病医学会推荐的肾功能评价指南中。
目前,广泛应用于Cys C检测的是免疫测定法,然而该方法存在一些局限性,如与不同动物物种蛋白的交叉反应、同种蛋白不同异构体间的识别、检测的灵敏度等方面存在亟待解决的问题。
因此,利用其他的Cys C检测方法,例如,细胞色素C动态检测法、凝胶等电聚焦的方法、质谱法等,至为急需。
为了进一步推广和优化Cys C的检测方法,本次研究拟开展基于辣根过氧化酶标记技术的人胱抑素C检测试剂盒的开发及相关临床应用。
二、研究目的本研究旨在开发一种高灵敏度、高特异性、可在线检测人胱抑素C的辣根过氧化酶标记技术检测方法,为临床肾功能评价提供可靠的工具,促进肾脏疾病的早期诊断和防治。
三、研究内容1.开发基于辣根过氧化酶标记技术的人胱抑素C检测试剂盒。
包括多重多抗夹心ELISA试剂盒、辣根过氧化酶标记免疫电泳技术检测方法等。
2.建立人群中人胱抑素C的基础水平和相关因素的对比分析及临床评价。
选择一定数量的正常人、不同年龄、不同性别、不同种族、不同疾病及疾病不同程度的肾病患者,采用开发的基于辣根过氧化酶标记技术的人胱抑素C检测试剂盒进行定量检测,分析其基础水平及各因素间的相关性。
3.评价基于辣根过氧化酶标记技术的人胱抑素C检测试剂盒的应用价值。