聚氯乙烯╱聚乙烯╱聚偏二氯乙烯固体药用复合硬片
- 格式:doc
- 大小:644.00 KB
- 文档页数:103

药用聚氯乙烯(PVC)硬片生产工艺摘要:PVC药用片主要由聚氯乙烯(PVC)树脂添加一定的加工助剂,通过挤出、压延等加工方法,生产出来的符合药用要求的一种新颖包装材料。
药品的铝塑料泡罩包装又称水包眼包装,英文名为“Press Through Package”,简称“PTP”包装。
PTP包装是先将塑料薄片输送到电热器上使之软化,再将薄片置于模具内,然后从上模内向薄片充入压缩空气或在下模内抽真空,使薄片形成泡罩或空穴,成型后冷却,将药品置入泡罩内,药用铝箔涂有粘合剂的一面在生定的温度、压力、时间条件下与已装有药品的塑料薄片热封,形成泡罩包装。
PTP 包装材料包括药用铝箔、塑料硬片等,这一章主要介绍用于PTP包装的塑料硬片。
PTP包装是由德国LAWSON MARDON SINGEN公司和BOSCH公司在20世纪50年代中期共同开发的。
PTP包装的应用使药品的单件包装走上成功之路。
PTP包装具有很大的优点:首先给患者提供了一次剂量的药品包装,既方便又经济;其次PTP包装保护药品的性能好,生产效率高,成本低,贮存占有的空间小,重量轻,运输方便;再次就是安全性好,由于PTP包装上可以印上文字说明,发药者和服药者均可避免错药的发生。
在我国,PTP铝塑包装的发展可追溯到20世纪80年代。
85年以前,我国生产的药品片剂、胶囊都采用玻璃瓶或简单塑料袋包装,在使用上和药品保质期以及用药安全性方面带来许多问题。
84年以后,国内由杭州塑料厂(杭州塑料工业有限公司前身)开发成功聚氯乙烯(PVC)药用包装硬片,使PTP铝塑包装——这一新颖的包装得到药厂的普遍欢迎,并迅速发展成为片剂、胶囊的主要包装形式。
PTP铝塑泡罩包装中所用到的面层材料,最常见的是PVC药用片和以PVC药用片为基材涂覆或复合其它功能性高分子材料是金属材料而成的系列复合材料,这些材料主要是聚偏二氯乙烯(PVDC)、聚三氟氯乙烯(PCTFE)、尼龙(PA)、聚乙烯(PE)、铝箔(AL)等等。

药用聚氯乙烯硬片检验标准1、目的:确保公司因生产需要而购进的包装材料符合规定的要求。
2、适用范围:本检验规程适用于以卫生级聚氯乙烯树脂为主要原料经炼塑、压延制成的透明药用聚氯乙烯薄片,主要做固体药品(片剂、胶囊剂等)泡罩包装的材料(以下简称PVC)。
3、质量标准和检验方法:3.1各种PVC应符合我司的样品(包括双方确认的材质等)或设计稿,并达到相应规格要求及配合尺寸。
3.2 外观要求与检验方法:3.2.1表面:PVC表面不允许有裂纹、伤痕、凹凸发皱、穿孔、析出、缺边;条状气泡3mm以上不允许有,3mm及3mm以下每平方米不超过10颗。
3.2.2卷取:平整、卷紧,切边整齐,不允许有漏切。
3.2.3接头数:每卷不得超过2个,每段长度应为10米以上(若接头在2个以上5个以下的,则由车间统计好损失的卷膜米数及浪费的人工,到时请供方折合成卷膜补偿给我司)。
3.2.4色泽:必须符合确认的标准样品,并在封样的上限/标准/下限范围内。
3.2.5洁净度:PVC卷内外不得有污染、灰尘;晶点在1.3mm以上不允许有,1.3mm及1.3mm以下每100cm2不超过3颗;黑点、白点杂质每平方米中粒径在0.3-0.8mm不超过20颗,0.8mm以上的不允许有;不允许油污。
3.2.6外包装:包装箱上应标明产品名称、容量、生产厂名、生产日期、数量、检验者代号等信息,同时包装纸箱不得脏及破损并内衬塑料保护袋,用胶带“工”字形封箱,出厂前产品必须附出厂检验报告单。
外观检验以目测为主,于正常光源下,60cm距离处正视观察。
3.3功能(物理机械性能)要求与检测方法:3.3.1拉伸强度试验:拉伸强度应大于450kgf/cm2。
检验方法:按GB 1040-79《塑料拉伸试验方法》进行。
3.3.2落球冲击破损试验:破损率应小于40%。
检验方法:按GB 5663-85的相应方法进行。
3.3.3加热伸缩率试验:加热伸缩率应为±7%。
检验方法:按GB 5663-85的相应方法进行。

药包材标准中药用复合硬片质量要求及测试方法药包材标准中药用复合硬片质量要求及测试方法介绍泡罩包装是将产品封合在透明塑料薄片形成的泡罩与底板(用纸板、塑料薄膜或薄片,铝箔或他们的符合材料制成)之间的一种包装方法,主要应用有药品包装行业,底板主要材质为各种不同材质复合成的药用复合硬片。
泡罩包装形式具有以下几种特点:1.包装透明直观。
2.药品使用方便。
3.相比于瓶或其他包装形式质量更为轻便。
4.对内容物的保护性较好。
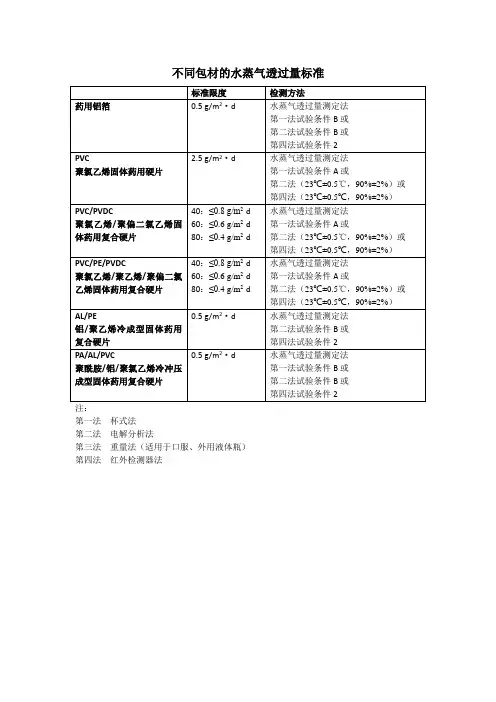
一、参考标准(部分):YBB00212005-2015聚氯乙烯固体药用硬片YBB00222005-2015聚氯乙烯、聚偏二氯乙烯固体药用复合硬片YBB00232005-2015聚氯乙烯、低密度聚乙烯固体药用复合硬片YBB00242002-2015聚酰胺、铝、聚氯乙烯冷冲压成型固体药用复合硬片YBB00182004-2015铝、聚乙烯冷成型固体药用复合硬片YBB00202005-2015聚氯乙烯、聚乙烯、聚偏二氯乙烯固体药用复合硬片二、测试项目及测试方法介绍1、水蒸气透过量取试样适量,照水蒸气透过量测定法YBB00092003-2015中第一法实验条件A或第二法(试验温度23℃±0.5℃,相对湿度90%±2%)或第四法(试验温度23℃±0.5℃,相对湿度90%±2%)测定,不得过2.5g/(m²·24h)。
第一法:杯式法,一般适用于水蒸气透过量不低于2 g/(m²·24h)的薄膜薄片。
第二法:电解分析法,水蒸气遇电极电解为氢气和氧气,通过电解电流的数值计算出一定时间内透过单位面积试样的水蒸气透过总量的分析方法。
第四法:红外检测器法(仲裁法)。
水蒸气从高湿向低湿渗透过程中,由载气传送到红外检测器产生一定量的电信号,通过输出的电信号计算出样品水蒸气透过量的分析方法。
2、氧气透过量取样品适量,照气体透过量测定法YBB00082003-2015第一法测定,不得超过30cm³/(m²·24h·0.1MPa)第一法:压差法,药用薄膜或薄片将低压室和高压室分开,高压室充约0.1MPa的实验气体,低压室体积已知。


YBB药包材标准(1~6辑)目录第一辑YBB00012002低密度聚乙烯输液瓶(试行)YBB00022002聚丙烯输液瓶(试行)YBB00032002钠钙玻璃输液瓶(试行)废止,新标准号YBB00032005YBB00042002药用氯化丁基橡胶塞(试行)YBB00052002药用溴化丁基橡胶塞(试行)YBB00062002低密度聚乙烯药用滴眼剂瓶(试行)YBB00072002聚丙烯药用滴眼剂瓶(试行)YBB00082002口服液体药用聚丙烯瓶(试行)YBB00092002口服液体药用高密度聚乙烯瓶(试行)YBB00102002口服液体药用聚酯瓶(试行)YBB00112002口服固体药用聚丙烯瓶(试行)YBB00122002口服固体药用高密度聚乙烯瓶(试行)YBB00132002药品包装用复合膜、袋通则(试行)YBB00142002药品包装材料与药物相容性试验指导原则(试行)第二辑YBB00152002药品包装用铝箔YBB00162002铝质药用软膏管YBB00172002聚酯/铝/聚乙烯药品包装用复合膜、袋YBB00182002聚酯/低密度聚乙烯药品包装用复合膜、袋YBB00192002双向拉伸聚丙烯/低密度聚乙烯药品包装用复合膜、袋YBB00202002聚氯乙烯/聚乙烯/聚偏二氯乙烯固体药用复合硬片YBB00212002聚氯乙烯固体药用硬片YBB00222002聚氯乙烯/聚偏二氯乙烯固体药用复合硬片YBB00232002聚氯乙烯/低密度聚乙烯固体药用复合硬片YBB00242002聚酰胺/铝/聚氯乙烯冷冲压成型固体药用复合硬片YBB00252002聚乙烯/铝/聚乙烯复合药用软膏管废止,新标准号YBB00252005YBB00262002口服固体药用聚酯瓶YBB00272002钠钙玻璃药瓶YBB00282002低硼硅玻璃管制口服液体瓶YBB00292002硼硅玻璃管制注射剂瓶废止,新标准号YBB00292005-1、YBB00292005-2YBB00302002低硼硅玻璃管制注射剂瓶YBB00312002钠钙玻璃模制注射剂瓶YBB00322002硼硅玻璃安瓿废止,新标准号YBB00322005-2YBB00332002低硼硅玻璃安瓿YBB00342002多层共挤输液用膜、袋通则第三辑YBB00012003细胞毒性检查法YBB00022003热原检查法YBB00032003溶血检查法YBB00042003急性全身毒性检查法YBB00052003皮肤致敏检查法YBB00062003皮内刺激检查法YBB00072003原发性皮肤刺激检查法YBB00082003气体透过量测定法YBB00092003水蒸气透过量测定法YBB00102003剥离强度测定法YBB00112003拉伸性能测定法YBB00122003热合强度测定法YBB00132003密度测定法YBB00142003氯乙烯单体测定法YBB00152003偏二氯乙烯单体测定法YBB00162003内应力测定法YBB00172003耐内压力测定法YBB00182003热冲击和热冲击强度测定法YBB00192003垂直轴偏差测定法YBB00202003平均线热膨胀系数的测定法YBB00212003线热膨胀系数的测定法YBB00222003砷、锑、铅浸出量的测定法YBB00232003三氧化二硼测定法YBB00242003121℃内表面耐水性测定法和分级第四辑YBB00262003硼硅玻璃药用管废止,新标准号YBB00012005-1、YBB00012005-2 YBB00272003低硼硅玻璃药用管YBB00282003钠钙玻璃药用管YBB00292003硼硅玻璃输液瓶废止,新标准号YBB00022005-2YBB00302003低硼硅玻璃模制药瓶YBB00312003硼硅玻璃模制注射剂瓶废止,新标准号YBB00062005-2YBB00322003低硼硅玻璃模制注射剂瓶YBB00332003钠钙玻璃管制注射剂瓶YBB00342003药用玻璃成份分类及其试验方法YBB00352003低硼硅玻璃管制药瓶YBB00362003钠钙玻璃管制药瓶YBB00372003抗生素瓶用铝塑组合盖YBB00382003口服液瓶撕拉铝盖YBB00392003外用液体药用高密度聚乙烯瓶YBB00402003输液瓶用铝塑组合盖第五辑YBB00072003原发性皮肤刺激检查法YBB00082003气体透过量测定法YBB00092003水蒸气透过量测定法YBB00102003剥离强度测定法YBB00112003拉伸性能测定法YBB00122003热合强度测定法YBB00132003密度测定法YBB00142003氯乙烯单体测定法YBB00152003偏二氯乙烯单体测定法YBB00162003内应力测定法YBB00172003耐内压力测定法YBB00182003热冲击和热冲击强度测定法YBB00192003垂直轴偏差测定法YBB00202003平均线热膨胀系数的测定法YBB00212003线热膨胀系数的测定法YBB00222003砷、锑、铅浸出量的测定法YBB00232003三氧化二硼测定法YBB00242003121℃内表面耐水性测定法和分级YBB00262003硼硅玻璃药用管YBB00272003低硼硅玻璃药用管YBB00282003钠钙玻璃药用管YBB00292003硼硅玻璃输液瓶YBB00302003低硼硅玻璃模制药瓶YBB00312003硼硅玻璃模制注射剂瓶YBB00322003低硼硅玻璃模制注射剂瓶YBB00332003钠钙玻璃管制注射剂瓶YBB00342003药用玻璃成份分类及其试验方法YBB00352003低硼硅玻璃管制药瓶YBB00362003钠钙玻璃管制药瓶YBB00372003抗生素瓶用铝塑组合盖YBB00382003口服液瓶撕拉铝盖YBB00392003外用液体药用高密度聚乙烯瓶YBB00402003输液瓶用铝塑组合盖YBB00012004低硼硅玻璃输液瓶YBB00022004硼硅玻璃管制口服液体瓶YBB00032004钠钙玻璃管制口服液体瓶YBB00042004硼硅玻璃管制药瓶YBB00052004硼硅玻璃模制药瓶YBB00062004预灌封注射器用硼硅玻璃针管YBB00072004预灌封注射器用氯化丁基橡胶活塞YBB00082004预灌封注射器用溴化丁基橡胶活塞YBB00092004预灌封注射器用不锈钢注射针YBB00102004预灌封注射器用聚异戊二烯橡胶针头护帽YBB00112004预灌封注射器组合件(带注射针)YBB00122004笔式注射器用硼硅玻璃珠YBB00132004笔式注射器用硼硅玻璃套筒YBB00142004笔式注射器用铝盖YBB00152004笔式注射器用氯化丁基橡胶活塞和垫片YBB00162004笔式注射器用溴化丁基橡胶活塞和垫片YBB00172004口服固体药用低密度聚乙烯防潮组合瓶盖YBB00182004铝/聚乙烯冷成型固体药用复合硬片YBB00192004双向拉伸聚丙烯/真空镀铝流延聚丙烯药品包装用复合膜、袋YBB00202004玻璃纸/铝/聚乙烯药品包装用复合膜、袋YBB00212004药品包装用铝塑封口垫片通则YBB00222004口服制剂用硅橡胶胶塞、垫片YBB00232004药用合成聚异戊二烯垫片YBB00242004塑料输液容器用聚丙烯组合盖YBB00252004胶囊用明胶YBB00262004包装材料红外光谱测定法YBB00272004包装材料不溶性微粒测定法YBB00282004乙醛测定法YBB00292004加热伸缩率测定法YBB00302004挥发性硫化物测定法YBB00312004包装材料溶剂残留量测定法YBB00322004注射剂用胶塞、垫片穿刺力测定法YBB00332004注射剂用胶塞、垫片穿刺落屑测定法YBB00342004玻璃耐沸腾盐酸浸蚀性的测定法和分级YBB00352004玻璃耐沸腾混合碱水溶液浸蚀性的测定法和分级YBB00362004玻璃颗粒在98℃耐水性测定法和分级YBB00372004砷、锑、铅、镉浸出量测定法YBB00382004抗机械冲击测定法YBB00392004直线度测定法YBB00402004药用陶瓷吸水率测定法YBB00412004药品包装材料生产厂房洁净室(区)的测试方法YBB00202005聚氯乙烯/聚乙烯/聚偏二氯乙烯固体药用复合硬片YBB00212005聚氯乙烯固体药用硬片YBB00222005聚氯乙烯/聚偏二氯乙烯固体药用复合硬片YBB00232005聚氯乙烯/低密度聚乙烯固体药用复合硬片YBB00042005注射液用卤化丁基橡胶塞YBB00052005注射用无菌粉末用卤化丁基橡胶塞第六辑YBB00072005药用低密度聚乙烯膜、袋YBB00082005注射剂瓶用铝盖YBB00092005输液瓶用铝盖YBB00102005三层共挤输液用膜(I)、袋YBB00112005五层共挤输液用膜(I)、袋YBB00122005药用固体纸袋装硅胶干燥剂YBB00132005药用聚酯/铝/聚丙烯封口垫片YBB00142005药用聚酯/铝/聚酯封口垫片YBB00152005药用聚酯/铝/聚乙烯封口垫片YBB00162005药用口服固体陶瓷瓶YBB00032005钠钙玻璃输液瓶替换YBB00032002YBB00292005-1高硼硅玻璃管制注射剂瓶替换YBB00292002YBB00292005-2中性硼硅玻璃管制注射剂瓶替换YBB00292002 YBB00322005-2中性硼硅玻璃安瓿替换YBB00322002YBB00012005-1药用高硼硅玻璃管替换YBB00262003YBB00012005-2药用中性硼硅玻璃管替换YBB00262003YBB00022005-2中性硼硅玻璃输液瓶替换YBB00292003YBB00062005-2中性硼硅玻璃模制注射剂瓶替换YBB00312003 YBB00252005药用聚乙烯/铝/聚乙烯复合软膏管替换YBB00252002 YBB00172005药用玻璃铅、镉、砷、锑浸出量限度YBB00182005药用陶瓷容器铅、镉浸出量限度YBB00192005药用陶瓷容器铅、镉浸出量测定法YBB00242005环氧乙烷残留量测定法YBB00262005橡胶灰分的测定法。
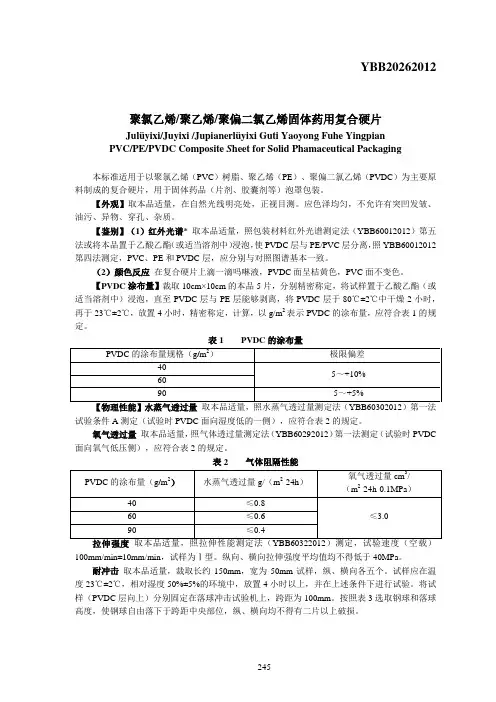
YBB20262012聚氯乙烯/聚乙烯/聚偏二氯乙烯固体药用复合硬片Julüyixi/Juyixi /Jupianerlüyixi Guti Yaoyong Fuhe Yingpian PVC/PE/PVDC Composite S heet for Solid Phamaceutical Packaging本标准适用于以聚氯乙烯(PVC)树脂、聚乙烯(PE)、聚偏二氯乙烯(PVDC)为主要原料制成的复合硬片,用于固体药品(片剂、胶囊剂等)泡罩包装。
【外观】取本品适量,在自然光线明亮处,正视目测。
应色泽均匀,不允许有突凹发皱、油污、异物、穿孔、杂质。
【鉴别】(1)红外光谱* 取本品适量,照包装材料红外光谱测定法(YBB60012012)第五法或将本品置于乙酸乙酯(或适当溶剂中)浸泡,使PVDC层与PE/PVC层分离,照YBB60012012第四法测定,PVC、PE和PVDC层,应分别与对照图谱基本一致。
(2)颜色反应在复合硬片上滴一滴吗啉液,PVDC面呈桔黄色,PVC面不变色。
【PVDC涂布量】裁取10cm×10cm的本品5片,分别精密称定,将试样置于乙酸乙酯(或适当溶剂中)浸泡,直至PVDC层与PE层能够剥离,将PVDC层于80℃±2℃中干燥2小时,再于23℃±2℃,放置4小时,精密称定,计算,以g/m2表示PVDC的涂布量,应符合表1的规定。
表1 PVDC的涂布量PVDC的涂布量规格(g/m2)极限偏差40-5~+10%6090 -5~+5%【物理性能】水蒸气透过量取本品适量,照水蒸气透过量测定法(YBB60302012)第一法试验条件A测定(试验时PVDC面向湿度低的一侧),应符合表2的规定。
氧气透过量取本品适量,照气体透过量测定法(YBB60292012)第一法测定(试验时PVDC 面向氧气低压侧),应符合表2的规定。
表2 气体阻隔性能PVDC的涂布量(g/m2)水蒸气透过量g/(m2·24h)氧气透过量cm3/(m2·24h·0.1MPa)40 ≤0.8≤3.060 ≤0.690 ≤0.4拉伸强度取本品适量,照拉伸性能测定法(YBB60322012)测定,试验速度(空载)100mm/min±10mm/min,试样为Ⅰ型。

国家食品药品监督管理局国家药品包装容器(材料)标准YBB00212005替代原YBB00212002聚氯乙烯固体药用硬片Julüyixi Gutiyaoyong YingpianPVC sheet for Solid Pharmaceutical Packaging本标准适用于以聚氯乙烯(PVC)树脂为主要原料制成的硬片,用于固体药品(片剂、胶囊剂等)泡罩包装。
【外观】取本品适量,在自然光线明亮处,正视目测。
应色泽均匀,不允许有凹凸发皱、油污、异物、穿孔、杂质。
每100cm2中,1.3mm及1.3mm以下的晶点,不得过3颗,不得有1.3mm以上的晶点。
【鉴别】 (1)红外光谱* 取本品适量,照包装材红外光谱测定法(YBB00262004)第四法应与对照图谱基本一致。
(2)密度 取本品约2g,照密度测定法(YBB00262004)测定,应为1.35~1.45g/cm3。
【物理性能】 水蒸气透过量 除另有规定外,取本品适量,照水蒸气透过量测定法(试行(YBB00092003) 第一法 杯式法测定,试验温度(23±0.6)℃,相对湿度(90±2)%, 不得过2.5g/(m2.24h)。
氧气透过量 除另有规定外,取本品适量,照气体透过量测定法(YBB0082003)第一法测定,应不得过30cm3/(m2•24h•0.1Mpa)。
拉伸强度 取本品适量,照拉伸性能测定法(YBB00112003)测定,试验速度(空载)100mm/min ±10mm/min,试样为Ⅰ型。
纵向、横向拉伸强度平均值均不得低于44MPa。
耐冲击 取本品适量,裁取长约150mm,宽为50mm试样,纵、横向各5个。
试样应在温度23℃±2℃,相对湿度50%±5%的环境中,放置4小时以上,并在上述条件下进行试验,将试样固定于落球冲击试验机上,跨距100mm,按照表1选取钢球和落球高度,使钢球自由落下于跨距中央部位,纵、横向均不得有二片以上破损。

YBB药包材标准(1~6辑)目录第一辑YBB00012002低密度聚乙烯输液瓶(试行)YBB00022002聚丙烯输液瓶(试行)YBB00032002钠钙玻璃输液瓶(试行)废止,新标准号YBB00032005YBB00042002药用氯化丁基橡胶塞(试行)YBB00052002药用溴化丁基橡胶塞(试行)YBB00062002低密度聚乙烯药用滴眼剂瓶(试行)YBB00072002聚丙烯药用滴眼剂瓶(试行)YBB00082002口服液体药用聚丙烯瓶(试行)YBB00092002口服液体药用高密度聚乙烯瓶(试行)YBB00102002口服液体药用聚酯瓶(试行)YBB00112002口服固体药用聚丙烯瓶(试行)YBB00122002口服固体药用高密度聚乙烯瓶(试行)YBB00132002药品包装用复合膜、袋通则(试行)YBB00142002药品包装材料与药物相容性试验指导原则(试行)第二辑YBB00152002药品包装用铝箔YBB00162002铝质药用软膏管YBB00172002聚酯/铝/聚乙烯药品包装用复合膜、袋YBB00182002聚酯/低密度聚乙烯药品包装用复合膜、袋YBB00192002双向拉伸聚丙烯/低密度聚乙烯药品包装用复合膜、袋YBB00202002聚氯乙烯/聚乙烯/聚偏二氯乙烯固体药用复合硬片YBB00212002聚氯乙烯固体药用硬片YBB00222002聚氯乙烯/聚偏二氯乙烯固体药用复合硬片YBB00232002聚氯乙烯/低密度聚乙烯固体药用复合硬片YBB00242002聚酰胺/铝/聚氯乙烯冷冲压成型固体药用复合硬片YBB00252002聚乙烯/铝/聚乙烯复合药用软膏管废止,新标准号YBB00252005YBB00262002口服固体药用聚酯瓶YBB00272002钠钙玻璃药瓶YBB00282002低硼硅玻璃管制口服液体瓶YBB00292002硼硅玻璃管制注射剂瓶废止,新标准号YBB00292005-1、YBB00292005-2YBB00302002低硼硅玻璃管制注射剂瓶YBB00312002钠钙玻璃模制注射剂瓶YBB00322002硼硅玻璃安瓿废止,新标准号YBB00322005-2YBB00332002低硼硅玻璃安瓿YBB00342002多层共挤输液用膜、袋通则第三辑YBB00012003细胞毒性检查法YBB00022003热原检查法YBB00032003溶血检查法YBB00042003急性全身毒性检查法YBB00052003皮肤致敏检查法YBB00062003皮内刺激检查法YBB00072003原发性皮肤刺激检查法YBB00082003气体透过量测定法YBB00092003水蒸气透过量测定法YBB00102003剥离强度测定法YBB00112003拉伸性能测定法YBB00122003热合强度测定法YBB00132003密度测定法YBB00142003氯乙烯单体测定法YBB00152003偏二氯乙烯单体测定法YBB00162003内应力测定法YBB00172003耐内压力测定法YBB00182003热冲击和热冲击强度测定法YBB00192003垂直轴偏差测定法YBB00202003平均线热膨胀系数的测定法YBB00212003线热膨胀系数的测定法YBB00222003砷、锑、铅浸出量的测定法YBB00232003三氧化二硼测定法YBB001℃内表面耐水性测定法和分级第四辑YBB00262003硼硅玻璃药用管废止,新标准号YBB00012005-1、YBB00012005-2 YBB00272003低硼硅玻璃药用管YBB00282003钠钙玻璃药用管YBB00292003硼硅玻璃输液瓶废止,新标准号YBB00022005-2YBB00302003低硼硅玻璃模制药瓶YBB00312003硼硅玻璃模制注射剂瓶废止,新标准号YBB00062005-2YBB00322003低硼硅玻璃模制注射剂瓶YBB00332003钠钙玻璃管制注射剂瓶YBB00342003药用玻璃成份分类及其试验方法YBB00352003低硼硅玻璃管制药瓶YBB00362003钠钙玻璃管制药瓶YBB00372003抗生素瓶用铝塑组合盖YBB00382003口服液瓶撕拉铝盖YBB00392003外用液体药用高密度聚乙烯瓶YBB00402003输液瓶用铝塑组合盖第五辑YBB00012004低硼硅玻璃输液瓶YBB00022004硼硅玻璃管制口服液体瓶YBB00032004钠钙玻璃管制口服液体瓶YBB00042004硼硅玻璃管制药瓶YBB00052004硼硅玻璃模制药瓶YBB00062004预灌封注射器用硼硅玻璃针管YBB00072004预灌封注射器用氯化丁基橡胶活塞YBB00082004预灌封注射器用溴化丁基橡胶活塞YBB00092004预灌封注射器用不锈钢注射针YBB00102004预灌封注射器用聚异戊二烯橡胶针头护帽YBB00112004预灌封注射器组合件(带注射针)YBB00122004笔式注射器用硼硅玻璃珠YBB00132004笔式注射器用硼硅玻璃套筒YBB00142004笔式注射器用铝盖YBB00152004笔式注射器用氯化丁基橡胶活塞和垫片YBB00162004笔式注射器用溴化丁基橡胶活塞和垫片YBB00172004口服固体药用低密度聚乙烯防潮组合瓶盖YBB00182004铝/聚乙烯冷成型固体药用复合硬片YBB00192004双向拉伸聚丙烯/真空镀铝流延聚丙烯药品包装用复合膜、袋YBB00202004玻璃纸/铝/聚乙烯药品包装用复合膜、袋YBB00212004药品包装用铝塑封口垫片通则YBB00222004口服制剂用硅橡胶胶塞、垫片YBB00232004药用合成聚异戊二烯垫片YBB00242004塑料输液容器用聚丙烯组合盖YBB00252004胶囊用明胶YBB00262004包装材料红外光谱测定法YBB00272004包装材料不溶性微粒测定法YBB00282004乙醛测定法YBB00292004加热伸缩率测定法YBB00302004挥发性硫化物测定法YBB00312004包装材料溶剂残留量测定法YBB00322004注射剂用胶塞、垫片穿刺力测定法YBB00332004注射剂用胶塞、垫片穿刺落屑测定法YBB00342004玻璃耐沸腾盐酸浸蚀性的测定法和分级YBB00352004玻璃耐沸腾混合碱水溶液浸蚀性的测定法和分级YBB00362004玻璃颗粒在98℃耐水性测定法和分级YBB00372004砷、锑、铅、镉浸出量测定法YBB00382004抗机械冲击测定法YBB00392004直线度测定法YBB00402004药用陶瓷吸水率测定法YBB00412004药品包装材料生产厂房洁净室(区)的测试方法YBB00202005聚氯乙烯/聚乙烯/聚偏二氯乙烯固体药用复合硬片YBB00212005聚氯乙烯固体药用硬片YBB00222005聚氯乙烯/聚偏二氯乙烯固体药用复合硬片YBB00232005聚氯乙烯/低密度聚乙烯固体药用复合硬片YBB00042005注射液用卤化丁基橡胶塞YBB00052005注射用无菌粉末用卤化丁基橡胶塞第六辑YBB00072005药用低密度聚乙烯膜、袋YBB00082005注射剂瓶用铝盖YBB00092005输液瓶用铝盖YBB00102005三层共挤输液用膜(I)、袋YBB00112005五层共挤输液用膜(I)、袋YBB00122005药用固体纸袋装硅胶干燥剂YBB00132005药用聚酯/铝/聚丙烯封口垫片YBB00142005药用聚酯/铝/聚酯封口垫片YBB00152005药用聚酯/铝/聚乙烯封口垫片YBB00162005药用口服固体陶瓷瓶YBB00032005钠钙玻璃输液瓶替换YBB00032002YBB00292005-1高硼硅玻璃管制注射剂瓶替换YBB00292002 YBB00292005-2中性硼硅玻璃管制注射剂瓶替换YBB00292002 YBB00322005-2中性硼硅玻璃安瓿替换YBB00322002YBB00012005-1药用高硼硅玻璃管替换YBB00262003YBB00012005-2药用中性硼硅玻璃管替换YBB00262003YBB00022005-2中性硼硅玻璃输液瓶替换YBB00292003YBB00062005-2中性硼硅玻璃模制注射剂瓶替换YBB00312003 YBB00252005药用聚乙烯/铝/聚乙烯复合软膏管替换YBB00252002 YBB00172005药用玻璃铅、镉、砷、锑浸出量限度YBB00182005药用陶瓷容器铅、镉浸出量限度YBB00192005药用陶瓷容器铅、镉浸出量测定法YBB00242005环氧乙烷残留量测定法YBB00262005橡胶灰分的测定法。

YBB药包材标准(1~6辑)目录第一辑YBB00012002低密度聚乙烯输液瓶(试行)YBB00022002聚丙烯输液瓶(试行)YBB00032002钠钙玻璃输液瓶(试行)废止,新标准号YBB00032005YBB00042002药用氯化丁基橡胶塞(试行)YBB00052002药用溴化丁基橡胶塞(试行)YBB00062002低密度聚乙烯药用滴眼剂瓶(试行)YBB00072002聚丙烯药用滴眼剂瓶(试行)YBB00082002口服液体药用聚丙烯瓶(试行)YBB00092002口服液体药用高密度聚乙烯瓶(试行)YBB00102002口服液体药用聚酯瓶(试行)YBB00112002口服固体药用聚丙烯瓶(试行)YBB00122002口服固体药用高密度聚乙烯瓶(试行)YBB00132002药品包装用复合膜、袋通则(试行)YBB00142002药品包装材料与药物相容性试验指导原则(试行)第二辑YBB00152002药品包装用铝箔YBB00162002铝质药用软膏管YBB00172002聚酯/铝/聚乙烯药品包装用复合膜、袋YBB00182002聚酯/低密度聚乙烯药品包装用复合膜、袋YBB00192002双向拉伸聚丙烯/低密度聚乙烯药品包装用复合膜、袋YBB00202002聚氯乙烯/聚乙烯/聚偏二氯乙烯固体药用复合硬片YBB00212002聚氯乙烯固体药用硬片YBB00222002聚氯乙烯/聚偏二氯乙烯固体药用复合硬片YBB00232002聚氯乙烯/低密度聚乙烯固体药用复合硬片YBB00242002聚酰胺/铝/聚氯乙烯冷冲压成型固体药用复合硬片YBB00252002聚乙烯/铝/聚乙烯复合药用软膏管废止,新标准号YBB00252005YBB00262002口服固体药用聚酯瓶YBB00272002钠钙玻璃药瓶YBB00282002低硼硅玻璃管制口服液体瓶YBB00292002硼硅玻璃管制注射剂瓶废止,新标准号YBB00292005-1、YBB00292005-2YBB00302002低硼硅玻璃管制注射剂瓶YBB00312002钠钙玻璃模制注射剂瓶YBB00322002硼硅玻璃安瓿废止,新标准号YBB00322005-2YBB00332002低硼硅玻璃安瓿YBB00342002多层共挤输液用膜、袋通则第三辑YBB00012003细胞毒性检查法YBB00022003热原检查法YBB00032003溶血检查法YBB00042003急性全身毒性检查法YBB00052003皮肤致敏检查法YBB00062003皮内刺激检查法YBB00072003原发性皮肤刺激检查法YBB00082003气体透过量测定法YBB00092003水蒸气透过量测定法YBB00102003剥离强度测定法YBB00112003拉伸性能测定法YBB00122003热合强度测定法YBB00132003密度测定法YBB00142003氯乙烯单体测定法YBB00152003偏二氯乙烯单体测定法YBB00162003内应力测定法YBB00172003耐内压力测定法YBB00182003热冲击和热冲击强度测定法YBB00192003垂直轴偏差测定法YBB00202003平均线热膨胀系数的测定法YBB00212003线热膨胀系数的测定法YBB00222003砷、锑、铅浸出量的测定法YBB00232003三氧化二硼测定法YBB00242003121℃内表面耐水性测定法和分级第四辑YBB00262003硼硅玻璃药用管废止,新标准号YBB00012005-1、YBB00012005-2 YBB00272003低硼硅玻璃药用管YBB00282003钠钙玻璃药用管YBB00292003硼硅玻璃输液瓶废止,新标准号YBB00022005-2YBB00302003低硼硅玻璃模制药瓶YBB00312003硼硅玻璃模制注射剂瓶废止,新标准号YBB00062005-2YBB00322003低硼硅玻璃模制注射剂瓶YBB00332003钠钙玻璃管制注射剂瓶YBB00342003药用玻璃成份分类及其试验方法YBB00352003低硼硅玻璃管制药瓶YBB00362003钠钙玻璃管制药瓶YBB00372003抗生素瓶用铝塑组合盖YBB00382003口服液瓶撕拉铝盖YBB00392003外用液体药用高密度聚乙烯瓶YBB00402003输液瓶用铝塑组合盖第五辑YBB00072003原发性皮肤刺激检查法YBB00082003气体透过量测定法YBB00092003水蒸气透过量测定法YBB00102003剥离强度测定法YBB00112003拉伸性能测定法YBB00122003热合强度测定法YBB00132003密度测定法YBB00142003氯乙烯单体测定法YBB00152003偏二氯乙烯单体测定法YBB00162003内应力测定法YBB00172003耐内压力测定法YBB00182003热冲击和热冲击强度测定法YBB00192003垂直轴偏差测定法YBB00202003平均线热膨胀系数的测定法YBB00212003线热膨胀系数的测定法YBB00222003砷、锑、铅浸出量的测定法YBB00232003三氧化二硼测定法YBB00242003121℃内表面耐水性测定法和分级YBB00262003硼硅玻璃药用管YBB00272003低硼硅玻璃药用管YBB00282003钠钙玻璃药用管YBB00292003硼硅玻璃输液瓶YBB00302003低硼硅玻璃模制药瓶YBB00312003硼硅玻璃模制注射剂瓶YBB00322003低硼硅玻璃模制注射剂瓶YBB00332003钠钙玻璃管制注射剂瓶YBB00342003药用玻璃成份分类及其试验方法YBB00352003低硼硅玻璃管制药瓶YBB00362003钠钙玻璃管制药瓶YBB00372003抗生素瓶用铝塑组合盖YBB00382003口服液瓶撕拉铝盖YBB00392003外用液体药用高密度聚乙烯瓶YBB00402003输液瓶用铝塑组合盖YBB00012004低硼硅玻璃输液瓶YBB00022004硼硅玻璃管制口服液体瓶YBB00032004钠钙玻璃管制口服液体瓶YBB00042004硼硅玻璃管制药瓶YBB00052004硼硅玻璃模制药瓶YBB00062004预灌封注射器用硼硅玻璃针管YBB00072004预灌封注射器用氯化丁基橡胶活塞YBB00082004预灌封注射器用溴化丁基橡胶活塞YBB00092004预灌封注射器用不锈钢注射针YBB00102004预灌封注射器用聚异戊二烯橡胶针头护帽YBB00112004预灌封注射器组合件(带注射针)YBB00122004笔式注射器用硼硅玻璃珠YBB00132004笔式注射器用硼硅玻璃套筒YBB00142004笔式注射器用铝盖YBB00152004笔式注射器用氯化丁基橡胶活塞和垫片YBB00162004笔式注射器用溴化丁基橡胶活塞和垫片YBB00172004口服固体药用低密度聚乙烯防潮组合瓶盖YBB00182004铝/聚乙烯冷成型固体药用复合硬片YBB00192004双向拉伸聚丙烯/真空镀铝流延聚丙烯药品包装用复合膜、袋YBB00202004玻璃纸/铝/聚乙烯药品包装用复合膜、袋YBB00212004药品包装用铝塑封口垫片通则YBB00222004口服制剂用硅橡胶胶塞、垫片YBB00232004药用合成聚异戊二烯垫片YBB00242004塑料输液容器用聚丙烯组合盖YBB00252004胶囊用明胶YBB00262004包装材料红外光谱测定法YBB00272004包装材料不溶性微粒测定法YBB00282004乙醛测定法YBB00292004加热伸缩率测定法YBB00302004挥发性硫化物测定法YBB00312004包装材料溶剂残留量测定法YBB00322004注射剂用胶塞、垫片穿刺力测定法YBB00332004注射剂用胶塞、垫片穿刺落屑测定法YBB00342004玻璃耐沸腾盐酸浸蚀性的测定法和分级YBB00352004玻璃耐沸腾混合碱水溶液浸蚀性的测定法和分级YBB00362004玻璃颗粒在98℃耐水性测定法和分级YBB00372004砷、锑、铅、镉浸出量测定法YBB00382004抗机械冲击测定法YBB00392004直线度测定法YBB00402004药用陶瓷吸水率测定法YBB00412004药品包装材料生产厂房洁净室(区)的测试方法YBB00202005聚氯乙烯/聚乙烯/聚偏二氯乙烯固体药用复合硬片YBB00212005聚氯乙烯固体药用硬片YBB00222005聚氯乙烯/聚偏二氯乙烯固体药用复合硬片YBB00232005聚氯乙烯/低密度聚乙烯固体药用复合硬片YBB00042005注射液用卤化丁基橡胶塞YBB00052005注射用无菌粉末用卤化丁基橡胶塞第六辑YBB00072005药用低密度聚乙烯膜、袋YBB00082005注射剂瓶用铝盖YBB00092005输液瓶用铝盖YBB00102005三层共挤输液用膜(I)、袋YBB00112005五层共挤输液用膜(I)、袋YBB00122005药用固体纸袋装硅胶干燥剂YBB00132005药用聚酯/铝/聚丙烯封口垫片YBB00142005药用聚酯/铝/聚酯封口垫片YBB00152005药用聚酯/铝/聚乙烯封口垫片YBB00162005药用口服固体陶瓷瓶YBB00032005钠钙玻璃输液瓶替换YBB00032002YBB00292005-1高硼硅玻璃管制注射剂瓶替换YBB00292002YBB00292005-2中性硼硅玻璃管制注射剂瓶替换YBB00292002 YBB00322005-2中性硼硅玻璃安瓿替换YBB00322002YBB00012005-1药用高硼硅玻璃管替换YBB00262003YBB00012005-2药用中性硼硅玻璃管替换YBB00262003YBB00022005-2中性硼硅玻璃输液瓶替换YBB00292003YBB00062005-2中性硼硅玻璃模制注射剂瓶替换YBB00312003 YBB00252005药用聚乙烯/铝/聚乙烯复合软膏管替换YBB00252002 YBB00172005药用玻璃铅、镉、砷、锑浸出量限度YBB00182005药用陶瓷容器铅、镉浸出量限度YBB00192005药用陶瓷容器铅、镉浸出量测定法YBB00242005环氧乙烷残留量测定法YBB00262005橡胶灰分的测定法。
YBB20242012聚氯乙烯/聚偏二氯乙烯固体药用复合硬片Julüyixi/Jupianerlüyixi GutiYaoyong Fuhe YingpianPVC/PVDC Composite Sheet for Solid Phamaceutical Packaging本标准适用于以聚氯乙烯(PVC)树脂、聚偏二氯乙烯(PVDC)为主要原料,制成的复合硬片,用于固体药品(片剂、胶囊剂等)泡罩包装。
【外观】取本品适量,在自然光线明亮处,正视目测。
应色泽均匀,不允许有凹凸发皱、油污、异物、穿孔、杂质。
每100cm2中,1.3mm及1.3mm以下的晶点,不得过3颗,不得有1.3mm以上的晶点。
【鉴别】(1)红外光谱* 取本品适量,照包装材料红外光谱测定法(YBB 60012012)第四法测定,PVC、PVDC层,应分别与对照图谱基本一致。
(2)颜色反应:在复合硬片上滴一滴吗啉液,PVDC面呈桔黄色,PVC面不变色。
【PVDC涂布量】取本品适量,裁取100mm×100mm的样片5片,将样片放在丙酮(或适当溶剂)中浸泡数分钟,取出样片,小心分离PVDC层,在80℃±2℃中将PVDC层干燥2小时,在室温23℃±2℃条件下,放置4小时,精密称定每片PVDC层重量,计算,以g/m2表示PVDC 的涂布量,PVDC涂布量偏差不得过±7%。
【物理性能】水蒸气透过量取本品适量,照水蒸气透过量测定法(YBB60302012)第一法实验条件A(试验时PVDC面向湿度低的一侧),应符合表1的规定。
氧气透过量取本品适量,照气体透过量测定法(YBB60292012)第一法测定(试验时PVDC 面向氧气低压侧),应符合表1的规定。
表1 气体物理性能PVDC涂布量(g/m2)水蒸气透过量g/(m2•24h)氧气透过量cm3 /(m2·24h·0.1MPa)40 ≤0.8≤3.060 ≤0.690 ≤0.4拉伸强度取本品适量,照拉伸性能测定法(YBB60322012)测定,试验速度(空载)100mm/min±10mm/min,试样为Ⅰ型。
聚氯乙烯固体药用硬片Julüyixi Gutiyaoyong YingpianPVC sheet for Solid Pharmaceutical Packaging本标准适用于以聚氯乙烯(PVC)树脂为主要原料制成的硬片,用于固体药品(片剂、胶囊剂等)泡罩包装。
【外观】取本品适量,在自然光线明亮处,正视目测。
应色泽均匀,不允许有凹凸发皱、油污、异物、穿孔、杂质。
每100cm2中,1.3mm及1.3mm以下的晶点,不得过3颗,不得有1.3mm以上的晶点。
【鉴别】(1)红外光谱* 取本品适量,照包装材红外光谱测定法(YBB00262004-2015)第四法应与对照图谱基本一致。
(2)密度取本品约2g,照密度测定法(YBB00132003-2015)测定,应为1.35~1.45g/cm3。
【物理性能】水蒸气透过量取本品适量,照水蒸气透过量测定法(YBB00092003-2015)第一法试验条件A或第二法测定(试验温度23℃±0.5℃,相对湿度90%±2%)或第四法(试验温度23℃±0.5℃,相对湿度90%±2%)测定,不得过2.5g/(m2.24h)。
氧气透过量除另有规定外,取本品适量,照气体透过量测定法(YBB0082003-2015)第一法测定,不得过30cm3/(m2•24h•0.1Mpa)。
拉伸强度取本品适量,照拉伸性能测定法(YBB00112003-2015)测定,试验速度(空载)100mm/min±10mm/min,试样为Ⅰ型。
纵向、横向拉伸强度平均值均不得低于44MPa。
耐冲击取本品适量,裁取150mm*50mm试片,纵、横向各5个。
试样应在温度23℃±2℃,相对湿度50%±5%的环境中,放置4小时以上,并在上述条件下进行试验,将试样固定于落球冲击试验机上,跨距100mm,按照表1选取钢球和落球高度,使钢球自由落下于跨距中央部位,纵、横向均不得有2片以上破损。
YBB20222012聚氯乙烯固体药用硬片Julüyixi Guti Yaoyong YingpianPVC Sheet for Solid Phamaceutical Packaging本标准适用于以聚氯乙烯(PVC)树脂为主要原料制成的硬片,用于固体药品(片剂、胶囊剂等)泡罩包装。
【外观】取本品适量,在自然光线明亮处,正视目测。
应色泽均匀,不允许有凹凸发皱、油污、异物、穿孔、杂质。
每100 cm2中,1.3mm及1.3mm以下的晶点,不得过3颗,不得有1.3mm以上的晶点。
【鉴别】(1)红外光谱* 取本品适量,照包装材料红外光谱测定法(YBB60012012)第四法测定,应与对照图谱基本一致。
(2)密度取本品约2g,照密度测定法(YBB60342012)测定,应为1.35~1.45g/cm3。
【物理性能】水蒸气透过量取本品适量,照水蒸气透过量测定法(YBB60302012)第一法实验条件A测定,不得过2.5 g/(m2·24h)。
氧气透过量取本品适量,照气体透过量测定法(YBB60292012)第一法测定,不得过30 cm3/(m2·24h·0.1MPa)。
拉伸强度取本品适量,照拉伸性能测定法(YBB60322012)测定,试验速度(空载)100mm/min±10mm/min,试样为Ⅰ型。
纵向、横向拉伸强度平均值均不得低于44MPa。
耐冲击取本品适量,裁取长约150mm,宽为50mm试样,纵、横向各五个。
试样应在温度23℃±2℃,相对湿度50%±5%的环境中,放置4小时以上,并在上述条件下进行试验。
将试样固定在落球冲击试验机上,跨距为100mm。
按照表1选取钢球和落球高度,使钢球自由落下于跨距中央部位,纵、横向均不得有二片以上破损。
表1 钢球和落球高度的选择单位:mm 样品厚度落球高度钢球直径0.20~0.30 600 25(60g±6g)0.31~0.40 600 28.6(100g±10g)加热伸缩率取本品适量,照加热伸缩率测定法(YBB60042012)测定,伸缩率应在±6%以内。
聚氯乙烯/低密度聚乙烯固体药用复合硬片测试标准
YBB00232005
聚氯乙烯/低密度聚乙烯固体药用复合硬片以其质量轻、强度高、密封性和耐压性好等优点,使用范围正在逐步的扩大。
作为直接接触药品的包装材料聚氯乙烯/低密度聚乙烯固体药用复合硬片在使用前一定要经过质量部门的相关检测,以保证生产的药用复合硬片达到国家的出厂规范,在医药的运用过程中确保不会出现质量事故,确保药品安全。
聚氯乙烯/低密度聚乙烯固体药用复合硬片热收缩仪
2015年,我国国家药品监督管理局发布了固体药用复合硬片的国家药品包装容器标准,分别是YBB00212005-2015 聚氯乙烯固体药用硬片、YBB00232005-2015 聚氯乙烯/低密度聚乙烯固体药用复合硬片、YBB00222005-2015 聚氯乙烯/聚偏二氯乙烯固体药用复合硬片、YBB00182004-2015 铝/聚乙烯冷成型固体药用复合硬片、YBB00202005-2015 聚氯乙烯/聚乙烯/聚偏二氯乙烯固体药用复合硬片、YBB00242002-2015 聚固酰胺/聚氯乙烯冷冲压成型固体药用复合硬片这些标准的出台,意味着企业需要严格执行对药用塑料瓶的质量监控与检测工作。
聚氯乙烯/低密度聚乙烯固体药用复合硬片拉伸强度仪
关于聚氯乙烯/低密度聚乙烯固体药用复合硬片的质量检测可以参照YBB00232005标准,该标准中规定的检测项目是药厂、药检所、质检单位关注的重点,所以,济南三泉中石实验仪器有限公司依据该标准要求研发了测试聚氯乙烯/低密度聚乙烯固体药用复合硬片质量的检测设备。
标准YBB00232005要求的聚氯乙烯/低密度聚乙烯固体药用复合硬片测试项目如下:
聚氯乙烯/低密度聚乙烯固体药用复合硬片热封仪。