GMP药品检验记录大全
- 格式:xls
- 大小:28.00 KB
- 文档页数:1

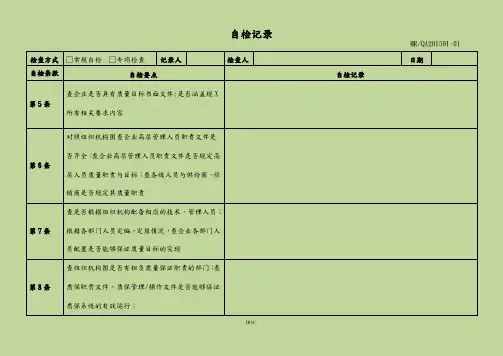
自检记录MR/QA201501-01检查方式□常规自检□专项检查记录人检查人日期自检条款自检要点自检记录第5条查企业是否具有质量目标书面文件;是否涵盖规X所有相关要求内容第6条对照组织机构图查企业高层管理人员职责文件是否齐全;查企业高层管理人员职责文件是否规定高层人员质量职责与目标;查各级人员与供给商、经销商是否规定其质量职责第7条查是否根据组织机构配备相应的技术、管理人员;根据各部门人员定编、定岗情况,查企业各部门人员配置是否能够保证质量目标的实现第8条查组织机构图是否有担负质量保证职责的部门;查质保职责文件、质保管理/操作文件是否能够保证质保系统的有效运行;第页 / 共页自检记录MR/QA201501-01 第9条查质保部职责文件检查质保部管理职责是否明确;查质保部是否对原辅料、包装材料的验收、取样、入库、贮存、发放、使用行使监控职责;查中间产品的流转是否经QA 人员监控;查公司确认与验证活动是否得到质保部门的监控;查质量受权人是否具有否决或批准产品出厂放行的职责与权利;查是否具有物料与产品运输的相关书面规定与规定是否合理、有效;检查方式 □常规自检 □专项检查 记录人检查人日期自检条款自检要点自检记录第10条查现已生产的品种生产工艺是否经过验证;检查结果评价企业现配备的资源是否满足药品生产与规X 要求;现场询问操作人员评价企业操作规程制定是否准确、易懂;抽查批记录,检查批生产记录是否能够涵盖生产全过程,是否能够追溯产品完整生产历史;检查企业对各类记录是否妥善保存、便于查阅;评价药品召回系统是否能够符合规X 要求第11条查是否具有质控部组织机构图;查质控的岗位设置与人员配置是否能够满足企业日常取样、检验需求第12条抽查控部岗位人员培训情况评价其能否满足其质量控制职责;查质控文件是否包括原辅料、包装材料、中间体、成品的取样、检查、检验与稳定性考察与必要的环境监测;取样人员是否经授权;检验方法是否经过验证或确认;检查取样、检查、检验记录是否齐全;检查物料、中间产品、待包装产品和成品是否按照质量标准进展检查和检验,并有记录;检查留样情况是否满足必要的检查与检验需求检查质量风险管理文件是否涵盖风险评估、控制、第13条沟通与审核第14条抽查风险评估第页 / 共页自检记录MR/QA201501-01检查方式□常规自检□专项检查记录人检查人日期自检条款自检要点自检记录第15条抽查风险评估查公司组织机构图是否与现行机构相符;查组织机第16条构图是否能表示管理机构职责与工作流程第页 / 共页自检记录MR/QA201501-01 第17条查质量负责人职责;查质量管理部门人员是否将职责委托给其他部门的人员第18条查公司各部门岗位职责是否齐全,无遗漏;岗位职责是否明确并有书面文件;查岗位人员是否承当过多职责;抽查岗位人员对自岗职责的了解情况 第19条查企业有无职责委托情况;查受委托人资质是否符合规X 要求检查方式 □常规自检 □专项检查 记录人检查人日期自检条款自检要点自检记录第20条查关键人员是否有公司任命书;查关键人员是否为全职;查质量负责与受权人职责履行情况第页 / 共页自检记录MR/QA201501-01 第21条查企业负责人工作职责是否满足规X 要求;查企业负责人是否按职责要求履行其职责第22条查生产管理负责人履历、学历、教育背景与职称情况是否符合规X 要求;查生产管理负责人工作职责是否符合规X 要求无遗漏第23条查质量管理负责人履历、学历、教育背景与职称情况是否符合规X 要求;查质量管理负责人、质量受权人工作职责是否符合GMP 要求无遗漏第24条于第22条、第23条中检查检查方式 □常规自检 □专项检查 记录人检查人日期自检条款自检要点自检记录第25条于第23条中检查第26条查是否有人负责公司培训和培训管理文件;查培训计划是否经生产管理负责人或质量管理负责人审核或批准第27条查培训记录与相关培训考核记录;抽查生产操作人员的人员培训档案是否符合要求第29条查培训记录是否满足规X要求;查有无卫生管理与操作规程第30条查人员卫生管理中是否包含健康、卫生习惯和着装内容,如健康检查与身体不适报告、着装、洗手、洁净作业、洁净区人员限制等;不同级别卫生操作规程;查看人员实际操作第页 / 共页自检记录MR/QA201501-01检查方式□常规自检□专项检查记录人检查人日期自检条款自检要点自检记录查有无公司人员健康档案;抽有无人员健康检查周第31条期的规定查公司有无关于防止体表伤口、可能污染药品疾病第32条人员的规定检查进入生产区、质控区人员进入管理中是否有关第33条于外来人员的规定;检查外来人员登记和培训记录检查是否有进入生产区更衣的规定和更衣流程;洁第34条净服材质、式样与穿戴是否符合规X第页 / 共页自检记录MR/QA201501-01 第35条检查有无洁净生产区人员不得化妆和佩戴饰物的规定;现场抽查洁净区人员执行情况检查方式 □常规自检 □专项检查 记录人检查人日期自检条款自检要点自检记录第36条生产区、仓储区的区域划分;现场检查生产区,仓储区执行情况第37条 查有无防止裸手直接接触药品、与药品直接接触的包装材料和设备外表的规定;检查执行情况;现场是否有手消毒措施第38条 查厂区周边环境图、厂区总平面图;第39条查生产、行政、生活、辅助区布局;查地面的绿化、硬化,阴沟清洁情况;查厂区与厂房人流和物流通道分布情况;垃圾是否集中存放,生活、生产垃圾第40条是否分开存放,垃圾存放位置是否合理第页 / 共页自检记录MR/QA201501-01检查方式□常规自检□专项检查记录人检查人日期自检条款自检要点自检记录是否制定厂房维护计划;查有无相关规程规定厂房第41条设施的日常检查流程和记录;查有无消毒记录;查是否有照明、温度、湿度和通风的要求和厂房验第42条证文件;查日常监控记录和偏差的处理第页 / 共页自检记录MR/QA201501-01 第43条 现场检查有无有防止昆虫或其它动物进入措施,是否有书面规定;假设使用灭鼠药、杀虫剂,应当有风险评估;检查措施有效性第44条 是否有生产区、仓储区、质控区人员进入权限限制的管理规定与措施有效性;有无外来人员进出记录;第45条是否保存厂房、公用设施、固定管道〔空调系统送风、回风管路;水系统管路〕竣工和改造图纸,是否受控管理;是否与布局一致;改造是否有许可和风险评估检查方式 □常规自检 □专项检查 记录人检查人日期自检条款自检要点自检记录第46条查有无相关的共用厂房、生产线、设备评估报告;查车间空调系统送风、回风管路图与验证报告;检查高产尘区排风、捕尘情况第47条现场检查生产设备能力和布局、物料暂存间、生产操作间面积和平面布局与工艺规程规定的适应情况;现场检查中间站、物料暂存间管理情况;是否有防止混淆、交叉污染、过失或遗漏的有效措施第48条检查空调净化系统平面布置图、洁净区平面布置图、洁净区换气次数、温湿度监控标准是否与生产工序环境一致;洁净区压差分布是否符合;检查空调系统验证情况;检查车间环境相关监控记录,环境监测报告第页 / 共页自检记录MR/QA201501-01 第49条 查洁净区施工验收和材质文件,每步验收均应有记录;现场检查洁净室内外表的装饰材料与平整、密封情况;现场检查洁净区的墙壁与地面的交界处防止尘粒聚积的措施;查洁净区维护、清洁、消毒的管理和记录第50条 现场检查洁净室(区)内各种管道、灯具、风口等公用设施的材质、样式、安装质量是否存在不易清洁情况与措施;定期检查、维护的管理制度和记录检查方式 □常规自检 □专项检查 记录人检查人日期自检条款自检要点自检记录第51条检查水池、地漏样式与封闭情况;检查清洁规程、状况与记录是否齐全第52条现场检查称量室气流、捕尘设施、手消毒第53条检查压差计和监控记录;检查产尘房间回风情况第54条现场检查包装区隔离措施与规定检查照明验证文件;现场检查照明情况;照明设施第55条的清洁第页 / 共页自检记录MR/QA201501-01检查方式□常规自检□专项检查记录人检查人日期自检条款自检要点自检记录第56条现场检查中控室对洁净区与药品生产的影响第57条检查是否有物料相关管理规程;原辅料、包装材料、成品的分库存放情况;检查物料分批存放与状态标志情况;检查固体物料与液体物料、特殊物料的分区存放情况;检查库区待验、合格、不合格、退货或召回分区情况第58条查看仓储区平面布置图;检查库房防虫防鼠设施与其安装位置是否合理;检查库房清洁情况;检查库房温湿度计安装位置是否合理与监控记录;第59条检查高活性的物料或产品以与印刷包装材料的管理规程;现场检查存放情况第60条现场检查防雨雪措施;现场检查仓储物料外包装清洁情况第页 / 共页自检记录MR/QA201501-01检查方式□常规自检□专项检查记录人检查人日期自检条款自检要点自检记录第61条检查个库区待验、合格、不合格、退货或召回分区情况是否符合规定;检查各区标志第62条现场检查取样间;检查取样间验证与日常监控情况第63条现场检查实验室布局第64条检查实验室平面布局图;现场检查各功能用室卫生与室内布局情况;现场检查样品、留样的存放与记录第页 / 共页自检记录MR/QA201501-01 第65条 现场检查需特殊存放的检验仪器、仪表的存放;实验仪器状态;现场检查存放间的防静电、震动、潮湿、高温等设施检查方式 □常规自检 □专项检查 记录人检查人日期自检条款自检要点自检记录第68条现场检查休息室布局,与生产区、仓储区、质控区分开第69条更衣室和盥洗室应满足人员进出;不得与生产区和仓储区直接相通第70条 维修间应尽量远离生产区;工具进入洁净区是否有控制;洁净区内的工具和备件是否有专门的存放区域第页 / 共页自检记录MR/QA201501-01 第71条 任意抽取设备检查其设计报告、结构设计图、使用说明书;安装应便于使用、清洁、消毒、维护保养;现场检查设备的结构与材质第72条抽查设备检查有无操作、维护、保养规程;相应记录是否完整、正确检查方式 □常规自检 □专项检查 记录人检查人日期自检条款自检要点自检记录第73条抽查设备检查采购、安装、确认的文件、记录是否齐全第74条 检查现场检查设备的结构与材质,是否有材质证明,特别是与药品直接接触的局部、容器、阀门、管路、输送泵、滤材第页 / 共页自检记录MR/QA201501-01 第75条 检查称量器具、压差计、温湿度计与压力表等的量程与精度是否与生产、检验使用要求匹配;是否在校验有效期内第76条检查清洗、清洁设备确实认和管理文件;现场检查清洁用具和清洁用剂的使用第77条查有无润滑剂、冷却剂的规定;查设备使用润滑剂情况检查方式 □常规自检 □专项检查 记录人检查人日期自检条款自检要点自检记录第78条检查有无模具相关规定;现场检查模具使用、收发情况第79条查有无设备维护、维修相关管理规定第80条查有无维护计划;查有无设备维修记录第81条确认有无重大维修;确认有无确认记录和风险评估第82条查看生产和检验设备是否具有明确的操作规程第页 / 共页自检记录MR/QA201501-01检查方式□常规自检□专项检查记录人检查人日期自检条款自检要点自检记录查设备使用参数;参数是否在工艺规程规定的X第83条围内第84条查设备清洁操作规程、记录与所使用的消毒剂查设备清洁规程中对已清洁设备的枯燥、存放的规第85条定第86条查生产和检验设备使用、运行记录第87条现场检查设备状态标志情况第页 / 共页自检记录MR/QA201501-01检查方式□常规自检□专项检查记录人检查人日期第页 / 共页自检记录MR/QA201501-01自检条款自检要点 自检记录第88条 现场检查设备状态标志情况第89条 现场检查管道状态标志情况第90条检查校准记录;是否有定期校准的规程和计划;检查设备、仪器的校准情况第91条第92条 确认有无使用计量标准器具;确认使用的计量标准器具已经校准且具有符合规X 的校准记录;计量标准器具的管理规程检查方式□常规自检□专项检查记录人检查人日期自检条款自检要点自检记录第93条现场检查校准情况第94条第95条确认有无使用自动或电子设备;确认有无操作规程与定期校准记录第96条检查公司制备纯化水、注射用水的原水、确保符合饮用水标准;查看纯化水是否采用药典允许的制水工艺第97条检查纯化水系统的设计与验证文件;第页 / 共页自检记录MR/QA201501-01检查方式□常规自检□专项检查记录人检查人日期自检条款自检要点自检记录第98条检查纯化水系统的设计与验证文件;检查纯化水系统管路图;现场检查管路情况;水位显示方式应能防止污染第99条检查有无工艺用水防止微生物滋生的规定第100条检查有无工艺用水检测规定与记录第101条检查有无工艺用水清洗、消毒规定和记录;检查纯化水达到有无警戒限、纠偏限有无相关处理操作规程第页 / 共页自检记录MR/QA201501-01 第102条 查有无原辅料、与药品直接接触的包装材料质量标准;查质量标准是否符合10版药典要求;查印字油墨标准是否符合食用标准要求检查方式 □常规自检 □专项检查 记录人检查人日期自检条款自检要点自检记录第103条查物料和产品操作规程是否涵盖接收、贮存、发放、使用、发运全过程并能有效防止污染、交叉污染、混淆和过失;查物料产品处理是否有相关规程支持并记录第104条查物料供给商变更与审计报告;查变更是否经质量部门批准第105条 查有无物料和产品的运输的规程支持并记录现场检查物料查有无物料验收操作规程与记录;查物料供给商是否经质量部门批准;检查物料外包装第106条是否有标签与已经清洁;查物料接收记录内容是否涵盖全部要求记录条款查有无物料、产品待验的管理;现场检查待验物料、第107条产品管理第页 / 共页自检记录MR/QA201501-01检查方式□常规自检□专项检查记录人检查人日期自检条款自检要点自检记录检查物料发放记录是否遵循先进先出和近效期先第108条出的原那么确认有无进展计算机化仓储管理和防止混淆和过第109条失的措施查有无相关规程支持;现场检查确认措施是否恰当第110条并涵盖每一包装内原辅料第111条查批取样、检验、放行记录第112条查标识是否涵盖全部要求标识内容第页 / 共页自检记录MR/QA201501-01检查方式□常规自检□专项检查记录人检查人日期自检条款自检要点自检记录第113条查物料批准放行的规定;现场检查执行情况第页 / 共页自检记录MR/QA201501-01 第114条 检查物料复验的记录第115条 查配料人是否为指定人;称量或计量工具、方法能否防止污染;现场检查物料称量与配制、物料标识是否符合规X 要求第116条 检查物料复核的规定;查有无复核记录第117条查有无同一批药品生产的所有配料存放的规定;现场检查执行是否符合要求检查方式 □常规自检 □专项检查 记录人检查人日期自检条款自检要点自检记录第118条查车间中间站培训与物料管理是否符合要求查标中间产品和待包装产品是否涵盖全部要求标第119条识内容现场检查与药品直接接触的包装材料和印刷包装第120条材料管理与控制是否符合规X要求查包装材料发放人是否为专人;包材管理规程;现第121条场检查包装材料管理是否符合规X要求查包材管理规程;查原版是否已保存与批准;抽查第122条种与现使用包装材料核对是否一致第页 / 共页自检记录MR/QA201501-01检查方式□常规自检□专项检查记录人检查人日期自检条款自检要点自检记录第123条查规程能否保证变更正确无误第124条现场检查印刷包装材料管理是否符合规X要求查印刷包装材料管理人是否为专人;查发放记录是第125条否符合规X要求第126条现场检查包材有无标识;查标识是否符合规X要求第127条查有无过期或废弃的印刷包装材料销毁记录;第页 / 共页自检记录MR/QA201501-01检查方式□常规自检□专项检查记录人检查人日期自检条款自检要点自检记录第128条现场检查成品贮存是否符合要求第129条现场检查成品贮存是否符合注册要求第130条查有无麻醉药品、精神药品、医疗用毒性药品〔包括药材〕、放射性药品、药品类易制毒化学品与易燃、易爆和其他危险品的验收、贮存、管理文件;查库房、车间能否满足特殊药品验收、贮存、管理要求第131条现场检查不合格物料、中间体、成品贮存与其标识是否符合规X要求查有无不合格的物料、中间产品、待包装产品和成第132条品的管理文件第页 / 共页自检记录MR/QA201501-01检查方式□常规自检□专项检查记录人检查人日期自检条款自检要点自检记录第133条查有无产品回收的管理规程和风险评估查关于重新加工的管理规定和相关风险评估;查文第134条件规定是否符合规X要求查有无相关文件支持;查文件规定是否符合规X第135条要求第页 / 共页自检记录MR/QA201501-01 第136条查有无相关文件支持;查文件规定是否符合规X要求第137条查有无相关文件支持;查文件规定是否符合规X要求检查方式 □常规自检 □专项检查 记录人检查人日期自检条款自检要点自检记录第138条查公司验证总计划;查确认或验证的X 围和程度是否经过风险评估第139条 查验证、确认文件总目录是否涵盖厂房、设施、设备和检验仪器;现场检查验证执行与验证状态是否符合验证内容一致第页 / 共页自检记录MR/QA201501-01 第140条 查有无相关文件规定第141条 检查产品工艺验证文件是否齐全并符合规X 要求第142条 检查变更程序是否规X ;检查变更是否经过验证;检查需药品监视管理部门批准的变更是否已经被批准;检查方式 □常规自检 □专项检查 记录人检查人日期自检条款自检要点自检记录第143条 检查清洁验证文件目录与X 围是否合理;抽查个清洁验证文件检查验证方法是否符合规X 规定的验证原那么第144条检查验证文件再验证周期规定是否合理第145条检查有无验证总计划第146条检查验证总计划涵盖X围是否规X要求抽查个验证文件检查方案是否经审核、批准;是否第147条明确参与人员职责第页 / 共页自检记录MR/QA201501-01检查方式□常规自检□专项检查记录人检查人日期自检条款自检要点自检记录抽查个验证文件检查方案是否经审核、批准;验证第148条记录是否符合规X要求第149条检查有无相关文件支持;第150条查文件总目录是否涵盖规X要求X围查有无相关书面规定;抽查份文件检查其审核与批第151条准情况查有无相关书面规定;任意抽取一份工艺文件检查第152条其与药品生产许可、药品注册是否一致第页 / 共页自检记录MR/QA201501-01检查方式□常规自检□专项检查记录人检查人日期自检条款自检要点自检记录查有无相关书面规定;查有无文件分发、撤销、复第153条制、销毁记录第154条查有无相关书面规定;查规定是否合理抽查文件检查文件编号、版本号是否正确;检查文第155条字内容是否确切、清晰、易懂第156条现场检查档案室文件存放是否符合理有有无相关书面规程;抽查份文件检查复制质量是第157条否符合规X要求第页 / 共页自检记录MR/QA201501-01检查方式□常规自检□专项检查记录人检查人日期自检条款自检要点自检记录查有无相关书面规程;现场检查部门与岗位文件是第158条否为现行版本检查有无相关规定;抽查份记录,检查其设计与填第159条写情况抽查份打印记录、图谱或曲线图检查其是否符合规第160条X要求检查有无相关书面规程;现场抽查人员对记录规X第161条要求的培训情况;抽查份记录进展检查任意抽取一批产品检查其批生产记录、批包装记录、批检验记录和药品放行审核记录是否齐全;检第162条查文件保存有无书面规定;检查规定是否符合规X要求第页 / 共页自检记录MR/QA201501-01检查方式□常规自检□专项检查记录人检查人日期自检条款自检要点自检记录检查有无使用其他方式进展记录与其是否符合规第163条X要求查文件总目录;任意抽取6种物料、成品或半成品第164条检查其是否具有质量标准;抽查种物料质量标准文件检查其内容是否涵盖所第165条有相关规X要求检查有无外购或外销的中间产品和待包装产品;检第166条查其是否具有质量标准抽查种成品质量标准文件检查其内容是否涵盖所第167条有相关规X要求第页 / 共页自检记录MR/QA201501-01检查方式□常规自检□专项检查记录人检查人日期自检条款自检要点自检记录检查工艺规程目录是否涵盖所有品种;抽查份工艺第168条规程检查其是否涵盖该品种所有批量第169条检查有无相关书面规定第页 / 共页自检记录MR/QA201501-01 第170条抽查份工艺规程检查其是否涵盖所有规X 相关要求第171条 抽查批产品检查其有无批生产记录;检查批生产记录是否可追溯该批产品的生产历史以与与质量有关的情况第172条抽查批批生产记录检查其内容是否已产品工艺规程一致;检查记录填写、设计是否符合规X 要求检查方式 □常规自检 □专项检查 记录人检查人日期自检条款自检要点自检记录第173条 检查批生产记录是否经生产管理负责人和质量管理负责人审核和批准;检查有无复制、发放规定与记录与每批发放数量是否符合规X 要求。
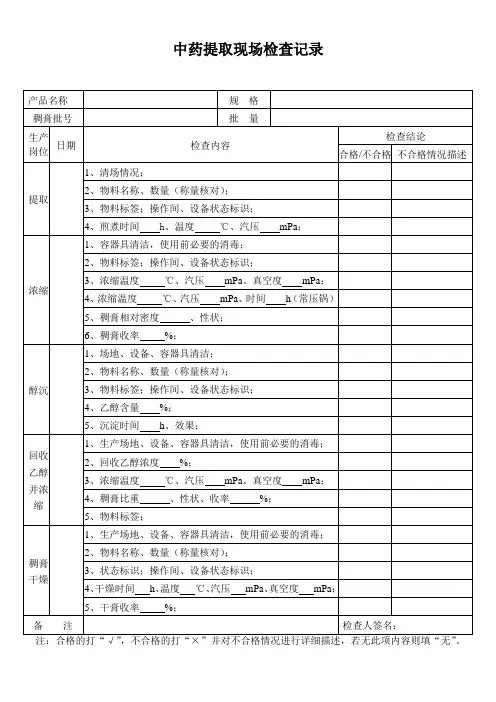


制药企业全套检验记录背景制药企业作为医药行业的重要组成部分,需要对其生产的药品进行严格的检验,以确保药品的质量和安全性。
本文档旨在介绍制药企业进行全套检验时需要记录的内容和相关流程。
检验内容原材料检验制药企业生产药品所需的原材料需要进行检验,确保其符合相关标准和规定。
原材料检验应包括以下内容:•检查原材料的外观、颜色、气味等•检验原材料的纯度和含量•检验原材料是否存在重金属、农药等有害物质在制品检验在制品检验是指在药品生产过程中需要进行的检验,以确保生产过程中的质量控制得到有效实施。
在制品检验应包括以下内容:•检查在制品外观是否正常•检验在制品的含量和纯度是否符合要求•检验在制品中是否存在杂质等不良物质成品检验成品检验是指对制作成功的药品进行检验,以确保药品符合规定的质量标准。
成品检验应包括以下内容:•检查成品的外观、气味、口感等•检验成品中的含量和纯度是否符合要求•检验成品中是否存在杂质等不良物质检验记录制药企业进行全套检验时需要进行详细的记录,各类型记录的主要内容如下:原材料检验记录原材料检验记录应包括以下内容:•原材料名称、规格、批号等基本信息•检验时间和地点•检验方法和结果•检验员及其资质证书信息•药品质量标准在制品检验记录在制品检验记录应包括以下内容:•在制品名称、规格、生产批次等基本信息•检验时间和地点•检验方法和结果•检验员及其资质证书信息•药品质量标准成品检验记录成品检验记录应包括以下内容:•成品名称、规格、生产批次等基本信息•检验时间和地点•检验方法和结果•检验员及其资质证书信息•药品质量标准检验流程制药企业进行全套检验的流程应包括以下步骤:1.原材料检验2.制剂检验3.包装材料检验4.成品检验每一步的检验内容和记录均需严格按照标准和规定执行,并由专业人员进行管理和操作。
总结制药企业进行全套检验对于保证药品的质量和安全性具有重要作用。
在检验过程中需要注意各项检验内容和相关要求,并进行详细的检验记录,以确保药品质量得到有效保障。
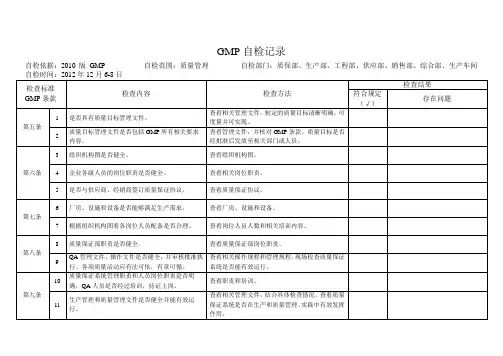
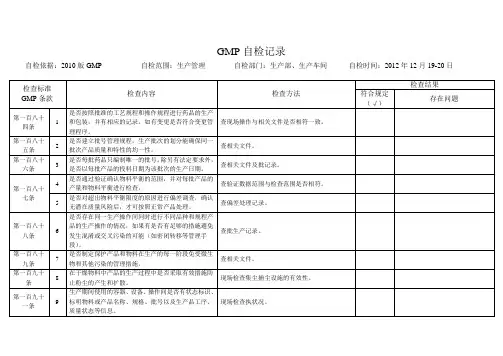
GMP 自检记录自检依据:2010版GMP 自检范围:质量管理 自检部门:质保部、生产部、工程部、供应部、销售部、综合部、生产车间 自检时间:2012年12月6-8日检查标准GMP 条款 检查内容 检查方法 检查结果符合规定(√)存在问题第五条1是否具有质量目标管理文件。
查看相关管理文件,制定的质量目标清晰明确,可度量并可实现。
2 质量目标管理文件是否包括GMP 所有相关要求内容。
查看管理文件,并核对GMP 条款。
质量目标是否经批准后发放至相关部门或人员。
第六条3组织机构图是否健全。
查看组织机构图。
4 企业各级人员的岗位职责是否健全。
查看相关岗位职责。
5 是否与供应商、经销商签订质量保证协议。
查看质量保证协议。
第七条6厂房、设施和设备是否能够满足生产需求。
查看厂房、设施和设备。
7 根据组织机构图看各岗位人员配备是否合理。
查看岗位人员人数和相关培训内容。
第八条8质量保证部职责是否健全。
查看质量保证部岗位职责。
9 QA 管理文件、操作文件是否健全,并审核批准执行。
各项质量活动应有法可依,有章可循。
查看相关操作规程和管理规程,现场检查质量保证系统是否能有效运行。
第九条10质量保证系统管理职责和人员岗位职责是否明确,QA 人员是否经过培训,持证上岗。
查看职责和培训。
11生产管理和质量管理文件是否健全并能有效运行。
查看相关管理文件,结合具体检查情况,查看质量保证系统是否在生产和质量管理、实践中有效发挥作用。
检查标准GMP条款检查内容检查方法检查结果符合规定(√)存在问题第九条12 物料供应商是否经过质保部审核批准。
查看供应商审计档案。
13 药品包装标签、说明书是否已在药监部门备案。
查看标签、说明书备案件。
14 是否建立印刷性包装材料管理规程并有效运行。
查看管理规程和实施情况。
15质保部对物料验收、取样、入库、贮存、发放、使用是否进行监督控制。
查看管理规程和实施情况。
16 中间产品流转过程中QA是否现场监控。


药品购进检查验收记录日期:xx年 xx月 xx日
1. 药品名称:xxx
药品批号:xxx
药品规格:xxx
药品数量:xxx
药品厂家:xxx
2.药品购进检查验收情况:
-药品外包装是否完整:是/否
-药品有效期是否符合要求:是/否
-药品包装是否密封良好:是/否
-药品外观是否正常:是/否
-药品气味是否正常:是/否
-药品颜色是否正常:是/否
-药品状况是否符合规定:是/否
-药品存储条件是否符合规定:是/否
-药品相对湿度是否符合规定:是/否
-药品存放位置是否符合规定:是/否
-药品包装是否完好:是/否
-药品包装材料是否符合规定:是/否
-药品容器是否符合规定:是/否
3.药品购进检查验收结论:
-如果所有检查项都符合要求,请注明:经检查验收,药品完好,质量符合规定,可接收。
-如果有不符合要求的项,请注明:经检查验收,发现以下不符合要求的情况:(列出具体情况)。
根据采购合同,要求供应商整改并重新验收。
4.其他备注:
对未符合要求的药品情况,需要记录未符合要求的具体原因,并通知供应商进行整改并重新验收。
同时,对该批次药品进行特别标识,以示与其他符合要求的药品区别。
为确保药品质量安全,验收员应妥善保管检查验收记录和相关文件,并通知质控部门进行相关处理。
质控部门负责人签字:________________
验收员签字:________________。
********药业有限公司物料检验记录纸编码:XJJL/QC00102 版本:A/0检验人:复核人:性状、外观、重(装)量差异检验原始记录编码:XJJL/QC00202 版本:A/0检验人:复核人:崩解时限(溶散时限)检验原始记录检验人:复核人:水分测定检验原始记录检验人:复核人:卡尔费休水分测定检验原始记录检验人:复核人:重金属检验原始记录检验人:复核人:砷盐检查法原始记录检验人:复核人:生物显微镜检验原始记录编码:XJJL/QC00802 版本:A/0检验人:复核人:薄层色谱法检验原始记录编码:XJJL/QC00902 版本:A/0检验人:复核人:微生物限度检验原始记录编码:XJJL/QC01002 版本:A/0检验人:复核人:高效液相色谱法原始记录编码:XJJL/QC01102 版本:A/0检验人:复核人:气相色谱法原始记录编码:XJJL/QC01202 版本:A/0检验人:复核人:红外鉴别原始记录编码:XJJL/QC01302 版本:A/0原子吸收分光光度法检验原始记录编码:XJJL/QC01402 版本:A/0检验人:复核人:紫外-可见分光光度法检验原始记录编码:XJJL/QC01502 版本:A/0陕西香菊药业集团有限公司物料检验报告单编码:XJJL/QC01602 检字( )号检验人:复核人:陕西香菊药业集团有限公司半成品检验报告单编码:XJJL/QC01702 检字()号陕西香菊药业集团有限公司成品检验报告书编码:XJJL/QC01802 版本:A/0检品编号:报告单号:物料检验台账26 / 88外包装材料检验台账27 / 88半成品、成品检验台账28 / 88化学试剂分类收发台账仪器使用情况记录制药企业全套检验记录制药企业全套检验记录仪器维护保养记录32 / 88计量器具使用情况记录制药企业全套检验记录对照品、标准品、对照药材分类收发台账35 / 88滴定液、标准液、检定菌分发记录制药企业全套检验记录培养基分类收发台账38 / 88溶液、试液配制记录溶液、试液配置记录标准溶液配制记录标准溶液配制记录滴定液配制标定记录培养基配制记录培养基配制记录制药企业全套检验记录消毒剂、清洁剂配制记录44 / 88检定菌使用记录检定菌传代接种记录生化培养箱使用记录高压灭菌锅使用记录微生物限度检查室清洁、消毒记录。
药品质量检查记录表
药品质量检查记录表是用于记录药品质量检查的情况,以下是一个药品质量检查记录表
总计检查数量:_________________
以上是药品质量检查记录表,可以根据实际情况进行调整和修改。
该表格可用于记录药品质量检查的情况,包括日期、药品名称、药品批号、规格、检查结果以及可能的备注信息。
通过记录药品质量检查的情况,可以评估药品的质量合格率,并提供参考依据用于监督和管理药品质量。
在检查过程中,请确保记录的准确性和完整性,按照相关标准和规定进行检查操作,并采取适当的质量控制措施。
1/ 1。