碘催化砷铈氧化还原
- 格式:ppt
- 大小:686.00 KB
- 文档页数:79

砷铈催化分光光度测定法测定尿中碘的方法探讨碘是人体必需的元素。
碘进入体内可随食物、饮水、食盐等途径摄取,其中90%由肾脏排出。
尿碘可大致反应碘摄入量和血液中的含碘量,碘缺乏和碘过量都可导致一系列疾病。
因此,探讨尿碘的分析方法对指导工业生产,为人群健康监护提供早期敏感指标有一定意义。
实验室参照尿中碘的砷铈催化分光光度测定方法(WS/T107—2006)对测定尿中碘进行了研究,总结了影响实验结果的几个方面因素,使实验更易于操作和控制减少测定误差,结果较为满意。
1.材料与方法1.1原理采用过硫酸铵溶液在100℃条件下,消化尿样与标准, 利用碘对砷铈氧化还原反应的催化作用,H3AsO3 + 2Ce4++H2O →H3AsO4+2Ce3++ 2H+,反应中黄色的Ce4+被还原成无色的Ce3+,碘含量越高,反应速度越快,所剩余的Ce4+则越少,控制反应温度和时间,于420 nm波长下测定体系中剩余Ce4+的吸光度值,求碘含量。
1.2仪器UV754N紫外可见分光光度计(上海精密科学仪器有限公司),DC-0515低温恒温槽(30±0.2℃),多孔电热消化器(孔间温度≤1℃),IKA旋涡混合器。
1.3试剂尿中碘的砷铈催化分光光度测定方法(WS/T107—2006)配套试剂盒(生产日期:110523 有效期至:111123 武汉众生生化技术有限公司)。
1.4分析步骤1.4.1尿碘标准系列(ug/L):0、50、100、150、200、250、3001.4.2测定分别取0.25mL碘标准使用系列溶液及尿样(取样前需摇匀尿液,使所有沉淀物混悬;如果尿样的碘浓度超过标准曲线的点浓度范围,则作适当稀释后取样)各置于玻璃试管中,各管加入1mL过硫酸铵溶液,混匀后置于控温100℃的消化控温装置中,消化60min,取下冷却至室温后置于30℃恒温槽中。
各管加入2.5mL亚砷酸溶液,充分混匀后放置15min,使其温度达到平衡;秒表计时,依顺序每管间隔相同时间(30s)向各管准确加入0.30mL硫酸铈铵溶液,立即混匀。

尿碘国标检测方法
尿碘的国标检测方法一般是采用砷铈催化分光光度法。
该方法具有操作简便、快速、灵敏、准确等优点,被广泛应用于尿碘的检测。
以下是尿碘国标检测方法的简要步骤:
1. 采集尿液样本:通常采集清晨空腹尿液,避免食物和药物对检测结果的影响。
2. 尿液处理:将尿液样本进行适当的稀释或浓缩,以调整碘的浓度在合适的检测范围内。
3. 催化反应:在尿液中加入一定量的砷铈试剂,进行催化反应。
在反应过程中,碘与砷铈试剂发生氧化还原反应,产生颜色变化。
4. 分光光度法测量:使用分光光度计或类似的仪器,在特定波长下测量反应体系的吸光度。
吸光度与尿碘浓度成正比,通过与标准曲线进行比较,可以确定尿碘的浓度。
5. 结果计算和报告:根据测量得到的吸光度值,通过标准曲线或计算公式,计算出尿碘的浓度,并报告结果。
需要注意的是,尿碘的检测方法可能因实验室和地区而有所差异,具体的操作步骤和条件可能会有所不同。
在进行尿碘检测时,应严格按照检测方法的要求和操作规程进行操作,以确保检测结果的准确性和可靠性。
如果你需要进行尿碘检测,建议咨询专业的医疗机构或实验室,以获取准确的检测结果和相关建议。




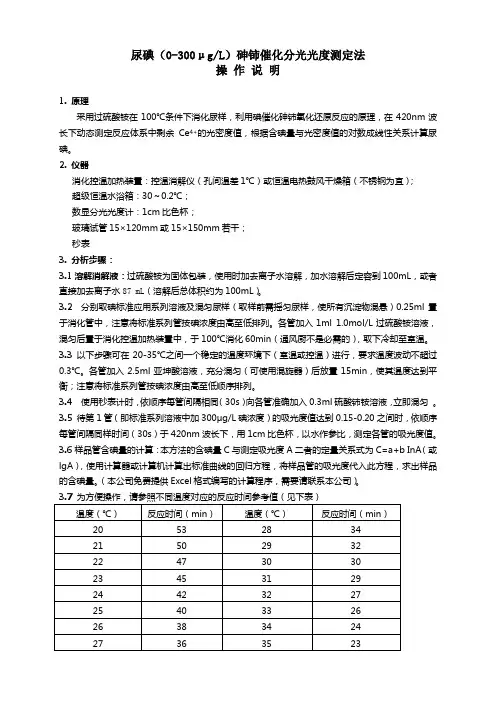
尿碘(0-300μg/L)砷铈催化分光光度测定法操作说明1. 原理采用过硫酸铵在100℃条件下消化尿样,利用碘催化砷铈氧化还原反应的原理,在420nm波长下动态测定反应体系中剩余Ce4+的光密度值,根据含碘量与光密度值的对数成线性关系计算尿碘。
2. 仪器消化控温加热装置:控温消解仪(孔间温差1℃)或恒温电热鼓风干燥箱(不锈钢为宜);超级恒温水浴箱:30~0.2℃;数显分光光度计:1cm比色杯;玻璃试管15×120mm或15×150mm若干;秒表3. 分析步骤:3.1溶解消解液:过硫酸铵为固体包装,使用时加去离子水溶解,加水溶解后定容到100mL,或者直接加去离子水87 mL(溶解后总体积约为100mL)。
3.2 分别取碘标准应用系列溶液及混匀尿样(取样前需摇匀尿样,使所有沉淀物混悬)0.25ml置于消化管中,注意将标准系列管按碘浓度由高至低排列。
各管加入1ml 1.0mol/L过硫酸铵溶液,混匀后置于消化控温加热装置中,于100℃消化60min(通风厨不是必需的),取下冷却至室温。
3.3 以下步骤可在20-35℃之间一个稳定的温度环境下(室温或控温)进行,要求温度波动不超过0.3℃。
各管加入2.5ml亚坤酸溶液,充分混匀(可使用混旋器)后放置15min,使其温度达到平衡;注意将标准系列管按碘浓度由高至低顺序排列。
3.4 使用秒表计时,依顺序每管间隔相同(30s)向各管准确加入0.3ml硫酸铈铵溶液,立即混匀。
3.5待第1管(即标准系列溶液中加300μg/L碘浓度)的吸光度值达到0.15-0.20之间时,依顺序每管间隔同样时间(30s)于420nm波长下,用1cm比色杯,以水作参比,测定各管的吸光度值。
3.6样品管含碘量的计算:本方法的含碘量C与测定吸光度A二者的定量关系式为C=a+b InA(或lgA),使用计算器或计算机计算出标准曲线的回归方程,将样品管的吸光度代入此方程,求出样品的含碘量。

尿中碘测定方法的质量控制摘要】碘缺乏病监测中尿碘是很重要的指标之一。
本研究分析我省疾控中心对尿碘检测实验室的质量控制考核,经尿中碘的砷铈催化分光光度测定方法分析尿中碘的质控结果,我实验室均通过考核,结果满意,并具体分析实验中注意各个环节,不断总结经验,为我国消除碘缺乏病提供技术支持。
【关键词】尿中碘;砷铈催化法;分光光度法【中图分类号】R197.323 【文献标识码】A 【文章编号】2095-1752(2017)29-0346-02碘是人体必需的微量元素这一,碘缺乏病(IDD)作为危害人类健康的疾病之一。
尿碘水平是监测和评价人群和个体碘营养状况的重要指标之一,是监测和诊断IDD的一个重要依据[1-2]。
尿碘的测定可用多种方法,如中子活化法、砷铈催化分光光度测定法、砷铈催化反应计时法等。
我国根据实情,应用的标准是过硫酸铵消化-砷铈催化分光光度测定法,其可靠性和可行性已被证实[3],但该实验对实验器材、水、环境、温度、时间控制等方面要求较严格,稍有疏忽将造成实验的失败。
我实验室近年来每年都要参加江苏省疾控中心对尿碘检测实验室的质量控制考核,现将2014年-2016年尿碘检测质量控制考核结果及几点体会总结如下。
1.材料与方法1.1 材料与仪器(1)仪器:T6可见分光光度计(北京普析通用仪器有限公司),QL-901旋涡混合器(江苏省海门市麒麟医用仪器厂),HH-601超级恒温水箱(金坛市富华仪器有限公司),XY-8012恒温加热器(青岛畅源通工贸有限公司),秒表,进口微量加样器,硬质玻璃消化管。
(2)试剂(试剂纯度除特别指明外均为分析纯):浓硫酸(优级纯),过硫酸铵,三氧化二砷,氢氧化钠,硫酸铈铵,氯化钠(优级纯),碘化钾(基准试剂),去离子水(电导率<1.0μs/cm)。
尿碘的考核样品和标准物质均由江苏省疾控中心提供。
考核样为高低两个浓度的样品,要求分3个工作日平行检测。
1.2 检测方法依据WS/T107-2006《尿中碘的砷铈催化分光光度测定方法》进行检测。

生活饮用水中碘化物的检测方法(国家碘缺乏病参照实验室推荐方法)●本方法规定了用硫酸铈催化分光光度法测定生活应用水及其水源中碘化物的含量。
●本方法适用于生活饮用水及其水源中碘化物的测定。
●本方法可以测定0~10 μg/L (I-),0~100 μg/L (I-)和100~600 μg/L (I-)范围碘化物。
1. 原理利用碘对砷铈氧化还原反应的催化作用:H3AsO3 + 2Ce4+ + H2O→H3AsO4 + 2Ce3+ + 2H+反应中黄色的Ce4+被还原成无色的Ce3+,碘含量越高,反应速度越快,剩余的Ce4+则越少。
控制反应温度和时间,在一定波长下测定体系中剩余的Ce4+的吸光度,求出碘含量.2. 仪器2.1 超级恒温水浴箱:30℃±0.2℃2.2数显分光光度计:1cm比色杯2.3 玻璃试管:15 mm⨯120 mm或15 mm⨯150 mm2.4秒表3. 试剂(本标准所使用的试剂纯度除特别指明外均为分析纯)3.1浓硫酸(H2SO4,优级纯)3.2氢氧化钠(NaOH,优级纯)3.3三氧化二砷(As2O3)3.4氯化钠(NaCl,优级纯)3.5硫酸铈铵(Ce(NH4)4(SO4)4.4H2O)3.6碘化钾(KI,优级纯)3.7过硫酸铵(H8N2O8S2)3.8去离子水(H2O,应符合GB/T 6682二级水规格,电导率≤1.0 μs/cm)4. 溶液配制4.1硫酸溶液[c(H2SO4)=2.5 mol/L]:取140 mL浓硫酸[优级纯,ρ20=1.84]缓慢加入到700 mL去离子水中,冷却后用水稀释至1L。
4.2低浓度水碘(范围:0~10 μg/L)测定所需溶液(1)过硫酸铵溶液[c(H8N2O8S2)=0.5 mol/L]:称取57.05 g 过硫酸铵(H8N2O8S2),溶于500 mL去离子水中。
置冰箱(4℃)避光保存, 至少稳定1个月。
(2)亚砷酸溶液Ⅰ[c(H3AsO3)=0.060 mol/L]:称取5.9340 g 三氧化二砷(As2O3)、20.0 g氯化钠(优级纯)和2.0 g氢氧化钠置于1L的烧杯中,加水约500 mL,加热至完全溶解后冷至室温,再缓慢加入350 mL 2.5 mol/L硫酸溶液(1.4.1),冷至室温后用水稀释至1L,贮于棕色瓶中室温放置,可保存数月。

WS/T107-2006尿中碘的砷铈催化分光光度测定方法修订原理采用过硫酸铵溶液在100℃条件下消化尿样,利用碘对砷铈氧化还原反应的催化作用:H3AsO3+ 2Ce4++ H2O →H3AsO4+ 2Ce3++ 2H+反应中黄色的Ce4+ 被还原成无色的Ce3+,碘含量越高,反应速度越快,所剩余的Ce4+ 则越少;控制反应温度和时间,于420nm 波长下测定体系中剩余Ce4+ 的吸光度值,求出碘含量。
1. 仪器和器材:与现行标准方法相同。
1.1消化控温加热装置:恒温消解仪,孔间温差≤1℃。
1.2数字显示光栅分光光度计:1cm比色杯。
1.3 恒温水浴:控温精度±0.3℃。
1.4 玻璃试管:15mm⨯150mm或15mm⨯120mm。
1.5 秒表。
2. 试剂:所用试剂品类规格与现行标准方法相同。
2.1所用试剂除另有说明外,均为分析纯试剂,实验用水为去离子水(符合GB/T 6682 二级水规格)。
2.2 过硫酸铵[(NH4)2S2O8,M=228.2]。
2.3 浓硫酸(H2SO4,ρ20=1.84g/mL),优级纯。
2.4 三氧化二砷(As2O3,M=197.8)。
2.5 氯化钠(NaCl,M=58.4),优级纯。
2.6 氢氧化钠(NaOH,M=40.0)。
2.7 硫酸铈铵[Ce(NH4)4(SO4)4·2H2O,M=632.6]。
2.8 碘酸钾(KIO3,M=214.0),基准试剂,使用国家标准物质GBW06110。
3. 溶液配制3.1 过硫酸铵溶液{c[(NH4)2S2O8]=1.0 mol/L}:称取114.1g 过硫酸铵溶解于约400ml纯水后再加纯水至500ml,避光4℃保存,至少稳定1个月。
3.2 硫酸溶液[c(H2SO4)=2.5mol/L]:配制方法与标准法相同。
取140mL浓硫酸缓慢加入到700mL去离子水中,边加边搅拌,冷却后用水稀释至1L。
3.3 亚砷酸溶液[c(H3AsO3)=0.025mol/L]:称取2.5g 三氧化二砷、40.0g氯化钠和1.0g氢氧化钠置于1L的烧杯中,加纯水约500mL,加热至完全溶解后冷至室温,再缓慢加入200ml 2.5mol/L硫酸溶液(3.2),冷至室温后用纯水稀释至1L,储于棕色瓶,室温放置可保存6个月。
碘分析方法原理:样品中的碘被还原为碘离子(I -)后,碘离子催化砷铈氧化还原反应:4333234H AsO 2Ce H O H AsO +2Ce 2H +++++→+该反应中,As(III)浓度过量且远大于Ce 4+含量,因此在反应中可将其浓度看作不变,I -作为催化剂参加反应后又恢复原状,因此该反应可看作一级反应,其反应速率可表示为:44-[Ce ][Ce ](I ) td k k d ++-=与浓度呈线性关系对上式进行积分可得:44t 0ln[Ce ]t ln[Ce]k ++=+ 即反应物Ce 4+瞬时浓度的对数值与反应时间t 成线性关系。
通过以分光光度计在相同的反应时间内于420 nm 波长处测定Ce 4+吸光度,并以碘离子含量为横坐标,Ce 4+吸光度的负对数为纵坐标作图,可获得-4Ce I ln[]C A +-—标准曲线。
1 药品试剂及配制1.1 主要药品1.2 试剂配制(1) 1 mol/L 过硫酸铵:称取22.82 g 过硫酸铵(M=228.2)溶解并稀释至100 mL ,保存于棕色容量瓶(4℃可稳定1个月)。
(2) 2.5 mol/L 硫酸:14 mL 浓硫酸缓慢加入到含70 mL 蒸馏水中的试剂瓶中。
(3) 0.038 mol/L 硫酸铈铵:称取2.40 g 硫酸铈铵(M=632.6)溶于70 mL 2.5 mol/L 硫酸中,用蒸馏水稀释并定容至100 mL ,保存于棕色容量瓶中(室温可稳定6个月)。
(4) 0.05 mol/L 亚砷酸:称取0.65 g 亚砷酸钠和2.50 g 氯化钠溶解,缓慢加入20 mL 2.5 mol/L 硫酸,冷却至室温后稀释至100 mL ,保存于棕色容量瓶中(室温可稳定6个月)。
(小心剧毒)(5) 1 g/L碘标准储备液:准确称取0.1686 g碘酸钾基准(或优级纯)于烧杯中,用水溶解后定量转入100 mL棕色容量瓶中(4℃可稳定1个月)。
(6) 25 mg/L碘中间液:移取2.5 mL 1 g/L碘储备液于100 mL棕色容量瓶中,定容至刻度(4℃可稳定1个月)。
食物中碘的测定方法1.原理砷铈接触法是利用在酸性环境中碘对亚砷酸与硫酸铈氧化还原反应的催化作用来测定碘含量:2Ce+4+H3As+3O3+H2O→2Ce+3+H3As+5O42Ce+4 + 2I- → 2Ce+3 + I2I2 + As+3 → 2I- + As+5由于Ce+4氧化碘离子成元素碘,然而元素碘又被As+3还原成碘离子,如此反复直至As+3、Ce+4全部消耗为止,当反应条件加以控制时,则反应速度与碘离子浓度成一定数值关系,碘离子越多反应速度越快,根据硫酸铈的退色程度来进行比色定量分析,从而测定出碘的含量。
本方法最低检出限0.001μg。
2.适用范围适用于检测各类食物、饲料及生物样品中的碘含量。
3.仪器与设备(1)恒温水浴(2)马福炉(3)烤箱(4)离心机(5)秒表(6) 722分光光度计4.试剂本试验所用试剂规格必需在分析纯以上,水为无碘水或去离子水,电阻率在500万欧姆以上。
(1) 0.44mol/L硫酸锌:称取100g优级纯硫酸锌溶于少量水中,完全溶解后至于1L容量瓶中,加水稀释至刻度。
(2) 0.5mol/L氢氧化钠:称取20g优级纯氢氧化钠溶于少量水中,完全溶解后移入1L容量瓶中加水稀释至刻度。
(3) 2.17mol/L碳酸钾溶液:称取30g优级纯碳酸钾溶于少量水中,完全溶解后移入100ml 容量瓶中,加水稀释至刻度。
(4) 0.005mol/L亚砷酸溶液:准确称取三氧化二砷0.986g,溶于温热的15ml 0.5mol/L氢氧化钠中,将此液加入850ml水中,再加入优级纯浓硫酸39.6ml,浓盐酸20ml,加热条件下不断搅拌直至完全溶解,冷却后移入1L容量瓶,加水定容至1000ml。
? 三氧化二砷的溶解性较差,如果当时不能完全溶解,可放至过夜后再定容。
(5) 0.02mol/L硫酸铈:称取硫酸铈8.087g,溶于水中,加优级纯浓硫酸44ml,冷却后加水定容至1000ml。
此溶液为杏黄色。