生活饮用水中碘化物的检测方法
- 格式:doc
- 大小:22.00 KB
- 文档页数:2
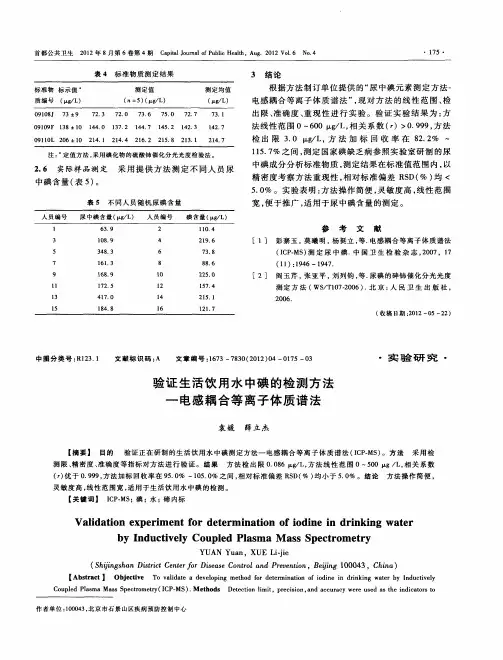

生活饮用水中碘含量测定标准检验方法--电感耦合等离子体质谱法碘:电感耦合等离子体质谱法1 范围本标准规定了用电感耦合等离子体质谱法(ICP/MS)测定生活饮用水及其水源水中的碘。
本法适用于生活饮用水及其水源水中碘的测定。
本法最低检测质量浓度为0.2 µg/L。
2 原理样品溶液经过雾化由载气(氩气)送入ICP炬焰中,经过蒸发、解离、原子化、电离等过程,大部分转化为带正电荷的正离子,经离子采集系统进入质谱仪,质谱仪根据其质荷比进行分离。
对于一定的质荷比,质谱积分面积与进入质谱仪中的离子数成正比,即样品中碘的浓度与质谱的积分面积成正比。
因此可通过测量质谱的峰面积来测定样品中碘的浓度。
3 试剂3.1 纯水: 电阻率大于18.0 MΩ·cm。
3.2 四甲基氢氧化铵[TMAH,(CH3)4NOH](25% w/w):电子级。
3.3 四甲基氢氧化铵(0.25%):取1 mL四甲基氢氧化铵(3.2)溶液,用纯水(3.1)定容至100 mL。
3.4 碘酸钾(KIO3):基准试剂或标准物质,纯度99.96%。
3.5 碘标准储备溶液[ρ(I)=1000.0 mg/L]:将碘酸钾标准物质(3.4)在105 ℃下干燥2 h,冷却后准确称取0.1686 g于100 mL容量瓶中,用纯水(3.1)溶解定容至100 mL。
3.6 碘标准中间溶液[ρ(I)=10.0 mg/L]:准确移取1 mL碘标准储备溶液(3.5)于100 mL容量瓶中,用四甲基氢氧化铵(3.3)定容至刻度。
3.7 碘标准使用溶液[ρ(I)=1.0 mg/L]:准确移取10 mL碘标准中间溶液(3.6)于100 mL容量瓶中,用四甲基氢氧化铵(3.3)定容至刻度。
3.8 质谱调谐液:混合溶液锂(Li)、钇(Y)、铈(Ce)、铊(TI)、钴(Co)的浓度均为10 mg/L。
3.9 内标溶液:推荐使用铑、碲、铼等相关元素为内标。
若采用碲元素为内标,使用前用四甲基氢氧化铵(3.3)稀释为3.0 mg/L;若采用铑、铼元素为内标,使用前用纯水(3.1)稀释为1.0 mg/L。

饮用水中碘化物、高氯酸盐的测定1.引言水是生命之源,人体的70%由水分构成。
为了保证正常的生理代谢,人每天必须适量饮水。
然而科学研究证明人类所患疾病的80%是由饮水不当引起的。
更甚者随着工业的发展水的污染越来越严重,健康洁净的饮用水越来越受到青睐。
碘是人类所必需的微量元素,碘的摄入对人类健康是非常重要的。
然而碘的的缺少和过量都会对身体产生一定的危害。
例如当饮用水中的碘含量在0.02ppm到0.05ppm时对人体有益,大于0.05ppm时则会引发碘中毒。
HJ778‐2015提供了饮用水中碘化物的检测离子色谱法。
高氯酸盐是一种甲状腺毒素,它会干扰碘的吸收,阻碍甲状腺产生,影响胎儿、儿童脑部的发育,甚至造成脑部的损伤。
随着检测技术的发展。
其在世界范围内的水体中陆续检出。
牛奶、瓶装饮料、土壤、植物中检出高氯酸盐也随之出现。
碘和其它常规阴离子对高氯酸盐的检测不产生干扰,我们介绍了离子色谱法检测水中的高氯酸盐2.实验2.1仪器和设备离子色谱仪(IC1820,上海舜宇恒平科学仪器有限公司);万分之一分析天平(AE224,上海舜宇恒平科学仪器有限公司);超声波清洗仪常规的实验室仪器2.2试剂碳酸钠(优级纯)、碳酸氢钠(优级纯)、碘的标准液(1000ppm)高氯酸钠(优级纯)、超纯水(电阻率≥18.25ΜΩ)2.3离子色谱测定条件色谱柱:阴离子色谱柱,Shodex® IC SI‐90 4E流动相:3.6mM Na2CO3 + 1.8mM NaHCO3 aq.流 速:1.0mL/min检测器:抑制型电导检测器(温度,40℃)抑制器电流:60mA柱 温:25℃进样量:25uL(可根据离子含量改变)2.4样品预处理水样过0.22um 的一次性针头过滤器,然后直接离子色谱测定,如果样品中重金属、有机物含量过多的话,样品还需过H 柱和C18小柱。
2.5样品谱图S i g n a l /μS2.6稳定性0.5ppm 的I ‐ 和-2-11S i g n a l /μS2.7Time/min自来水中碘化物加标回收率序号 样品本底(mg/L)加标量(mg/L)测得量(mg/L)回收率(%)1 0 0.2 0.187 93.52 0 0.5 0.465 93.03 0 1.0 0.936 93.6自来水中高氯酸根加标回收率序号 样品本底(mg/L)加标量(mg/L)测得量(mg/L)回收率(%)1 0 0.2 0.191 95.52 0 0.5 0.458 91.63 0 1.0 0.924 92.43.结论采用Shodex® IC SI‐90 4E的色谱柱,碳酸盐体系的淋洗液,抑制型电导检测器,离子色谱法完全可以检测饮用水中的碘化物以及高氯酸盐。

生活饮用水中碘化物的检测方法-CAL-FENGHAI.-(YICAI)-Company One1生活饮用水中碘化物的检测方法本方法规定了用砷铈催化分光光度法测定生活饮用水及其水源水中碘化物的含量。
本方法适用于生活饮用水及其水源水中碘化物的测定。
本方法检测范围:0—100ug/L(I-),检测限为2ug/L(取样量1.0mL)。
1. 原理利用碘对砷铈氧化还原反应的催化作用:H3AsO3 + 2Ce4+ + H2O → H3AsO4 + 2Ce3+ + 2H+反应中黄色的Ce4+被还原成无色的Ce3+,碘含量越高,反应速度越快,剩余的Ce4+则越少。
控制反应温度和时间,在一定波长下测定体系中剩余的Ce4+的吸光度,求出碘含量。
2. 仪器超级恒温水浴箱:30℃0.2℃数显分光光度计:1cm比色杯玻璃试管:15 mm120 mm或15 mm150 mm秒表3. 试剂(本方法所使用的试剂纯度除特别指明外均为分析纯)浓硫酸(H2SO4,优级纯)氢氧化钠(NaOH,优级纯)三氧化二砷(As2O3)氯化钠(NaCl,优级纯)硫酸铈铵(Ce(NH4)4(SO4)4·4H2O)碘化钾(KI,优级纯)去离子水(H2O,应符合GB/T 6682二级水规格,电导率s/cm)4. 溶液配制硫酸溶液[c(H2SO4)= mol/L]:取140 mL浓硫酸缓慢加入到700 mL去离子水中,冷却后用水稀释至1L。
亚砷酸溶液 [c(H3AsO3)= mol/L]:称取10.0 g三氧化二砷(As2O3)、25.0 g氯化钠和2.0 g氢氧化钠置于1L的烧杯中,加水约500 mL,加热至完全溶解后冷至室温,再缓慢加入200 mL mol/L硫酸溶液(),冷至室温后用水稀释至1L,贮于棕色瓶中室温放置,可保存数月。
硫酸铈铵溶液 [c(Ce4+)= mol/L]:称取35.43g硫酸铈铵溶于490 mL mol/L硫酸溶液(),用水稀释至1L,贮于棕色瓶中避光室温放置, 可保存数月。

生活饮用水中碘化物的检测方法(国家碘缺乏病参照实验室推荐方法)●本方法规定了用硫酸铈催化分光光度法测定生活应用水及其水源中碘化物的含量。
●本方法适用于生活饮用水及其水源中碘化物的测定。
●本方法可以测定0~10 μg/L (I-),0~100 μg/L (I-)和100~600 μg/L (I-)范围碘化物。
1. 原理利用碘对砷铈氧化还原反应的催化作用:H3AsO3 + 2Ce4+ + H2O→H3AsO4 + 2Ce3+ + 2H+反应中黄色的Ce4+被还原成无色的Ce3+,碘含量越高,反应速度越快,剩余的Ce4+则越少。
控制反应温度和时间,在一定波长下测定体系中剩余的Ce4+的吸光度,求出碘含量.2. 仪器2.1 超级恒温水浴箱:30℃±0.2℃2.2数显分光光度计:1cm比色杯2.3 玻璃试管:15 mm⨯120 mm或15 mm⨯150 mm2.4秒表3. 试剂(本标准所使用的试剂纯度除特别指明外均为分析纯)3.1浓硫酸(H2SO4,优级纯)3.2氢氧化钠(NaOH,优级纯)3.3三氧化二砷(As2O3)3.4氯化钠(NaCl,优级纯)3.5硫酸铈铵(Ce(NH4)4(SO4)4.4H2O)3.6碘化钾(KI,优级纯)3.7过硫酸铵(H8N2O8S2)3.8去离子水(H2O,应符合GB/T 6682二级水规格,电导率≤1.0 μs/cm)4. 溶液配制4.1硫酸溶液[c(H2SO4)=2.5 mol/L]:取140 mL浓硫酸[优级纯,ρ20=1.84]缓慢加入到700 mL去离子水中,冷却后用水稀释至1L。
4.2低浓度水碘(范围:0~10 μg/L)测定所需溶液(1)过硫酸铵溶液[c(H8N2O8S2)=0.5 mol/L]:称取57.05 g 过硫酸铵(H8N2O8S2),溶于500 mL去离子水中。
置冰箱(4℃)避光保存, 至少稳定1个月。
(2)亚砷酸溶液Ⅰ[c(H3AsO3)=0.060 mol/L]:称取5.9340 g 三氧化二砷(As2O3)、20.0 g氯化钠(优级纯)和2.0 g氢氧化钠置于1L的烧杯中,加水约500 mL,加热至完全溶解后冷至室温,再缓慢加入350 mL 2.5 mol/L硫酸溶液(1.4.1),冷至室温后用水稀释至1L,贮于棕色瓶中室温放置,可保存数月。


HZHJSZ00140 水质碘化物的测定 催化比色法HZ-HJ-SZ-0140水质催化比色法1 范围本方法适用于测定饮用水其最低检出浓度为1ìg/L¿É½µµÍµâµÄ·Ç´ß»¯Ð͵ÄÉú³ÉºÍÒøÓ빯µÄÒÖÖÆ×÷ÓõâÀë×Ó¶ÔÑÇÉéËáÓëÁòËáîæµÄÑõ»¯»¹Ô-·´Ó¦¾ßÓд߻¯ÄÜÁ¦ÔÚ¼ä¸ôÒ»¶¨Ê±¼äºó²Ð´æµÄ¸ßîæÀë×ÓÓëÑÇÌú·´Ó¦ºóÕßÓëÁò°±Ëá¼ØÉú³ÉÎȶ¨µÄºìÉ«ÂçºÏÎï±ØҪʱ²¢¾-ÕôÁóºó¹©ÓóÆÈ¡200g氯化钠溶于水如含碘较高3.2 亚砷酸溶液加入0.2mL浓硫酸使溶解3.3 1+3硫酸溶液称取13.38g硫酸铈铵 [Ce(NH4)4(SO4)4¼Ó44mL浓硫酸 3.5 硫酸亚铁铵溶液6H2O]溶于含0.6mL硫酸的100mL水中3.6 硫氰酸钾溶液3.7 碘化物标准贮备液移入500mL容量瓶中此溶液每毫升含1.00mg碘离子(I-)·ÖÈ¡ÉÏÊöµâ»¯Îï±ê×¼Öü±¸ÒºÁÙÓÃÇ°ÅäÖÆ4.2 分光光度计可控制温度为305 水样保存水样在采集后应尽快进行测定保存于2~5并在24h内完成测定1.005.00加水至10.0mL0.5mL亚砷酸溶液和1mL 1+3硫酸溶液置于30恒温水浴中每隔30s(以秒表计)分别加入1.0mL硫酸铈铵溶液经15min°´Ô-˳Ðòÿ¸ô30s加入1.00mL硫酸亚铁铵溶液此时黄色高价铈离子的颜色应消失混匀于510nm波长处用光程长10mm比色皿测量吸光度6.2 水样的测定取10.0mL水样(或分取适量按校准曲线绘制相同操作步骤测量吸光度以相同操作步骤进行空白测定m由水样减去空白试验后的校正吸光度 V分取水样体积(mL)(1) 催化反应与温度故应严格按规定时间操作绘制校准曲线碘离子浓度与测得吸光度成反比而两端向上弯曲水和废水监测分析方法水和废水监测分析方法中国环境科学出版社1997。

生活饮用水中碘化物的检测方法1.电位滴定法:这是一种常用的测定方法,通过测定溶液的电位变化来确定溶液中碘化物的含量。
首先,将样品经过预处理后,用硝酸将样品中的碘化物转化为碘酸盐。
然后,将样品溶液与电极连接在一起,通过向样品中滴定一定浓度的亚硝酸钠溶液来观察溶液的电位变化。
当溶液中的碘化物被亚硝酸钠滴定完后,电位突然下降,此时记录电位变化的体积,根据计算公式可以得到样品中碘化物的含量。
2.荧光法:荧光法是一种快速、灵敏、无污染的检测方法。
该方法利用吸收光谱和荧光光谱的差异来判断样品中碘化物的含量。
首先,将样品与一种特定的荧光染料反应生成荧光复合物,然后对该复合物进行荧光测量。
根据荧光的强度来确定样品中碘化物的含量。
3.离子色谱法:离子色谱法是一种常用的检测水中离子的方法之一、这种方法可用于测定饮用水中碘离子的含量。
首先,将样品中的离子通过离子交换柱分离,然后通过检测器检测离子的浓度。
根据样品中离子的峰面积或峰高来计算样品中碘化物的含量。
4.高效液相色谱法:这是一种高效、灵敏的检测方法,也可用于测定饮用水中碘化物的含量。
该方法利用高效液相色谱仪对样品中的碘化物进行分离和测量,在分离过程中使用特定的流动相和柱温来实现高效的分离。
通过仪器测量样品中离子的峰面积或峰高,根据标准曲线来计算样品中碘化物的含量。
需要注意的是,在进行碘化物的检测时,需要对水样进行适当的预处理以去除可能干扰的物质。
例如,可以通过氯仿提取法提取碘化物,并用硫酸钾和氯仿洗涤去除可能的干扰物质。
此外,在进行碘化物的检测过程中,需要仪器和试剂的标定、校准以确保结果的准确性和可靠性。
总结而言,生活饮用水中碘化物的检测方法多种多样,每种方法都有其特点和适用范围。
在选择合适的检测方法时,需要考虑样品的性质、检测的灵敏度和准确性要求以及实验条件等因素,并根据实际情况选择合适的方法。

碘化物的测定可以采用多种方法,其中一种常用的方法是碘量法。
该方法基于碘离子与碘的氧化还原反应,通过加入适量的溴水将碘离子氧化成碘,然后用硫代硫酸钠标准溶液滴定碘。
在滴定过程中,可以通过加入淀粉指示剂来观察滴定终点,从而确定碘离子的含量。
另一种方法是使用离子色谱法进行测定。
该方法基于离子交换的原理,通过将水样中的碘离子与其他离子分离,然后使用电导检测器检测碘离子的电导率,从而确定其含量。
该方法的优点是能够同时测定水样中的多种离子,而且具有较高的精度和准确性。
此外,还可以使用光谱法进行碘化物的测定。
例如,可以采用原子吸收光谱法或原子荧光光谱法,通过测量特定波长下的吸光度或荧光强度来测定碘离子的含量。
这些方法需要使用专业的仪器和试剂,并且需要进行严格的实验操作和控制。
对于碘化物的测定,需要根据具体的实验要求和条件选择合适的方法。
在实际应用中,需要根据水样的性质、碘离子的浓度范围以及其他干扰离子的存在情况来选择最合适的方法。


山西科技SHANXI SCIENCE TECHNOLOGY2020年第35卷第2期碘化物是含碘为-1价氧化态的二元离子化合物,属于易溶于水的电解质。
碘是首批被确认的生命元素之一,在天然水体中含量极微,成人每日需碘量约为100µg~300µg,当水中碘含量<10µg/L或平均每人每日碘摄入量<40µg时,即可断定为碘缺乏。
碘缺乏会引起儿童智力低下、甲状腺肿大等疾病,碘化物含量过高时则可引起高碘甲状腺肿。
鉴于碘化物对人体有着重要的生理影响,准确测定生活饮用水中的碘化物含量就显得尤为重要。
目前生活饮用水卫生标准(GB5749—2006)中对碘化物的测定主要为催化分光光度法。
该方法涉及复杂的催化反应,操作步骤烦琐,条件苛刻,干扰因素多,显色不明显,标准曲线相关性差,结果误差较大,不适合准确快速测定。
本文在充分借鉴国家环境保护标准中碘化物的测定方法基础上,根据本实验仪器建立了离子色谱法测定生活饮用水中碘化物的方法。
1检测原理水样中的碘离子随氢氧化钾淋洗液进入阴离子交换分离系统(由保护柱和分析柱组成),根据分析柱对各离子的亲和力不同进行分离,分离出的碘离子由电导检测器检测,根据碘离子保留时间定性,外标法定量。
2仪器设备及试剂材料离子色谱仪:美国戴安公司的ICS-1000离子色谱仪,配电导检测器:EG50淋洗液在线发生器:ASRS-300型阴离子抑制器:AS40自动进样器:色谱柱为IonPac AS19型阴离子分析柱(4×250mm)及IonPac AG19型阴离子保护柱(4×50mm)。
实验用水为超纯水,电阻率为18.2MΩ·cm。
碘化物标准贮备液:购买市售有证标准物质,ρ(I-)=1000mg/L。
碘化物标准使用溶液:ρ(I-)=10mg/L,取1mL标准贮备液,用水稀释并定容至100mL。
3实验步骤样品前处理:水样经过0.22µm水系滤膜过滤器直接进样。
生活饮用水碘化物的标准曲线
生活饮用水碘化物的标准曲线是一种用于检测饮用水中碘化物含量的方法。
标准曲线是通过测量一系列标准溶液的吸光度或浓度,然后绘制出的一个曲线图。
这个图形通常是一个直线,其斜率和截距用于计算未知样品中的碘化物浓度。
标准曲线的制备通常包括以下步骤:
1. 准备一系列已知浓度的标准溶液。
这些溶液通常是由纯粹的碘化物化合物和纯水按照不同浓度比例混合得到的。
2. 使用分光光度计或其他适当的仪器测量每个标准溶液的吸光度,以确定其对应的吸光度值。
3. 绘制标准曲线图。
横坐标表示标准溶液的碘化物浓度,纵坐标表示吸光度值。
根据已知标准溶液的浓度和相应的吸光度值,绘制出一个直线。
4. 使用标准曲线来测量未知样品中的碘化物浓度。
通过测量未知样品的吸光度值,并在标准曲线上找到相应的浓度值,可以计算出样品中的碘化物浓度。
标准曲线的制备和使用是饮用水质量检测中的常见方法,可以准确地测量饮用水中碘化物的含量,并与相关的标准进行比较,以评估水质是否符合规定的标准。
水质碘化物的测定分光光度法
碘化物是水中溶解的碘元素,是污染水体的重要指标,碘化物的浓度超标会影响水体的生态环境,因此碘化物的测定是评价水质的一个重要指标。
碘化物的测定主要通过分光光度法。
分光光度法是将溶液中的碘化物吸收到一定量的紫外光中,根据吸收光谱的不同波长的紫外线,测量其有效吸收率确定碘化物含量,进而推算出碘化物的浓度。
首先,选择溶液样本,将样品加入分光光度仪中,调节分光光度仪的参数,对样品进行分光光度测量。
将样品的吸收光谱的不同波长的吸收率和标准曲线进行比较,确定碘化物在样品中的浓度。
其次,在分光光度测量中,应注意样品的准备,样品的准备应该符合分光光度仪的要求,如果样品太稀或太浓,则可能会影响测量结果的准确性。
此外,在使用分光光度仪测量碘化物时,应尽量选择具备良好的稳定性和可靠性的仪器。
如果仪器的稳定性和可靠性不足,则可能会对测量结果产生较大的影响。
最后,应注意校正分光光度仪的参数,分光光度仪的参数在使用前应进行校正,以确保测量结果的准确性。
总之,碘化物的测定主要通过分光光度法,在进行分光光度测量时,需要注意仪器的稳定性和可靠性,样品的准备,以及校正分光光度仪的参数,这样才能得出准确的测量结果,做出相应的污染防治措施。
水质碘化物标样
水质碘化物标样是一种用来检测水中碘化物含量的标准物质。
具体来说,水质碘化物标样通常采用离子色谱法进行检测。
这种方法是通过采集水样,然后将其淋洗液进入阴离子分离柱,分离出的碘离子用电导检测器进行检测。
根据碘离子保留时间定性,并采用外标法进行定量。
当水样体积为250ul时,此方法的检出限为0.002mg/L。
此外,水质碘化物标样的使用也需要一些特别的注意事项。
例如,在采集水样时需要使用聚乙烯瓶或棕色玻璃瓶,并加入氢氧化钠饱和溶液调节pH。
采集后的水样要经过0.45um水系微孔滤膜进行过滤,弃去10ml初滤液,将剩余的滤液保存待测。
总的来说,水质碘化物标样是用来检测水中碘化物含量的一种标准物质,使用时需要遵循一定的方法和注意事项。
水质碘化物的测定离子色谱法《水质碘化物的测定离子色谱法指南》嘿,朋友们!今天咱来聊聊水质碘化物的测定离子色谱法。
这可真是个有趣的事儿呢!想象一下,那水就像一个神秘的世界,里面藏着各种我们看不见的东西,碘化物就是其中之一啦。
而我们呢,就像是侦探,要用离子色谱法这个厉害的工具去把它给揪出来。
先来说说准备工作吧。
就像要去探险得先准备好装备一样,我们得把需要的东西都准备齐全咯。
仪器得调试好,试剂得选对,可不能马虎。
然后就是正式操作啦。
把水样小心翼翼地放进仪器里,就好像送一个小宝贝去接受检查。
这时候离子色谱法就开始大显身手啦。
它就像一个超级厉害的筛选机器,能把碘化物从其他乱七八糟的东西里准确地挑出来。
在这个过程中,可要有耐心哦。
不能着急,得慢慢等,就像等一朵花慢慢开放一样。
看着仪器上的数据一点点出来,心里还真有点小期待呢。
有时候可能会遇到一些小麻烦,比如数据不太对劲呀。
别着急,别慌张,咱就像解决一个小谜题一样,仔细找找原因,说不定就是哪里出了一点点小差错。
哎呀,我想起我有一次做实验的时候,就因为一个小小的操作失误,结果出来的数据那叫一个奇怪呀。
后来我静下心来,一点点排查,才发现原来是自己不小心弄错了一个步骤。
从那以后呀,我做实验就更仔细啦。
经过一番努力,终于得到准确的数据啦!这时候的心情呀,就像是找到了宝藏一样开心。
总之呢,水质碘化物的测定离子色谱法虽然听起来有点复杂,但只要我们认真对待,一步一步来,就一定能做好。
它就像是一把钥匙,能帮我们打开水质这个神秘世界的大门,让我们更加了解水里面的奥秘。
所以呀,大家别怕麻烦,大胆去尝试吧!让我们一起成为水质侦探,去探索那些看不见的秘密!。
水中碘含量标准检测方法1. 碘是人体必需的微量元素之一,在水中的适量含量对人体健康至关重要,因此需要标准化的检测方法来确定水中的碘含量是否符合安全标准。
2. 传统的水中碘含量检测方法包括化学分析法和物理分析法。
3. 化学分析法是指利用化学试剂和反应原理来测定水中碘的含量,常采用的方法有吸光光度法、滴定法和原子吸收光谱法。
4. 吸光光度法是基于碘与特定试剂之间的光化学反应,通过测量溶液在特定波长处的吸光度来确定碘的含量。
5. 滴定法是通过加入已知浓度的反应溶液到待测溶液中,根据滴定反应的终点变化来确定碘的含量。
6. 原子吸收光谱法则是通过光谱仪测量碘在特定波长处的吸光度,然后根据标准曲线来计算出碘的含量。
7. 物理分析法是指利用物理性质或仪器设备来测定水中的碘含量,常使用的方法有电化学法和光谱法。
8. 电化学法是通过测量溶液中氧化还原反应的电流强度或电位来确定碘的含量,常采用的方法有极谱法和电位滴定法。
9. 光谱法是利用碘溶液在特定波长处的吸光度与碘的含量成正比关系,通过光度计或分光光度计来测量吸光度。
10. 标准的水中碘含量检测方法应该具备准确、快速、灵敏和可靠的特点,以确保结果的准确性和可重复性。
11. 选择合适的检测方法需要考虑样品的特性、目标检测碘的浓度范围、仪器设备的可用性和实验条件等因素。
12. 在进行水中碘含量检测之前,需要对样品进行预处理,如过滤、稀释或提取等,以消除对测量结果的干扰。
13. 检测前需要准备标准溶液,根据已知浓度的标准物质制备一系列浓度递增的碘溶液,用于构建标准曲线和校准仪器。
14. 校准仪器是指通过测量标准溶液的吸光度或电流强度来调整仪器的灵敏度和准确性,以确保检测结果的精准度。
15. 标准曲线是根据已知浓度的标准溶液的吸光度或电流强度与其浓度之间的关系绘制而成,用于计算待测样品中碘的含量。
16. 检测过程中需要注意测量条件的控制,如温度、pH值、光线强度等因素,以确保实验结果的准确性和可靠性。
生活饮用水中碘化物的检测方法
本方法规定了用砷铈催化分光光度法测定生活饮用水及其水源水中碘化物的含量。
本方法适用于生活饮用水及其水源水中碘化物的测定。
本方法检测范围:0—100ug/L(I-),检测限为2ug/L(取样量
1.0mL)。
1. 原理
利用碘对砷铈氧化还原反应的催化作用:
H3AsO3 + 2Ce4+ + H2O → H3AsO4 + 2Ce3+ + 2H+
反应中黄色的Ce4+被还原成无色的Ce3+,碘含量越高,反应速度越快,剩余的Ce4+则越少。
控制反应温度和时间,在一定波长下测定体系中剩余的Ce4+的吸光度,求出碘含量。
2. 仪器
超级恒温水浴箱:30℃0.2℃
数显分光光度计:1cm比色杯
玻璃试管:15 mm120 mm或15 mm150 mm
秒表
3. 试剂(本方法所使用的试剂纯度除特别指明外均为分析纯)浓硫酸(H2SO4,优级纯)
氢氧化钠(NaOH,优级纯)
三氧化二砷(As2O3)
氯化钠(NaCl,优级纯)
硫酸铈铵(Ce(NH4)4(SO4)4·4H2O)
碘化钾(KI,优级纯)
去离子水(H2O,应符合GB/T 6682二级水规格,电导率s/cm)4. 溶液配制
硫酸溶液[c(H2SO4)= mol/L]:取140 mL浓硫酸缓慢加入到700 mL去离子水中,冷却后用水稀释至1L。
亚砷酸溶液 [c(H3AsO3)= mol/L]:称取10.0 g三氧化二砷(As2O3)、25.0 g氯化钠和2.0 g氢氧化钠置于1L的烧杯中,加水约500 mL,加热至完全溶解后冷至室温,再缓慢加入200 mL mol/L硫酸溶液(),冷至室温后用水稀释至1L,贮于棕色瓶中
室温放置,可保存数月。
硫酸铈铵溶液 [c(Ce4+)= mol/L]:称取35.43g硫酸铈铵溶于490 mL mol/L硫酸溶液(),用水稀释至1L,贮于棕色瓶中避光室温放置, 可保存数月。
碘标准溶液:
(1)贮备液:准确称取经硅胶干燥器干燥24 h以上的碘化钾0.1308 g于烧杯中,用%NaOH溶液溶解后定量移入1L容量瓶中,用%NaOH溶液稀释至刻度,此溶液1 mL含碘100 g。
置冰箱(4℃)内可保存半年。
(2)中间溶液Ⅰ:临用时吸取 mL贮备液置于100 mL容量瓶中,用%NaOH水溶液稀释至刻度,此溶液1mL含碘10ug/L,%NaOH。
(3)中间溶液Ⅱ:临用时吸取中间溶液Ⅰ置于100 mL容量瓶中,用%NaOH水溶液稀释至刻度,此溶液1mL含碘1ug/L,%NaOH。
(4)0-100ug/L水碘标准应用系列溶液:临用时吸取碘标准中间溶液Ⅱ 0,,, , , mL分别置于100 mL容量瓶中, 用%NaOH 水溶液稀释至刻度。
此标准系列溶液的碘浓度分别为0, 20, 40, 60, 80, 100ug/L,%NaOH。
5.分析步骤
分别取碘标准应用系列溶液及水样各 mL置于玻璃试管中,然后加入 mL亚砷酸溶液Ⅱ,充分混匀后置于30℃恒温水浴中温浴15min。
使用秒表计时,依顺序每管间隔15~30秒向各管准确加入 mL 硫酸铈铵溶液Ⅱ,立即混匀,放回水浴中。
待第一管加入硫酸铈铵溶液Ⅱ后准确反应15min时,依顺序每管间隔15—30秒于420 nm波长下,用1cm比色杯,测定各管的吸光度。
样品碘含量的计算:碘浓度C与测得的吸光度A之间的定量关系为C= a + b lnA(或lgA),计算出标准曲线的回归方程,将样品的吸光度值代入此方程,求出样品的碘浓度。
说明:本方法已经发表在《中国地方病学杂志》2007年第26卷第3期,页码333-336。