元素性质的递变规律汇总
- 格式:ppt
- 大小:4.71 MB
- 文档页数:47

同一族元素从上到下的递变规律
同一族元素,也被称为同族元素或族元素,指的是在元素周期表中位于同一列的元素。
它们具有相似的电子排布,特别是在价电子层上。
由于核电荷数的增加,从上到下,这些元素在物理和化学性质上展现出一些明显的递变规律。
首先,我们来看物理性质的递变。
随着原子序数的增加,同一族元素的原子半径逐渐增大。
这是因为原子核的电荷增加,但电子层数也增加,导致对最外层电子的吸引力减弱,电子云向外部扩展。
同时,元素的金属性逐渐增强,非金属性减弱。
这是因为原子半径的增大使得原子间的相互作用减弱,导致金属键的形成更为容易。
在化学性质方面,同一族元素的化合价通常是相同的,因为它们的价电子数相同。
但随着原子序数的增加,元素的电负性逐渐减小,这意味着元素吸引电子的能力降低。
因此,从上到下,元素的氧化性逐渐减弱,还原性逐渐增强。
这解释了为什么同一族元素从上到下,金属性逐渐增强,非金属性逐渐减弱。
此外,同一族元素的电离能也呈现出递变规律。
随着原子序数的增加,元素的电离能逐渐减小。
这是因为原子半径的增大使得原子核对外层电子的束缚力减弱,导致电离所需的能量降低。
总的来说,同一族元素从上到下在物理和化学性质上展现出明显的递变规律。
这些规律反映了元素周期表中元素性质的变化趋势,为我们理解元素的性质提供了重要的线索。



元素性质的递变规律
1、原子半径
(1)同一周期,随着核电荷数的增大,原子半径依次减小
(2)同一主族,随着电子层数逐渐增多,原子半径依次增大
2、金属性和非金属性
金属性——元素的原子失电子能力的强弱
原子半径大,最外层电子数少,越易失电子
非金属性——元素的原子得电子能力的强弱
原子半径小,最外层电子数多,越易得电子
(1)同一周期,随着核电荷数的增大,元素的金属性逐渐减弱,非金属性逐渐增强。
(2)同一主族,随着核电荷数的增大,元素的金属性逐渐增强,非金属性逐渐减弱。
3、元素气态氢化物的热稳定性
(1)同一周期,非金属性增强,元素气态氢化物的热稳定性逐渐增强。
(2)同一主族,非金属性减弱,元素气态氢化物的热稳定性逐渐减弱。
4、主族元素最高价氧化物对应的水化物酸、碱性
(1)同一周期,从左到右,元素最高价氧化物对应的水化物碱性逐渐减弱,酸性逐渐增强。
(2)同一主族,从上到下,元素最高价氧化物对应的水化物碱性逐渐增强,酸性逐渐减弱。

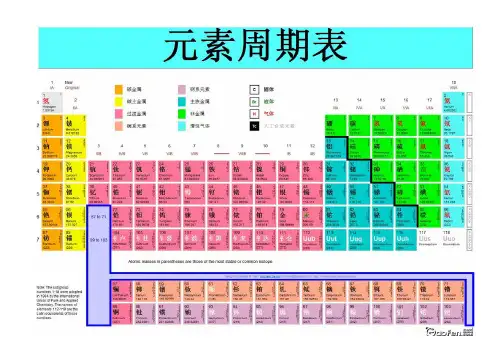
非金属氧性化渐性强渐氢化物渐稳定强还原熔氢原子沸化性半点物渐径渐渐熔强渐大稳沸金大定点属最高价氧化物的水合物的酸性渐强渐性最高价氧化物的水合物的碱性渐强大渐强原子半径渐大化合价+1 +2 +3 +4 +5 +6 +7 +6 +6 +6 +2 +2 +3 +4 +5 +6 +7+3 +4 +3 +3 +3 +1 +2 +4 +4 +5 化合价最高正价渐高+3 +2 +2 +2 +3 +4+2 +3+1 +1-4 -3 -2 -11. 元素周期表中元素性质的递变规律2.3.几个规律:①.金属性强弱:单质与水或非氧化性酸反应难易;单质的还原性(或离子的氧化性);M(OH)n的碱性;金属单质间的置换反应;原电池中正负极判断,金属腐蚀难易;非金属性强弱:与氢气反应生成气态氢化物难易;单质的氧化性(或离子的还原性);最高价氧化物的水化物(H n RO m)的酸性强弱;非金属单质间的置换反应。
② .半径比较三规律:阴离子与同周期稀有气体电子层结构相同;阳离子与上周期稀有气体电子层结构相同。
(1)电子层数越多,半径越大(2)电子层数相同,核电荷数越多,半径越小(3)电子层数和核电荷数相同,最外层电子数越多,半径越大③ .元素化合价规律主族最高正价 == 最外层电子数,非金属的负化合价 == 最外层电子数-8,最高正价数和负化合价绝对值之和为8;其代数和分别为:0、2、4、6。
化合物氟元素、氧元素只有负价(-1、-2),但HFO中0为+1价;金属元素只有正价;④. 熔沸点高低的比较:原子晶体>离子晶体>分子晶体⑤. 1-20号元素符号、名称、原子结构、特殊化学性质。
⑥ .电子式的书写原子的电子式离子的电子式:分子或共价化合物电子式离子化合价电子式同周期元素性质的递变规律:同一周期元素(稀有气体元素除外)的原子,从左往右,最外层电子数逐渐增加,原子半径逐渐减小,元素的原子失电子能力逐渐减弱,得电子能力逐渐增强,即元素的金属性逐渐减弱,非金属性逐渐增强第3周期:元素原子失电子能力(元素的金属性、元素单质的还原性)Na > Mg > Al氧化性:Na+< Mg2+< Al3+(相反)与水或酸反应置换出氢的难易程度:Na > Mg > Al易难剧烈不剧烈最高价氧化物对应的水化物的碱性NaOH > Mg(OH)2> Al(OH)3元素原子得电子能力(元素的非金属性)Si < P < S < Cl还原性:P3->S2->Cl-(Si4-不存在) (相反)元素单质的氧化性Si < P < S < Cl2单质与氢气化合的难易程度Si < P < S < Cl2难易气态氢化物的稳定性SiH4< PH3< H2S < HCl最高价氧化物对应的水化物的酸性H4SiO4(或H2SiO3) < H3PO4< H2SO4< HClO4第2周期:元素原子失电子能力(元素的金属性、元素单质的还原性)Li > Be氧化性:Li+< Be2+(相反)与水或酸反应置换出氢的难易程度:Li > Be易较难剧烈较不剧烈最高价氧化物对应的水化物的碱性LiOH > Be(OH)2元素原子得电子能力(元素的非金属性)C < N < O < F还原性:N3->O2->F-(C4-不存在) (相反)元素单质的氧化性C < N2< O2< F2单质与氢气化合的难易程度C < N2< O2< F2难易气态氢化物的稳定性CH4< NH3< H2O < HF最高价氧化物对应的水化物的酸性H2CO3< HNO3同主族元素性质的递变规律:同主族元素从上到下,电子层数依次增多,原子半径逐渐增大,元素的原子失电子能力逐渐增强,得电子能力逐渐减弱即元素的金属性逐渐增强,非金属性逐渐减弱ⅦA族ⅠA族(除氢H外,即碱金属元素)ⅤA族。

第二单元元素性质的递变规律【学海导航】元素的性质随着核电荷数的递增而呈现周期性的变化,这个规律叫做元素周期律。
一、原子核外电子排布的周期性元素按原子序数递增的顺序依次排列时,原子的最外层上的电子数,由1(s1)到8(s2p6),呈现出周期性变化。
相应于这种周期性变化,每周期以碱金属开始,以稀有气体结束。
元素的化学性质,主要取决于元素原子的电子结构,特别是最外层电子结构。
所以元素性质的周期性,来源于原子电子层结构的周期性。
根据元素原子的外围电子排布的特征,可将元素周期表分成五个区域:s区、p区、d 区、ds区、f区。
二、元素第一电离能的周期性变化1、定义:从气态的基态原子中移去一个电子变成+1价气态阳离子所需的最低能量,称为第Ⅰ电离能。
常用符号I1表示。
M(g)→ M+(g)+ e-,+1价气态阳离子移去一个电子变成+2价气态阳离子所需的最低能量,称为第Ⅱ电离能。
依次类推。
元素的第一电离能越小,表示它越容易失去电子,即该元素的金属性越强。
2、影响电离能的因素电离能的大小主要取决于原子的核电荷、原子半径及原子的电子构型。
一般说来,核电荷数越大,原子半径越小,电离能越大。
另外,电子构型越稳定,电离能也越大。
3. 电离能的周期性变化同周期中, 从左向右,核电荷数增大,原子半径减小, 核对电子的吸引增强, 愈来愈不易失去电子, 所以 I 总的趋势是逐渐增大。
但有些元素(如Be、Mg、N、P等)的电离能比相邻元素的电离能高些,这主要是这些元素的最外层电子构型达到了全充满或半充满的稳定构型。
同主族元素自上而下电离能依次减小。
但在同一副族中,自上而下电离能变化幅度不大,且不甚规则。
4.电离能与价态之间的关系失去电子后, 半径减小, 核对电子引力大, 更不易失去电子, 所以有: I1 < I2 < I3 < I4…., 即电离能逐级加大.三、元素电负性的周期性变化1、定义:电负性: 表示一个元素的原子在分子中吸引电子的能力. 元素的电负性越大,表示原子吸引成键电子的能力越强,该元素的非金属性也就越强;电负性越小,该元素的金属性越强。


同主族元素性质的递变规律对于同主族元素来说,它们具有相似的原子结构,包括相同的电子层排布和相似的价电子配置。
这使得它们在化学反应中的行为和性质相似。
在同一周期的元素中,随着原子序数的增加,电子层的能量逐渐增加,原子半径逐渐变大。
这一变化规律可以通过考察同一周期元素的原子半径来说明。
原子半径是指原子核和最外层电子之间的平均距离。
原子半径的变化往往反映了元素性质的变化。
一般来说,在同一周期的元素中,原子半径随着原子序数的增加而增加。
这是因为随着电子层的增加,电子云的半径也会增大。
此外,随着电子层数的增加,电子间的排斥力也会增强,导致电子云膨胀。
因此,同一周期元素的原子半径会逐渐增大。
同主族元素的性质也受到原子核的带电量和电子层结构的影响。
原子核的带电量通过元素的原子序数来体现,它决定了元素的化学反应性和离子化趋势。
具体来说,同一周期的元素,原子核的带电量随着原子序数的增加而增加。
在同一周期的元素中,原子核带电量的增加会导致价层电子与核之间的吸引力增强,进而影响元素的化学反应性。
随着原子核带电量的增加,元素原子更容易失去或获得电子,因此化合价也会逐渐增加。
另外,由于同一周期的元素具有相同的价电子环境,它们的化学性质也有较大的相似之处。
例如,同一周期的元素在与氧发生化合反应时,往往形成相似的氧化物。
此外,同一周期的元素还表现出相似的离子化趋势。
随着原子序数的增加,原子核带电量增加,原子的电离能也会增加,因此,同一周期元素的电离能会逐渐增大。
同样地,随着原子核带电量的增加,元素形成阴离子的能力也会增加。
总之,同主族元素的递变规律是由它们的原子半径、原子核带电量和电子层结构所决定的。
随着原子序数的增加,同一周期的元素的性质逐渐变化,但仍然保持着相似性。
这种递变规律为我们理解元素周期表中元素的性质提供了一种有序的方式。


卤族元素性质递变规律卤族元素是周期表中第17族的元素,包括氟、氯、溴、碘和砹。
这些元素在化学性质上有许多共同点,但也存在着一些递变规律。
首先,卤族元素的物理性质递变规律如下:1.原子半径递增:从氟到砹,原子半径呈现递增趋势。
这是因为随着核电荷数的增加,核外电子的层次也增加,电子云分布范围扩大,从而使原子半径增大。
2.离子半径递减:卤族元素通常失去一个电子形成阴离子。
离子半径呈现递减趋势,这是因为电子云的静电斥力减小,拉近了核与电子云的距离。
3.电离能递增:卤族元素的电离能从氟到砹递增。
这是由于原子半径减小,核对电子的吸引力增强,电子释放出来需要克服更大的吸引力。
4.电负性递减:卤族元素的电负性从氟到砹递减。
氟是周期表中最电负的元素,而砹则是较不电负的元素。
这是由于原子半径增加,电子云扩大,电子对其他原子核的吸引力减弱。
其次,卤族元素的化学性质递变规律如下:1.氧化性递减:卤族元素的氧化性从氟到砹递减。
氟是最强的氧化剂,能够氧化几乎所有非金属和大多数金属。
氯也具有较强的氧化性,如能与氢气反应形成盐酸。
而溴和碘更不容易发生氧化反应。
2.还原性递增:卤族元素的还原性从氟到砹递增。
氟是最强的还原剂,能够将大多数非金属元素从其他化合物中还原出来。
砹则是较强的还原剂,可以还原一些金属的化合物。
3.酸性递减:卤族元素的酸性从氟到砹递减。
氟的化合物通常是强酸,如氟化氢。
而砹的化合物则通常是弱酸。
4.溶解度递递增:卤化物的溶解度从氟化物到碘化物递增。
氟化物通常溶解度较小,溴化物和碘化物的溶解度则较大。
此外,卤族元素化合物的性质也表现出一定的递变规律:1.氟化物的离解热较大,熔点和沸点较高,易形成离子化合物。
2.氯化物的离解热适中,在室温下多为晶体,如果存在水合物,则多为六配位。
3.溴化物的离解热较小,多数为固体,但有些溴化物具有一定的溶解性。
4.碘化物的离解热更小,常为固体,但具有较大的溶解性。
综上所述,卤族元素的物理和化学性质在周期表中呈现一定的递变规律。
知识网络 中子N (不带电荷) 同位素原子核 → 质量数(A=N+Z ) 近似相对原子质量质子Z (带正电荷) → 核电荷数 元素 → 元素符号原子结构 : 最外层电子数决定主族元素的电子数(Z 个): 化学性质及最高正价和族序数 核外电子 排布规律 → 电子层数 周期序数及原子半径表示方法 → 原子(离子)的电子式、原子结构示意图随着原子序数(核电荷数)的递增:元素的性质呈现周期性变化①、原子最外层电子的周期性变化(元素周期律的本质)元素周期律 ②、原子半径的周期性变化③、元素主要化合价的周期性变化④、元素的金属性与非金属性的周期性变化①、按原子序数递增的顺序从左到右排列;元素周期律和 排列原则 ②、将电子层数相同的元素排成一个横行;元素周期表 ③、把最外层电子数相同的元素(个别除外)排成一个纵行。
①、短周期(一、二、三周期) 周期(7个横行) ②、长周期(四、五、六周期) 周期表结构 ③、不完全周期(第七周期) ①、主族(ⅠA ~ⅦA 共7个) 元素周期表 族(18个纵行) ②、副族(ⅠB ~ⅦB 共7个) ③、Ⅷ族(8、9、10纵行) ④、零族(稀有气体)同周期同主族元素性质的递变规律①、核外电子排布②、原子半径性质递变 ③、主要化合价④、金属性与非金属性⑤、气态氢化物的稳定性⑥、最高价氧化物的水化物酸碱性电子层数 相同条件下,电子层越多,半径越大。
判断的依据 核电荷数 相同条件下,核电荷数越多,半径越小。
决定原子呈电中性 编排依据 X)(A Z 七主七副零和八三长三短一不全 决定元素种类最外层电子数 相同条件下,最外层电子数越多,半径越大。
微粒半径的比较 1、同周期元素的原子半径随核电荷数的增大而减小(稀有气体除外)如:Na>Mg>Al>Si>P>S>Cl.2、同主族元素的原子半径随核电荷数的增大而增大。
如:Li<Na<K<Rb<Cs具体规律 3、同主族元素的离子半径随核电荷数的增大而增大。
知识网络 中子N原子核质子Z原子结构 :电子数(Z 个)核外电子 排布规律 → 电子层数 周期序数及原子半径表示方法 → 原子(离子)的电子式、原子结构示意图随着原子序数(核电荷数)的递增:元素的性质呈现周期性变化①、原子最外层电子的周期性变化(元素周期律的本质)元素周期律 ②、原子半径的周期性变化③、元素主要化合价的周期性变化④、元素的金属性与非金属性的周期性变化①、按原子序数递增的顺序从左到右排列;元素周期律和 排列原则 ②、将电子层数相同的元素排成一个横行;元素周期表 ③、把最外层电子数相同的元素(个别除外)排成一个纵行。
①、短周期(一、二、三周期) 周期(7个横行) ②、长周期(四、五、六周期) 周期表结构 ③、不完全周期(第七周期) ①、主族(ⅠA ~ⅦA 共7个) 元素周期表 族(18个纵行) ②、副族(ⅠB ~ⅦB 共7个) ③、Ⅷ族(8、9、10纵行) ④、零族(稀有气体)同周期同主族元素性质的递变规律①、核外电子排布②、原子半径性质递变 ③、主要化合价④、金属性与非金属性⑤、气态氢化物的稳定性⑥、最高价氧化物的水化物酸碱性电子层数 相同条件下,电子层越多,半径越大。
判断的依据 核电荷数 相同条件下,核电荷数越多,半径越小。
决定原子呈电中性 编排依据 X)(A Z 七主七副零和八三长三短一不全最外层电子数 相同条件下,最外层电子数越多,半径越大。
微粒半径的比较1、同周期元素的原子半径随核电荷数的增大而减小(稀有气体除外)如:Na>Mg>Al>Si>P>S>Cl.2、同主族元素的原子半径随核电荷数的增大而增大。
如:Li<Na<K<Rb<Cs具体规律 3、同主族元素的离子半径随核电荷数的增大而增大。
如:F --<Cl --<Br --<I --4、电子层结构相同的离子半径随核电荷数的增大而减小。
如:F -> Na +>Mg 2+>Al 3+5、同一元素不同价态的微粒半径,价态越高离子半径越小。
Al3+/Al,-1.66V)。
②铍和铝经浓硝酸处理都表现钝化,而其它碱土金属均易与硝酸反应。
③铍和铝都是两性金属,既能溶于酸也能溶于碱。
④氢氧化物均为两性,而其它碱土金属氢氧化物均为碱性。
⑤BeO和Al2O3都有高熔点和高硬度。
⑥铝和铍的氯化物是共价分子,能通过氯桥键形成双聚分子,易升华、易聚合,易溶于有机溶剂。
3、硼和硅的相似性。
B和Si虽是不同族元素,在周期表中处于相邻族的对角位置,由于离子极化作用相近(Si4+电荷高一些,但半径大;B3+电荷低一些,但半径小),性质上有许多相似之处。
①单质晶体都是高熔点原子晶体;与键强度相关。
②在自然界均以含氧化合物存在。
③卤化物都彻底水解,生成含B─O,Si─O键的化合物(硅酸、硼酸)④都有一系列氢化物,氢化物均有挥发性,不稳定。
⑤含氧酸都是弱酸,含氧酸盐都易水解对角线规则是从有关元素及其化合物的许多性质中总结出来的经验规律;对此可以用离子极化的观点加以粗略的说明。
同一周期最外层电子构型相同的金属离子,从左至右随离子电荷的增加而引起极化作用的增强;同一族电荷相同的金属离子,自上而下随离子半径的增大而使得极化作用减弱。
因此,处于周期表中左上右下对角线位置上的邻近两个元素,由于电荷和半径的影响恰好相反,它们的离子极化作用比较相近,从而使它们的化学性质比较相似。
由此反映出物质的结构与性质之间的内在联系。
三. 周期表中的变化规律(一) 同一元素:r -离子>r原子>r+离子>r2+离子(二) 同一周期1. 短周期:每一个短周期从左到右,有效核电荷依次增大,所以原子半径依次递减.2. 长周期:过渡元素自左至右,电子逐一填入(n-1)d层,而它对核的屏蔽作用较小,所以自左向右半径减小的幅度不如主族元素那么大.3. 内过渡元素:电子填入再次外层的(n-2)f层,由于f电子对核的屏蔽作用更小,使得原子半径由左至右收缩的平均幅度更小.比较短周期和长周期,相邻元素原子半径减小的平均幅度大致是非过渡元素>过渡元素>内过渡元素(~10pm)(~5pm)(<1pm)(三) 同一族1. 主族:同一主族由上而下,原子半径一般是增大的.因为同族元素原子由上而下电子层数增多,所以半径由上至下依次增大.2. 副族:副族元素由上至下,原子半径增大的幅度较小,特别是五,六周期的同族元素原子半径非常接近,这是由于后面要提到的镧系收缩效应所造成的结果.特殊元素集锦1、最活泼的金属元素、最高价氧化物对应的水化物碱性最强的元素、阳离子氧化性最弱的元素是铯(Cs)。
高一化学元素周期表应用知识点汇总化学元素周期表是化学学科的重要基石,对于高一的同学来说,深入理解和掌握其应用知识点至关重要。
以下是对高一化学元素周期表应用知识点的详细汇总。
一、原子结构与元素周期表的关系元素周期表是按照原子序数递增的顺序排列的。
原子序数等于质子数,而质子数决定了元素的种类。
同时,原子的核外电子排布也与元素周期表的结构密切相关。
同一周期的元素,其原子具有相同的电子层数,从左到右,原子序数递增,核电荷数逐渐增大,原子半径逐渐减小(稀有气体元素除外),失电子能力逐渐减弱,得电子能力逐渐增强,金属性逐渐减弱,非金属性逐渐增强。
同一主族的元素,其原子最外层电子数相同,从上到下,电子层数逐渐增多,原子半径逐渐增大,失电子能力逐渐增强,得电子能力逐渐减弱,金属性逐渐增强,非金属性逐渐减弱。
例如,钠(Na)和钾(K)位于同一主族,钾比钠多一个电子层,所以钾的原子半径比钠大,钾的金属性比钠强,与水反应时更加剧烈。
二、元素周期表中的化合价规律主族元素的最高正化合价等于其族序数(O、F 除外),最低负化合价等于族序数减去 8。
例如,氯(Cl)位于第ⅦA 族,其最高正化合价为+7 价,最低负化合价为-1 价。
元素的化合价在一定条件下是可以变化的,例如铁(Fe)有+2 价和+3 价等。
三、元素周期表与元素性质的递变规律1、金属性和非金属性的递变规律金属性:同一周期从左到右逐渐减弱,同一主族从上到下逐渐增强。
非金属性:同一周期从左到右逐渐增强,同一主族从上到下逐渐减弱。
2、单质的氧化性和还原性的递变规律氧化性:同一周期从左到右逐渐增强,同一主族从上到下逐渐减弱。
还原性:同一周期从左到右逐渐减弱,同一主族从上到下逐渐增强。
3、最高价氧化物对应水化物的酸碱性递变规律酸性:同一周期从左到右逐渐增强,同一主族从上到下逐渐减弱。
碱性:同一周期从左到右逐渐减弱,同一主族从上到下逐渐增强。
四、元素周期表在推断元素性质中的应用通过元素在周期表中的位置,可以推断出元素的性质。
Al3+/Al,-1.66V)。
②铍和铝经浓硝酸处理都表现钝化,而其它碱土金属均易与硝酸反应。
③铍和铝都是两性金属,既能溶于酸也能溶于碱。
④氢氧化物均为两性,而其它碱土金属氢氧化物均为碱性。
⑤BeO和Al2O3都有高熔点和高硬度。
⑥铝和铍的氯化物是共价分子,能通过氯桥键形成双聚分子,易升华、易聚合,易溶于有机溶剂。
3、硼和硅的相似性。
B和Si虽是不同族元素,在周期表中处于相邻族的对角位置,由于离子极化作用相近(Si4+电荷高一些,但半径大;B3+电荷低一些,但半径小),性质上有许多相似之处。
①单质晶体都是高熔点原子晶体;与键强度相关。
②在自然界均以含氧化合物存在。
③卤化物都彻底水解,生成含B─O,Si─O键的化合物(硅酸、硼酸)④都有一系列氢化物,氢化物均有挥发性,不稳定。
⑤含氧酸都是弱酸,含氧酸盐都易水解对角线规则是从有关元素及其化合物的许多性质中总结出来的经验规律;对此可以用离子极化的观点加以粗略的说明。
同一周期最外层电子构型相同的金属离子,从左至右随离子电荷的增加而引起极化作用的增强;同一族电荷相同的金属离子,自上而下随离子半径的增大而使得极化作用减弱。
因此,处于周期表中左上右下对角线位置上的邻近两个元素,由于电荷和半径的影响恰好相反,它们的离子极化作用比较相近,从而使它们的化学性质比较相似。
由此反映出物质的结构与性质之间的内在联系。
三. 周期表中的变化规律(一) 同一元素:r -离子>r原子>r+离子>r2+离子(二) 同一周期1. 短周期:每一个短周期从左到右,有效核电荷依次增大,所以原子半径依次递减.2. 长周期:过渡元素自左至右,电子逐一填入(n-1)d层,而它对核的屏蔽作用较小,所以自左向右半径减小的幅度不如主族元素那么大.3. 内过渡元素:电子填入再次外层的(n-2)f层,由于f电子对核的屏蔽作用更小,使得原子半径由左至右收缩的平均幅度更小.比较短周期和长周期,相邻元素原子半径减小的平均幅度大致是非过渡元素>过渡元素>内过渡元素(~10pm)(~5pm)(<1pm)(三) 同一族1. 主族:同一主族由上而下,原子半径一般是增大的.因为同族元素原子由上而下电子层数增多,所以半径由上至下依次增大.2. 副族:副族元素由上至下,原子半径增大的幅度较小,特别是五,六周期的同族元素原子半径非常接近,这是由于后面要提到的镧系收缩效应所造成的结果.特殊元素集锦1、最活泼的金属元素、最高价氧化物对应的水化物碱性最强的元素、阳离子氧化性最弱的元素是铯(Cs)。