《元素性质的递变规律》
- 格式:ppt
- 大小:826.50 KB
- 文档页数:33




元素性质的递变规律
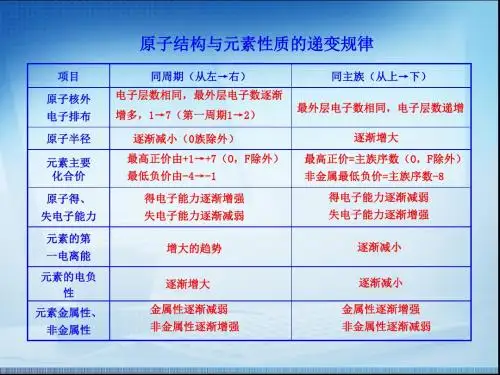
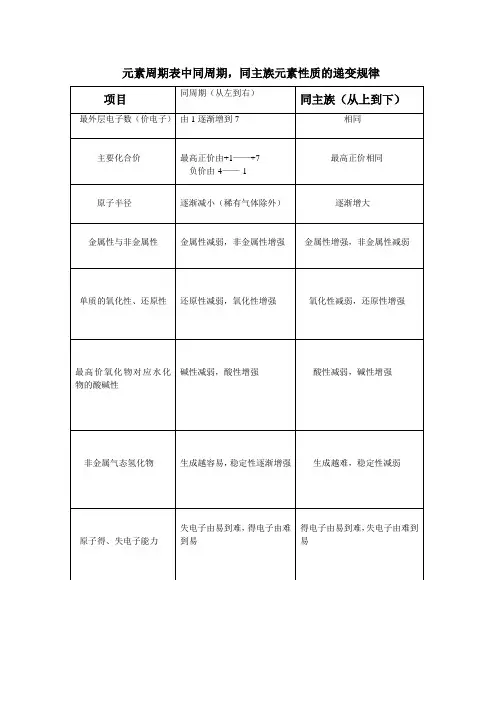
1、原子半径
(1)同一周期,随着核电荷数的增大,原子半径依次减小
(2)同一主族,随着电子层数逐渐增多,原子半径依次增大
2、金属性和非金属性
金属性——元素的原子失电子能力的强弱
原子半径大,最外层电子数少,越易失电子
非金属性——元素的原子得电子能力的强弱
原子半径小,最外层电子数多,越易得电子
(1)同一周期,随着核电荷数的增大,元素的金属性逐渐减弱,非金属性逐渐增强。
(2)同一主族,随着核电荷数的增大,元素的金属性逐渐增强,非金属性逐渐减弱。
3、元素气态氢化物的热稳定性
(1)同一周期,非金属性增强,元素气态氢化物的热稳定性逐渐增强。
(2)同一主族,非金属性减弱,元素气态氢化物的热稳定性逐渐减弱。
4、主族元素最高价氧化物对应的水化物酸、碱性
(1)同一周期,从左到右,元素最高价氧化物对应的水化物碱性逐渐减弱,酸性逐渐增强。
(2)同一主族,从上到下,元素最高价氧化物对应的水化物碱性逐渐增强,酸性逐渐减弱。

福建省泉州2019年秋高三专题复习--原子结构与性质—元素性质的递变规律—一、单选题(本大题共20小题)1.基态原子的核外电子排布为4d105s1的元素应在()A.s区、第五周期、IA族B.ds区、第五周期、IB族C.d区、第四周期、IB族D.ds区、第五周期、IA族2,某元素基态原子的外围电子排布为3d54s2,则下列说法错误的是()A.该元素为Mn元素B.该元素最高化合价为+7C.该元素属于d区元素D.该元素原子最外层共有7个电子3.根据下列五种元素的电离能数据(单位:kJ.molT),判断下列说法不正确的是()元素代号11h13:4 Q2080400061009400R500460069009500S7401500770010500T5801800270011600U420310044005900A.元素的电负性最大的可能是Q元素B.R和S均可能与U在同一主族C.U元素可能在元素周期表的S区D.原子的价电子排布为ns2npi的可能是T元素4,下列说法正确的是()A.元素周期表每一周期元素原子的最外层电子排布均是从ns】过渡到ns2np6B.所有的非金属元素都分布在p区C.原子核外电子排布式为Is】的原子与原子核外电子排布式为1s22s】的原子的化学性质相似D.元素周期表中第HIB族到第U B族的10个纵行的元素都是金属元素,统称过渡金属兀素5, 在元素周期表中,伯元素与铁元素同族,则祐元素位于。
A. s 区B. p 区C. d 区D. ds 区6, 第一电离能最小的金属、电负性最大的的非金属、常温下呈液态的金属(价电子排布为5d 106s 2)分别位于下面元素周期表中的()—. 11 1Illi Illi ___iill till . _ J . ■ 1. ■ .-i _ . ; . ■血i i i i i i 1 1 1 | 1 11 1■ ill • • i i 1 11::::::ds ;1::: J f 1 1 1 1 1 1------1 J 1 1 i 1 11i i i 1 i i DC i i i i i i ■ a • 1 e >11A. s 区、p 区、ds 区B. s 区、p 区、d 区C. f 区、p 区、ds 区D. s 区、f 区、ds 区7, 现有①、②、③三种元素的基态原子的电子排布式如下:①ls 22s 22p 63s 23p 4;②ls 22s 22p 63s 23p 3; (3)ls 22s 22p 5.则下列有关比较中正确的是( )A.第一电离能:③〉②>①B.原子半径:①'②〉③C.电负性:③ > ② > ①D.最高正化合价:③ > ① > ②8, 己知X 、Y 是主族元素,I 为电离能,单位是kJ-mol 1.根据如表所列数据判断,错误的是( )A. 元素X 的常见化合价是+1价B. 元素Y 是IIIA 族元素C. 若元素Y 处于第3周期,它的单质可与冷水剧烈反应D. 元素X 与氯元素形成化合物时,化学式可能是XC1元素II I 2【3I4X500460069009500Y 58018002700116009,某元素的第一电离能至第七电离能(kJ/mol )如下:II I2I 3I4I 5I 6I75781817274511575148301837623293该元素最有可能位于元素周期表的族是()第2页,共33页A.I A b.ha c. nA D.IVA10.下列说法中正确的是()①s p3杂化轨道是由同一个原子中能量最近的S轨道和P轨道混合起来形成的一组能量相同的新轨道②同一周期从左到右,元素的第一电离能、电负性都是越来越大③分子中键能越大,表示分子拥有的能量越高④所有的配合物都存在配位键⑤所有含极性键的分子都是极性分子⑥熔融状态下能导电的化合物一定是离子化合物⑦所有的原子晶体都不导电A.①②③B.①⑦C.④⑥⑦D.①④⑥11.下列叙述正确的个数是O①配位键在形成时,是由成键双方各提供一个电子形成共用电子对②s-s6键与s-p6键的电子云形状相同③Ge的核外电子排布式为:[Ar]4s24p2,属于P区元素④下列分子键角大小由大到小为:COS>BC13>CC14>H2O>P4⑤冰中存在极性共价键和氢键两种化学键的作用⑥C u(OH)2是一种蓝色的沉淀,既溶于硝酸、浓硫酸,也能溶于氨水中⑦中心原子采取sp3杂化的分子,其立体构型不一定是正四面体形⑧键长:C-H⑨第一电离能:SiA.1B.2C.3D.412.气态中性原子失去一个电子转化为气态正离子所需要的最低能量叫做第一电离能(11),气态正离子继续失去电子所需要的最低能量依次称为第二电离能(【2),第三电离能03)……右表是第3周期部分元素的电离能[单位:eV(电子伏特)擞据。

第二单元元素性质的递变规律【学海导航】元素的性质随着核电荷数的递增而呈现周期性的变化,这个规律叫做元素周期律。
一、原子核外电子排布的周期性元素按原子序数递增的顺序依次排列时,原子的最外层上的电子数,由1(s1)到8(s2p6),呈现出周期性变化。
相应于这种周期性变化,每周期以碱金属开始,以稀有气体结束。
元素的化学性质,主要取决于元素原子的电子结构,特别是最外层电子结构。
所以元素性质的周期性,来源于原子电子层结构的周期性。
根据元素原子的外围电子排布的特征,可将元素周期表分成五个区域:s区、p区、d 区、ds区、f区。
二、元素第一电离能的周期性变化1、定义:从气态的基态原子中移去一个电子变成+1价气态阳离子所需的最低能量,称为第Ⅰ电离能。
常用符号I1表示。
M(g)→ M+(g)+ e-,+1价气态阳离子移去一个电子变成+2价气态阳离子所需的最低能量,称为第Ⅱ电离能。
依次类推。
元素的第一电离能越小,表示它越容易失去电子,即该元素的金属性越强。
2、影响电离能的因素电离能的大小主要取决于原子的核电荷、原子半径及原子的电子构型。
一般说来,核电荷数越大,原子半径越小,电离能越大。
另外,电子构型越稳定,电离能也越大。
3. 电离能的周期性变化同周期中, 从左向右,核电荷数增大,原子半径减小, 核对电子的吸引增强, 愈来愈不易失去电子, 所以 I 总的趋势是逐渐增大。
但有些元素(如Be、Mg、N、P等)的电离能比相邻元素的电离能高些,这主要是这些元素的最外层电子构型达到了全充满或半充满的稳定构型。
同主族元素自上而下电离能依次减小。
但在同一副族中,自上而下电离能变化幅度不大,且不甚规则。
4.电离能与价态之间的关系失去电子后, 半径减小, 核对电子引力大, 更不易失去电子, 所以有: I1 < I2 < I3 < I4…., 即电离能逐级加大.三、元素电负性的周期性变化1、定义:电负性: 表示一个元素的原子在分子中吸引电子的能力. 元素的电负性越大,表示原子吸引成键电子的能力越强,该元素的非金属性也就越强;电负性越小,该元素的金属性越强。

同主族元素性质的递变规律主族元素是指具有相同价电子层最外层电子数的元素,它们的化学性质有着一定的规律和规律。
在化学中,我们可以通过分析这些规律来预测和解释元素的化学行为。
以下是同主族元素性质的递变规律的一些重要方面。
1.原子和离子半径的变化规律主族元素的原子半径(或离子半径)随着周期数的增加而逐渐增加。
这是因为,随着周期数的增加,原子核内的质子数量也在增加,使得原子核更加吸引外层电子。
相应地,电子云被拉近,原子半径减小。
然而,在同一周期内,由于外层电子数不变,所以原子和离子半径随着原子核电荷的增加而逐渐减小。
因此,原子半径和离子半径在周期表中的变化呈现周期性的趋势。
2.电离能的变化规律主族元素的第一电离能随着周期数的增加而增加。
这是因为,随着周期数的增加,原子半径减小,原子核电荷增加,使得原子核对外层电子的吸引力增强。
因此,更多的能量(电离能)需要提供给外层电子,才能将其从原子中移走。
而在同一周期中,由于外层电子数不变,所以第一电离能也随着原子核电荷的增加而逐渐增加。
总体上,电离能呈现周期性的趋势,周期性地增加。
3.电负性的变化规律主族元素的电负性随着周期数的增加而增加。
这是因为,原子核对外层电子的吸引力取决于原子核的电荷和电子与原子核之间的距离。
随着周期数的增加,原子半径减小,原子核电荷增加,电子与原子核之间的距离减小,使得原子核对外层电子的吸引力增强,从而增加了电负性。
在同一周期中,由于外层电子数不变,所以电负性也随着原子核电荷的增加而逐渐增加。
总体上,电负性呈现周期性的趋势,周期性地增加。
4.首次电子亲和能的变化规律主族元素的首次电子亲和能随着周期数的增加而增加。
首次电子亲和能指的是一个原子吸收一个电子所释放的能量。
随着周期数的增加,原子半径减小,原子核电荷增加,使得原子核对外层电子的吸引力增强。
因此,外层电子更难被移除,所以需要更多的能量才能将电子增加到原子中,从而增加了首次电子亲和能。

同主族元素性质的递变规律对于同主族元素来说,它们具有相似的原子结构,包括相同的电子层排布和相似的价电子配置。
这使得它们在化学反应中的行为和性质相似。
在同一周期的元素中,随着原子序数的增加,电子层的能量逐渐增加,原子半径逐渐变大。
这一变化规律可以通过考察同一周期元素的原子半径来说明。
原子半径是指原子核和最外层电子之间的平均距离。
原子半径的变化往往反映了元素性质的变化。
一般来说,在同一周期的元素中,原子半径随着原子序数的增加而增加。
这是因为随着电子层的增加,电子云的半径也会增大。
此外,随着电子层数的增加,电子间的排斥力也会增强,导致电子云膨胀。
因此,同一周期元素的原子半径会逐渐增大。
同主族元素的性质也受到原子核的带电量和电子层结构的影响。
原子核的带电量通过元素的原子序数来体现,它决定了元素的化学反应性和离子化趋势。
具体来说,同一周期的元素,原子核的带电量随着原子序数的增加而增加。
在同一周期的元素中,原子核带电量的增加会导致价层电子与核之间的吸引力增强,进而影响元素的化学反应性。
随着原子核带电量的增加,元素原子更容易失去或获得电子,因此化合价也会逐渐增加。
另外,由于同一周期的元素具有相同的价电子环境,它们的化学性质也有较大的相似之处。
例如,同一周期的元素在与氧发生化合反应时,往往形成相似的氧化物。
此外,同一周期的元素还表现出相似的离子化趋势。
随着原子序数的增加,原子核带电量增加,原子的电离能也会增加,因此,同一周期元素的电离能会逐渐增大。
同样地,随着原子核带电量的增加,元素形成阴离子的能力也会增加。
总之,同主族元素的递变规律是由它们的原子半径、原子核带电量和电子层结构所决定的。
随着原子序数的增加,同一周期的元素的性质逐渐变化,但仍然保持着相似性。
这种递变规律为我们理解元素周期表中元素的性质提供了一种有序的方式。
