第二单元元素性质的递变规律讲解
- 格式:doc
- 大小:3.45 MB
- 文档页数:16




元素性质的递变规律
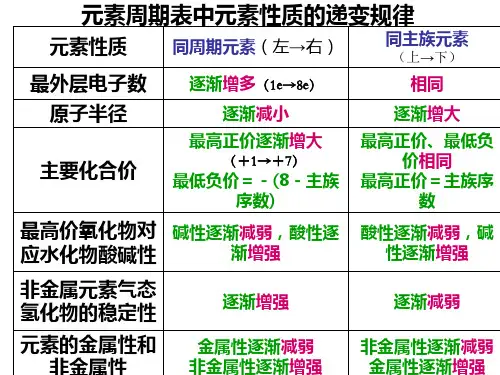
1、原子半径
(1)同一周期,随着核电荷数的增大,原子半径依次减小
(2)同一主族,随着电子层数逐渐增多,原子半径依次增大
2、金属性和非金属性
金属性——元素的原子失电子能力的强弱
原子半径大,最外层电子数少,越易失电子
非金属性——元素的原子得电子能力的强弱
原子半径小,最外层电子数多,越易得电子
(1)同一周期,随着核电荷数的增大,元素的金属性逐渐减弱,非金属性逐渐增强。
(2)同一主族,随着核电荷数的增大,元素的金属性逐渐增强,非金属性逐渐减弱。
3、元素气态氢化物的热稳定性
(1)同一周期,非金属性增强,元素气态氢化物的热稳定性逐渐增强。
(2)同一主族,非金属性减弱,元素气态氢化物的热稳定性逐渐减弱。
4、主族元素最高价氧化物对应的水化物酸、碱性
(1)同一周期,从左到右,元素最高价氧化物对应的水化物碱性逐渐减弱,酸性逐渐增强。
(2)同一主族,从上到下,元素最高价氧化物对应的水化物碱性逐渐增强,酸性逐渐减弱。

第二单元元素性质的递变规律【学海导航】元素的性质随着核电荷数的递增而呈现周期性的变化,这个规律叫做元素周期律。
一、原子核外电子排布的周期性元素按原子序数递增的顺序依次排列时,原子的最外层上的电子数,由1(s1)到8(s2p6),呈现出周期性变化。
相应于这种周期性变化,每周期以碱金属开始,以稀有气体结束。
元素的化学性质,主要取决于元素原子的电子结构,特别是最外层电子结构。
所以元素性质的周期性,来源于原子电子层结构的周期性。
根据元素原子的外围电子排布的特征,可将元素周期表分成五个区域:s区、p区、d 区、ds区、f区。
二、元素第一电离能的周期性变化1、定义:从气态的基态原子中移去一个电子变成+1价气态阳离子所需的最低能量,称为第Ⅰ电离能。
常用符号I1表示。
M(g)→ M+(g)+ e-,+1价气态阳离子移去一个电子变成+2价气态阳离子所需的最低能量,称为第Ⅱ电离能。
依次类推。
元素的第一电离能越小,表示它越容易失去电子,即该元素的金属性越强。
2、影响电离能的因素电离能的大小主要取决于原子的核电荷、原子半径及原子的电子构型。
一般说来,核电荷数越大,原子半径越小,电离能越大。
另外,电子构型越稳定,电离能也越大。
3. 电离能的周期性变化同周期中, 从左向右,核电荷数增大,原子半径减小, 核对电子的吸引增强, 愈来愈不易失去电子, 所以 I 总的趋势是逐渐增大。
但有些元素(如Be、Mg、N、P等)的电离能比相邻元素的电离能高些,这主要是这些元素的最外层电子构型达到了全充满或半充满的稳定构型。
同主族元素自上而下电离能依次减小。
但在同一副族中,自上而下电离能变化幅度不大,且不甚规则。
4.电离能与价态之间的关系失去电子后, 半径减小, 核对电子引力大, 更不易失去电子, 所以有: I1 < I2 < I3 < I4…., 即电离能逐级加大.三、元素电负性的周期性变化1、定义:电负性: 表示一个元素的原子在分子中吸引电子的能力. 元素的电负性越大,表示原子吸引成键电子的能力越强,该元素的非金属性也就越强;电负性越小,该元素的金属性越强。

元素周期表中主族元素性质递变规律金属性强弱的判断依据1.单质跟水或酸反应置换出氢的难易程度(或反应的剧烈程度):反应越容易,说明其金属性越强。
2.最高价氧化物对应水化物的碱性强弱:碱性越强,说明其金属性越强,反之则越弱。
3.金属间的置换反应:依据氧化还原反应的规律,金属甲能从金属乙的盐溶液里置换出乙,说明甲的金属性比乙强。
4.金属活动性顺序按Au顺序,金属性逐渐减弱。
5.元素周期表中,同周期元素从左至右金属性逐渐减弱;同主族元素从上至下金属性逐渐增强。
6.原电池中的正负极:一般情况下,活泼金属作负极。
7.金属阳离子氧化性的强弱:阳离子的氧化性越强.对应金属的金属性就越弱。
非金属性强弱的判断依据:1.同周期元素,从左到右,随核电荷数的增加,非金属性增强;同主族元素,从上到下,随着陔电荷数的增加,非金属性减弱。
2.最高价氧化物对应水化物的酸性强弱:酸性越强,其元素的非金属性也越强,反之则越弱。
3.气态氢化物的稳定性:稳定性越强,非金属性越强。
4.单质跟氢气化合的难易程度:越易与H2反应,说明其非金属性越强。
5.与盐溶液之间的置换反应:非金属元素甲的单质能从非金属乙的盐溶液中置换出乙,说明甲的非金属性比乙强。
如,说明溴的非金属性比碘强。
6.相互化合后的价态:如,说明O 的非金属性强于S。
7.其他:如CuCl2,所以C1的非金属性强于S。
•元素周期律定义:元素的性质随原子序数的递增而呈现周期性变化的规律叫元素周期律。
实质:元素性质随原子序数递增呈现周期性变化是元素原子的核外电子排布周期性变化的必然结果。
元素周期表中主族元素性质递变规律:微粒半径大小的比较方法:1.同周期元素的微粒同周期元素的原子或最高价阳离子半径随核电荷数增大而减小(稀有气体元素除外),如半径:Na>Mg >Al,Na+>Mg2+‘>Al3+。
2.同主族元素的微粒同主族元素的原子或离子半径随核电荷数增大而增大,如半径:3.电子层结构相同的微粒电子层结构相同(核外电子排布相同)的微粒半径随核电荷数的增加而减小,如半径:(上一周期元素形成的阴离子与下一周期元素形成的最高价阳离子有此规律)。



第二单元元素性质的递变规律第1课时原子核外电子排布的周期性●课标要求了解元素周期表中各区、周期、族元素的原子核外电子排布规律。
●课标解读1.掌握核外电子排布与周期划分的关系。
2.掌握核外电子排布与族划分的关系。
3.了解元素周期表的分区。
4.能确定元素在元素周期表中的位置。
●教学地位用原子结构知识揭示元素或相关物质的性质的中间载体为元素周期表,要使用元素周期表解决元素或物质的性质,必须将元素有效的放入周期表中。
本课时的内容主要解决该方面的问题。
●新课导入建议据美国《科学新闻》杂志报道,美国劳伦斯·伯克利国家实验室的Victor Ninov领导的研究小组,用大约100万万亿(即1018)个氪离子对一个铅靶轰击10多天,终于得到118号元素的3个原子,后者又很快衰变成116号、114号和其他元素。
这一结果令科学家们兴奋不已,他们说预计还将有更多的超重元素被发现。
看到这些令人吃惊的成果,伯克利实验室的Ken Gregorich预计,该实验室和德国重离子研究中心以及俄罗斯的研究人员不久将会用氪离子来轰击铋靶,以获得119号元素。
由于119号元素会衰变成尚未发现的117、115和113号元素,所以科学家有可能一次就获得4种新元素!(1)根据元素周期表的结构,118号元素应该位于其中什么位置?(2)类比同族的元素的性质,118号元素性质的活泼性会怎么样?课标解读重点难点1.进一步理解元素周期律。
2.理解元素性质随原子序数递增的周期性变化的本质是核外电子排布的周期性变化。
理解元素性质随原子序数递增的周期性变化的本质是核外电子排布的周期性变化。
(重点)主族元素原子核外价电子排布和元素性质的周期性变化主族ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA原子核外价电子排布n s1n s2n s2n p1n s2n p2n s2n p3n s2n p4n s2n p5最高正化合价+1 +2 +3 +4 +5 +6 +7 最低负化合价----4 -3 -2 -1性质递变规律化合价同主族最高正价相同,且等于主族序数同周期最高正价逐渐升高,从+1递增到+7金属性非金属性同主族从上到下,金属性逐渐增强,非金属性逐渐减弱同周期从左到右,金属性逐渐减弱,非金属性逐渐增强原子半径同主族从上到下,原子半径逐渐增大同周期从左到右,原子半径逐渐减小1.(1)主族元素的最高正价、最低负价之间有什么关系?(2)主族元素的族序数均等于该元素的最高正价吗?【提示】(1)最高正价+|最低负价|=8(其中H、O、F除外)(2)O、F两元素无正化合价,不符合主族序数等于元素的最高正价。
1~6周期元素原子的外围电子排布周期元素种类外围电子排布ⅠA族0族最多可容纳的外围电子数1 2 1s11s2 22 8 2s12s22p683 8 3s13s23p684 18 4s14s24p685 18 5s15s25p686 32 6s16s26p682.最外层电子排布为n s2的元素一定位于第ⅡA族吗?【提示】不一定,如He及大部分过渡元素的最外层电子排布也为n s2ⅡA族。
元素原子核外电子排布的周期性变化每隔一定数目的元素,元素原子的外围电子排布重复出现从n s1到n s2n p6的周期性变化。
核外电子排布与元素周期表的关系①元素周期表中的一个横行就是一个周期吗?一列就是一个族吗?②从原子结构示意图上能直接得出所有元素的周期序数和族序数吗?③元素的价电子与族序数有什么联系?1.核外电子排布与周期的划分周期序数电子层数外围电子排布特征元素原子的电子排布式该周期的元素种数1 1 1s 1s1~2 22 2 2s2p [He]2s1~22p1~683 3 3s3p [Ne]3s1~23p1~684 4 3d4s或4s4p [Ar]3d1~104s1~24p1~618(1)每种元素的电子层数,就是该元素所处的周期数,主族元素的最外层电子数为其主族序数。
(2)每周期起始元素和结束元素的外围电子排布分别为n s1和n s2n p6(第1周期为n s2)。
2.核外电子排布与族的划分族的划分依据是原子的外围电子排布(1)同主族元素原子的外围电子排布完全相同,外围电子全部排布在n s或n s n p轨道上。
外围电子数与族序数相同。
(2)稀有气体的外围电子排布为1s2或n s2n p6。
(3)过渡元素(副族和Ⅷ族)同一纵行原子的外围电子排布基本相同。
外围电子排布为(n-1)d1~10n s1~2,ⅢB~ⅦB族的外围电子数与族序数相同,第ⅠB、ⅡB族和第Ⅷ族的外围电子数与族序数不相同。
1.ⅠB、ⅡB的族序数=原子的[(n-1)d10n s1~2]n s电子数。
2.当[(n-1)d+n s]电子数为8、9、10时统称为Ⅷ族。
已知M2+的3d轨道中有5个电子,该元素在周期表中的位置为() A.第4周期ⅡA族B.第4周期ⅡB族C.第4周期ⅦB族D.第4周期Ⅷ族确定第4周期元素族序数的方法:除利用例1中外围电子排布法外,还可以通过记忆法确定。
1.某元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子。
(1)其基态原子的外围电子排布式为________________________________________________________________________;(2)在周期表中的位置________________________________________________________________________。
核外电子排布与周期表的分区【问题导思】①元素周期表划分区的依据是什么?【提示】依据是原子的价层电子排布。
②区的名称与电子的能级符号之间有什么关系?【提示】区的名称来自于按构造原理最终填入电子的能级的符号(除ds区外)。
1.元素周期表的分区:元素周期表按电子排布分为5个区:s区、p区、d区、ds区、f区。
2.各区元素特点分区元素分布外围电子排布式元素性质特点s区ⅠA族、ⅡA族n s1~2除氢外都是活泼金属元素p区ⅢA族~ⅦA族、0族n s2n p1~6最外层电子参与反应(稀有气体除外) d区ⅢB族~ⅦB族、Ⅷ族(n-1)d1~9n s1~2d轨道也不同程度地参与化学键的形成ds区ⅠB族、ⅡB族(n-1)d10n s1~2金属元素f区镧系、锕系(n-2)f0~14(n-1)d0~2n s2镧系元素化学性质相近,锕系元素化学性质相近1.处于金属与非金属交界线(又称梯形线)附近的非金属元素具有一定的金属性,又称为半金属或准金属,但不能叫两性元素。
2.价电子数⎩⎪⎨⎪⎧主族元素:最外层电子数,如碱金属为n s1副族元素:与最外层电子和内层电子有关,如Fe为3d64s2指出下列元素是主族元素还是副族元素,在周期表中的位置是什么?(1)1s22s22p63s2是________族元素,位于周期表中第________周期第________族,属于________区元素;(2)[Kr]4d105s25p2是________族元素,位于周期表中第________周期第________族,属于________区元素;(3)[Ar]3d14s2是________族元素,位于周期表中第________周期第________族,属于________区元素;(4)[Ar]3d104s1是________族元素,位于周期表中第________周期第________族,属于________区元素。
2.元素周期表长周期共有18个纵行,从左到右排为18列,即碱金属是第1列,稀有气体是第18列。
按这种规定,下列说法正确的是()A.第9列元素中没有非金属B.第15列元素的原子最外层的电子排布是n s2n p5C.最外层电子排布为n s2的元素一定在第二列D.第11、12列为d区的元素【课外资料】金属元素、非金属元素的分区下列各组元素均属于p区的是()A.原子序数为1,2,7的元素B.O、S、PC.Fe、Ar、ClD.Na、Li、Mg●课标要求1.能说出元素电离能、电负性的涵义。
2.能应用元素的电离能说明元素的某些性质。
●课标解读1.会比较I1、电负性大小。
2.能利用I1比较金属元素的金属性、非金属元素的非金属性强弱。
3.能利用电离能推测原子最外层电子数。
4.能利用电负性比较元素的金属性、非金属性强弱。
5.能利用电负性确定化合物中化学键的类型及元素化合价的正负。
●教学地位本节课内容是“必修2 元素周期律”的延伸,可以与必修2的内容融为一体命题,是高考的高频考点。
近几年来,高考试题中均有涉及。
●新课导入建议从复习元素性质(主要化合价、原子半径、金属性、非金属性)在元素周期表中的递变规律入手,提出元素除上述三方面的性质外,还有其他性质,如电离能、电负性等。
本节课将学习电离能、电负性在元素周期表中的递变规律及其应用。
课标解读重点难点1.了解元素电离能、电负性的概念和电离能、电负性随原子序数递增的周期性变化的规律。
2.了解电离能和电负性的简单应用。
1.元素电离能、电负性的概念。
(重点)2.电离能的周期性变化规律。
(难点)元素第一电离能的周期性变化1.第一电离能(1)含义气态原子失去一个电子形成+1价气态阳离子所需的最低能量,用符号I1表示,单位:kJ·mol-1。
(2)意义第一电离能数值越小,原子越容易失去一个电子;第一电离能数值越大,原子越难失去一个电子。
(3)变化规律同周期⎩⎪⎨⎪⎧随着原子序数的增加,元素的第一电离能呈现增大的趋势,碱金属的第一电离能最小,稀有气体的第一电离能最大。
同主族⎩⎪⎨⎪⎧随着电子层数的增加,元素的第一电离能逐渐减小。
(4)与原子的核外电子排布的关系通常情况下,当原子核外电子排布在能量相等的轨道上形成全空(p0、d0、f0)、半满(p3、d5、f7)和全满(p6、d10、f14)结构时,原子的能量较低,该元素具有较大的第一电离能。
2.第二电离能和第三电离能(1)第二电离能+1价气态离子失去1个电子,形成+2价气态离子所需要的最低能量,用I2表示。
(2)第三电离能+2价气态离子再失去1个电子,形成+3价气态离子所需的最低能量,用I3表示。
1.(1)镁和铝的第一电离能谁大,为什么?(2)为什么钠易形成Na+,而不易形成Na2+,镁易形成Mg2+,而不易形成Mg3+?元素电负性的周期性变化1.概念:描述元素的原子在化合物中吸引电子能力的物理量。
2.意义电负性越大,其原子在化合物中吸引电子的能力越强。
3.变化规律(1)同周期:左→右,主族元素的电负性逐渐增大。
(2)同主族:上→下,元素的电负性呈现减小趋势。
2.在元素周期表中,除稀有气体元素以外,I1和电负性均最大的是哪种元素?电离能的应用【问题导思】①I2就是气态原子失去两个电子需要吸收的能量吗,若不是,它又是怎样规定的?②理论上Na原子有几级电离能,预测其数值在哪些电离能上会突然增大?【提示】①不是。