2019届高考化学第一轮实战训练题16
- 格式:doc
- 大小:99.50 KB
- 文档页数:6
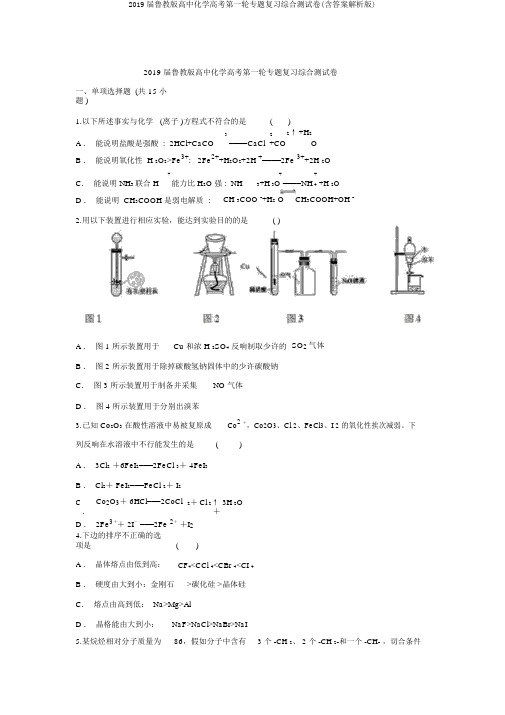
2019 届鲁教版高中化学高考第一轮专题复习综合测试卷一、单项选择题 (共 15 小题 )1.以下所述事实与化学 (离子 )方程式不符合的是()A .能说明盐酸是强酸 : 2HCl+CaCO 322↑+H2 ====CaCl +CO OB .能说明氧化性 H 2O2>Fe3+: 2Fe2++H2O2+2H +====2Fe 3++2H 2O+能力比 H2O 强 : NH +++H 2OC.能说明 NH3联合 H3+H 3O ====NH 4D .能说明 CH3COOH 是弱电解质 :CH 3COO -+H2 O CH3COOH+OH -2.用以下装置进行相应实验,能达到实验目的的是( )A .图 1 所示装置用于Cu 和浓 H 2SO4反响制取少许的SO2气体B .图 2 所示装置用于除掉碳酸氢钠固体中的少许碳酸钠C.图 3 所示装置用于制备并采集NO 气体D .图 4 所示装置用于分别出溴苯3.已知 Co2O3在酸性溶液中易被复原成Co2+,Co2O3、Cl 2、FeCl3、I 2的氧化性挨次减弱。
下列反响在水溶液中不行能发生的是()A . 3Cl2+6FeI2===2FeCl 3+ 4FeI3B . Cl2+ FeI2===FeCl 2+ I2C.Co2O3+ 6HCl===2CoCl2+Cl 2↑3H 2O+D . 2Fe3++ 2I- ===2Fe 2++I24.下边的排序不正确的选项是()A .晶体熔点由低到高:CF4<CCl 4<CBr 4<CI 4B .硬度由大到小:金刚石>碳化硅 >晶体硅C.熔点由高到低: Na>Mg>AlD .晶格能由大到小:NaF>NaCl>NaBr>NaI5.某烷烃相对分子质量为86,假如分子中含有 3 个 -CH 2、 2 个 -CH 2-和一个 -CH- ,切合条件的该烃的构造式有(不考虑立体构造)()A. 1种B. 2种C. 3种D . 4 种6.以下说法或表示方法中正确的选项是)(A .等质量的硫蒸气和硫固体分别完整焚烧,后者放出的热量多B .由 C(金刚石)→C(石墨) +119kJ 可知,金刚石比石墨稳固C.在 101kpa 时, 2gH 2完整焚烧生成液态水,放出285.8kJ 热量,氢气焚烧的热化学方程式为: 2H2( g) +O 2( g)→2H 2O( l )+285.8kJD .在稀溶液中: H+(aq) +OH ﹣( aq)→H2O( l) +53.7kJ,若将含 0.5molH 2SO4的浓溶液与含 1 molNaOH 的溶液混淆,放出的热量大于53.7kJ7.以下对于某溶液所含离子查验的方法和结论正确的选项是()A .加入碳酸钠溶液产生白色积淀,再加盐酸白色积淀消逝,说明有 Ca2+B .通入少许 Cl2后 ,溶液变为黄色 ,再加入淀粉溶液后,溶液变蓝 ,说明有 I-C.加入盐酸产生能使澄清石灰水变污浊的气体,则原溶液中必定有 CO或 SOD .往溶液中加入 BaCl2溶液和稀 HNO 3,有白色积淀生成 ,说明必定有 SO8.以下说法正确的选项是 ( )A . 0.5 mol O 3与 11.2 L O 2所含的分子数必定相等B . 25℃与 60℃时,水的 pH 相等C.中和等体积,等物质的量的浓度的盐酸和醋酸所耗费的n(NaOH) 相等D . 2SO2(g)+O 2(g)=2SO 3(g) 和 4SO2(g)+2O 2(g)=4SO 3(g) 的△ H 相等9.以下物质中属于天然高分子化合物的是()A.纤维素B.蔗糖C.油脂D.麦芽糖10.以下对σ键的认识不正确的选项是()A . s-sσ与键s-pσ键的对称性同样B .烯烃分子中的碳碳双键的键能是碳碳单键键能的二倍C.分子中含有共价键,则起码含有一个σ键D .含有π键的化合物与只含σ键的化合物的化学性质不一样11.镁燃料电池在可挪动电子设施电源和备用电源等方面应用远景广阔.如图为“镁一次氯酸盐”燃料电池表示图,电极为镁合金和铂合金.对于该电池的表达正确的选项是()A . E 为该燃料电池的正极B .负极发生的电极反响式为ClO ﹣ +2e﹣ +H 2O=Cl ﹣+2OH ﹣C.电池工作时,正极四周溶液的pH 将不停变小D .镁燃料电池负极能发生自腐化产生氢气,使负极利用率降低12.已知下表数据:对含等物质的量的CuSO4、 FeSO4、 Fe2 (SO4)3的混淆溶液的说法,不正确的选项是()A .向该混淆溶液中逐滴加入NaOH溶液,最初看到红褐色积淀B .该溶液中c(SO):[ c(Cu2+)+ c(Fe2+ )+ c(Fe3+)]>5:4C.向该溶液中加入适当氯水,并调理pH到 3.4 后过滤,可获取纯净的CuSO4溶液D .在pH = 5 的溶液中Fe3+不可以大批存在()13.下述有关实验操作正确的选项是A .溴苯中混有溴:加入碘化钾溶液后分液B .除掉 CO2中的少许 SO2: 经过盛有饱和Na2CO3溶液的洗气瓶C.用玻璃棒在过滤器上搅拌以加快AgCl 积淀的清洗D .中和滴定实验中,锥形瓶用蒸馏水洗净后未干燥,不影响测定结果14.制肥皂时,皂化反响后加盐的作用是()A .加大溶液密度B .催化作用C.与甘油反响D .盐析使肥皂析出15.以下金属防腐的举措中,使用外加电流的阴极保护法的是()A .水中的钢闸门连结电源的负极B .金属护拦表面涂漆C.枪炮表面涂上一层油D .地下钢管连结镁块二、填空题 (共 3 小题 )16.C 和 Si 元素在化学中据有极其重要的地位。

2019人教高考化学一轮训练题(2)及答案一、选择题1、(2017·潍坊质检)下列说法正确的是()A.1 mol任何气体的气体摩尔体积都约为22.4 L·mol-1B.20 ℃、1.0×105Pa时,同体积的O2与CO2含有相同的分子数C.当1 mol气态物质的体积为22.4 L时,该气体一定处于标准状况D.2 mol气体的体积约为44.8 L解析A项,没有给出气体所处的温度和压强,标准状况下气体摩尔体积约为22.4 L·mol-1,A项错误;B项,根据阿伏加德罗定律,同温、同压下,同体积的任何气体都含有相同的分子数,B项正确;C项,1 mol气态物质在非标准状况时,体积也有可能等于22.4 L,C项错误;D项,没有给出气体所处的温度和压强,D项错误。
答案B2、(2017·湖南五市十校模拟)如下图为雾霾的主要成分示意图。
下列说法不正确的是()A.重金属离子可导致蛋白质变性B.苯是最简单的芳香烃C.SO2和N x O y都属于酸性氧化物D.汽车尾气的大量排放是造成雾霾天气的人为因素之一解析NO、NO2都不属于酸性氧化物,C错误。
答案C3、(2017·绵阳模拟)下列叙述中不正确的是()A.钠在反应TiCl4+4Na===Ti+4NaCl中作还原剂B.NaOH应密封保存,以防分解变质C.盛放KOH溶液的试剂瓶不能用玻璃塞D.当足量的CO2通入饱和NaOH溶液中,会有固体析出解析选项B,NaOH密封保存,目的是防止空气中的CO2与之反应而变质。
答案B4、(2017·安徽合肥高三一次质检,2)硅及其化合物是带来人类文明的重要物质。
下列说法正确的是()A.陶瓷、水晶、水泥、玻璃都属于硅酸盐B.水玻璃是纯净物,可用于生产黏合剂和防火剂C.某硅酸盐的化学式为KAlSi3O8,可用K2O·Al2O3·6SiO2表示D.高纯硅可用于制造光导纤维,高纯二氧化硅可用于制造太阳能电池解析水晶的主要成分为SiO2,其不属于硅酸盐,A项错误;水玻璃是Na2SiO3的水溶液,属于混合物,B项错误;用于制造光导纤维的是二氧化硅,用于制造太阳能电池的是高纯硅,D项错误。

(人教版)化学2019 高考一轮练练题:填空题(5)含答案1、已知反响Ⅰ:2SO2 (g) + O2(g) ??2SO3(g)- 1H=-196.6 kJ·mol反响Ⅱ:2NO(g) + O2(g) ??2NO(g)- 1H=-113.0 kJ·mol则 SO2(g) 与 NO2(g) 反应生成 SO3(g) 和 NO(g) 的热反应方程式为________________________ 。
答案 SO(g) +NO(g) ??SO(g) + NO(g)223H=-41.8 kJ- 1· mol剖析已知反响Ⅰ: 2SO2(g) + O2(g) ??2SO(g)3H=-196.6 kJ· mol-1,反响Ⅱ: 2NO(g) + O(g) ??2NO(g)2H=-113.0 kJ·mol-1,依照盖斯定律(Ⅰ-Ⅱ)/2即获取 SO2(g) 与 NO2(g) 反响生成 SO3(g)和 NO(g) 的热反响方程式:SO2(g) + NO2(g) ??SO3(g) + NO(g)=- 41.8 kJ ·mol -1。
H2、在催化剂作用下合成气合成甲烷过程中会发生以下反响:242Ⅰ .CO(g) + 3H(g)=== CH(g) +HO(g)1=-206 k J·mol-1HⅡ .CO(g) + H2O(g) === CO 2(g) +H2(g)- 12H=-41 kJ·molⅢ .2CO(g) + 2H2(g)===CH4(g) +CO2(g)H3=-247.4 kJ·mol- 1(1) 图 1 是太原理工大学煤化工研究所利用热力学数据剖析获取温度对反响Ⅰln ( 化学K平衡常数 K 的自然对数)的曲线图,请剖析出现这样趋势的原因是________________________________________________________________________________________________________________________________________________________________________________________________________________________ 。
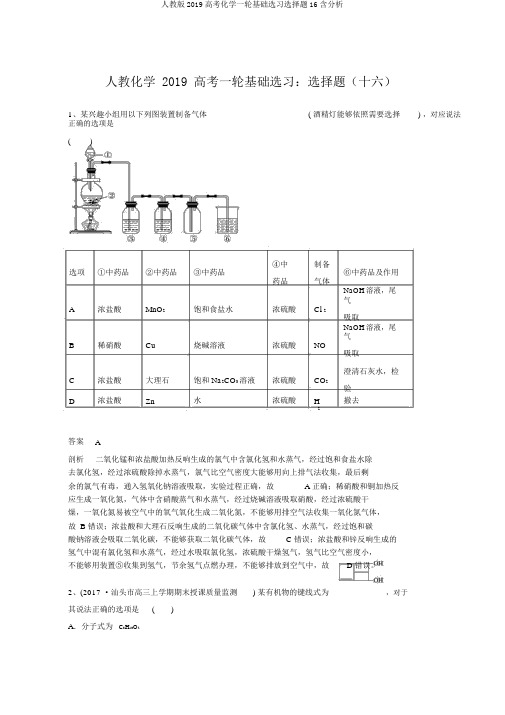
人教化学 2019 高考一轮基础选习:选择题(十六)1、某兴趣小组用以下列图装置制备气体( 酒精灯能够依照需要选择) ,对应说法正确的选项是()选项①中药品②中药品③中药品④中制备⑥中药品及作用药品气体A浓盐酸MnO2饱和食盐水浓硫酸Cl 2NaOH溶液,尾气吸取B稀硝酸Cu烧碱溶液浓硫酸NO NaOH溶液,尾气吸取C浓盐酸大理石饱和 Na2CO3溶液浓硫酸CO2澄清石灰水,检验D浓盐酸Zn水浓硫酸H撤去2答案A剖析二氧化锰和浓盐酸加热反响生成的氯气中含氯化氢和水蒸气,经过饱和食盐水除去氯化氢,经过浓硫酸除掉水蒸气,氯气比空气密度大能够用向上排气法收集,最后剩余的氯气有毒,通入氢氧化钠溶液吸取,实验过程正确,故 A 正确;稀硝酸和铜加热反应生成一氧化氮,气体中含硝酸蒸气和水蒸气,经过烧碱溶液吸取硝酸,经过浓硫酸干燥,一氧化氮易被空气中的氧气氧化生成二氧化氮,不能够用排空气法收集一氧化氮气体,故 B 错误;浓盐酸和大理石反响生成的二氧化碳气体中含氯化氢、水蒸气,经过饱和碳酸钠溶液会吸取二氧化碳,不能够获取二氧化碳气体,故 C 错误;浓盐酸和锌反响生成的氢气中混有氯化氢和水蒸气,经过水吸取氯化氢,浓硫酸干燥氢气,氢气比空气密度小,不能够用装置⑤收集到氢气,节余氢气点燃办理,不能够排放到空气中,故 D 错误。
2、(2017 ·汕头市高三上学期期末授课质量监测) 某有机物的键线式为,对于其说法正确的选项是()A.分子式为C8H10O2B.可发生氧化、取代、加成反响C.该有机物含酯基的芬芳族化合物的同分异构体有 4 种D.它的另一种同分异构体最多有13 个原子共平面答案B剖析此有机物分子式为C8H8O2,故 A 错误;此有机物含有碳碳双键,可发生氧化、加成反响,还有醇羟基可发生取代反响,故 B 正确;该有机物的含酯基的芬芳族化合物的同分异构体有 6 种,其中苯环上含有一个甲基和一个甲酸酯基时有 3 种,还有苯甲酸甲酯、乙酸苯酯和甲酸苯甲酯,故 C 错误;有机物分子中所有原子都可能共平面,故 D 错误;答案为B。

2019高考化学一轮选择题练习(1)李仕才1.下列叙述中正确的是()A.摩尔是物质的量的单位,每摩尔物质约含有6.02X10;〃个分子B. 1 mol氧的质量为16 gC.0.5 mol He 约含有6. 02X 1023个电子D.2H既可表示2个氢原子又可表示2 mol氢分子解析作为物质的量的单位,mol可以计量微观粒子(包括原子、分子、离子、原子团等),每摩尔物质约含有6.02X102’个“粒子”,这里的“粒子”并不一定是分子,A项错误;使用“mol”作单位时,所指粒子必须明确,且粒子种类要用适当的符号或化学式表示,“1呗1氧”的说法错误,B项错误;2H只表示2个氢原子,D项错误。
答案C链接一一【2018新课标2卷】化学与生活密切相关。
下列说法错误的是A.碳酸钠可用于去除餐具的油污B.漂白粉可用于生活用水的消毒C.氢氧化铝可用于中和过多胃酸D.碳酸f贝可用于胃肠X射线造影检查【答案】D【解析】精准分析:A.碳酸钠水解滚滋显碱性,因此可用于去除餐具的油污,A正确;B・漂白紛具有强氧化性,可用于生活用水的消毒,B正确:C.氢氧化铝是两性氢氧化物,能与酸反应,可用于中和过多胃酸,C正确;D.碳酸顿难溶于水,但可溶于酸,生成可溶性顿盐而使蛋白质变性,所以不能用于胃肠X射线造影检查,应该用硫酸報,D错误。
答案选考点定位:查常见化学物质的性质和用途判断,涉及碳酸钠、漂白粉、氢氧化铝、顿餐等【试题点评】本题主要是考查常见化学物质的性质和用途判断,题目难度不大。
平吋注意相关基础知识的积累并能灵活应用即可,注意碳酸锁与硫酸锁的性质差异。
[2018江苏卷】用化学用语表示Nlh+ IICl=NIhCl 中的相关微粒,其中正确的是A. 中子数为8的氮原子:知 B . HC1的电子式:1口£阴II-N-II I C. N 出的结构式: H【答案】C 【解析】精准分析:A 项,中子数为S 的氮原子的质重数为15,表示为達N, A 项错误;B 项,HCI 中只H • • —X —H 含共价键,HC1的电子式为寻项错误;C 项,NH]中含3个VH 键,NH?的结构式为 H , C项正确;D 项,Ci 最外层有8个电子,C1的结构示意图为考点定位:电子式、核素、结构示意图、结构式的识别。

2019届高考模拟训练化学 Word版含答案姓名,年级:时间:绝密★启用前化学注意事项:1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。
答题前,考生务必将自己的姓名、考生号填写在答题卡上。
2.回答第Ⅰ卷时,选出每小题的答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其他答案标号.写在试卷上无效.3.回答第Ⅱ卷时,将答案填写在答题卡上,写在试卷上无效.4.考试结束,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 S 32 Cl 35。
5 K 39第Ⅰ卷一、选择题:本大题共7小题,每小题6分。
在每小题给出的四个选项中,只有一项是符合题目要求的.7.宋应星所著《天工开物》被外国学者誉为“17世纪中国工艺百科全书”。
下列说法不正确的是A.“凡白土曰垩土,为陶家精美启用”中“陶”是一种传统硅酸盐材料B.“凡火药,硫为纯阳,硝为纯阴”中“硫"指的是硫磺,“硝"指的是硝酸C.“烧铁器淬于胆矾水中,即成铜色也”该过程中反应的类型为置换反应准考证号考场号座位号D.“每红铜六斤,入倭铅四斤,先后入罐熔化,冷定取出,即成黄铜”中的黄铜是合金8.设N A为阿伏加德罗常数的值。
下列说法正确的是A.25℃,101kPa条件下,5。
6L甲烷和乙烯的混合气体中含氢原子数为N AB.将4.6g钠用铝箔包裹并刺小孔,与足量水充分反应生成H2分子数为0.1N AC.50℃时,1L pH=1的H2SO4溶液中,含有H+的数目为0.1N A D.将1mol Cl2通入到足量的水中,则N(HClO)+N(Cl−)+N (ClO−)=2N A(N表示粒子数)9.某学习小组以废催化剂(主要成分SiO2、ZnO、ZnS和CuS)为原料,制备锌和铜的硫酸盐晶体。
设计的实验方案如下:下列说法不正确的是A.步骤①、③中发生的反应均为氧化还原反应B.步骤①中能溶于稀硫酸的是ZnO、ZnSC.步骤③涉及的离子反应可能为CuS+H2O2+2H+错误!Cu2++S+2H2OD.步骤②和④,采用蒸发浓缩、冷却结晶,过滤后均可获取粗晶体10.化合物如图的分子式均为C7H8。
名师圈题”化学模拟试卷(一)可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Mg 24Al 27 S 32 Cl 35.5 K 39 Fe 56 Cu 64 As75第Ⅰ卷本卷包括 16 小题,每小题 2 分,共 32 分。
在每题列出的四个选项中,只有一项是最符合题目要求的。
1.下列说法正确的是()A.SiO2 和 CO2 都酸性氧化物,都是共价化合物B.为防止月饼等富脂食品被氧化变质,可在包装袋中放入硅胶C.NaHCO3 溶液中含有Na2SiO3 杂质,可通入足量 CO2 后过滤D.SiO2 中含 Al2O3 杂质,可加入足量 NaOH溶液然后过滤除去2.化学与生产、生活、社会密切相关,下列说法错.误.的是()A.葡萄糖、麦芽糖均能与银氨溶液反应B.甘氨酸和丙氨酸缩合最多可以形成四种二肽C.富含蛋白质的豆浆煮沸后即可得人体所需的氨基酸D.油脂在氢氧化钾溶液中水解可制得汽车洗涤用的液体肥皂3.一定温度下某密闭容器中,对可逆反应 A(g)+2B(g) 3C(g)的下列叙述中,能说明反应已达到平衡的是()A.容器内的压强不再变化 B.混合气体的密度不再变化C.混合气体的质量4 不再改变D .单位时间内消耗 a mol A ,同时消耗 3a mol C4.已知:Na 2S 2O 3+H 2SO 4=Na 2SO 4+SO 2↑+S ↓+H 2O 。
下列各组实验中最先出现浑浊的是 ( )5.下列离子方程式正确的是( ) A .KI 溶液中滴加稀硫酸:4H + +4I -+O 2=2I 2+2H 2O B .过量 SO 2 通入氨水中:2NH 3∙H 2O+SO 2=2NH ++SO 32-+H 2OC .NaAlO 2 溶液中滴加过量盐酸:AlO 2-+H 2O+H += Al(OH)3↓D .氨水滴入 AgNO 3 溶液中至沉淀完全:Ag + +2NH 3∙H 2O=[Ag(NH 3)2]++2H 2ONa 2S 2O 3 溶液稀硫酸H 2O实验 反应温度/℃c /mol ∙L-1c /mol ∙L-1V /mLV /mLV /mLA B C D20 20 30 305 5 5 50.1 0.2 0.1 0.210 5 10 50.1 0.2 0.1 0.25 10 5 106.下列实验的叙述正确的是()A.酸碱中和滴定需将标准溶液直接注入到用水清洗后的滴定管中B.若需 94 mL1.00 mol/LNaCl 溶液,需称 5.85 g NaCl配制成 100 mL 溶液 C.用一元酸和一元碱测定中和反应热时,取等体积等浓度的稀溶液为佳D.测定稀酸或稀碱溶液的 pH 时,需将待测液直接滴在湿润的 pH 试纸上7.下列叙述正确的是()A.0.1 mol/L 的 Na2S 溶液中:2c(Na+) = c(S2-)+c(HS-)+c(H2S) B.0.1 mol/L NaHCO3 溶液中:c(OH-)= c(H+)+c(HCO3-)+2c(H2CO3) C.含等物质的量的 NaHC2O4 和 Na2C2O4 的溶液:2c(Na+)=3[c(HC2O4-) + c(C2O42-) + c(H2C2O4)]D.pH=2 的H2C2O4 溶液与pH=12 的NaOH 溶液任意比例混合:c(Na+)+ c(H+) = c(OH-)+c( HC2O4-)8.已知:2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ∙mol-1Na2O2(s)+CO2(g)===Na2CO3(s)+1/2O2(g) ΔH=-226 kJ∙mol-1根据以上热化学方程式判断,下列说法正确的是()A.CO 的燃烧热为 283 kJB.右图可表示由 CO 生成 CO2 的反应过程和能量关系C.2Na2O2(s)+2CO2(s)===2Na2CO3(s)+O2(g) ΔH=-452 kJ∙mol-1D.CO(g)与 Na2O2(s)反应放出 509 kJ热量时,电子转移数为 1.204×10249.下图所示仪器可用于实验室制备少量无水 FeCl3,仪器连接顺序正确的是()A.a—e—d—c—b—h—i—gB.a—b—c—d—e—f—g—h C.a—d—e—c—b—h—i—g D.a—c—b—d—e—h—i—f10.短周期主族元素 a、b、c、d 的原子序数依次增大,b、c、d 位于同一周期,c 原子的最外层电子数既是 a 原子内层电子数的 3 倍又是 b 原子最外层电子数的 3 倍;a、b、c 原子的最外层电子数之和为 12。
(人教版)化学2019高考一轮练练题:填空题(1)含答案李仕才1、红磷P(s)和Cl2(g)发生反应生成PCl3(g)、PCl5(g),反应过程如下:2P(s)+ 3Cl2(g) === 2PCl3(g) ΔH=-612 kJ·mol-12P(s)+ 5Cl2(g) ===2PCl5(g) ΔH=-798 kJ·mol-1气态 PCl5生成气态PCl3和Cl2的热化学方程式为________________________________________________________________________________________________________________________________________________。
答案PCl5(g)??PCl3(g)+ Cl2(g) ΔH=+93 kJ·mol-1解析已知:①2P(s)+3Cl2(g)===2PCl3(g) ΔH=-612 kJ·mol-1,②2P(s)+5Cl2===2PCl5(g) ΔH=-798 kJ·mol-1,根据盖斯定律可知(①-②)/2即得到气态PCl5生成气态PCl3和Cl2的热化学方程式:PCl5(g)??PCl3(g)+Cl2(g) ΔH=+93 kJ·mol-1。
2、一定条件下,CO和H2合成CH3OH:CO(g)+2H2(g)??CH3OH(g)。
在体积一定的密闭容器中按物质的量之比1∶2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。
(1)A、B、C三点平衡常数K A、K B、K C的大小关系是________________;压强:p1________(填“>”“<”或“=”,下同)p2;逆反应速率:v逆(A)________v逆(B)。
(2)在C点,CO的转化率为________;在C点,若再按物质的量之比1∶2充入一定量的CO 和H2,当其他条件不变,达到新的平衡时,CH3OH的体积分数________(填“增大”“减小”或“不变”)。
人教版化学2019高考一轮选练习题(1)一、选择题1、设N A为阿伏加德罗常数的值。
下列说法正确的是A.标准状况下,2.24 L HF和NH3分子所含电子数目均为N AB.23gC2H6O含C-H键数目一定为2.5N AC.将1molCl2通入到水中,则N(HClO)+N(Cl−)+N(ClO−)=2N A(N表示粒子数)D.8.0gCuO和Cu2S的混合物中含有铜原子的数目为0.1N A【答案】D【解析】A.HF的沸点是19.5℃,在标准状况下其为液体,无法根据气体摩尔体积的数据计算2.24 L HF的物质的量,A不正确;B.C2H6O可能是乙醇,也可能是二甲醚。
23gC2H6O的物质的量是0.5mol,0.5mol乙醚含C-H键数目为3N A,B不正确;C.将1molCl2通入到水中,若氯气完全溶于水中,则2N(Cl2)+N(HClO)+N(Cl−)+N(ClO −)=2N A(N表示粒子数),C不正确;D.8.0gCuO和8.0g Cu2S 均含有0.1mol Cu原子,所以8.0gCuO和Cu2S的混合物中含有铜原子的数目为0.1N A,D正确。
本题选D。
点睛:在使用气体摩尔体积进行相关物质的计算时,一定要先确定计算对象是否为气体,很多学生易把HF误认为是气体而犯错。
另外,还要注意使用的条件是标准状况。
2、某溶液中可能含有Na+、Mg2+、Fe2+、H+、HCO3-、OH-、Cl-、NO3-、I-中的若干种,向该溶液中加入铝粉后,溶液中有AlO2- 生成,则原溶液中能大最共存的离子最多有A.4种B.5种C.6 种D.7种【答案】B【解析】向该溶液中加入铝粉后,溶液中有AlO2- 生成,说明溶液呈碱性,Mg2+、Fe2+、H+、HCO3-都与OH-发生反应而不能大量共存,所以溶液中能大量共存的离子最多有Na+、OH-、Cl-、NO3-、I- 5种。
答案选B.3、某试液中只可能含有K+、NH4+、Fe2+、Al3+、Cl-、SO42-、CO32-、AlO2-中的若干种离子。
人教化学2019高考一轮选训习题(1)李仕才一、选择题K (2018 •江西九江联考)设佩为阿伏加德罗常数的值。
下列说法正确的是(C )A.0.5 mol Cu与足量的S反应转移的电子数为佩B.在粗铜精炼的实验中,阳极质量减少6.4 g,则电解过程中转移的电子数为0.2加C. 2 g D2O和也%的混合物中含有的中子数为加D.46 g有机物GHeO中含有极性共价键的数0 一定为7抠解析Cu与S反应生成Cu2S, 0. 5 mol Cu与足量的S反应转移的电子数为0. 5加,A项错误;精炼铜时,阳极减少的不都是Cu,还有Zn、Fe、Ni等杂质金属,所以阳极质量减少6. 4 g时转移的电子数不是0.2僦,B项错误;D2O和出叱的摩尔质量相同,均为20g・ mol"1, 中子数也相同,均为10,故2 g址0和山"0的混合物的物质的量是0. 1 mol,所含中子数为汕,C项正确;CJIcO可以是乙醇,也可以是二甲(CIh—0—CIh),若是二甲醛,则46 g CzHsO 中含有的极性共价键的数目是8批,D项错误。
2、下列离子方程式书写正确的是(B )A.CL通入水中:Cl2+H20=2H++Cr+C10'B.双氧水加入稀硫酸和KI溶液:H202+2H+ + 2r=I2+2H20C.用铜作电极电解CuSOj溶液:2Cu2+ + 2H20^S2Cu+02 t +4H+D.NQ2S2O3溶液中加入稀硫酸:2S20r + 4H+=S0r + 3S ! +2H203、某校化学兴趣小组用如图所示过程除去AlCls溶液中含有的Mg2\广杂质离子并尽可能减少A1C13的损失。
|->Mg(OH)2沉淀足就NaOH溶液厶-严液,盐酸「沉淀a邑空A1C1;溶液ci-丄介" L溶液b下列说法正确的是(D )A.NaOH溶液可以用氨水来代替B.溶液a 中含有Alt K\ Cl"> NaS 0H_C.溶液b中只含有NaClD.向溶液a中滴加盐酸筒控制溶液的pll解析A项,用氨水将会使Al:,\ Mg2+均沉淀下来,达不到分离的目的;B项,溶液a屮,A13 +已转化为A10;; C项,b中含有KChNaCKHCl等物质;D项,若不控制pH,沉淀a[Al(0H)3] 将不能分离出来。
板块三高考层面·高考真题实战
1.[高考集萃]判断正误,正确的画“√”,错误的画“×”。
(1)[2018·江苏高考]用玻璃棒蘸取溶液点在水润湿的pH试纸上,测定该溶液的pH。
()
(2)[2018·江苏高考]室温下pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,溶液的pH>7。
()
(3)[2018·课标全国卷Ⅰ]酸式滴定管装标准溶液前,必须先用该溶液润洗。
()
(4)[2018·课标全国卷Ⅰ]酸碱滴定实验中,用待滴定溶液润洗锥形瓶以减小实验误差。
()
(5)[2018·大纲全国卷]用蒸馏水润湿的试纸测溶液的pH,一定会使结果偏低。
()
(6)[2018·天津高考]在蒸馏水中滴加浓H2SO4,K w不变。
()
(7)[2018·天津高考]NaCl溶液和醋酸铵溶液均显中性,两溶液中水的电离程度相同。
()
(8)[2018·福建高考]25 ℃与60 ℃时,水的pH相等。
()
(9)[2018·广东高考]对于常温下pH=2的盐酸中,由H2O电离出的c(H+)=1.0×10-12 mol·L-1。
()
(10)[2018·江苏高考]水的离子积常数K w随着温度的升高而增大,说明水的电离是放热反应。
()
答案(1)×(2)×(3)√(4)×(5)×(6)×(7)×(8)×(9)√(10)×
解析(1)测定pH时,不能将pH试纸润湿,故错误;(2)pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,反应后醋酸过量,溶液显酸性,错误;(3)滴定管使用前,需先用标准溶液润洗,以减小实验误差,正确;(4)酸碱滴定实验中,不能用待测液润洗锥形瓶,润洗会导致待测液增多,使实验误差增大,错误;(5)当
溶液本身呈中性时,用蒸馏水润湿pH,对测量结果不产生影响,错误;(6)浓H2SO4加入蒸馏水中会放热,使K w变大,错误;(7)NaCl 是强酸强碱盐,对水的电离不产生影响,而CH3COONH4是弱酸弱碱盐,对水的电离起促进作用,两者影响不同,错误;(8)水的电离受到温度的影响,温度不同,水电离出的氢离子浓度不同,pH也不同,错误;(9)pH=2的盐酸中,水的电离受到抑制,水电离出的c(H +)=水电离出的c(OH-)=溶液中的c(OH-)=10-12 mol·L-1,正确;
(10)水的电离是吸热过程,错误。
2.[2018·广东高考]一定温度下,水溶液中H+和OH-的浓度变化曲线如图。
下列说法正确的是()
A.升高温度,可能引起由c向b的变化
B.该温度下,水的离子积常数为1.0×10-13
C.该温度下,加入FeCl3可能引起由b向a的变化
D.该温度下,稀释溶液可能引起由c向d的变化
答案 C
解析升温促进水的电离,升温后溶液不能由碱性变为中性,A 项错误;根据c(H+)和c(OH-)可求出K w=1.0×10-14,B项错误;
加入FeCl3,Fe3+水解溶液呈酸性,可引起由b向a变化,C项正确;温度不变,稀释后,c(OH-)减小,c(H+)增大,但仍在该曲线上,不可能到达d点,D项错误。
3.[2018·山东高考] 室温下向10 mL 0.1 mol·L-1 NaOH溶液中加入0.1 mol·L-1的一元酸HA,溶液pH的变化曲线如图所示。
下列说法正确的是()
A.a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA)
B.a、b两点所示溶液中水的电离程度相同
C.pH=7时,c(Na+)=c(A-)+c(HA)
D.b点所示溶液中c(A-)>c(HA)
答案 D
解析加入10 mL一元酸HA溶液时,恰好中和,但溶液的pH 为8.7,说明HA为弱酸,a点表示NaA溶液,A-+H2O HA+OH-,存在A-的水解溶液显碱性,应有c(Na+)>c(A-)>c(OH -)>c(HA)>c(H+),A项错误;a点水的电离受到促进,b点为等物质的量浓度的NaA和HA的混合溶液,溶液呈酸性的原因是HA的电离程度大于A-的水解程度,故c(A-)>c(HA),总的来看水的电离受到了抑制,B项错误,D项正确;由溶液中电荷守恒可知c(Na+)+c(H
+)=c(A-)+c(OH-),溶液呈中性,即c(H+)=c(OH-),则可知c(Na +)=c(A-),C项错误。
4.[2018·四川高考]下列溶液中粒子的物质的量浓度关系正确的是()
A.0.1 mol·L-1 NaHCO3溶液与0.1 mol·L-1 NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO2-3)>
c(HCO-3)>c(OH-)
B.20 mL 0.1 mol·L-1CH3COONa溶液与10 mL 0.1 mol·L-1 HCl 溶液混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(Cl -)>c(CH3COOH)>c(H+)
C.室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH+4)+c(OH-)
D.0.1 mol·L-1 CH3COOH溶液与0.1 mol·L-1 NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH)
答案 B
解析A项,NaHCO3+NaOH===Na2CO3+H2O,故溶液中各离子浓度大小关系应为c(Na+)>c(CO2-3)>c(OH-)>c(HCO-3),错误;B项正确;C项,两溶液混合,NH3·H2O过量,溶液呈碱性,c(OH -)>c(H+),c(NH+4)>c(Cl-),故c(Cl-)+c(H+)<c(NH+4)+c(OH-),C 错误;D项,两溶液等体积混合后,得CH3COONa溶液,根据质子守恒得c(OH-)=c(H+)+c(CH3COOH),故错误。
5.[2018·山东高考]毒重石的主要成分为BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:
(1)毒重石用盐酸浸取前需充分研磨,目的是__________________。
实验室用37%的盐酸配制15%的盐酸,除量筒外还需使用下列仪器中的________。
a.烧杯b.容量瓶
c.玻璃棒d.滴定管
(2)加入NH3·H2O调pH=8可除去________(填离子符号),滤渣Ⅱ中含________(填化学式)。
加入H2C2O4时应避免过量,原因是___________________________________________________________ _____________。
已知:K sp(BaC2O4)=1.6×10-7,K sp(CaC2O4)=2.3×10-9
已知:2CrO2-4+2H+===Cr2O2-7+H2O;
Ba2++CrO2-4===BaCrO4↓。
步骤Ⅰ:移取x mL一定浓度的Na2CrO4溶液于锥形瓶中,加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V0 mL。
步骤Ⅱ:移取y mL BaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1 mL。
滴加盐酸标准液时应使用酸式滴定管,“0”刻度位于滴定管的________(填“上方”或“下方”)。
BaCl2溶液的浓度为________mol·L-1。
若步骤Ⅱ中滴加盐酸时有少量待测液溅出,Ba2+浓度测量值将________(填“偏大”或“偏小”)。
答案(1)增大接触面积,加快反应速率,提高原料利用率ac
(2)Fe3+Mg(OH)2、Ca(OH)2H2C2O4过量会导致生成BaC2O4沉淀,产品产量减少
(3)上方 b (V 0-V 1)y
偏大 解析 (1)配制一定质量分数的溶液不必使用容量瓶和滴定管,需使用量筒、烧杯和玻璃棒。
(2)由表中数据可知,调pH =8可使Fe 3+完全转化为Fe(OH)3沉淀;调pH =12.5可使Mg 2+完全沉淀,同时使Ca 2+部分沉淀,故滤渣Ⅱ中含Mg(OH)2和Ca(OH)2。
若H 2C 2O 4过量,则会生成BaC 2O 4沉淀,使产品产量降低。
(3)由关系式:CrO 2-4~H +、CrO 2-4
~Ba 2+可知,与Ba 2+结合生成BaCrO 4沉淀的Na 2CrO 4的物质的量等于(V 0-V 1) mL 盐酸中HCl
的物质的量,故BaCl 2溶液的浓度为b (V 0-V 1)y。
若步骤Ⅱ中滴加盐酸时有少量待测液溅出,则步骤Ⅱ中测得滴加盐酸的体积偏小,导致Ba 2+浓度测量值偏大。