无机化学原子结构
- 格式:ppt
- 大小:1.88 MB
- 文档页数:71



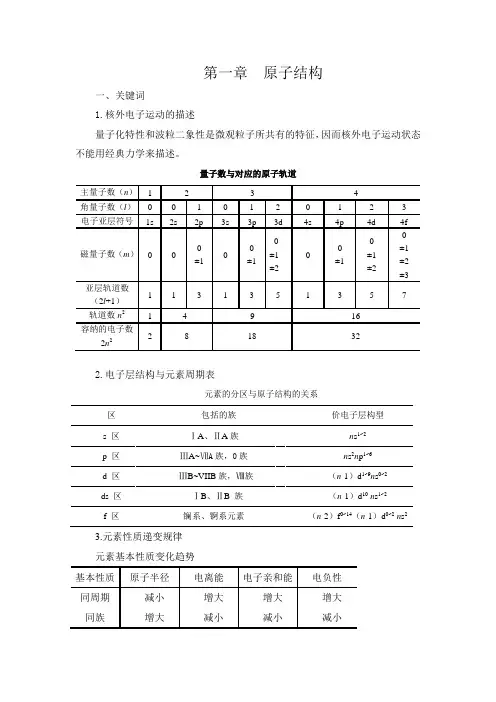
第一章原子结构一、关键词1.核外电子运动的描述量子化特性和波粒二象性是微观粒子所共有的特征,因而核外电子运动状态不能用经典力学来描述。
量子数与对应的原子轨道2.电子层结构与元素周期表元素的分区与原子结构的关系3.元素性质递变规律元素基本性质变化趋势二、学习感悟1.原子结构模型的演变历史给我们的启迪原子结构模型是科学家根据自己的认识,对原子结构的形象描摹。
一种模型代表了人类对原子结构认识的一个阶段。
人类认识原子的历史是漫长的、无尽的,随着科学技术的发展,人类对原子的认识过程还会不断深化。
①化学认识发展的规律和所有科学认识发展的规律一样是继承、积累和突破。
②实验方法是科学研究的一种重要方法,实验手段的不断改进促使化学理论向前发展。
人类对原子结构的认识体现了人类认识自然的历程,向我们提示了一个科学理论发展的模式:实践-认识-再实践-再认识。
2.研究原子结构涉及较深的数学知识和物理知识初学者往往觉得枯燥难懂,因此,学习时重点放在理解,接受相关的基本概念,加上一定的空间想像。
3.结构决定性质,性质体现结构元素的电离能、电子亲和能和电负性在衡量元素的金属性和非金属性强弱时,结果是大致相同的。
但由于元素的电负性的大小是表示分子中原子吸引电子的能力大小,所以它能方便地定性反映元素的某些性质,如:金属性与非金属性、氧化还原性;化合物中化学键的类型、键的极性等,故它在化学领域中被广泛地运用。
而元素的电子亲和能的数值一般较电离能小一个数量级,而且已知的元素的电子亲和能数据较少,测定的准确性也差,所以其重要性不如元素的电离能。
三、难点辅导1.微观粒子运动具有哪些特点?能量是量子化的。
量子化是相对于连续而言,也就是说变化过程是不连续的,是间隔的,是跳跃式的,一个一个的,不连续的。
与宏观物体的逐渐的、连续的运动有很大的区别。
打个比方说,光从微观角度讲就是不连续的,爱因斯坦的光子说中把每一个光子叫做光量子,是一个个不连续的能量包,虽然光没有静质量,但光有动质量,有质量就有能量。

第五章 原子结构和元素周期表本章总目标:1:了解核外电子运动的特殊性,会看波函数和电子云的图形2:能够运用轨道填充顺序图,按照核外电子排布原理,写出若干元素的电子构型。
3:掌握各类元素电子构型的特征4:了解电离势,电负性等概念的意义和它们与原子结构的关系。
各小节目标:第一节:近代原子结构理论的确立 学会讨论氢原子的玻尔行星模型213.6E eV n =。
第二节:微观粒子运动的特殊性1:掌握微观粒子具有波粒二象性(h h P mv λ==)。
2:学习运用不确定原理(2h x P mπ∆•∆≥)。
第三节:核外电子运动状态的描述1:初步理解量子力学对核外电子运动状态的描述方法——处于定态的核外电子在核外空间的概率密度分布(即电子云)。
2:掌握描述核外电子的运动状态——能层、能级、轨道和自旋以及4个量子数。
3:掌握核外电子可能状态数的推算。
第四节:核外电子的排布1:了解影响轨道能量的因素及多电子原子的能级图。
2;掌握核外电子排布的三个原则:○1能量最低原则——多电子原子在基态时,核外电子尽可能分布到能量最低的院子轨道。
○2Pauli 原则——在同一原子中没有四个量子数完全相同的电子,或者说是在同一个原子中没有运动状态完全相同的电子。
○3Hund原则——电子分布到能量简并的原子轨道时,优先以自旋相同的方式分别占据不同的轨道。
3:学会利用电子排布的三原则进行第五节:元素周期表认识元素的周期、元素的族和元素的分区,会看元素周期表。
第六节:元素基本性质的周期性掌握元素基本性质的四个概念及周期性变化1:原子半径——○1从左向右,随着核电荷的增加,原子核对外层电子的吸引力也增加,使原子半径逐渐减小;○2随着核外电子数的增加,电子间的相互斥力也增强,使得原子半径增加。
但是,由于增加的电子不足以完全屏蔽增加的核电荷,因此从左向右有效核电荷逐渐增加,原子半径逐渐减小。
2:电离能——从左向右随着核电荷数的增多和原子半径的减小,原子核对外层电子的引力增大,电离能呈递增趋势。


第五版无机化学大一知识点无机化学是化学科学中的一个重要分支,主要研究无机物质的性质、结构和变化规律。
作为大一学生,掌握基础的无机化学知识对于后续学习和研究有着重要的作用。
下面将介绍第五版无机化学大一知识点。
一、原子结构和元素周期表原子是物质的基本单位,由质子、中子和电子组成。
质子带正电荷,中子不带电荷,电子带负电荷。
原子核由质子和中子组成,电子围绕原子核运动。
元素周期表是将元素按照一定规律进行排列,用于描述元素的性质和结构。
二、化学键和分子结构化学键是原子之间的相互作用力,常见的化学键包括共价键、离子键和金属键。
共价键是由共享电子对形成的,离子键是由带正电荷的金属离子和带负电荷的非金属离子之间的电荷吸引力形成的,金属键是由金属原子之间的金属离子形成的。
分子结构是指分子内原子的排列方式和原子之间的连接方式。
三、化学反应和化学平衡化学反应是物质发生变化的过程,包括化学反应方程式的写法、化学反应速率和反应机理的研究等。
化学平衡是指在闭合系统中,反应物和生成物的浓度达到一定比例时,反应停止,但反应物和生成物仍处于动态平衡状态。
四、酸碱和盐酸是指具有给出H+离子的物质,碱是指具有给出OH-离子的物质。
酸碱反应会生成盐和水。
盐是由阳离子和阴离子组成的晶体化合物。
五、氧化还原反应氧化还原反应是指电子的转移过程,包括氧化反应和还原反应。
氧化是指物质失去电子,还原是指物质获得电子。
氧化还原反应可以通过电子传递实现,也可以通过氧原子的转移实现。
六、配位化学配位化学研究配位化合物和配位键的形成和性质。
配位化合物是由中心金属离子和配体(通常是带有孤对电子的配位基团)形成的。
不同的配体可以形成不同的配位键,如配位键可以是双电子提供的孤对电子,也可以是单电子提供的孤对电子。
七、主要无机化合物大一学习的无机化合物主要包括氢化物、氧化物、酸盐、过渡金属配合物等。
氢化物是由氢原子和其他元素形成的化合物,氧化物是由氧元素和其他元素形成的化合物,酸盐是由阳离子、阴离子和氧元素形成的化合物,过渡金属配合物是由过渡金属离子和配体形成的化合物。



无机化学原子结构
无机化学是关于非有机物的研究,其原子结构由空间分子结构和核结构组成。
空间分子结构指物质的真实结构,而核结构是由原子核的结构组成,它由原子核和原子核外的电子构成。
首先,原子核结构包括核子和中子。
核子是原子核内的结构元素,它由原子核发射出的小点组成,可以由质量数和发射能量来描述。
原子核中的中子由原子核发射出的小点组成,可以由质量数和发射能量来描述。
其次,原子核外的电子结构可被分为电子层和电子层内的电子结构。
电子层由电子结构组成,它指电子组成原子的层次结构,如
1s,2s,2p,3s,3p,3d等加以形成,可以描述电子结构中各个电子能级的特征,比如它们的质量数和能量。
再次,原子核结构可以用空间分子结构来描述。
它是一种由原子核及其中的各原子组成的空间图案,根据质量数,其中原子核的形状可以描述为球形或长方体形,其中的原子由不同数量的电子组成,并且有多种层次结构,以便随着原子核电子束断裂的变化发生相应变化。
最后,空间分子结构还可以用于描述无机化学元素的分子性质,如分子式、分子量、熔点、沸点、折射率等。