无机化学第五章原子结构与元素周期表
- 格式:ppt
- 大小:1.18 MB
- 文档页数:51



第五章 原子结构和元素周期表本章总目标:1:了解核外电子运动的特殊性,会看波函数和电子云的图形2:能够运用轨道填充顺序图,按照核外电子排布原理,写出若干元素的电子构型。
3:掌握各类元素电子构型的特征4:了解电离势,电负性等概念的意义和它们与原子结构的关系。
各小节目标:第一节:近代原子结构理论的确立 学会讨论氢原子的玻尔行星模型213.6E eV n =。
第二节:微观粒子运动的特殊性1:掌握微观粒子具有波粒二象性(h h P mv λ==)。
2:学习运用不确定原理(2h x P mπ∆•∆≥)。
第三节:核外电子运动状态的描述1:初步理解量子力学对核外电子运动状态的描述方法——处于定态的核外电子在核外空间的概率密度分布(即电子云)。
2:掌握描述核外电子的运动状态——能层、能级、轨道和自旋以及4个量子数。
3:掌握核外电子可能状态数的推算。
第四节:核外电子的排布1:了解影响轨道能量的因素及多电子原子的能级图。
2;掌握核外电子排布的三个原则:○1能量最低原则——多电子原子在基态时,核外电子尽可能分布到能量最低的院子轨道。
○2Pauli 原则——在同一原子中没有四个量子数完全相同的电子,或者说是在同一个原子中没有运动状态完全相同的电子。
○3Hund原则——电子分布到能量简并的原子轨道时,优先以自旋相同的方式分别占据不同的轨道。
3:学会利用电子排布的三原则进行第五节:元素周期表认识元素的周期、元素的族和元素的分区,会看元素周期表。
第六节:元素基本性质的周期性掌握元素基本性质的四个概念及周期性变化1:原子半径——○1从左向右,随着核电荷的增加,原子核对外层电子的吸引力也增加,使原子半径逐渐减小;○2随着核外电子数的增加,电子间的相互斥力也增强,使得原子半径增加。
但是,由于增加的电子不足以完全屏蔽增加的核电荷,因此从左向右有效核电荷逐渐增加,原子半径逐渐减小。
2:电离能——从左向右随着核电荷数的增多和原子半径的减小,原子核对外层电子的引力增大,电离能呈递增趋势。



无机化学基本知识点总结一、原子结构1. 原子的组成原子是由质子、中子和电子组成的。
质子和中子位于原子核中,电子围绕原子核运动。
2. 元素的原子序数和质量数原子序数表示元素的质子数,而质量数表示元素的质子数和中子数之和。
原子序数决定了元素的化学性质,而质量数决定了元素的同位素。
3. 电子结构原子的电子结构决定了元素的化学性质。
电子在原子内的分布遵循一定的规律,即电子遵循能级分布,并且填充规律是按照“2-8-18-32”规则进行填充。
二、元素周期表1. 周期表的性质元素周期表是根据元素的化学性质和原子结构而排列的。
周期表中的元素按照原子序数排列,具有周期性。
2. 元素的周期性规律元素周期表中的元素具有周期性规律,即元素的周期表现出周期性变化。
这种周期性变化可以通过元素的原子结构和电子的排布规律来解释。
三、化学键1. 化学键的形成化学键是由原子之间的相互作用形成的。
化学键的形成使得原子之间形成更加稳定的结构,从而形成化合物。
2. 化学键的类型化学键主要包括离子键、共价键和金属键。
离子键是正负离子之间的电荷吸引力,共价键是原子间电子的共享,金属键是金属原子之间的电子云共享。
3. 极性与非极性化学键化学键可以分为极性和非极性两种。
极性化学键是由于原子电负性差距所产生的电荷分布不均匀的现象,而非极性化学键则是由于原子电负性相等而产生的电荷分布均匀的现象。
四、晶体结构1. 晶体结构的定义晶体结构是指晶体中原子、离子或者分子的排列规律和空间结构。
不同的元素或化合物在晶体中具有不同的晶体结构。
2. 晶体结构的分类晶体结构主要可以分为离子晶体、共价分子晶体和金属晶体。
离子晶体是由正负离子通过离子键结合而形成的,共价分子晶体是由共价键结合而形成的,而金属晶体则是由金属键结合而形成的。
五、酸碱性质1. 酸碱的定义酸是指能够释放出H+离子的物质,而碱则是指能够释放出OH-离子的物质。
酸碱的定义主要有布朗斯特德理论和劳里亚-布隆斯特德理论。

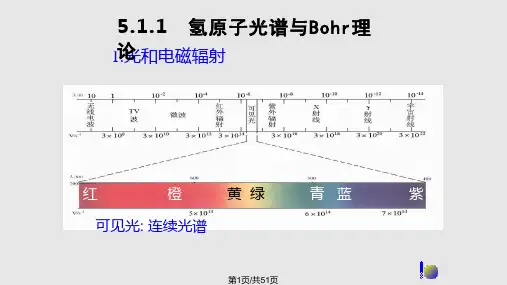



第五章 原子结构和元素周期系原子结构理论发展简史 1897年英国物理学家J.J.汤姆生通过阴极射线发现电子 “浸入模型”原子模型1原子的组成Rutherford有核原子模型原子核 原 子电子质子 中子25.1 原子和元素氢原子光谱和玻尔模型 Na光谱光谱一般分为连续和不连续两类.1. 灼热的固体和太阳光谱是连续光谱. 2. 原子光谱 (包括氢光谱)是线状光谱.3所有波长红橙黄绿青蓝紫45“Plank量子理论”光子的能量大小与光的频率成正比:E= hν E为光子的能量,ν光的频率,h为普朗克常数 h = 6.62×10-34 [J·s]物质以光的形式吸收或发射的能量只能是光量 子能量的整数倍,即称这种能量是量子化的6玻尔理论: 1)稳定轨道的概念(有确定的半径和能量);电子通常在稳定轨道上运动, 且不辐射能量。
2)离核最近的轨道能量最低,称为基态。
离核越 远的轨 道能量越高-----激发态。
3) 处于激发态的电子不稳定,可以跃迁到离核较 近的轨道上同时释放出光能7玻尔理论的形象化图示:电子在这些定态轨道 上运动时,既不吸收 能量又不放出能量。
放出能 量,回到 基态。
吸收能量 跃迁。
最高能 量轨道8氢光谱玻尔理论成功地解释了氢原子光谱! 玻尔理论的局限 : ● 不能解释氢原子光谱的精细结构 ● 不能解释氢原子光谱在磁场中的分裂. ● 不能解释多电子原子的光谱.9原因: 机械地应用了普朗克量子理论和“确定轨道”等概念.经典物理学理论面临的窘境---微观粒子的运动状态丹 麦 物 理 学 家 玻 尔105.2 原子结构的近代概念一 微观粒子的波粒二象性 干涉\衍射现象和光电效应证明光具有波粒二象性1924年,法国的de Broglie提出假设: 电子具有波粒二象性.λ= hmv 这就是著名的 德布罗依关系式.1927年,Davissson和Germer应用Ni晶体进行电子衍射 实验,证实电子具有波动性。
无机化学:第五章原子结构和元素周期律无机化学:第五章原子结构和元素周期律第五章原子结构和元素周期律一、核外电子运动的特殊性1、微观粒子的性质德布罗意关系-P?H波粒二象性是微粒运动的第一个显著特征。
电子衍射实验证实了电子运动的起伏。
不确定原理――?x??p≥h?不确定原理是微观粒子运动的第二个显著特点。
式中h为普朗克常量,其值为6.626×10―34js。
对微粒运动特殊性的研究表明,具有波粒二象性的微粒运动遵循不确定性原理,这是牛顿力学无法研究的,而应研究微粒运动的统计规律,其中波动性是微粒性质的统计结果。
二、核外电子运动状态的描述1、薛定谔方程222? 2.8.M公式:?E五、x2?y2?Z2h2这是一个二阶偏微分方程。
哪里是粒子空间坐标的函数,称为波函数;E是总能量;v是势能;m是微观粒子的质量;h是普朗克常数;x、y、z是空间坐标。
通过求解薛定谔方程可以得到波函数吗?相应的能量E,每个?表示原子核外电子的运动状态。
求解薛定谔方程时,应先进行坐标变换,将直角坐标系中的X、y、Z变换为R,?,和在球面坐标系中?,即x?rsin?cos?y?rsin?sin?ZRCO?Rx2?y2?Z2然后分离变量,并将R,?,?,哪个包含三个变量?将偏微分方程转化为三个只有一个变量的常微分方程,然后分别求解得到r?R那是??RRR令y??,,得??r,?,r?r?y??,??地点:R?R叫做波函数的径向部分,y??,??叫做波函数的角部分。
用薛定谔方程求解的描述电子运动状态的波函数在量子力学中称为原子轨道。
与经典的轨道意义不同,它是一个轨道函数,有时被称为轨道函数。
2.表示波函数的四个量子数在解薛定谔方程时,为了使结果有意义,即保证解的合理性,常需要引入三个量子数n,l、此时,薛定谔方程被改写为?n、 l,m?R瑞恩,我?Ryl,m??,??1)主量子数na、取值:n=1,2,3,4…?(n为正整数)光谱符号:k,l,m,n……b、意思是:① n代表原子轨道的大小,以及原子核外电子与原子核的距离(或电子所在的电子层数),也就是n离原子核越远?能量越高。
第五章 原子结构和元素周期表本章总目标:1:了解核外电子运动的特殊性,会看波函数和电子云的图形2:能够运用轨道填充顺序图,按照核外电子排布原理,写出若干元素的电子构型。
3:掌握各类元素电子构型的特征4:了解电离势,电负性等概念的意义和它们与原子结构的关系。
各小节目标:第一节:近代原子结构理论的确立 学会讨论氢原子的玻尔行星模型213.6E eV n =。
第二节:微观粒子运动的特殊性1:掌握微观粒子具有波粒二象性(h h P mv λ==)。
2:学习运用不确定原理(2h x P mπ∆∙∆≥)。
第三节:核外电子运动状态的描述1:初步理解量子力学对核外电子运动状态的描述方法——处于定态的核外电子在核外空间的概率密度分布(即电子云)。
2:掌握描述核外电子的运动状态——能层、能级、轨道和自旋以及4个量子数。
3:掌握核外电子可能状态数的推算。
第四节:核外电子的排布1:了解影响轨道能量的因素及多电子原子的能级图。
2;掌握核外电子排布的三个原则:○1能量最低原则——多电子原子在基态时,核外电子尽可能分布到能量最低的院子轨道。
○2Pauli 原则——在同一原子中没有四个量子数完全相同的电子,或者说是在同一个原子中没有运动状态完全相同的电子。
○3Hund 原则——电子分布到能量简并的原子轨道时,优先以自旋相同的方式分别占据不同的轨道。
3:学会利用电子排布的三原则进行第五节:元素周期表认识元素的周期、元素的族和元素的分区,会看元素周期表。
第六节:元素基本性质的周期性掌握元素基本性质的四个概念及周期性变化1:原子半径——○1从左向右,随着核电荷的增加,原子核对外层电子的吸引力也增加,使原子半径逐渐减小;○2随着核外电子数的增加,电子间的相互斥力也增强,使得原子半径增加。
但是,由于增加的电子不足以完全屏蔽增加的核电荷,因此从左向右有效核电荷逐渐增加,原子半径逐渐减小。
2:电离能——从左向右随着核电荷数的增多和原子半径的减小,原子核对外层电子的引力增大,电离能呈递增趋势。