改进五步碘量法测定二氧化氯含量的研究
- 格式:pdf
- 大小:85.68 KB
- 文档页数:3

二氧化氯含量和纯度的测定方法1 紫外可见分光光度法1.1 范围本方法规定了消毒剂中二氧化氯的测定方法—紫外可见分光光度法。
本方法适合于含量在10mg/L~ 250mg/L二氧化氯的测定,高浓度消毒剂可稀释后测定。
本方法最低检出浓度为10mg/L。
1.2 原理使用石英比色皿,采用紫外可见分光光度计在190nm~600nm 波长范围内扫描,观察二氧化氯水溶液特征吸收峰,二氧化氯的最大吸收峰在360nm 处,可作为定性依据。
但氯气在此也有弱吸收,产生干扰。
应采用二氧化氯水溶液在430nm 处的吸收,吸光度与二氧化氯含量成正比,且氯气、CI02- CI03- Cl0在此无吸收,可作为定量依据。
1.3 试剂分析中所用试剂均为分析纯,用水为二次蒸馏水。
1.3.1 二氧化氯标准贮备溶液:亚氯酸钠溶液与稀硫酸反应,可产生二氧化氯。
氯等杂质通过亚氯酸钠溶液除去。
用恒定的空气流将所产生的二氧二氧化氯溶液制备方法(见图A1):在A瓶(洗气瓶)中放入300mL水,A瓶封口上有二根玻璃管,一根玻璃管(L1)下端插至近瓶底,上端与空气压缩机相接,另一根玻璃管(L2)下端口离开液面20 mm〜30mm,其另一端插入B瓶底部。
B瓶为高强度硼硅玻璃瓶,滴液漏斗(E),下端伸至液面下,玻璃管(L3)下端离开液面20 mm〜30mm,另一端插入C瓶底部。
溶解10g亚氯酸钠于750mL水内并倒入B 瓶中,在分液漏斗中装有20mL硫酸溶液(1+9, V/V)。
C瓶结构同A瓶一样,瓶内装有亚氯酸钠饱和溶液。
玻璃管(L4)插入D瓶底部,D瓶为2升硼硅玻璃收集瓶,瓶中装有1500mL水,用以吸收所发生的二氧化氯,余气由排气管排出。
D瓶上的另一根玻璃管(L5)下端离开液面20 mm〜30mm,上端与环境空气相通而作为排气管,尾气由排气管排出。
整套装置启动空气压缩机,使适量空气均匀通过整个装置。
每隔5min 由分液漏斗加入5mL硫酸溶液,在全部加完硫酸溶液后,空气流要持续30min。


咨询回答:(一)二氧化氯含量测定方法目前国内外有关二氧化氯(以下均简称为“ClO2”)含量测定方法的研究及应用种类较多,如碘量法、电流滴定法、紫线一分光光度、色谱法……等,但国内应用较多的仍然以碘量法及改进碘量法为主,如美国《水及废水检验标准方法》,丙二酸碘量法,五步碘量法,三步碘量法等。
现将碘量法简介如下:1、一般碘量法:是国际早期根据美国《水及废水检验标准方法》规定作为二氧化氯有效含量测定方法,其操作方法与有效氯测定方法完全相同,只是在是在计算时,将有效氯计算系数换成ClO2系数而已,因此该法所测量的是Cl2、ClO2、ClO2-、-……等各种成分氧化能力的总和,不能证明其产品真正ClO2含量。
ClO32、丙二酸碘量法:是卫生部《消毒技术规范》2001年版规定,目的是将ClO2样品中的Cl2用丙二酸掩蔽,消除Cl2对ClO2有效含量测定时的干扰,然后用碘量法进行测定,其结果ClO2含量中仍为ClO2、ClO2-、ClO3-三种成分的总和,也不能完全证明ClO2真正含量。
3、五步碘量法:是卫生部《消毒技术规范》2002年修订版规定法,也是目前国际公认及通用的一种方法,其原理是根据ClO2产出的ClO2、Cl2、ClO2-、ClO3-等成分在不同酸碱条件下形成不同状态而设计的一种方法,例如字PH=7时,有1/5 ClO2及ClO2—存在,而在PH=2-3时,ClO2及Cl2则可完全转为C l-状态存在。
ClO2溶液中的ClO2可用高纯氮气或空气可以完全吹脱等原理进行的,因此通过此法可将产品中的ClO2、Cl2、ClO2-、ClO3-完全分开,所测结果才能真正反映ClO2实际含量。
(其操作方法请参考卫生部《消毒技术规范》2002版)但经近几年各地实际应用经验有以下几点操作注意事项:A.工业ClO2产品的ClO2溶液中,除ClO2外,常伴有一定数量的Cl2,是难以完全避免的。
因活化时,多采用过量酸而引起的,否则不能迅速完全活化。


碘量法测定二氧化氯1.1测定原理稳定性二氧化氯(ClO2)在酸性条件下可氧化碘化钾,使其释放出碘。
以标准硫代硫酸钠溶液滴定反应析出得碘,根据硫代硫酸钠得用量,计算出溶液中ClO2的含量。
2 ClO2+10KI+8HCl →10K Cl+5I2+4H2O5 I2+10Na2S2O3→10NaI+5NaS4O61.2主要试剂及器材1.2.1试剂:0.1mol/L硫代硫酸钠标准溶液6%碘化钾溶液0.5mol/L盐酸溶液0.5%淀粉指示液1.2.2器材:250毫升碘量瓶50毫升量筒2毫升移液管50毫升滴定管1.3测定方法以2ml移液管准确移取样品2ml,置于250ml碘量瓶中,加50ml的0.5mol/L HCl溶液和50ml的6%碘化钾溶液,塞紧瓶盖,振摇均匀后,于暗处避光静置5分钟使反应完全,此时溶液呈黄色,然后打开瓶塞,用少量蒸馏水冲洗瓶塞及瓶壁,立即用0.1 mol/L硫代硫酸钠标准溶液滴定,至溶液呈浅黄色时,加0.5%淀粉指示液10滴,继续滴定至蓝色消失即为终点。
将滴定结果用空白实验校正。
每1ml硫代硫酸钠标准溶液(0.1mol/L)相当于13.49mg的ClO2。
1.4计算公式ClO2(w/v)=[m(V1-V2)*0.01349/V]*1000000式中:M——硫代硫酸钠克分子浓度V1——样品消耗的硫代硫酸钠的毫升数V2——空白实验消耗的硫代硫酸钠的毫升数V——取样量(ml)资料源自:/forum.php?mod=misc&action=attachcredit&aid=122075&formhash=d91b572d/thread-173748-1-1.html End。

二氧化氯含量检测方法文章一、碘量法珠化99——卫生部《消毒技术规范》( 1999.11)第三版1. 配制 2mol/L 硫酸, 10% 碘化钾, 0.5% 淀粉溶液及 10% 丙二酸溶液( 10g 丙二酸加无离子水溶解成 100ml )。
配制并标定 0.05mol/L 硫代硫酸钠标准溶液。
2. 取二氧化氯样液 1.0ml( 若预计其含量 >1.5% ,需经 50ml 容量瓶稀释后取样 ) 。
置于含 100ml 无离子水的碘量瓶中,加 10% 丙二酸溶液 2ml ,摇匀。
静置反应 2min 后,加 2mol/L 硫酸 10ml , 10% 碘化钾溶液 10ml 。
盖上盖并振摇混匀后加蒸馏水数滴于碘量瓶盖缘,置暗处 5min 。
打开盖,让盖缘蒸馏水流入瓶内。
用硫代硫酸钠标准溶液(装入 25ml 滴定管中)滴定游离碘,边滴边摇匀。
待溶液呈淡黄色时加入 0.5% 淀粉溶液 10 滴,溶液立即变蓝色。
继续滴定至蓝色消失,记录用去的硫代硫酸钠溶液总量。
重复测 3 次,取 3 次平均值进行以下计算。
3. 由于 1mol/L 硫代硫酸钠溶液 1ml 相当于 13.49mg 二氧化氯,故可按下式计算二氧化氯含量:二氧化氯含量( mg/L )=M × V × 13.49/W ×1000[M 与 V 分别为硫代硫酸钠标准溶液的溶液浓度( mol/L )与滴定中用去的毫升数; W 为碘量瓶中所含二氧化氯样液毫升数。
]广东番禺珠江化工研究所广州九九消毒剂有限公司文章二、二氧化氯(ClO2) 含量的测定--五步碘量法来源:本站原创作者:佚名发布时间:2009-08-13 查看次数:638第一法:五步碘量法(1) 制备无氯二次蒸馏水(蒸馏水中加入亚硫酸钠,将余氯还原为氯离子,并以DPD检查不显色,再进行蒸馏,即得)。
配制并标定0.1mol/L硫代硫酸钠滴定液 (见 2.2.1.3.1)。
配制并标定0.01mol/L硫代硫酸钠滴定液(临用时现配)。

改进五步碘量法测定二氧化氯含量的研究陈路瑶林立旺黄育红(福建省产生预防控制中心,福州 350001)提要: 在实验室用“五步碘量法”测定两种二氧化氯产品含量,来了解影响该方法测定准确性的因素并进行改进。
结果,按规范所示方法(方法1)进行测定,消毒剂A中二氧化氯含量为L,消毒剂B中二氧化氯含量为L。
对方法1的反应液的pH值进行适当调节控制(方法2)后再测定,则消毒剂A中二氧化氯含量为L,消毒剂B中二氧化氯含量为L。
显示方法1与方法2测定结果差异较大。
说明五步法测定过程中根据不同产品pH值作适当调节,使pH值均能接近7,才能保持二氧化氯最佳反应状态,所测得的二氧化氯含量比较接近实际。
关键词: 二氧化氯;含量测定;五步碘量法;中图分类号:文献标识码:B现用的化学法和电解法工艺生产的二氧化氯产品中均含有二氧化氯(ClO2)、亚氯酸根(ClO2—)、氯(Cl2)和氯酸根(ClO3—)等成分。
过去,二氧化氯含量测定方法一直采用第三版《消毒技术规范》规定的丙二酸碘量法[1],由于其特异性方面的原因,对上述成分区分测定比较困难。
因此,2002年版《消毒技术规范》规定用五步碘量法测定二氧化氯含量。
根据这种方法原理,应可以分别测定出二氧化氯消毒剂中所含的ClO2、ClO2—、Cl2、ClO3—的含量,但经实际应用发现该五步法尚有不完善之处,使得测定结果不稳定。
为此,我们对“五步碘量法”某些操作环节进行改进,并在实验室对两种二氧化氯产品进行了测定比较。
现将结果报告如下。
1 方法试验以两种品牌二氧化氯消毒剂为对象,二氧化氯消毒剂A以盐酸为激活剂,溶液pH 值为;二氧化氯消毒剂B以柠檬酸为激活剂,溶液pH值为。
五步碘量法[2](方法1)1.2.1 测定步骤::①在500ml碘量瓶中加200ml蒸馏水、1ml磷酸盐缓冲溶液,加入二氧化氯溶液,再加入10ml碘化钾溶液混匀。
用L硫代硫酸钠标准液滴定,记录读数为A。
②在上述滴定出A值的溶液中再加入L盐酸,并放置暗处5min。

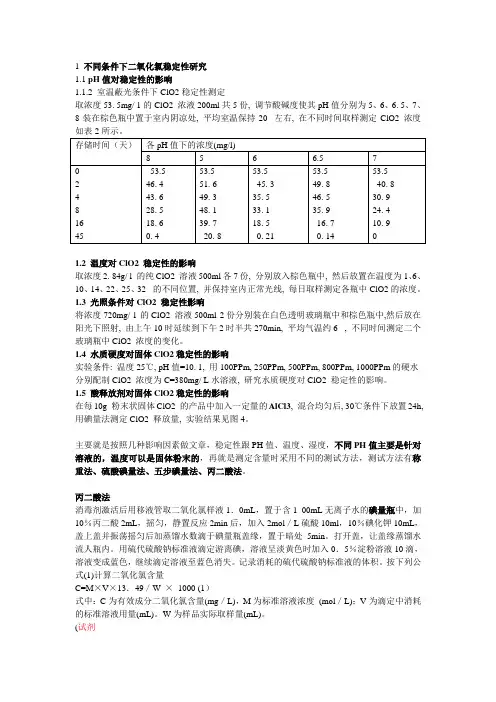
1 不同条件下二氧化氯稳定性研究1.1 pH值对稳定性的影响1.1.2 室温蔽光条件下ClO2稳定性测定取浓度53. 5mg/ 1的ClO2 浓液200ml共5份, 调节酸碱度使其pH值分别为5、6、6. 5、7、8装在棕色瓶中置于室内阴凉处, 平均室温保持20 左右, 在不同时间取样测定ClO2 浓度如表2所示。
存储时间(天)各pH值下的浓度(mg/l)8 5 6 6.5 70 2 4 8 16 4553.546. 443. 628. 518. 60. 453.551. 649. 348. 139. 720. 853.545. 335. 533. 118. 50. 2153.549. 846. 535. 916. 70. 1453.540. 830. 924. 410. 91.2 温度对ClO2 稳定性的影响取浓度2. 84g/ l 的纯ClO2 溶液500ml各7份, 分别放入棕色瓶中, 然后放置在温度为1、6、10、14、22、25、32 的不同位置, 并保持室内正常光线, 每日取样测定各瓶中ClO2的浓度。
1.3 光照条件对ClO2 稳定性影响将浓度720mg/ l 的ClO2 溶液500ml 2份分别装在白色透明玻璃瓶中和棕色瓶中,然后放在阳光下照射, 由上午10时延续到下午2时半共270min, 平均气温约6 , 不同时间测定二个玻璃瓶中ClO2 浓度的变化。
1.4 水质硬度对固体ClO2稳定性的影响实验条件: 温度25℃, pH值=10. 1, 用100PPm, 250PPm, 500PPm, 800PPm, 1000PPm的硬水分别配制ClO2 浓度为C=380mg/ L水溶液, 研究水质硬度对ClO2 稳定性的影响。
1.5 酸释放剂对固体ClO2稳定性的影响在每10g 粉末状固体ClO2 的产品中加入一定量的AlCl3, 混合均匀后, 30℃条件下放置24h,用碘量法测定ClO2 释放量, 实验结果见图4。


二氧化氯稳定性研究实验方法-丙二酸法,五步碘量法1 不同条件下二氧化氯稳定性研究1.1 pH值对稳定性的影响1.1.2 室温蔽光条件下ClO2稳定性测定取浓度53. 5mg/ 1的ClO2 浓液200ml共5份, 调节酸碱度使其pH值分别为5、6、6. 5、7、8装在棕色瓶中置于室内阴凉处, 平均室温保持20??左右, 在不同时间取样测定ClO2 浓度如表2所示。
1.2 温度对ClO2 稳定性的影响取浓度2. 84g/ l 的纯ClO2 溶液500ml各7份, 分别放入棕色瓶中, 然后放置在温度为1、6、10、14、22、25、32??的不同位置, 并保持室内正常光线, 每日取样测定各瓶中ClO2的浓度。
1.3 光照条件对ClO2 稳定性影响将浓度720mg/ l 的ClO2 溶液500ml 2份分别装在白色透明玻璃瓶中和棕色瓶中,然后放在阳光下照射, 由上午10时延续到下午2时半共270min, 平均气温约6??, 不同时间测定二个玻璃瓶中ClO2 浓度的变化。
1.4 水质硬度对固体ClO2稳定性的影响实验条件: 温度25℃, pH值=10. 1, 用100PPm, 250PPm, 500PPm,800PPm, 1000PPm的硬水分别配制ClO2 浓度为C=380mg/ L水溶液, 研究水质硬度对ClO2 稳定性的影响。
1.5 酸释放剂对固体ClO2稳定性的影响在每10g 粉末状固体ClO2 的产品中加入一定量的AlCl3, 混合均匀后, 30℃条件下放置24h,用碘量法测定ClO2 释放量, 实验结果见图4。
主要就是按照几种影响因素做文章,稳定性跟PH值、温度、湿度,不同PH值主要是针对溶液的,温度可以是固体粉末的,再就是测定含量时采用不同的测试方法,测试方法有称重法、硫酸碘量法、五步碘量法、丙二酸法。
丙二酸法消毒剂激活后用移液管取二氧化氯样液1.0mL,置于含1 00mL无离子水的碘量瓶中,加10%丙二酸2mL,摇匀,静置反应2min后,加入2mol /L硫酸10ml,10%碘化钾10mL,盖上盖并振荡摇匀后加蒸馏水数滴于碘量瓶盖缘,置于暗处5min。
五步碘量法原理及步骤1.反应原理该法是利用I—还原各种氯化物的程度随pH值的不同而变化,用硫代硫酸钠标准溶液滴定游离I2,以区分出ClO2、ClO2—、Cl2、ClO3—,反应条件及反应式如下[3]:pH≤7时,Cl2+2I—=I2+2Cl—①pH=7时,2ClO2+2I—=I2+2ClO2—②pH≤2时,2ClO2+10I—+8H+=5I2+2Cl—+4H2O ③pH≤2时,ClO2—+4I—+4H+=2I2+Cl—+2H2O ④pH≤0.1时,ClO3—+6I—+6H+=3I2+Cl—+3H2O ⑤ClO2还原成Cl—需要转移五个电子,这一过程分两步完成。
第一步ClO2转移1个电子,生成ClO2—,如果反应条件控制在pH=7,则反应到此停止,如②所示。
它相当于1/5的ClO2被还原。
如果将pH调至2,则反应继续进行,转移另外4个电子,将ClO2—完全还原成Cl—,如④所示。
2.试剂和仪器2.1 20%碘化钾溶液:称取50g碘化钾溶于450ml蒸馏水中,储于棕色瓶中,避光保存于冰箱中,若溶液变黄需重新配制。
2.2 0.5%淀粉溶液:称取可溶性淀粉0.5g于小烧杯中,加少许蒸馏水成糊状,加入到100ml正在沸腾的蒸馏水中,煮沸几分钟,取下放冷。
两周后重配。
2.3 浓盐酸2.4 1+1盐酸2.5 饱和磷酸氢二钠溶液2.6 pH=7磷酸盐缓冲溶液:称取25.4g无水磷酸二氢钾和86.0g十二水磷酸氢二钠,溶于800ml蒸馏水中,用水稀释到1000ml。
2.6 10%溴化钾溶液:称取10g溴化钾于90ml蒸馏水中,储于棕色瓶中,每周重配一次。
2.7 0.01mol/L硫代硫酸钠标准滴定溶液:用水稀释0.1mol/L硫代硫酸钠标准滴定溶液。
2.8 纯氮气钢瓶3.采样3.1应用清洁干燥的棕色广口瓶采集样品。
采样时,将发生器采样口的管子直接插到瓶底,打开采样口阀门,直至样品溶液溢出达采样瓶体积的一倍时,关闭阀门,立即盖上瓶盖。
五步碘量法测定消毒剂中二氧化氯的方法改进方赤光;王岙;黄新宇;张冠英;杨明远;姜楠【期刊名称】《中国消毒学杂志》【年(卷),期】2007(24)6【摘要】目的改进五步碘量法对二氧化氯测定方法,以便更准确地检测消毒剂中二氧化氯含量。
方法采用调整测定试液pH值和延长吹氮气时间的措施进行了实际样品检测。
结果改进五步碘量法测定中,样品溶液中氧化性物质的总浓度在1000-3000mg/L,取样量为2-5ml为佳。
测定不同样品需要将磷酸盐缓冲溶液pH值调节到7.0,pH值随缓冲液加入量的变化而变化,达到一定量后pH值趋于稳定。
同一种二氧化氯样品的不同次取样,吹氮时将样品溶液吹至无色,测得二氧化氯含量存在差别;吹至无色后再继续吹不同时间,测得二氧化氯量基本一致,在吹至无色后,再继续吹30min即可。
结论在改进五步碘量法操作中,采用控制样品液氧化物总浓度,适当调整试液酸碱度和延长吹氮气时间,可保证二氧化氯测定浓度准确性。
【总页数】3页(P507-509)【关键词】碘量法;二氧化氯;含量测定;酸碱度【作者】方赤光;王岙;黄新宇;张冠英;杨明远;姜楠【作者单位】吉林省卫生监测检验中心【正文语种】中文【中图分类】R187.2【相关文献】1.碘量法测定饮用水中二氧化氯方法的改进 [J], 张长红;陈云峰;陈维楼2.封闭溶样一碘量法测定金精矿和氰渣中金方法的改进 [J], 袁敬华;邵江泽;杨巧维3.碘量法测定铜阳极泥中铜的方法改进 [J], 张月琳;刘芳美;李文英;赖秋祥4.碘量法测定含氯和含碘消毒剂的有关技术问题 [J], 魏青;徐秀英5.改进五步碘量法测定二氧化氯含量的研究 [J], 陈路瑶;林立旺;黄育红因版权原因,仅展示原文概要,查看原文内容请购买。
二氧化氯含量和纯度的测定方法二氧化氯含量和纯度的测定方法1紫外可见分光光度法1.1范围本方法规定了消毒剂中二氧化氯的测定方法—紫外可见分光光度法。
本方法适合于含量在10mg/L~250mg/L二氧化氯的测定,高浓度消毒剂可稀释后测定。
本方法最低检出浓度为10mg/L。
1.2原理使用石英比色皿,采用紫外可见分光光度计在190nm~600nm波长范围内扫描,观察二氧化氯水溶液特征吸收峰,二氧化氯的最大吸收峰在360nm处,可作为定性依据。
但氯气在此也有弱吸收,产生干扰。
应采用二氧化氯水溶液在430nm处的吸收,吸光度与二氧化氯含量成正比,且氯气、ClO2-、ClO3-、ClO-在此无吸收,可作为定量依据。
1.3试剂分析中所用试剂均为分析纯,用水为二次蒸馏水。
1.3.1二氧化氯标准贮备溶液:亚氯酸钠溶液与稀硫酸反应,可产生二氧化氯。
氯等杂质通过亚氯酸钠溶液除去。
用恒定的空气流将所产生的二氧化氯带出,并通入纯水中配成二氧化氯标准贮备溶液,在每次使用前,其浓度以碘量法测定。
二氧化氯溶液应避光、密闭,并冷藏保存。
二氧化氯溶液制备方法(见图A1):在A瓶(洗气瓶)中放入300mL水,A瓶封口上有二根玻璃管,一根玻璃管(L1)下端插至近瓶底,上端与空气压缩机相接,另一根玻璃管(L2)下端口离开液面20 mm~30mm,其另一端插入B瓶底部。
B瓶为高强度硼硅玻璃瓶,滴液漏斗(E),下端伸至液面下,玻璃管(L3)下端离开液面20 mm~30mm,另一端插入C瓶底部。
溶解10g 亚氯酸钠于750mL水内并倒入B瓶中,在分液漏斗中装有20mL硫酸溶液(1+9,V/V)。
C瓶结构同A瓶一样,瓶内装有亚氯酸钠饱和溶液。
玻璃管(L4)插入D瓶底部,D 瓶为2升硼硅玻璃收集瓶,瓶中装有1500mL水,用以吸收所发生的二氧化氯,余气由排气管排出。
D瓶上的另一根玻璃管(L5)下端离开液面20 mm~30mm,上端与环境空气相通而作为排气管,尾气由排气管排出。
两种方法测定消毒剂中二氧化氯含量的比较
刘吉起;李艳芬;李发生
【期刊名称】《实用预防医学》
【年(卷),期】2004(11)5
【摘要】目的比较二氧化氯消毒剂的两种含量测定方法 ,为二氧化氯含量测定方法的标准化提供参考。
方法采用丙二酸 -碘量法和五步碘量法。
结果两种试验方法测定的结果差别很大 ,pH值越低 ,两种方法测定的结果越接近。
且方法的精密度也不同 ,两种方法的相对标准偏差分别为 0 .0 9996%~ 0 .2 5 0 3 %和
0 .73 3 6%~ 14 .80 %。
结论作为消毒剂中二氧化氯含量测定的标准方法 ,这两种方法都还有待于进一步完善。
【总页数】2页(P914-915)
【关键词】二氧化氯;含量测定;丙二酸-碘量法;五步碘量法
【作者】刘吉起;李艳芬;李发生
【作者单位】河南省卫生防疫站
【正文语种】中文
【中图分类】R187.1
【相关文献】
1.消毒剂中二氧化氯含量的两种测定方法的比较 [J], 许浩
2.低含量甲醛测定中两种测定方法之比较 [J], 李敏
3.6种二氧化氯两种含量测定方法结果的比较 [J], 赵伟霞;罗嵩
4.两种方法检测消毒剂中醋酸氯己定含量的不确定度比较 [J], 岳丽君;帖金凤;王长德;姚楚水
因版权原因,仅展示原文概要,查看原文内容请购买。