中国药典和美国药典中的细菌内毒素检测法的不同点比较
- 格式:docx
- 大小:10.25 KB
- 文档页数:5

各国药典细菌内毒素检查法的比较1968年美国科学家Dr. Levin和Bang建立了鲎试验法。
此后世界各国对鲎试剂的生产和应用得以迅速发展。
1980年美国药典20版首先收载了细菌内毒素检查法。
随后,英国药典、日本药局方、中国药典等也相继收载了该方法。
本文主要对中国药典1995年版与英国药典1995年增补本、美国药典23版和日本药局方13版等的细菌内毒素检查法进行了比较。
1 检验品种的比较中国药典1995年版二部共收载细菌内毒素检查品种12个,2000年版二部增至47个,而美国药典23版收载了471个品种进行细菌内毒素检查。
因此,我们需加紧对更多的品种进行细菌内毒素检查方法的研究,加快该法对药品检验的普及和推广工作,提高我国药品标准和检验水平。
2 检验方法的比较细菌内毒素试验的方法有凝胶法、浊度法、显色基质法、免疫学法等。
其中凝胶法多为限量检查法,浊度法和显色基质法为定量检查法,且后两种方法都属于分光光度法。
浊度法还可分为终点浊度法和动态浊度法;显色基质法也可分为终点显色基质法和动态显色基质法。
凝胶法是较为经典的方法,各国药典都有收载,而收载了细菌内毒素定量测定法的有美国药典、英国药典、欧洲药典和日本药局方等。
中国药典1995年版只收载了凝胶法,2000年版才涉及到定量测定法。
因此,我们还需要对细菌内毒素定量测定进行研究,需要有供定量测定用的标准品、仪器和试剂,以后逐步建立起我国的细菌内毒素定量测定方法。
3 细菌内毒素标准品各国药典均设置了细菌内毒素的标准品,其中中国药典、英国药典和美国药典还可采用根据标准品为基准进行标定的工作标准品或对照标准品。
除英国药典采用U为内毒素的单位外,其余各国药典都用EU为内毒素的单位。
美国药典和中国药典对内毒素标准品每一步稀释时的混匀时间作出了明确规定。
除中国药典外,其余各国药典规定了内毒素标准贮备液在冰箱里保存不得超过14d,且用前应在旋涡混合器上充分混合至少3min。

.CP(2015版)1143EP(8.0)2.6.14USP(36)85JP(16)6.06定义CP(2015) EP(8.0) USP(36) JP(16)本法系利用鲎试剂来检测或量化由革兰阴性菌产生的细菌内素素本法利用鲎试剂(从美洲鲎或中华鲎——阿米巴细胞溶解产物制备而来)检测由革兰氏阴性菌产生的细菌内毒素或对内毒素进行定量检查和定量供试品内毒素的方法。
本法利用鲎(美洲鲎或中华鲎)阿米巴细胞溶解产物制备的用于内毒素检测的鲎试剂( LAL)检定内毒素本法利用鲎试剂(从美洲鲎或中华鲎——阿米巴细胞溶解产物制备而来)检测由革兰氏阴性菌产生的细菌内毒素或对内毒素进行定量方法CP(2015) EP(8.0)一、凝胶法二、光度测定法1、浊度法2、显色基质法方法 A:凝胶法:限度试验方法 B:凝胶法:定量试验方法 C:动态浊度法方法 D:终点显色法方法 F:终点浊度法.USP(36) JP(16)仪器CP(2015) EP(8.0) USP(36) JP(16)一、凝胶法二、光度测定法1、浊度法2、显色法一、凝胶法二、光度测定法1、浊度法2、显色法干热灭菌法(250℃, 30 分钟以上),塑料器具应无内毒素并且对试验无干扰干热灭菌法(250℃, 30 分钟以上),塑料器具应无内毒素并且对试验无干扰干热灭菌法(250℃, 30 分钟以上),塑料器具应无内毒素并且对试验无干扰干热灭菌法(250℃, 30 分钟以上),塑料器具应无内毒素并且对试验无干扰溶液制备CP(2015) EP(8.0)供试品溶液的制备某些供试品需进行复溶、稀释或在水性溶液中浸提制成供试品溶液。
必要时,可调节被测溶液( 或其稀释液)的pH值,一般供试品溶液和鲎试剂混合后溶液的pH 值在 6.0-8.0的范围内为宜,可使用适宜的酸、碱溶液或缓冲液调节pH 值。
酸或碱溶液须用细菌内毒素检査用水在已去除内毒素的容器中配制。
缓冲液必须经过验证不含内毒素和干扰因子。


鲎试剂-LAL,中国药典和美国药典的内毒素检测要求鲎试剂是从栖生于海洋的节肢动物“鲎”的兰色血液中提取变形细胞溶解物,经低温冷冻干燥而成的生物试剂,专用于细菌内毒素检测。
鲎试验法是国际上至今为止检测内毒素最好的方法,它简单﹑快速﹑灵敏﹑准确,因而被欧美药典及我国药典定为法定内毒素检查法,并已被世界各国所采用。
目前国际上销售的鲎试剂有两种,一种称美洲鲎试剂(Limulus Amebocyte Lysate),缩写为LAL,由美国生产;另一种称东方鲎鲎试剂(Tachypleus Amebocyte Lysate),缩写为TAL。
实验证明:美洲鲎试剂-LAL比东方鲎试剂LAL更纯洁,检测效果更好。
TAL检查内毒素有很多方法,目前应用最广泛的是凝胶法,此外还有动态浊度法﹑显色基质法,比色法等。
其用途有以下几方面:1. 药检:用于注射药品﹑放射性药物﹑生物制品﹑注射器及生产工艺流程中的内毒素检测;2. 临床:用于检测病人各种体液中的内毒素含量;3. 其他:用于检测水或食品中的内毒素含量。
2005年版中国药典《细菌内毒素检查法-鲎试剂法》(鲎试剂-LAL法)本法系利用鲎试剂来检测或量化由革兰阴性菌产生的细菌内毒素,以判断供试品中细菌内毒素的限量是否符合规定的一种方法。
细菌内毒素检查包括两种方法,即凝胶法和光度测定法,后者包括浊度法和显色基质法。
供试品检测时,可使用其中任何一种方法进行试验。
当测定结果有争议时,除另有规定外,以凝胶法结果为准。
细菌内毒素的量用内毒素单位(EU)表示。
细菌内毒素国家标准品系自大肠杆菌提取精制而成,用于标定、复核、仲裁鲎试剂灵敏度和标定细菌内毒素工作标准品的效价。
细菌内毒素工作标准品系以细菌内毒素国家标准品为基准标定其效价,用于试验中鲎试剂灵敏度复核、干扰试验及设置的各种阳性对照。
凝胶法细菌内毒素检查用水系指内毒素含量小于0.015EU/ml的灭菌注射用水。
定量测定用的细菌内毒素检查用水,其内毒素的含量应小于0.005EU/ml。




美国药典、中国药典、英国药典热原检测方法的比较作者:方菁嶷梁羽李新寅来源:《中国实用医药》2014年第29期【摘要】目的比较美国药典、中国药典、英国药典热原检测方法的差异。
方法用三种药典热原检测方法检测同一种生理盐水,比较其方法差异。
结果三种方法在动物选择、基础体温测定、结果判定方面都有差异。
结论医学卫生检测应用中要根据产品特点和客户要求合理选择检测方法,结果不能相互引用。
【关键词】热原;比较;药典Comparison between methods of pyrogen test in United States Pharmacopoeia, Chinese Pharmacopoeia and British Pharmacopoeia FANG Jing-yi, LIANG Yu, LI Xin-yin. Medical college of Suzhou University, Suzhou 215123, China【Abstract】 Objective To compare the differences between the methods of pyrogen test in United States Pharmacopoeia, Chinese Pharmacopoeia and British Pharmacopoeia. Methods Three different pharmacopoeia pyrogen tests were applied in the detection of the same normal saline respectively. The differences of those methods were compared. Results There were differences in animal selection, initial temperature measurement and result determination between the three methods. Conclusion Test method in medical detection should be chosen according to the characteristic of the product and the requirements of the clients. The result of one method cannot be used in that of the other methods.【Key words】 Pyrogen; Comparison; Pharmacopoeia热原(pyrogen)系指能引起恒温动物体温异常升高的致热物质。

CP(2015 版)1143 EP (8.0) 2.6.14 USP( 36) 85JP( 16) 6.06仅在最低浓度的标准溶液的所有平行管的检查结果均为阴性的情况下,试验方为有效。
反应终点浓度指系列递减的内毒素浓度中最后一个呈阳性结果的浓度。
将终点浓度取对数,计算它们的平均值,再将平均值的结果取反对数,最后的表达式如下:终点浓度的几何平均值=lg-1(工e/f)工e =所用系列溶液的终点浓度的对数值的和f=平行管的数量反应终点的浓度的几何平均值即为鲎试剂灵敏度的测量值(IU/ml )。
当终点浓度的几何平均值在0.5入至2.0入之间时,可判定受试鲎试剂的标示灵敏度为入,可用于内毒素的检查。
(ii )干扰因素试验开展该项实验的目的是检查供试品溶液中反应的增强因素或阻抑因素的存在。
按表2.6.14.-1 制备溶液A B、C D。
供试品的稀释度不得超过MVD且供试品溶液不能检查出内毒素,具体操作见(1)预备试验的(i )鲎试剂标示灵敏度的复核试验项。
表 2614-1人=经检查无内毒素的溶液工e为所用系列溶液的终点浓度的对数值的和;f为平行管的数量。
反应终点的几何平均值即为LAL试剂的标示灵敏度(单位为EU/mL。
当终点浓度的几何平均值在0.5入至2.0入之间,可判定受试 LAL试剂的标示灵敏度为入。
凝胶法的干扰因素试验一一按表1制备溶液A B C D,使用的供试品溶液应为未检验出内毒素且不超过MVD勺溶液,按LAL试剂灵敏度复核试验项下操作。
用检查法给出的公式计算溶液B、C的反应终点的几何平均值。
示灵敏度范围内时,试验方有效。
计算溶液B的鲎试剂灵敏度,如果值在 [0.5入,2.0入]间,可判定供试品溶液在该浓度下无干扰作用;反之则判定供试品溶液对试验能形成干扰。
若供试品溶液在小于 MVD的稀释倍数下对试验有干扰,应将供试品溶液进行不超过MVD勺进一步稀释,再重复干扰试验。
使用灵敏度更高如溶液的平行管的检查结果均为阳性时:- 如供试品的稀释倍数为 MVD供试品不符合规定。

四国药典有关药品微生物限度标准的比较[日期:2005-2-21] 来源:作者:胡敏[1] 胡昌勤* 刘文英2 [字体:大中小]四国药典有关药品微生物限度标准的比较微生物限度规定的作用,是为药品生产提供一个标准或指导,以确保药品使用的安全。
各国药典标准分为强制性的和非强制性的可达到的限度标准,这些指标正确、有效地规范了药品生产、检定和监督的程序。
药品要能反映不引起生物降解物和没有药源性污染的微生物存在是必要的,严格控制条件致病菌及致病菌。
一、CP、USP、BP、JP的微生物限度要求的特点及其发展趋势⒈各国药典收载微生物限度检查法的时间不同(见表1)表1 各国药典收载微生物限度检查法的时间各国药典CP USP BP JP收载微生物限度检查法的时间1995版* 1975(19)1973---方法1988---品种**第十三改正版****1978年颁布第一个药品卫生标准;1986年颁布了修改的药品卫生标准;1989年下发药品卫生标准补充规定和说明1995年版中国药典收载微生物限度检查法(标准仅为少数剂型)**品种98版43个,其中原料药品种38个,制剂品种仅5个。
***仅有6个品种。
⒉品种不断扩大USP版本(年代)19(1975)22(1990)23(1995)24(2000)微生物限度品种数35 140 150 217**217种包括原料药品种72个(占1/3);制剂品种(占2/3)。
⒊活菌数要求各有特点活菌数(个/1g或1ml)CP BP JP USP需气菌102~3×104 102~107 102~103 10~104真菌0~102 102~105 5×10~5×102 10~103⒋控制菌的要求各有特点CP BP JP USP大肠杆菌+ b + b + b + a沙门菌+ b +a + b + a铜绿色假单胞菌+b + b + b +a金黄色葡萄球菌+b + b + b + a破伤风杆菌+ b梭菌+c肠道菌及其他某些革兰阴性杆菌+ c支原体+分枝杆菌+病毒的其他因子+活螨+ da 10g或10ml样品不得检出。
2020年药典中细菌内毒素检测方法和2015版的区别2020年药典中细菌内毒素检测方法和2015版的区别一、引言细菌内毒素(bacterial endotoxins),是由细菌细胞外膜的脂多糖部分组成,具有很强的生物活性和致病性。
作为一种重要的检测指标,细菌内毒素检测在药品生产过程中起着至关重要的作用,有助于确保制药企业生产出高质量和无致病性的药品。
药典中关于细菌内毒素检测的方法一直在不断发展和完善,特别是2020年版药典中实施的细菌内毒素检测方法与2015年版相比有了一些改变和进步。
本文将比较2020年版药典中细菌内毒素检测方法与2015年版的区别。
二、方法2.1 2020年版药典中的细菌内毒素检测方法2020年版药典中,细菌内毒素检测方法主要有两种,一种是传统的大鼠致敏试验(LAL Test),另一种是光学密度试验(OET Test)。
在传统的大鼠致敏试验中,将药物样品与内毒素标准溶液混合,注射到大鼠体内,观察大鼠是否产生过敏反应。
这种方法虽然在很长一段时间内被广泛应用,但存在一些缺点,如需要大量的动物实验、耗时耗力、无法鉴定具体细菌种类等。
而在光学密度试验中,利用内毒素与金纳米颗粒的相互作用,通过测量金纳米颗粒溶液的光学密度来检测内毒素的存在。
这种方法具有操作简单、灵敏度高、速度快等优点,被认为是一种具有潜力的替代方法。
2.2 2015年版药典中的细菌内毒素检测方法2015年版药典中,细菌内毒素检测方法主要是基于大鼠致敏试验。
相对于2020年版药典,2015年版药典中的细菌内毒素检测方法在方法选择上相对单一,主要依赖于大鼠体内的反应,缺乏相应的替代方法。
三、讨论细菌内毒素检测方法的改变主要体现在2020年药典中新增的光学密度试验。
相比于传统的大鼠致敏试验,光学密度试验具有更多的优势。
光学密度试验操作简单,无需使用大量的动物实验,符合当前推崇的3R原则:减少(reduce)、替代(replace)和改进(refine)动物实验。
《中国药典》、《美国药典》和《英国药典》注射用氢化可的松琥珀酸钠质量控制标准与方法的比较张莹【摘要】本文讨论2010年版《中国药典》注射用氢化可的松琥珀酸钠新增内容,并与《美国药典》(35版)和《英国药典》(2010年版)比较,2010年版《中国药典》注射用氢化可的松琥珀酸钠较2005年版《中国药典》增加了红外鉴别及有关物质检查,对杂质和有害物质的控制进一步加强,以保证药品的质量.【期刊名称】《天津药学》【年(卷),期】2012(024)006【总页数】4页(P6-8,35)【关键词】药典;氢化可的松琥珀酸钠;标准;比较【作者】张莹【作者单位】天津市药品检验所,天津300070【正文语种】中文【中图分类】R927.11氢化可的松琥珀酸钠是肾上腺皮质激素类药,具有抗炎、抗过敏和抑制免疫等多种药理作用。
目前,注射用氢化可的松琥珀酸钠收载于《中国药典》2010年版[1]、《美国药典》35 版[2]和《英国药典》2010年版[3]中。
通过对三国药典的比较,对于进一步完善和提高我国药品质量标准具有指导意义,并指出下一步标准提高的方向。
1 2010年版《中国药典》与2005年版《中国药典》的比较1.1 性状外观描述同《中国药典》2005年版二部原质量标准[1],未做修订。
1.2 鉴别化学反应、高效液相色谱法及钠盐鉴别反应同《中国药典》2005年二部原质量标准,方法未做修订。
《中国药典》2010年版增加了红外光吸收图谱鉴别[2],标准规定样品的红外吸收图谱应与对照的图谱(光谱集994图)一致。
1.3 检查1.3.1 碱度、溶液的颜色、干燥失重、异常毒性、无菌及其他项目检查均同《中国药典》2005年二部原质量标准,方法未做修订。
1.3.2 有关物质《中国药典》2005年二部原质量标准未制订此项检查,只控制游离氢化可的松的限度。
由于氢化可的松琥珀酸钠在合成中主要产物为21-氢化可的松琥珀酸钠,但也不同程度地存在17-氢化可的松琥珀酸钠和游离氢化可的松以及未知的其他有关物质,为此,《中国药典》2010年版增加了有关物质检查,色谱条件采用含量测定项下的色谱条件,限度规定按外标法以峰面积计算游离氢化可的松不得过标示量的3.0%,其他单个杂质峰面积不得大于对照溶液主峰面积的1/3(1.0%),其他杂质峰面积的和不得大于对照溶液主峰面积(3.0%),该项目的增订可进一步控制药品的质量。
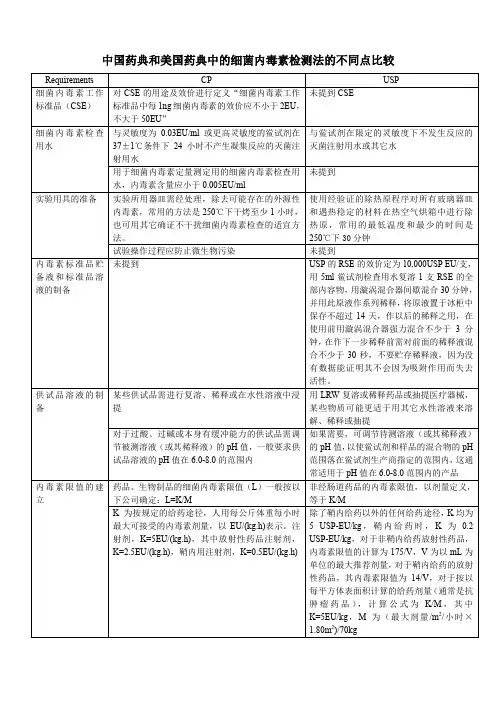
中国药典和美国药典中的细菌内毒素检测法的不同点比较1、细菌内毒素工作标准品(CSE)CP 对CSE的用途及效价进行定义“细菌内毒素工作标准品中每1ng细菌内毒素的效价应不小于2EU,不大于50EU”USP未提到CSE2、细菌内毒素检查用水CP :与灵敏度为0.03EU/ml或更高灵敏度的鲎试剂在37±1℃条件下24小时不产生凝集反应的灭菌注射用水;USP:与鲎试剂在限定的灵敏度下不发生反应的灭菌注射用水或其它水。
CP:用于细菌内毒素定量测定用的细菌内毒素检查用水,内毒素含量应小于0.005EU/ml。
USP:未提到。
3、实验用具的准备CP:实验所用器皿需经处理,除去可能存在的外源性内毒素,常用的方法是250℃下干烤至少1小时,也可用其它确证不干扰细菌内毒素检查的适宜方法。
USP:使用经验证的除热原程序对所有玻璃器皿和遇热稳定的材料在热空气烘箱中进行除热原,常用的最低温度和最少的时间是250℃下30分钟。
4、内毒素标准品贮备液和标准品溶液的制备CP:未提到USP:RSE的效价定为10,000USP EU/支,用5ml鲎试剂检查用水复溶1支RSE的全部内容物,用漩涡混合器间歇混合30分钟,并用此原液作系列稀释,将原液置于冰柜中保存不超过14天,作以后的稀释之用,在使用前用漩涡混合器强力混合不少于3分钟,在作下一步稀释前需对前面的稀释液混合不少于30秒,不要贮存稀释液,因为没有数据能证明其不会因为吸附作用而失去活性。
5、供试品溶液的制备CP:|某些供试品需进行复溶、稀释或在水性溶液中浸提用LRW复溶或稀释药品或抽提医疗器械,某些物质可能更适于用其它水性溶液来溶解、稀释或抽提。
对于过酸、过碱或本身有缓冲能力的供试品需调节被测溶液(或其稀释液)的pH值,一般要求供试品溶液的pH值在6.0-8.0的范围内。
USP:用LRW复溶或稀释药品或抽提医疗器械,某些物质可能更适于用其它水性溶液来溶解、稀释或抽提。
《美国药典》《欧洲药典》《日本药典》与《中国药典》中中药饮片微生物限度检查及标准的比较研究作者:范一灵李琼琼秦峰刘浩杨美成来源:《中国药房》2020年第22期摘要目的:比較《美国药典》43版(USP43)、《欧洲药典》10.0版(EP10.0)、《日本药典》17版(JP17)与《中国药典》2020年版(ChP2020)中中药饮片微生物限度检查方法及标准的差异,为我国中药饮片相关微生物标准的修订和完善提供参考。
方法:比较USP43、EP10.0、JP17和ChP2020在中药饮片的微生物计数法(包括抽样与取样、菌种和培养基选择、微生物和耐热菌计数等)、控制菌检查(包括样品前处理、增菌、分离、鉴定等)、微生物相关限度标准等方面的差异。
结果与结论:在中药饮片微生物的检查方法上,USP43、EP10.0、JP17都有各自独立的规定,ChP2020则新增了“通则1108”。
在检验项目上,除需氧菌总数、霉菌和酵母菌总数外,ChP2020与EP10.0规定了3种控制菌(耐胆盐革兰阴性菌、大肠埃希菌、沙门菌)的检查方法;在此基础上,JP17补充了金黄色葡萄球菌的检查方法;USP43增加了梭菌的检查方法,并最早提出不可接受微生物风险评估理念;ChP2020还新增了耐热菌计数方法。
在微生物限度标准上,USP 43对中药饮片的分类最为细致,要求较为严格且高于EP10.0、JP17;ChP2020仍未对中药饮片控制菌检查设立统一的限度标准。
虽然,ChP2020对“中药提取物及中药饮片的微生物限度标准”进行了修订,但相较于美国、欧洲和日本药典的规定还不完善。
建议根据我国中药饮片微生物污染和控制现状,逐步完善药典对中药相关产品的微生物检验和限度标准,合理细化相应产品的微生物限度水平。
关键词中药饮片;药典;微生物检查;限度标准;比较研究中图分类号 R921;R927.1 文献标志码 A 文章编号 1001-0408(2020)22-2695-06DOI 10.6039/j.issn.1001-0408.2020.22.02ABSTRACT; ;OBJECTIVE: To compare the difference of microbiological limit test and criteria of TCM decoction pieces among 43 edition of United States Pharmacopeia; (USP43),10.0 edition of European Pharmacopeia; (EP10.0), 17 edition of Japanese Pharmacopeia;(JP17) and 2020 edition of Chinese Pharmacopeia (ChP2020), and to provide refernce for the revision and improvement of microbiological standards for TCM decoction pieces in China. METHODS: The differences in the microbial enumeration tests method (including sampling and sample preparation, selection of bacteria and culture medium, count of microorganisms and heat-resistant bacteria, etc.), tests for specified microorganisms (including sample pretreatment,enrichment, separation and identification, etc.) and microbial related limit criteria were compared among USP43, EP10.0, JP17 and ChP2020. RESULTS & CONCLUSIONS: In terms of microbiological examination of TCM decoction pieces, USP43, EP10.0, JP17 had their own independent provisions. Chp2020 added “general rule 1108”. In terms of inspection items, in addition to the total aerobic bacteria count and total combined yeasts and molds count, ChP2020 and EP10.0 provided three methods for the inspection of control bacteria (bile-resistant Gram-negative bacteria, Escherichia coli, Salmonella). On the basis, JP17 supplemented Staphylococcus aureus test; However, USP43 added Clostridium test method and put forward the concept of objectionable microorganisms risk assessment; ChP2020 also added a new method for counting heat-resistant bacteria. In terms of microbial limit criteria, USP43 was the most detailed in the classification of TCM decoction pieces, which was more strict than EP10.0 and JP17; ChP2020 had not set up a unified limit for the inspection of control bacteria of TCM decoction pieces. ChP2020 revised the “microbial limit standard for TCM extracts and TCM decoction pieces”, but it was notperfect compared with the Pharmacopoeia of the United States, Europe and Japan. It is suggested that according to the current situation of microbial contamination and control of TCM decoction pieces, the microbial limit test and criteria of TCM related products in Pharmacopoeia should be gradually improved, and the microbial limit level of corresponding products should be reasonably refined.KEYWORDS; ;TCM decoction piece; Pharmacopeia; Microbial limit test; Limit criteria; Comparative study中药饮片是由中药材通过炮制加工而成的可直接用于中医临床的产品,其大多源自天然植物、动物或矿物,通常携带有大量微生物[1-2]。
药品GMP(Good Manufacturing Practice,良好生产规范)是确保药品质量和安全的国际标准,它涵盖了从原材料采购到生产制造、成品检验和质量控制等方方面面。
细菌内毒素检测标准在药品GMP中扮演着至关重要的角色,因为细菌内毒素是一种可能存在于药品中的有害物质,对人体健康造成严重危害。
本文将从深度和广度两方面探讨药品GMP中细菌内毒素检测标准的重要性、相关要求和实施方法。
一、药品GMP概述1.1 药品GMP的意义药品GMP是指针对药品生产过程中的所有环节,包括原辅料的采购和检验、药品生产和包装等,制定一系列的规范要求,目的是保证药品质量和安全性,保护人民群众的身体健康,维护国家药品市场秩序。
1.2 药品GMP的基本原则在GMP标准下,药品生产企业需要建立质量管理体系,包括生产工艺的严格控制、设备和环境的清洁与消毒、员工的培训和管理等,以确保每一批药品都能达到质量标准,不会对患者产生危害。
1.3 药品GMP的国内外认证体系国际上常见的药品GMP认证标准有FDA、EU GMP、WHO GMP等,国内也有CFDA发布的《药品GMP认证管理办法》。
药品生产企业需要依照相关标准进行认证,以取得原料药或制剂的GMP证书。
二、细菌内毒素检测标准在药品GMP中的重要性2.1 细菌内毒素的危害细菌内毒素是一种由细菌产生的有害物质,即便细菌已经被杀灭,细菌内毒素仍然存在,对人体造成危害。
在药品中,含有细菌内毒素的药物会引起副作用甚至危及患者生命。
2.2 国际标准对细菌内毒素的要求国际上对药品GMP的细菌内毒素检测标准有着明确要求,包括检测方法、检测限和检测频率等。
药品生产企业需要建立完善的细菌内毒素检测体系,确保生产的每一批药品都符合标准。
2.3 细菌内毒素检测在生产中的应用在药品生产过程中,细菌内毒素检测是一个必不可少的环节。
生产企业需要对原辅料、中间体和成品进行细菌内毒素检测,确保药品的质量和安全性。