四国药典细菌内毒素对比
- 格式:doc
- 大小:60.60 KB
- 文档页数:27

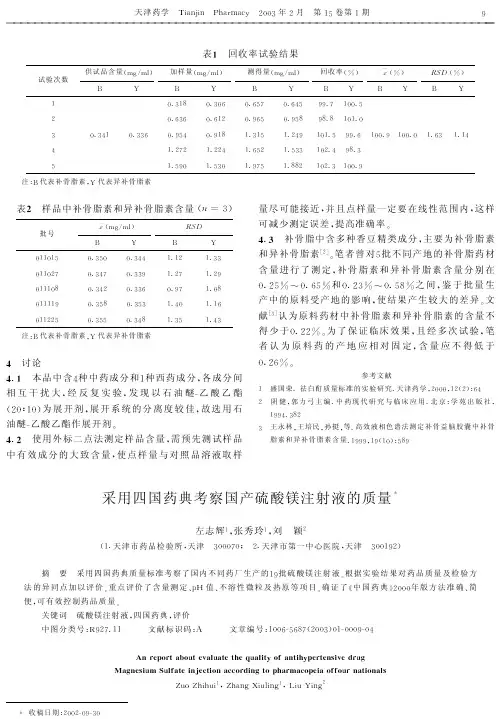
各国药典细菌内毒素检查法的比较1968年美国科学家Dr. Levin和Bang建立了鲎试验法。
此后世界各国对鲎试剂的生产和应用得以迅速发展。
1980年美国药典20版首先收载了细菌内毒素检查法。
随后,英国药典、日本药局方、中国药典等也相继收载了该方法。
本文主要对中国药典1995年版与英国药典1995年增补本、美国药典23版和日本药局方13版等的细菌内毒素检查法进行了比较。
1 检验品种的比较中国药典1995年版二部共收载细菌内毒素检查品种12个,2000年版二部增至47个,而美国药典23版收载了471个品种进行细菌内毒素检查。
因此,我们需加紧对更多的品种进行细菌内毒素检查方法的研究,加快该法对药品检验的普及和推广工作,提高我国药品标准和检验水平。
2 检验方法的比较细菌内毒素试验的方法有凝胶法、浊度法、显色基质法、免疫学法等。
其中凝胶法多为限量检查法,浊度法和显色基质法为定量检查法,且后两种方法都属于分光光度法。
浊度法还可分为终点浊度法和动态浊度法;显色基质法也可分为终点显色基质法和动态显色基质法。
凝胶法是较为经典的方法,各国药典都有收载,而收载了细菌内毒素定量测定法的有美国药典、英国药典、欧洲药典和日本药局方等。
中国药典1995年版只收载了凝胶法,2000年版才涉及到定量测定法。
因此,我们还需要对细菌内毒素定量测定进行研究,需要有供定量测定用的标准品、仪器和试剂,以后逐步建立起我国的细菌内毒素定量测定方法。
3 细菌内毒素标准品各国药典均设置了细菌内毒素的标准品,其中中国药典、英国药典和美国药典还可采用根据标准品为基准进行标定的工作标准品或对照标准品。
除英国药典采用U为内毒素的单位外,其余各国药典都用EU为内毒素的单位。
美国药典和中国药典对内毒素标准品每一步稀释时的混匀时间作出了明确规定。
除中国药典外,其余各国药典规定了内毒素标准贮备液在冰箱里保存不得超过14d,且用前应在旋涡混合器上充分混合至少3min。

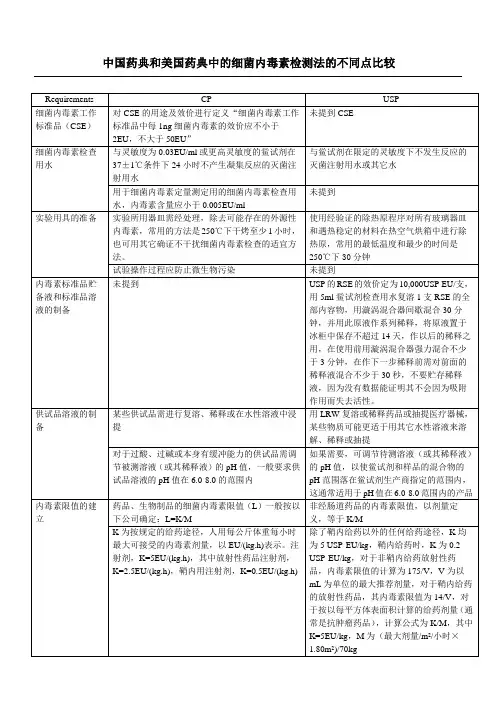
.CP(2015版)1143EP(8.0)2.6.14USP(36)85JP(16)6.06定义CP(2015) EP(8.0) USP(36) JP(16)本法系利用鲎试剂来检测或量化由革兰阴性菌产生的细菌内素素本法利用鲎试剂(从美洲鲎或中华鲎——阿米巴细胞溶解产物制备而来)检测由革兰氏阴性菌产生的细菌内毒素或对内毒素进行定量检查和定量供试品内毒素的方法。
本法利用鲎(美洲鲎或中华鲎)阿米巴细胞溶解产物制备的用于内毒素检测的鲎试剂( LAL)检定内毒素本法利用鲎试剂(从美洲鲎或中华鲎——阿米巴细胞溶解产物制备而来)检测由革兰氏阴性菌产生的细菌内毒素或对内毒素进行定量方法CP(2015) EP(8.0)一、凝胶法二、光度测定法1、浊度法2、显色基质法方法 A:凝胶法:限度试验方法 B:凝胶法:定量试验方法 C:动态浊度法方法 D:终点显色法方法 F:终点浊度法.USP(36) JP(16)仪器CP(2015) EP(8.0) USP(36) JP(16)一、凝胶法二、光度测定法1、浊度法2、显色法一、凝胶法二、光度测定法1、浊度法2、显色法干热灭菌法(250℃, 30 分钟以上),塑料器具应无内毒素并且对试验无干扰干热灭菌法(250℃, 30 分钟以上),塑料器具应无内毒素并且对试验无干扰干热灭菌法(250℃, 30 分钟以上),塑料器具应无内毒素并且对试验无干扰干热灭菌法(250℃, 30 分钟以上),塑料器具应无内毒素并且对试验无干扰溶液制备CP(2015) EP(8.0)供试品溶液的制备某些供试品需进行复溶、稀释或在水性溶液中浸提制成供试品溶液。
必要时,可调节被测溶液( 或其稀释液)的pH值,一般供试品溶液和鲎试剂混合后溶液的pH 值在 6.0-8.0的范围内为宜,可使用适宜的酸、碱溶液或缓冲液调节pH 值。
酸或碱溶液须用细菌内毒素检査用水在已去除内毒素的容器中配制。
缓冲液必须经过验证不含内毒素和干扰因子。



药典三部版通则细菌内毒素检查法标准化工作室编码[XX968T-XX89628-XJ668-XT689N]1143 细菌内毒素检查法本法系利用鲎试剂来检测或量化由革兰阴性菌产生的细菌内毒素,以判断供试品中细菌内毒素的限量是否符合规定的一种方法。
细菌内毒素检查包括两种方法,即凝胶法和光度测定法,后者包括浊度法和显色基质法。
供试品检测时,可使用其中任何一种方法进行试验。
当测定结果有争议时,除另有规定外,以凝胶限度试验结果为准。
本试验操作过程应防止内毒素的污染。
细菌内毒素的量用内毒素单位(EU)表示,1EU与1个内毒素国际单位(IU)相当。
细菌内毒素国家标准品系自大肠埃希菌提取精制而成,用于标定、复核、仲裁鲎试剂灵敏度、标定细菌内毒素工作标准品的效价,干扰试验及检查法中编号B和C溶液的制备、凝胶法中鲎试剂灵敏度复核试验、光度测定法中标准曲线可靠性试验。
细菌内毒素工作标准品系以细菌内毒素国家标准品为基准标定其效价,用于干扰试验及检查法中编号B和C溶液的制备、凝胶法中鲎试剂灵敏度复核试验、光度测定法中标准曲线可靠性试验。
细菌内毒素检查用水应符合灭菌注射用水标准,其内毒素含量小于0.015EU/ml(用于凝胶法)或0.005EU/ml(用于光度测定法),且对内毒素试验无干扰作用。
试验所用的器皿需经处理,以去除可能存在的外源性内毒素。
耐热器皿常用干热灭菌法(250℃、30分钟以上)去除,也可采用其他确证不干扰细菌内毒素检查的适宜方法。
若使用塑料器皿,如微孔板和与微量加样器配套的吸头等,应选用标明无内毒素并且对试验无干扰的器具。
供试品溶液的制备某些供试品需进行复溶、稀释或在水性溶液中浸提制成供试品溶液。
必要时,可调节被测溶液(或其稀释液)的pH值,一般供试品溶液和鲎试剂混合后溶液的pH值在6.0~8.0的范围内为宜,可使用适宜的酸、碱溶液或缓冲溶液调节pH值。
酸或碱溶液须用细菌内毒素检查用水在已去除内毒素的容器中配制。

中国药典和美国药典的内毒素检测要求鲎试剂-LAL,中国药典和美国药典的内毒素检测要求鲎试剂是从栖⽣于海洋的节肢动物“鲎”的兰⾊⾎液中提取变形细胞溶解物,经低温冷冻⼲燥⽽成的⽣物试剂,专⽤于细菌内毒素检测。
鲎试验法是国际上⾄今为⽌检测内毒素最好的⽅法,它简单﹑快速﹑灵敏﹑准确,因⽽被欧美药典及我国药典定为法定内毒素检查法,并已被世界各国所采⽤。
⽬前国际上销售的鲎试剂有两种,⼀种称美洲鲎试剂(Limulus Amebocyte Lysate),缩写为LAL,由美国⽣产;另⼀种称东⽅鲎鲎试剂(Tachypleus Amebocyte Lysate),缩写为TAL。
实验证明:美洲鲎试剂-LAL⽐东⽅鲎试剂LAL更纯洁,检测效果更好。
TAL检查内毒素有很多⽅法,⽬前应⽤最⼴泛的是凝胶法,此外还有动态浊度法﹑显⾊基质法,⽐⾊法等。
其⽤途有以下⼏⽅⾯:1. 药检:⽤于注射药品﹑放射性药物﹑⽣物制品﹑注射器及⽣产⼯艺流程中的内毒素检测;2. 临床:⽤于检测病⼈各种体液中的内毒素含量;3. 其他:⽤于检测⽔或⾷品中的内毒素含量。
2005年版中国药典《细菌内毒素检查法-鲎试剂法》(鲎试剂-LAL法)本法系利⽤鲎试剂来检测或量化由⾰兰阴性菌产⽣的细菌内毒素,以判断供试品中细菌内毒素的限量是否符合规定的⼀种⽅法。
细菌内毒素检查包括两种⽅法,即凝胶法和光度测定法,后者包括浊度法和显⾊基质法。
供试品检测时,可使⽤其中任何⼀种⽅法进⾏试验。
当测定结果有争议时,除另有规定外,以凝胶法结果为准。
细菌内毒素的量⽤内毒素单位(EU)表⽰。
细菌内毒素国家标准品系⾃⼤肠杆菌提取精制⽽成,⽤于标定、复核、仲裁鲎试剂灵敏度和标定细菌内毒素⼯作标准品的效价。
细菌内毒素⼯作标准品系以细菌内毒素国家标准品为基准标定其效价,⽤于试验中鲎试剂灵敏度复核、⼲扰试验及设置的各种阳性对照。
凝胶法细菌内毒素检查⽤⽔系指内毒素含量⼩于0.015EU/ml的灭菌注射⽤⽔。



热原和细菌内毒素一、热原(progon)医院临床在使用药品注射剂时,常有发生冷感、寒战、发热、头痛、恶心、呕吐、肤色灰白、休克、严重时导致死亡,这种症状称为热原反应。
为提高药品质量和用药安全,人们对热原进行了广泛的研究,直到1923年Seibert提出了用家兔检测热原的方法。
在1942年美国药典首先将家兔热原检查项收入药典成为法定方法,中国药典1953年版开始收载该方法,随后的世界各国药典都以动物热原检查法作为药品质量监测的方法之一。
家兔热原检查法的优点,可在规定时间里观察到家兔的体温变化,相应反应了热原质引起哺乳类动物复杂的体温反应过程。
所以,在半个多世纪以来热原检查法,为保障药品质量和用药安全发挥了重要作用。
但随着制药工业的发展和临床用药的要求,该方法的局限性越来越明显。
这种热原检查法,只局限于某种药物进入体内(血循环)是否能引起体温变化或热原反应作为判断药品是否污染热原的方法,已不能满足医药工业发展的需要。
其缺点:①标准化程度低,无法判断检查样品中存在的热原质到底是什么或是哪一种物质。
②由于试验动物家兔是处在被细菌污染的环境中,通过吸入或皮肤感染细菌内毒素而被免疫,导致动物的个体差异较大。
③试验动物受到药品的药理活性干扰,而影响体温变化(如放射性药品、抗生素、生物制品等),实验结果难以判断。
④设备及实验费用昂贵(如建设动物房、水电、动物饲料等耗费),做一种药品需要几百元/次,而鲎试剂仅几十元/次。
综上情况分析,鲎试验法可避免以上动物热原检查法的不足,该技术的成功和应用真可谓是药品质量监控一场大革命。
什么是热原?目前国内外仍未有统一的认识,但从国内外文献报道中,一个共同的意见,都普遍认为:它是指细菌内毒素的脂多糖。
欧洲药典委员会副主席J.Van Noordwijk提出:“严格地讲,不是每一种热原都具有脂多糖的结构,但所有已知的细菌内毒素脂多糖都有热原活性”。
在药品生产质量管理规范(GMP)条件下,药品生产的质量控制一般可以接受的观点是:不存在细菌内毒素意味着不存在热原。
CP(2015 版)1143 EP (8.0) 2.6.14 USP( 36) 85JP( 16) 6.06仅在最低浓度的标准溶液的所有平行管的检查结果均为阴性的情况下,试验方为有效。
反应终点浓度指系列递减的内毒素浓度中最后一个呈阳性结果的浓度。
将终点浓度取对数,计算它们的平均值,再将平均值的结果取反对数,最后的表达式如下:终点浓度的几何平均值=lg-1(工e/f)工e =所用系列溶液的终点浓度的对数值的和f=平行管的数量反应终点的浓度的几何平均值即为鲎试剂灵敏度的测量值(IU/ml )。
当终点浓度的几何平均值在0.5入至2.0入之间时,可判定受试鲎试剂的标示灵敏度为入,可用于内毒素的检查。
(ii )干扰因素试验开展该项实验的目的是检查供试品溶液中反应的增强因素或阻抑因素的存在。
按表2.6.14.-1 制备溶液A B、C D。
供试品的稀释度不得超过MVD且供试品溶液不能检查出内毒素,具体操作见(1)预备试验的(i )鲎试剂标示灵敏度的复核试验项。
表 2614-1人=经检查无内毒素的溶液工e为所用系列溶液的终点浓度的对数值的和;f为平行管的数量。
反应终点的几何平均值即为LAL试剂的标示灵敏度(单位为EU/mL。
当终点浓度的几何平均值在0.5入至2.0入之间,可判定受试 LAL试剂的标示灵敏度为入。
凝胶法的干扰因素试验一一按表1制备溶液A B C D,使用的供试品溶液应为未检验出内毒素且不超过MVD勺溶液,按LAL试剂灵敏度复核试验项下操作。
用检查法给出的公式计算溶液B、C的反应终点的几何平均值。
示灵敏度范围内时,试验方有效。
计算溶液B的鲎试剂灵敏度,如果值在 [0.5入,2.0入]间,可判定供试品溶液在该浓度下无干扰作用;反之则判定供试品溶液对试验能形成干扰。
若供试品溶液在小于 MVD的稀释倍数下对试验有干扰,应将供试品溶液进行不超过MVD勺进一步稀释,再重复干扰试验。
使用灵敏度更高如溶液的平行管的检查结果均为阳性时:- 如供试品的稀释倍数为 MVD供试品不符合规定。
热原和细菌内毒素一、热原(progon)医院临床在使用药品注射剂时,常有发生冷感、寒战、发热、头痛、恶心、呕吐、肤色灰白、休克、严重时导致死亡,这种症状称为热原反应。
为提高药品质量和用药安全,人们对热原进行了广泛的研究,直到1923年Seibert提出了用家兔检测热原的方法。
在1942年美国药典首先将家兔热原检查项收入药典成为法定方法,中国药典1953年版开始收载该方法,随后的世界各国药典都以动物热原检查法作为药品质量监测的方法之一。
家兔热原检查法的优点,可在规定时间里观察到家兔的体温变化,相应反应了热原质引起哺乳类动物复杂的体温反应过程。
所以,在半个多世纪以来热原检查法,为保障药品质量和用药安全发挥了重要作用。
但随着制药工业的发展和临床用药的要求,该方法的局限性越来越明显。
这种热原检查法,只局限于某种药物进入体内(血循环)是否能引起体温变化或热原反应作为判断药品是否污染热原的方法,已不能满足医药工业发展的需要。
其缺点:①标准化程度低,无法判断检查样品中存在的热原质到底是什么或是哪一种物质。
②由于试验动物家兔是处在被细菌污染的环境中,通过吸入或皮肤感染细菌内毒素而被免疫,导致动物的个体差异较大。
③试验动物受到药品的药理活性干扰,而影响体温变化(如放射性药品、抗生素、生物制品等),实验结果难以判断。
④设备及实验费用昂贵(如建设动物房、水电、动物饲料等耗费),做一种药品需要几百元/次,而鲎试剂仅几十元/次。
综上情况分析,鲎试验法可避免以上动物热原检查法的不足,该技术的成功和应用真可谓是药品质量监控一场大革命。
什么是热原?目前国内外仍未有统一的认识,但从国内外文献报道中,一个共同的意见,都普遍认为:它是指细菌内毒素的脂多糖。
欧洲药典委员会副主席J.V an Noordwijk提出:“严格地讲,不是每一种热原都具有脂多糖的结构,但所有已知的细菌内毒素脂多糖都有热原活性”。
在药品生产质量管理规范(GMP)条件下,药品生产的质量控制一般可以接受的观点是:不存在细菌内毒素意味着不存在热原。
CP(2015版)1143 EP(8.0)2.6.14 USP(36)85
JP(16)6.06
文案大全
文案大全
文案大全
文案大全
文案大全
文案大全
文案大全
文案大全
文案大全
文案大全
文案大全
文案大全
文案大全
文案大全
文案大全
文案大全
文案大全
文案大全
文案大全
文案大全
文案大全
文案大全
文案大全
文案大全
文案大全
文案大全
文案大全
小结:
细菌内毒素检测法,CP、EP、USP、JP中所描述的检测方法一致,包括种类、操作基本相同。
EP、USP、JP中有关于鲎试剂的介绍,CP中没有对这方面进行描述。
检测方法EP、USP、JP比CP描述的更加详细,例如鲎试剂的反应原理、供试品溶液表示方法等。
文案大全。
CP(2015版)1143 EP(8.0)2.6.14 USP(36)85 JP(16)6.06
文案大全
文案大全
文案大全
文案大全
文案大全
文案大全
文案大全
文案大全
文案大全
文案大全
文案大全
文案大全
文案大全
文案大全
文案大全
文案大全
文案大全
文案大全
文案大全
文案大全
文案大全
文案大全
文案大全
文案大全
文案大全
文案大全
小结:
细菌毒素检测法,CP、EP、USP、JP中所描述的检测方法一致,包括种类、操作基本相同。
EP、USP、JP中有关于鲎试剂的介绍,CP中没有对这方面进行描述。
检测方法EP、USP、JP比CP描述的更加详细,例如鲎试剂的反应原理、供试品溶液表示方法等。
文案大全。