四国药典细菌内毒素对比
- 格式:docx
- 大小:76.33 KB
- 文档页数:28

各国药典细菌内毒素检查法的比较1968年美国科学家Dr. Levin和Bang建立了鲎试验法。
此后世界各国对鲎试剂的生产和应用得以迅速发展。
1980年美国药典20版首先收载了细菌内毒素检查法。
随后,英国药典、日本药局方、中国药典等也相继收载了该方法。
本文主要对中国药典1995年版与英国药典1995年增补本、美国药典23版和日本药局方13版等的细菌内毒素检查法进行了比较。
1 检验品种的比较中国药典1995年版二部共收载细菌内毒素检查品种12个,2000年版二部增至47个,而美国药典23版收载了471个品种进行细菌内毒素检查。
因此,我们需加紧对更多的品种进行细菌内毒素检查方法的研究,加快该法对药品检验的普及和推广工作,提高我国药品标准和检验水平。
2 检验方法的比较细菌内毒素试验的方法有凝胶法、浊度法、显色基质法、免疫学法等。
其中凝胶法多为限量检查法,浊度法和显色基质法为定量检查法,且后两种方法都属于分光光度法。
浊度法还可分为终点浊度法和动态浊度法;显色基质法也可分为终点显色基质法和动态显色基质法。
凝胶法是较为经典的方法,各国药典都有收载,而收载了细菌内毒素定量测定法的有美国药典、英国药典、欧洲药典和日本药局方等。
中国药典1995年版只收载了凝胶法,2000年版才涉及到定量测定法。
因此,我们还需要对细菌内毒素定量测定进行研究,需要有供定量测定用的标准品、仪器和试剂,以后逐步建立起我国的细菌内毒素定量测定方法。
3 细菌内毒素标准品各国药典均设置了细菌内毒素的标准品,其中中国药典、英国药典和美国药典还可采用根据标准品为基准进行标定的工作标准品或对照标准品。
除英国药典采用U为内毒素的单位外,其余各国药典都用EU为内毒素的单位。
美国药典和中国药典对内毒素标准品每一步稀释时的混匀时间作出了明确规定。
除中国药典外,其余各国药典规定了内毒素标准贮备液在冰箱里保存不得超过14d,且用前应在旋涡混合器上充分混合至少3min。


药典三部版通则细菌内毒素检查法标准化工作室编码[XX968T-XX89628-XJ668-XT689N]1143 细菌内毒素检查法本法系利用鲎试剂来检测或量化由革兰阴性菌产生的细菌内毒素,以判断供试品中细菌内毒素的限量是否符合规定的一种方法。
细菌内毒素检查包括两种方法,即凝胶法和光度测定法,后者包括浊度法和显色基质法。
供试品检测时,可使用其中任何一种方法进行试验。
当测定结果有争议时,除另有规定外,以凝胶限度试验结果为准。
本试验操作过程应防止内毒素的污染。
细菌内毒素的量用内毒素单位(EU)表示,1EU与1个内毒素国际单位(IU)相当。
细菌内毒素国家标准品系自大肠埃希菌提取精制而成,用于标定、复核、仲裁鲎试剂灵敏度、标定细菌内毒素工作标准品的效价,干扰试验及检查法中编号B和C溶液的制备、凝胶法中鲎试剂灵敏度复核试验、光度测定法中标准曲线可靠性试验。
细菌内毒素工作标准品系以细菌内毒素国家标准品为基准标定其效价,用于干扰试验及检查法中编号B和C溶液的制备、凝胶法中鲎试剂灵敏度复核试验、光度测定法中标准曲线可靠性试验。
细菌内毒素检查用水应符合灭菌注射用水标准,其内毒素含量小于0.015EU/ml(用于凝胶法)或0.005EU/ml(用于光度测定法),且对内毒素试验无干扰作用。
试验所用的器皿需经处理,以去除可能存在的外源性内毒素。
耐热器皿常用干热灭菌法(250℃、30分钟以上)去除,也可采用其他确证不干扰细菌内毒素检查的适宜方法。
若使用塑料器皿,如微孔板和与微量加样器配套的吸头等,应选用标明无内毒素并且对试验无干扰的器具。
供试品溶液的制备某些供试品需进行复溶、稀释或在水性溶液中浸提制成供试品溶液。
必要时,可调节被测溶液(或其稀释液)的pH值,一般供试品溶液和鲎试剂混合后溶液的pH值在6.0~8.0的范围内为宜,可使用适宜的酸、碱溶液或缓冲溶液调节pH值。
酸或碱溶液须用细菌内毒素检查用水在已去除内毒素的容器中配制。

中国药典和美国药典的内毒素检测要求鲎试剂-LAL,中国药典和美国药典的内毒素检测要求鲎试剂是从栖⽣于海洋的节肢动物“鲎”的兰⾊⾎液中提取变形细胞溶解物,经低温冷冻⼲燥⽽成的⽣物试剂,专⽤于细菌内毒素检测。
鲎试验法是国际上⾄今为⽌检测内毒素最好的⽅法,它简单﹑快速﹑灵敏﹑准确,因⽽被欧美药典及我国药典定为法定内毒素检查法,并已被世界各国所采⽤。
⽬前国际上销售的鲎试剂有两种,⼀种称美洲鲎试剂(Limulus Amebocyte Lysate),缩写为LAL,由美国⽣产;另⼀种称东⽅鲎鲎试剂(Tachypleus Amebocyte Lysate),缩写为TAL。
实验证明:美洲鲎试剂-LAL⽐东⽅鲎试剂LAL更纯洁,检测效果更好。
TAL检查内毒素有很多⽅法,⽬前应⽤最⼴泛的是凝胶法,此外还有动态浊度法﹑显⾊基质法,⽐⾊法等。
其⽤途有以下⼏⽅⾯:1. 药检:⽤于注射药品﹑放射性药物﹑⽣物制品﹑注射器及⽣产⼯艺流程中的内毒素检测;2. 临床:⽤于检测病⼈各种体液中的内毒素含量;3. 其他:⽤于检测⽔或⾷品中的内毒素含量。
2005年版中国药典《细菌内毒素检查法-鲎试剂法》(鲎试剂-LAL法)本法系利⽤鲎试剂来检测或量化由⾰兰阴性菌产⽣的细菌内毒素,以判断供试品中细菌内毒素的限量是否符合规定的⼀种⽅法。
细菌内毒素检查包括两种⽅法,即凝胶法和光度测定法,后者包括浊度法和显⾊基质法。
供试品检测时,可使⽤其中任何⼀种⽅法进⾏试验。
当测定结果有争议时,除另有规定外,以凝胶法结果为准。
细菌内毒素的量⽤内毒素单位(EU)表⽰。
细菌内毒素国家标准品系⾃⼤肠杆菌提取精制⽽成,⽤于标定、复核、仲裁鲎试剂灵敏度和标定细菌内毒素⼯作标准品的效价。
细菌内毒素⼯作标准品系以细菌内毒素国家标准品为基准标定其效价,⽤于试验中鲎试剂灵敏度复核、⼲扰试验及设置的各种阳性对照。
凝胶法细菌内毒素检查⽤⽔系指内毒素含量⼩于0.015EU/ml的灭菌注射⽤⽔。


CP(2015 版)1143 EP (8.0) 2.6.14 USP( 36) 85JP( 16) 6.06仅在最低浓度的标准溶液的所有平行管的检查结果均为阴性的情况下,试验方为有效。
反应终点浓度指系列递减的内毒素浓度中最后一个呈阳性结果的浓度。
将终点浓度取对数,计算它们的平均值,再将平均值的结果取反对数,最后的表达式如下:终点浓度的几何平均值=lg-1(工e/f)工e =所用系列溶液的终点浓度的对数值的和f=平行管的数量反应终点的浓度的几何平均值即为鲎试剂灵敏度的测量值(IU/ml )。
当终点浓度的几何平均值在0.5入至2.0入之间时,可判定受试鲎试剂的标示灵敏度为入,可用于内毒素的检查。
(ii )干扰因素试验开展该项实验的目的是检查供试品溶液中反应的增强因素或阻抑因素的存在。
按表2.6.14.-1 制备溶液A B、C D。
供试品的稀释度不得超过MVD且供试品溶液不能检查出内毒素,具体操作见(1)预备试验的(i )鲎试剂标示灵敏度的复核试验项。
表 2614-1人=经检查无内毒素的溶液工e为所用系列溶液的终点浓度的对数值的和;f为平行管的数量。
反应终点的几何平均值即为LAL试剂的标示灵敏度(单位为EU/mL。
当终点浓度的几何平均值在0.5入至2.0入之间,可判定受试 LAL试剂的标示灵敏度为入。
凝胶法的干扰因素试验一一按表1制备溶液A B C D,使用的供试品溶液应为未检验出内毒素且不超过MVD勺溶液,按LAL试剂灵敏度复核试验项下操作。
用检查法给出的公式计算溶液B、C的反应终点的几何平均值。
示灵敏度范围内时,试验方有效。
计算溶液B的鲎试剂灵敏度,如果值在 [0.5入,2.0入]间,可判定供试品溶液在该浓度下无干扰作用;反之则判定供试品溶液对试验能形成干扰。
若供试品溶液在小于 MVD的稀释倍数下对试验有干扰,应将供试品溶液进行不超过MVD勺进一步稀释,再重复干扰试验。
使用灵敏度更高如溶液的平行管的检查结果均为阳性时:- 如供试品的稀释倍数为 MVD供试品不符合规定。

CP(2015版)1143 EP(8.0)2.6.14 USP(36)85
JP(16)6.06
文案大全
文案大全
文案大全
文案大全
文案大全
文案大全
文案大全
文案大全
文案大全
文案大全
文案大全
文案大全
文案大全
文案大全
文案大全
文案大全
文案大全
文案大全
文案大全
文案大全
文案大全
文案大全
文案大全
文案大全
文案大全
文案大全
文案大全
小结:
细菌内毒素检测法,CP、EP、USP、JP中所描述的检测方法一致,包括种类、操作基本相同。
EP、USP、JP中有关于鲎试剂的介绍,CP中没有对这方面进行描述。
检测方法EP、USP、JP比CP描述的更加详细,例如鲎试剂的反应原理、供试品溶液表示方法等。
文案大全。

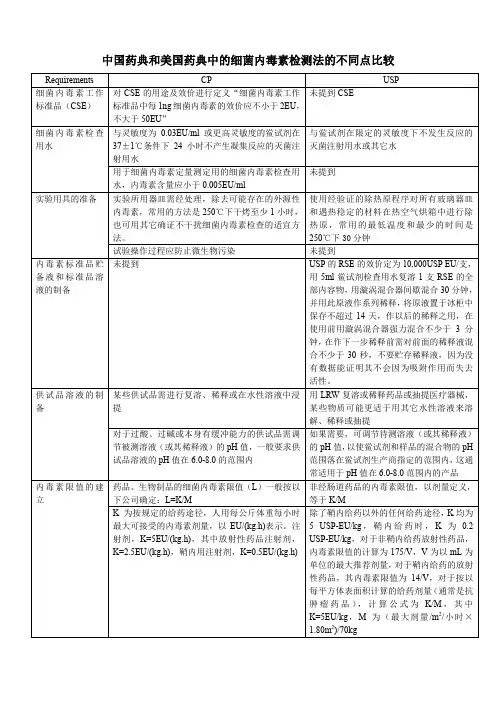
中国药典和美国药典中的细菌内毒素检测法的不同点比较1、细菌内毒素工作标准品(CSE)CP 对CSE的用途及效价进行定义“细菌内毒素工作标准品中每1ng细菌内毒素的效价应不小于2EU,不大于50EU”USP未提到CSE2、细菌内毒素检查用水CP :与灵敏度为0.03EU/ml或更高灵敏度的鲎试剂在37±1℃条件下24小时不产生凝集反应的灭菌注射用水;USP:与鲎试剂在限定的灵敏度下不发生反应的灭菌注射用水或其它水。
CP:用于细菌内毒素定量测定用的细菌内毒素检查用水,内毒素含量应小于0.005EU/ml。
USP:未提到。
3、实验用具的准备CP:实验所用器皿需经处理,除去可能存在的外源性内毒素,常用的方法是250℃下干烤至少1小时,也可用其它确证不干扰细菌内毒素检查的适宜方法。
USP:使用经验证的除热原程序对所有玻璃器皿和遇热稳定的材料在热空气烘箱中进行除热原,常用的最低温度和最少的时间是250℃下30分钟。
4、内毒素标准品贮备液和标准品溶液的制备CP:未提到USP:RSE的效价定为10,000USP EU/支,用5ml鲎试剂检查用水复溶1支RSE的全部内容物,用漩涡混合器间歇混合30分钟,并用此原液作系列稀释,将原液置于冰柜中保存不超过14天,作以后的稀释之用,在使用前用漩涡混合器强力混合不少于3分钟,在作下一步稀释前需对前面的稀释液混合不少于30秒,不要贮存稀释液,因为没有数据能证明其不会因为吸附作用而失去活性。
5、供试品溶液的制备CP:|某些供试品需进行复溶、稀释或在水性溶液中浸提用LRW复溶或稀释药品或抽提医疗器械,某些物质可能更适于用其它水性溶液来溶解、稀释或抽提。
对于过酸、过碱或本身有缓冲能力的供试品需调节被测溶液(或其稀释液)的pH值,一般要求供试品溶液的pH值在6.0-8.0的范围内。
USP:用LRW复溶或稀释药品或抽提医疗器械,某些物质可能更适于用其它水性溶液来溶解、稀释或抽提。
《美国药典》《欧洲药典》《日本药典》与《中国药典》中中药饮片微生物限度检查及标准的比较研究作者:范一灵李琼琼秦峰刘浩杨美成来源:《中国药房》2020年第22期摘要目的:比較《美国药典》43版(USP43)、《欧洲药典》10.0版(EP10.0)、《日本药典》17版(JP17)与《中国药典》2020年版(ChP2020)中中药饮片微生物限度检查方法及标准的差异,为我国中药饮片相关微生物标准的修订和完善提供参考。
方法:比较USP43、EP10.0、JP17和ChP2020在中药饮片的微生物计数法(包括抽样与取样、菌种和培养基选择、微生物和耐热菌计数等)、控制菌检查(包括样品前处理、增菌、分离、鉴定等)、微生物相关限度标准等方面的差异。
结果与结论:在中药饮片微生物的检查方法上,USP43、EP10.0、JP17都有各自独立的规定,ChP2020则新增了“通则1108”。
在检验项目上,除需氧菌总数、霉菌和酵母菌总数外,ChP2020与EP10.0规定了3种控制菌(耐胆盐革兰阴性菌、大肠埃希菌、沙门菌)的检查方法;在此基础上,JP17补充了金黄色葡萄球菌的检查方法;USP43增加了梭菌的检查方法,并最早提出不可接受微生物风险评估理念;ChP2020还新增了耐热菌计数方法。
在微生物限度标准上,USP 43对中药饮片的分类最为细致,要求较为严格且高于EP10.0、JP17;ChP2020仍未对中药饮片控制菌检查设立统一的限度标准。
虽然,ChP2020对“中药提取物及中药饮片的微生物限度标准”进行了修订,但相较于美国、欧洲和日本药典的规定还不完善。
建议根据我国中药饮片微生物污染和控制现状,逐步完善药典对中药相关产品的微生物检验和限度标准,合理细化相应产品的微生物限度水平。
关键词中药饮片;药典;微生物检查;限度标准;比较研究中图分类号 R921;R927.1 文献标志码 A 文章编号 1001-0408(2020)22-2695-06DOI 10.6039/j.issn.1001-0408.2020.22.02ABSTRACT; ;OBJECTIVE: To compare the difference of microbiological limit test and criteria of TCM decoction pieces among 43 edition of United States Pharmacopeia; (USP43),10.0 edition of European Pharmacopeia; (EP10.0), 17 edition of Japanese Pharmacopeia;(JP17) and 2020 edition of Chinese Pharmacopeia (ChP2020), and to provide refernce for the revision and improvement of microbiological standards for TCM decoction pieces in China. METHODS: The differences in the microbial enumeration tests method (including sampling and sample preparation, selection of bacteria and culture medium, count of microorganisms and heat-resistant bacteria, etc.), tests for specified microorganisms (including sample pretreatment,enrichment, separation and identification, etc.) and microbial related limit criteria were compared among USP43, EP10.0, JP17 and ChP2020. RESULTS & CONCLUSIONS: In terms of microbiological examination of TCM decoction pieces, USP43, EP10.0, JP17 had their own independent provisions. Chp2020 added “general rule 1108”. In terms of inspection items, in addition to the total aerobic bacteria count and total combined yeasts and molds count, ChP2020 and EP10.0 provided three methods for the inspection of control bacteria (bile-resistant Gram-negative bacteria, Escherichia coli, Salmonella). On the basis, JP17 supplemented Staphylococcus aureus test; However, USP43 added Clostridium test method and put forward the concept of objectionable microorganisms risk assessment; ChP2020 also added a new method for counting heat-resistant bacteria. In terms of microbial limit criteria, USP43 was the most detailed in the classification of TCM decoction pieces, which was more strict than EP10.0 and JP17; ChP2020 had not set up a unified limit for the inspection of control bacteria of TCM decoction pieces. ChP2020 revised the “microbial limit standard for TCM extracts and TCM decoction pieces”, but it was notperfect compared with the Pharmacopoeia of the United States, Europe and Japan. It is suggested that according to the current situation of microbial contamination and control of TCM decoction pieces, the microbial limit test and criteria of TCM related products in Pharmacopoeia should be gradually improved, and the microbial limit level of corresponding products should be reasonably refined.KEYWORDS; ;TCM decoction piece; Pharmacopeia; Microbial limit test; Limit criteria; Comparative study中药饮片是由中药材通过炮制加工而成的可直接用于中医临床的产品,其大多源自天然植物、动物或矿物,通常携带有大量微生物[1-2]。
四国药典有关药品微生物限度标准的比较微生物限度规定的作用,是为药品生产提供一个标准或指导,以确保药品使用的安全。
各国药典标准分为强制性的和非强制性的可达到的限度标准,这些指标正确、有效地规范了药品生产、检定和监督的程序。
药品要能反映不引起生物降解物和没有药源性污染的微生物存在是必要的,严格控制条件致病菌及致病菌。
一、CP、USP、BP、JP的微生物限度要求的特点及其发展趋势⒈各国药典收载微生物限度检查法的时间不同(见表1)表1 各国药典收载微生物限度检查法的时间各国药典CP USP BP JP收载微生物限度检查法的时间1995版* 1975(19)1973---方法1988---品种**第十三改正版****1978年颁布第一个药品卫生标准;1986年颁布了修改的药品卫生标准;1989年下发药品卫生标准补充规定和说明,1995年版中国药典收载微生物限度检查法(标准仅为少数剂型)**品种98版43个,其中原料药品种38个,制剂品种仅5个。
***仅有6个品种。
⒉品种不断扩大USP版本19(1975)22(1990)23 24(2000)*217种包括原料药品种72个(占1/3);制剂品种(占2/3)。
⒊活菌数要求各有特点⒋控制菌的要求各有特点a 10g或10ml样品不得检出。
b 1g或1ml 样品不得检出。
c 仅为个别品种要求10~103/1g或1ml。
*d 不列在剂型项内而以说明提出,意即不作为常规检查,如有检出,以不合格处理的依据。
二、稀释剂的种类* pH7.0缓冲氯化钠-蛋白胨水:磷酸二氢钾3.56g,磷酸氢二钠4.30g,蛋白胨(肉胨或酪胨1.0g纯水1000ml/L。
溶解以上成份,加入1~10g 吐温-20或吐温-80。
121℃高压蒸汽灭菌30min。
作用:可调节供试液pH至近中性,其中蛋白胨对菌细胞有保护作用,有利于菌数及控制菌的测定。
吐温加入对含油性供试品的助溶具有作用。
** USP、BP微生物限度(污染)检查用稀释剂,除磷酸盐缓冲液、磷酸盐缓冲胨水外,尚采用以上两种培养基,直接稀释供试品并作增菌培养.。
.CP(2015版)1143EP(8.0)2.6.14USP(36)85JP(16)6.06定义CP(2015) EP(8.0) USP(36) JP(16)本法系利用鲎试剂来检测或量化由革兰阴性菌产生的细菌内素素本法利用鲎试剂(从美洲鲎或中华鲎——阿米巴细胞溶解产物制备而来)检测由革兰氏阴性菌产生的细菌内毒素或对内毒素进行定量检查和定量供试品内毒素的方法。
本法利用鲎(美洲鲎或中华鲎)阿米巴细胞溶解产物制备的用于内毒素检测的鲎试剂( LAL)检定内毒素本法利用鲎试剂(从美洲鲎或中华鲎——阿米巴细胞溶解产物制备而来)检测由革兰氏阴性菌产生的细菌内毒素或对内毒素进行定量方法CP(2015) EP(8.0)一、凝胶法二、光度测定法1、浊度法2、显色基质法方法 A:凝胶法:限度试验方法 B:凝胶法:定量试验方法 C:动态浊度法方法 D:终点显色法方法 F:终点浊度法.USP(36) JP(16)仪器CP(2015) EP(8.0) USP(36) JP(16)一、凝胶法二、光度测定法1、浊度法2、显色法一、凝胶法二、光度测定法1、浊度法2、显色法干热灭菌法(250℃, 30 分钟以上),塑料器具应无内毒素并且对试验无干扰干热灭菌法(250℃, 30 分钟以上),塑料器具应无内毒素并且对试验无干扰干热灭菌法(250℃, 30 分钟以上),塑料器具应无内毒素并且对试验无干扰干热灭菌法(250℃, 30 分钟以上),塑料器具应无内毒素并且对试验无干扰溶液制备CP(2015) EP(8.0)供试品溶液的制备某些供试品需进行复溶、稀释或在水性溶液中浸提制成供试品溶液。
必要时,可调节被测溶液( 或其稀释液)的pH值,一般供试品溶液和鲎试剂混合后溶液的pH 值在 6.0-8.0的范围内为宜,可使用适宜的酸、碱溶液或缓冲液调节pH 值。
酸或碱溶液须用细菌内毒素检査用水在已去除内毒素的容器中配制。
缓冲液必须经过验证不含内毒素和干扰因子。