键参数——键能键长与键角
- 格式:ppt
- 大小:3.28 MB
- 文档页数:11

§2-2 键参数——键能、键长与键角【学习目标】1、初步了解键能、键长、键角的概念,能根据其数据认识共价键的强弱;2、了解键能的应用—与反应热、分子稳定性的关系。
【重、难点】键参数及其应用一、键参数包括____________、____________、________________1.键能(1)定义:___________原子形成________mol化学键释放的______能量。
(2)单位:_____________ 通常取_________如H—H键的键能是436.0kJ·mol-1,表示_______________________________________。
(3)意义①表示共价键的强弱:原子形成共价键时,轨道重叠程度______,体系能量降低______,释放出的能量_______,形成的共价键的键能_______,共价键__________。
②表示分子的稳定性:键能_________,分子越_________。
-1分解为气态原子时,需要(填)能量;2(2)1mol H2在2 mol Cl2中燃烧,放出的热量kJ;(3)由表中所列化学键形成的单质分子中,最稳定的是,最不稳定是,形成的化合物分子中,最稳定的是,最不稳定的是;(4)在一定条件下,1mol H2与足量的Cl2、Br2、I2分别反应,放出热量由多到少的是__________________________________;(5)预测1mol H2在足量F2中燃烧比在Cl2中放热。
【归纳】键能的应用——反应热与键能的关系由键能求反应热的公式为:△H =____________的键能总和—____________的键能总和2.键长:(1)概念:形成共价键的两个原子之间的________________相同原子的共价键键长的一半称为_____________(2)意义:一般来说,键长______,键能就_______,键就_______,分子就_________,受热时就________,热稳定性_________。

第二课时键参数——键能、键长与键角1.下列说法正确的是()A.键角决定了分子的结构B.共价键的键能越大,共价键越牢固,含有该键的分子越稳定C.CH4、CCl4中键长相等,键角不同D.C===C键的键能是C—C键的键能的两倍2.下列说法中正确的是()A.乙烯中碳碳双键的键能是乙烷中碳碳单键的键能的2倍B.N—O键的极性比C—O键的极性大C.氮气分子中含有1个σ键和2个π键D.NH+4中4个N—H键的键能不同3.已知X—X、Y—Y、Z—Z键的键长分别为198 pm、74 pm、154 pm,则它们单质分子的稳定性是()A.X2>Y2>Z2B.Z2>Y2>X2C.Y2>X2>Z2D.Y2>Z2>X24.等电子体的结构相似、物理性质相似,下列各对粒子中,空间结构相似的是() A.SO2与O3B.CO2与NO2C.CS2与NO2D.PCl3与BF35.根据等电子原理,下列各组分子或离子的空间构型不相似的是()A.NH+4和CH4B.H3O+和NH3C.NO-3和CO2-3D.CO2和H2O6.三氯化磷分子的立体构型是三角锥形而不是平面正三角形。
下列关于三氯化磷分子的叙述,不正确的是()A.PCl3分子中三个共价键的键长、键角都相等B.PCl3分子中的P—Cl键属于σ键C.PCl3分子中三个共价键的键能、键角均相等D.PCl3分子中三个共价键的键角均为120°7.已知H—H键能为436 kJ·mol-1,H—N键能为391 kJ·mol-1,1 mol N2与足量H2反应放出的热量为92.4 kJ·mol-1,则N≡N键的键能是()A.431 kJ·mol-1B.945.6 kJ·mol-1C.649 kJ·mol-1D.896 kJ·mol-18.N2的结构可以表示为,CO的结构可以表示为,其中椭圆框表示π键,下列说法中不正确的是()A.N2分子与CO分子中都含有三键B.CO分子与N2分子中的π键并不完全相同C.N2与CO互为等电子体D.N2与CO的化学性质相同9.美国科学家合成了含有N+5的盐类,N+5的结构呈V形,如图所示(图中箭头代表单键)。



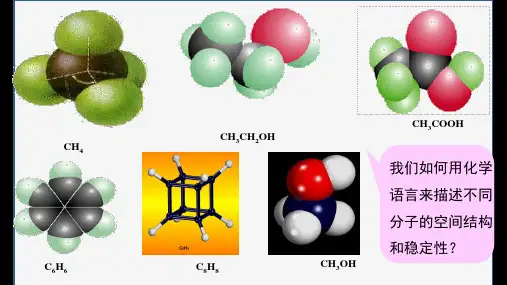

第一节共价键第2课时键参数——键能、键长与键角1.下列事实不能用键能的大小来解释的是()A.N元素的电负性较大,但N2的化学性质很稳定B.稀有气体一般难发生化学反应C.HF、HCl、HBr、HI的热稳定性逐渐减弱D.F2比O2更容易与H2反应答案B解析由于N2分子中存在三键,键能很大,破坏共价键需要很大的能量,所以N2的化学性质很稳定;稀有气体都为单原子分子,分子内部没有化学键;卤族元素从F到I原子半径逐渐增大,其氢化物中的化学键键长逐渐变长,键能逐渐变小,所以热稳定性逐渐减弱;由于H—F的键能大于H—O的键能,所以二者相比较,更容易生成HF。
2.下列说法正确的是()A.在分子中,两个原子间的距离叫键长B.非极性键的键能大于极性键的键能C.键能越大,表示该分子越容易受热分解D.H—Cl的键能为431 kJ·mol-1,H—I的键能为297 kJ·mol-1,这可说明HCl分子比HI分子稳定答案D解析形成共价键的两个原子的核间距为键长,A项不正确;键能的大小取决于成键原子的电负性,与键的极性无必然联系,B项不正确;键能越大,分子越稳定,C项不正确、D项正确。
3.下列单质分子中,键长最长,键能最小的是()A.H2B.Cl2C.Br2D.I2答案D解析键长与原子的半径有关,原子半径越大,形成的分子的键长越长;键能与得失电子的难易有关,得电子越容易,键能越大。
四种原子中,I的原子半径最大,且得电子最难,故D 项正确。
4.关于键长、键能和键角,下列说法错误的是()A.键角是描述分子空间结构的重要参数B.键长是形成共价键的两原子的核间距C.键能:H—I>H—Br>H—ClD.键角的大小与键长、键能的大小无关答案C解析键角是描述分子空间结构的重要参数,如CO2中的2个C==O的键角为180°,故分子为直线形分子,A正确;键长是形成共价键的两个原子的核间距,B正确;键角的大小取决于成键原子轨道的夹角,D正确。