2018届高考化学专项复习共价键键参数——键能、键长与键角(2)练习苏教版解析
- 格式:doc
- 大小:38.00 KB
- 文档页数:4
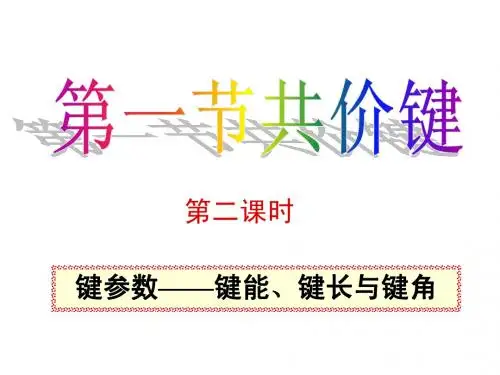

键参数——键能、键长与键角专题训练1班级:________________,姓名:__________________。
1.键长是描述共价键的物理量之一,下列各项中的距离属于键长的是()A.水分子中两个氢原子核之间的距离B.氯气分子中两个氯原子核之间的距离C.氩气中两个相邻氩原子核间的距离D.CO2分子中两个氧原子核之间的距离【答案】B【解析】A.键长是成键原子间的核间距,水分子中两个氢原子不成键,A错误;B.氯气分子中两个氯原子间形成共价键,两个氯原子核之间的距离属于键长,B正确;C.氩气中两个相邻氩原子不成键,C错误;D.CO2分子中两个氧原子不成键,D错误。
2.反映共价键强弱的物理量是()A.键能B.键能、键长C.键能、键长、键角D.键长、键角【答案】B【解析】键能可看作是断开共价键所需的能量,键能越大,则断开共价键时所需的能量就越大,含该键的分子就越稳定;键长越长键能反而越小,故反映键的强弱的物理量是键能和键长,故选B。
3.键长、键角和键能是描述共价键的三个重要参数,下列叙述正确的是()A.键角是描述分子空间结构的重要参数B.因为H—O的键能小于H—F的键能,所以O2、F2与H2反应的能力逐渐减弱C.H—F的键长是H—X中最长的D.碳碳三键和碳碳双键的键能分别是单键键能的3倍和2倍【答案】A【解析】A.当物质分子内有多个化学键时,化学键之间的夹角叫键角,它反映了分子内原子的空间分布情况,因此键角是描述分子空间结构的重要参数,A正确;B.O2分子内两个O原子形成2对共用电子对,结合力强,断裂吸收的能量高,而F2内的2个F 原子形成1对共用电子对,结合力相对O2来说弱,断裂吸收的能量低,因此与H2反应F2更容易发生反应,而O2相对来说弱,即F2比O2与H2反应的能力强,B错误;C.F的原子半径是X中最小的,H—F键的键长是H—X中最短的,C错误;D.碳碳三键中有一个σ键两个π键,碳碳双键中有一个σ键一个π键,π键键能小于σ键键能,则碳碳三键和碳碳双键键能小于单键键能的3倍和2倍,D错误。


第2课时键参数——键能、键长与键角基础巩固1.下列说法正确的是()A.分子的结构是由键角决定的B.共价键的键能越大,共价键越牢固,由该键形成的分子越稳定C.CF4、CCl4、CBr4、CI4中C—X(X===F、Cl、Br、I)键的键长、键角均相等D.H2O分子中两个O—H键的键角为180°解析分子的结构是由键参数——键角、键长决定的,A项错误;由于F、Cl、Br、I的原子半径不同,故C—X(X=F、Cl、Br、I)键的键长不相等,C项错误;H2O分子中两个O—H键的键角为105°,D项错误。
答案B2.根据π键的成键特征判断C===C的键能与C—C键能的数量关系()A.双键的键能等于单键的键能的2倍B.双键的键能大于单键的键能的2倍C.双键的键能小于单键的键能的2倍D.无法确定解析由于π键的键能比σ键键能小,双键中有一个π键和一个σ键,所以双键的键能小于单键的键能的2倍。
答案C3.右表为元素周期表前4周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是()A.W、R元素单质分子内都存在非极性键B.X、Z元素都能形成双原子分子C.键长W—H<Y—H,键的极性Y—H>W—HD.键长X—H<W—H,键能X—H<W—H解析由元素在周期表中的位置可知,X为N、W为P、Y为S、R为Ar、Z为Br。
白磷单质中存在非极性键,但稀有气体分子为单原子分子,分子中没有化学键,A错误;氮气、溴单质都是双原子分子,B正确;原子半径W>Y,故键长W—H>Y—H,电负性W<Y,元素电负性越大,对键合电子吸引力越大,与H元素形成的化学键极性越大,故键的极性Y—H>W—H,C错误;原子半径W>X,故键长W—H>X—H,键长越短,键能越大,故键能W—H<X—H,D错误。
答案B4.下列说法中正确的是()A.分子中键能越大,键长越小,则分子越稳定B.只有非金属原子之间才能形成共价键C.水分子可表示为H—O—H,分子中键角为180°D.H—O键键能为463 kJ/mol,即18 g H2O分解成H2和O2时,消耗能量为(2×463) kJ解析在分子中键能越大,键长越小,分子越稳定,A正确;有些金属和非金属之间也能形成共价键,如AlCl3,B错误;水分子中两个H—O键的键角为105°,C错误;H—O键键能为463 kJ/mol指的是拆开1 mol H—O键形成气态氢原子和氧原子所吸收的能量为463 kJ,1 mol H2O中含2 mol H—O键,需吸收(2×463) kJ的能量形成气态氢原子和氧原子,但氢原子和氧原子进一步形成H2和O2时释放能量,即需知H—H键和O===O键的键能方能计算,故D错。

第二课时键参数——键能、键长与键角必备知识基础练1.下列说法正确的是()A.键角决定了分子的结构B.共价键的键能越大,共价键越牢固,含有该键的分子越稳定C.CH4、CCl4分子中键长相等,键角不同D.C C的键能是C—C键能的两倍2.下列说法正确的是()A.双原子分子中化学键键能越大,分子越稳定B.双原子分子中化学键键长越大,分子越稳定C.双原子分子中化学键键角越大,分子越稳定D.在双键中,σ键的键能要小于π键的键能3.从键长的角度来判断下列共价键中最稳定的是()A.H—ClB.P—HC.Si—HD.S—H4.能说明BF3分子中的4个原子在同一平面的理由是()A.B—F之间夹角为120°B.B—F为σ键C.3个B—F的键能相同D.3个B—F的键长相等5.下列分子最难分裂成原子的是()A.HFB.HClC.HBrD.HI6.已知1 mol气态基态氢原子完全结合形成氢气时,释放出的能量为218 kJ·mol-1,下列说法正确的是()A.H—H键能为218 kJ·mol-1B.H—H键能为436 kJ·mol-1C.1 mol气态氢原子的能量低于0.5 mol H2的能量D.使1 mol H2完全分解至少需要218 kJ的能量7.(2021·黑龙江哈尔滨高二检测)氰气的化学式为(CN)2,结构式为N≡C—C≡N,其性质与卤素气体单质相似,氰气可用于有机合成,制作农药,也可用作消毒、杀虫的熏蒸剂等。
下列叙述正确的是()A.气体单质中,一定有σ键,可能有π键B.氰气分子中N≡C的键长大于C—C的键长C.氰气分子中含有3个σ键和4个π键D.(CN)2不能与氢氧化钠溶液发生反应8.已知下列化学键的键能:化学键C—C N—N O—O O O O—H回答下列问题:(1)过氧化氢不稳定,易发生分解反应2H2O2(g)2H2O(g)+O2(g),利用键能数据计算该反应的反应热为。

第2课时键参数——键能、键长与键角目标导航1.通过认识共价键的键能、键长和键角,从微观角度模型化解释分子的空间结构。
2.结合共价键的键长、键能和键角等数据,理解分子的性质与键参数的关系,培养证据推理与模型认知的核心素养。
3.掌握用共价键的强弱解释物质稳定性的方法。
【课前初探】知识铺垫1.甲烷分子为结构,键角是。
2.F、Cl、Br、I原子半径逐渐,F2、Cl2、Br2、I2与氢气反应越来,HF、HI、HBr、HI的稳定性逐渐。
必备知识1.键参数——键能、键长与键角(1)键能。
键能是分子中断裂化学键解离成气态原子所的能量。
键能可用于估算化学反应的热效应,如H—H键、F—F键、H—F键的键能分别为436 kJ·mol-1、157 kJ·mol-1、568 kJ·mol-1,则H2与F2反应是反应(填“放热”或“吸热”)。
(2)键长。
键长是指形成共价键的两个原子之间的。
化学键的键长与键能是相关的。
例如,C—C 键、C=C键、C≡C键的键长分别为154 pm、133 pm、120 pm,键长越来越,它们的键能分别为347.7 kJ·mol-1、615 kJ·mol-1和812 kJ·mol-1,越来越。
(3)键角。
键角是指在多原子分子中,两个相邻共价键之间的。
如CO2的结构式为,键角为,是一种分子;H2O分子中的H—O—H键角是105°,是一种形(或称角形)分子。
多原子分子中的键角一定,表明共价键具有。
键长和键角的数值可以通过晶体的实验获得。
2.键参数的应用(1)分子的热稳定性。
参照教材37页表2-1中的键能数据。
计算1 mol H2分别与1 mol Cl2、1 mol Br2(蒸气)反应生成2 mol HCl和2 mol HBr时,分别(填“放出”或“吸收”)kJ和(填“放出”或“吸收”)kJ的热量。
则2 mol HBr分解需要吸收的能量比2 mol HCl (填“高”或“低”),故更易分解。

第三单元共价键共价晶体第2课时共价键键能与化学反应的反应热共价晶体课后训练巩固提升基础巩固1.下列说法正确的是()。
A.键能越大,表示该分子越容易受热分解B.共价键都具有方向性C.在分子中,两个成键的原子间的距离叫键长D.H—Cl键的键能为431.8 kJ·mol-1,H—Br键的键能为366 kJ·mol-1,则HCl分子比HBr 分子稳定答案:D解析:键能越大,分子越稳定,则越不容易受热分解,A项错误,D项正确。
如H—H键没有方向性,B项错误。
形成共价键的两个原子核之间的平均间距是键长,C项错误。
2.已知X—X、Y—Y、Z—Z键的键长分别为198 pm、74 pm、154 pm,则它们单质分子的稳定性是()。
A.X2>Y2>Z2B.Z2>Y2>X2C.Y2>X2>Z2D.Y2>Z2>X2答案:D解析:共价键的键长越短,键能越大,共价键越稳定,分子也越稳定,而三种单质的键长由小到大的顺序为Y—Y<Z—Z<X—X,故三种单质分子的稳定性为Y2>Z2>X2。
3.根据下列性质判断,属于共价晶体的物质是()。
A.熔点2 700 ℃,导电性好,延展性强B.无色晶体,熔点3 550 ℃,不导电,质硬,难溶于水和有机溶剂C.无色晶体,能溶于水,质硬而脆,熔点为800 ℃,熔化时能导电D.熔点-56.6 ℃,微溶于水,硬度小,固态或液态时不导电答案:B解析:共价晶体一般熔点较高,不导电,质硬,难溶于水和有机溶剂,故B项符合。
4.据报道,在40 GPa的高压下,用激光加热到1 800 K,人们成功制得了共价晶体CO2,下列对该物质的推断一定不正确的是()。
A.该共价晶体中含有极性键B.该共价晶体易汽化,可用作制冷材料C.该共价晶体有很高的熔点D.该共价晶体硬度大,可用作耐磨材料答案:B解析:CO2的共价晶体中化学键依然为极性共价键,A项正确。

共价键1.下列物质只含共价键的是()A.Na2O2 B.H2O C.NH4Cl D.NaOH【答案】B【解析】Na2O2、NH4Cl、NaOH既含离子键又含共价键,H2O中只含共价键。
2.下列物质的分子中既含有极性键,又含有非极性键的是()A.CO2B.H2O C.H2O2D.H2【答案】C【解析】判断极性键和非极性键的标准是成键原子是否为同种元素的原子。
CO2(O==C==O)、H2O(H—O—H)分子中只有极性键;H2分子中只有非极性键;而H2O2分子的结构式为H—O—O—H,既有极性键,又有非极性键。
3.下列分子中,只有σ键没有π键的是()A.CH4 B.N2 C.CH2==CH2D.CH≡CH【答案】A【解析】两原子间形成共价键,先形成σ键,然后再形成π键,即共价单键全部为σ键,共价双键、共价叁键中一定含有一个σ键,其余为π键。
4.下列物质分子中一定含有π键的是()A.HCl B.H2O2 C.C2H4D.CH2Cl2【答案】C【解析】A项,HCl:H—Cl,只含σ键;B项,H2O2:H—O—O—H,只含σ键;C项,C2H4:,C==C双键中含π键;D项,CH2Cl2:,只含σ键。
5.下列分子中键角最大的是()A.CH4 B.NH3 C.H2O D.CO2【答案】D【解析】CH4分子为正四面体结构,键角为109.5°,NH3分子为三角锥形,键角为107.3°,H2O分子为V形,键角为104.5°,CO2为直线形分子,键角为180°。
6.下列说法正确的A.含有共价键的化合物一定是共价化合物B.分子中只有共价键的化合物一定是共价化合物C.由共价键形成的一定是共价化合物分子D.只有非金属原子间才能形成共价键【答案】B【解析】A项,全部由共价键形成的化合物是共价化合物,含有共价键的化合物不一定是共价化合物,例如氢氧化钠中存在共价键,氢氧化钠是离子化合物,A项错误;B项,全部由共价键形成的化合物是共价化合物,则分子中只有共价键的化合物一定是共价化合物,B项正确;C项,由共价键形成的分子不一定是共价化合物分子,也可能是单质,例如氢气,C项错误;D项,金属原子与非金属原子间也能形成共价键,例如氯化铝为共价化合物,氯原子和铝原子间为共价键,D项错误;故选B。

第二章分子结构与性质第一节共价键2.1.2 键参数—键能、键长与键角一.选择题1.键长、键角和键能是描述共价键的三个重要参数,下列叙述正确的是()A.键角是描述分子立体构型的重要参数B.因为H—O键的键能小于H—F键的键能,所以O2、F2与H2反应的能力逐渐减弱C.水分子的结构可表示为H—O—H,分子中的键角为180°D.H—O键的键能为463 kJ·mol-1,即18 g H2O分解成H2和O2时,消耗的能量为2×463 kJ 【答案】A【解析】H—O键、H—F键的键能依次增大,意味着形成这些键时放出的能量依次增大,化学键越来越稳定,O2、F2与H2反应的能力逐渐增强,B项错误;水分子呈V形,键角为105°,C项错误;H—O键的键能为463 kJ·mol-1,指的是断开1 mol H—O键形成气态氢原子和气态氧原子所需吸收的能量为463 kJ,18 g H2O即1 mol H2O中含2 mol H—O键,断开时需吸收2×463 kJ的能量形成气态氢原子和气态氧原子,再进一步形成H2和O2时,还会释放出一部分能量,D项错误。
2.下列分子或离子中键角由大到小的排列顺序是()①SO2②NH3③H2O④CH4⑤CO2A.⑤④①②③B.⑤⑤⑤⑤⑤ C.⑤⑤⑤⑤⑤ D.⑤⑤⑤⑤⑤【答案】B【解析】⑤SO2分子为V形结构,键角为120°;⑤NH3为三角锥形结构,键角为107°;⑤H2O为V形结构,键角为105°;⑤CH4为正四面体结构,键角为109°28′;⑤CO2为直线形结构,键角为180°。
所以键角的大小顺序为CO2>SO2>CH4>NH3>H2O,所以B正确。
3.根据如表所列键能数据,下列分子中最不稳定的是()A.HCl B.HBr C.H2D.Br2【答案】D【解析】由题表中数据可知,分子中键能:E(H2)>E(HCl)>E(HBr)>E(Cl2)>E(Br2),键能越大越稳定,故Br2分子最不稳定,D项符合题意。
第2课时键参数——键能、键长与键角题组一键参数的理解1.下列事实不能用键能的大小来解释的是()A.N元素的电负性较大,但N2的化学性质很稳定B.稀有气体一般难发生化学反应C.HF、HCl、HBr、HI的热稳定性逐渐减弱D.F2比O2更容易与H2反应2.下列说法正确的是()A.在分子中,两个原子间的距离叫键长B.非极性键的键能大于极性键的键能C.键能越大,表示该分子越容易受热分解D.H—Cl的键能为431 kJ·mol-1,H—I的键能为297 kJ·mol-1,这可说明HCl分子比HI分子稳定3.关于键长、键能和键角,下列说法错误的是()A.键角是描述分子空间结构的重要参数B.键长是形成共价键的两原子的核间距C.键能:H—I>H—Br>H—ClD.键角的大小与键长、键能的大小无关题组二键参数的应用4.H2和I2在一定条件下能发生反应:H2(g)+I2(g)2HI(g)ΔH=-a kJ·mol-1,下列说法正确的是()已知:(a、b、c均大于零)A.H2、I2和HI分子中的化学键都是非极性共价键B.断开2 mol HI分子中的化学键所需能量约为(c+b+a) kJC.相同条件下,1 mol H2(g)和1 mol I2(g)的总能量小于2 mol HI (g)的总能量D.向密闭容器中加入2 mol H2(g)和2 mol I2(g),充分反应后放出的热量为2a kJ5.下列性质能用共价键的键能大小解释的是()A.稳定性:HCl>HI B.密度:HI>HClC.沸点:HI>HCl D.还原性:HI>HCl6.下列分子中键角由大到小的排列顺序是()①SO2②NH3③H2O④CH4⑤CO2A.⑤④①②③B.⑤①④②③C.④①②⑤③D.③②④①⑤7.三氯化磷分子的空间结构不是平面正三角形,其理由叙述正确的是()A.PCl3分子中3个共价键的键角均相等B.PCl3分子中P—Cl属于极性共价键C.PCl3分子中3个共价键的键长均相等D.PCl3分子中P—Cl的3个键角都是100.1°8.意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的气态N4分子,其分子结构如图所示。
江苏省启东市2018届高中化学键参数——键能、键长与键角课后微练习苏教版必修2编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(江苏省启东市2018届高中化学键参数——键能、键长与键角课后微练习苏教版必修2)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为江苏省启东市2018届高中化学键参数——键能、键长与键角课后微练习苏教版必修2的全部内容。
键参数——键能、键长与键角班级______ 姓名__________ 学号________1.已知N2+O2===2NO为吸热反应,ΔH=+180 kJ·mol-1,其中N≡N、O===O键的键能分别为946 kJ·mol-1、498 kJ·mol-1,则N—O键的键能为()A.1 264 kJ·mol-1 B.632 kJ·mol-1C.316 kJ·mol-1 D.1 624 kJ·mol-1 2.下列叙述中的距离属于键长的是()A.氨分子中两个氢原子间的距离B.氯分子中两个氯原子间的距离C.金刚石晶体中任意两个相邻的碳原子核间的距离D.氯化钠晶体中相邻的氯离子和钠离子的核间距离3.下列分子的稳定性的比较中正确的是()A.HF>HI B.CH4〈SiH4 C.PH3>NH3 D.H2O<H2S4.下列说法中正确的是()A.双原子分子中化学键键能越大,分子越稳定B.双原子分子中化学键键长越长,分子越稳定C.双原子分子中化学键键角越大,分子越稳定D.在双键中,σ键的键能要小于π键的键能5.能说明CH4分子中的5个原子不在同一平面而是正四面体结构的是( )A.任意两个键之间的夹角都是109°28′B.碳原子的4个sp3杂化轨道能量不同C.4个C-H键的键长、键能都相同D.碳的价层电子都形成共价键6.下列选项的说法中正确的是( )A.分子的结构是由键角决定的B.共价键的键能越大,共价键越牢固,由该键形成的分子越稳定C.CF4、CCl4、CBr4、CI4中C—X键的键长、键角均相等D.H2O分子中的两个O—H键的键角为180°7.下列说法不正确的是()A.双键、叁键都含有π键B.成键原子间原子轨道重叠愈多,共价键愈牢固C.因每个原子未成对电子数是一定的,故配对原子个数也一定D.每一个原子轨道在空间都具有自己的方向性8.下列说法正确的是()A.共价键都是极性的B.共价键的键能越大,共价键越牢固,含有该键的双原子分子越稳定C.CF4、CCl4、CBr4、CI4中C-X键的键长、键角均相等D.H2O分子中2个O-H键夹角为180°9.下列共价化合物中,共价键的键能最大的是()A.HCl B.HF C.HBr D.HI[10.下列分子含有的电子数目与HF相同,且只有两个极性共价键的是()A.CO2 B.N2O C.H2O D.CH4参考答案:1.答案: B解析: 180kJ·mol-1=946kJ·mol-1+498kJ·mol-1-2E N-O,所以E N-O=632 kJ·mol-1。
第2课时键参数——键能、键长和键角基础过关练题组一键能1.N—H键键能的含义是()A.由N和H形成1mol NH3所放出的能量B.把1mol NH3中的共价键全部拆开所吸收的能量C.拆开约6.02×1023个N—H键所吸收的能量D.形成1个N—H键所放出的能量2.根据下表中所列的键能数据,判断下列分子中最不稳定的是()化学键H—H H—Cl H—Br Br—Br键能/kJ·mol-1436.0431.8366193.7A.HClB.HBrC.H2D.Br23.下列事实中,能够用键能解释的是()A.氮气的化学性质比氧气稳定B.常温常压下,溴呈液态,碘呈固态C.稀有气体一般很难发生化学反应D.硝酸易挥发,硫酸难挥发4.已知N2+O22NOΔH=+180kJ·mol-1,其中键、键的键能分别为946kJ·mol-1、498kJ·mol-1,则N—O键的键能为()A.1264kJ·mol-1B.632kJ·mol-1C.316kJ·mol-1D.1624kJ·mol-15.下列事实不能..用键能的大小来解释的是()A.N元素的电负性较大,但N2的化学性质很稳定B.H2O比H2S沸点高C.HF、HCl、HBr、HI的稳定性逐渐减弱D.F2比O2更容易与H2反应6.已知一定条件下断裂或形成某些化学键的能量关系如下表:断裂或形成的化学键能量数据断裂1mol H2分子中的化学键吸收能量436kJ断裂1mol Cl2分子中的化学键吸收能量243kJ形成1mol HCl分子中的化学键释放能量431kJ对于反应:H2(g)+Cl2(g)2HCl(g),下列说法正确的是()A.该反应的ΔH>0B.生成1mol HCl时反应放热431kJC.氢气分子中的化学键比氯气分子中的化学键更牢固D.相同条件下,氢气分子具有的能量高于氯气分子具有的能量题组二键长7.下列单质分子中,键长最长、键能最小的是()A.H2B.Cl2C.Br2D.I28.下列说法中正确的是()A.乙烯中碳碳双键的键能是乙烷中碳碳单键的键能的2倍B.N—O键的键长比C—O键的键长长C.1个氮气分子中含有1个σ键和2个π键D.N H4+中4个N—H键的键能不同9.键长是描述共价键的物理量之一,下列各项中的距离属于键长的是()A.水分子中两个氢原子核之间的距离B.氯气分子中两个氯原子核之间的距离C.氩气中两个相邻氩原子核间的距离D.CO2分子中两个氧原子核之间的距离10.(2020上海金山高三一模,)SiF4与SiCl4分子都是正四面体结构。
第二章分子结构与性质第二节共价键第2课时键参数——键能、键长与键角一、选择题1.(2023·山东微山县第二中学高二阶段练习)根据下表中所列键能数据,判断下列分子中,最不稳定的分子是化学键H-H H-Cl H-I Cl-Cl Br-Br键能/kJ·mol-1436431299247193 A.HCl B.HBr C.H2D.Br2【答案】D【解析】分子中,键能越小,分子越不稳定,从表中读出键能最小的是溴,故选D项。
2.(2022·安徽青阳第一中学高二阶段练习)根据键能数据(H-Cl 431 kJ·mol-1,H-I 297 kJ·mol-1),可得出的结论是A.溶于水时,HI比HCl更容易电离B.HI比HCl熔沸点高C.HI比HCl稳定D.拆开等物质的量的HI和HCl,HI消耗的能量多【答案】A【解析】A项,溶于水时,HI、HCl分子内的共价键被破坏,由于H-Cl的键能大于H-I的键能,所以HI 比HCl更容易电离,符合题意;B项,HI、HCl熔化和气化时,并没有破坏共价键,所以HI比HCl沸点高与键能无关,不符合题意;C项,由于H-Cl的键能大于H-I的键能,所以HI不如HCl稳定,不符合题意;D项,拆开等物质的量的HI和HCl,由于HCl的键能大,所以HCl消耗的能量多,不符合题意。
3.(2022·重庆高二阶段练习)关于共价键,下列说法正确的是A.H-Cl键的键能为431.8 kJ·mol-1,H-Br键的键能为366 kJ·mol-1,这可以说明HCl比HBr分子稳定B.共价键都具有方向性C.在分子中,两个成键的原子间的距离叫键长D.键能越大,表示该分子越容易受热分解【答案】A【解析】A项,键能越大,化合物越稳定,正确;B项,H的1s电子为球形对称,s-s电子重叠没有方向性,则H-H键无方向性,错误;C项,键长是分子中两个成键原子的核间平均距离,不是两个成键的原子间的距离,错误;D项,键能越大,表示该分子越难受热分解,错误。
键参数——键能、键长与键角
1.下列分子中键角最大的是()
A.CH4 B.NH3 C.H2O D.CO2
2. Al和Si、Ge和As在元素周期表中金属和非金属过渡的位置上,其单质和化合物在建筑业、电子工业和石油化工等领域应用广泛.请回答下列问题:
(1)As的价电子构型为________.
(2)AlCl3是化工生产中的常用催化剂,熔点为192.6℃,熔融状态以二聚体Al2Cl6形式存在,其中铝原子与氯原子的成键类型是________.
(3)超高导热绝缘耐高温纳米氮化铝(AlN)在绝缘材料中应用广泛,AlN晶体与金刚石类似,每个Al原子与________个N原子相连,与同一个Al原子相连的N原子构成的空间构型为________.在四大晶体类型中,AlN属于________晶体.
(4)Si和C同主族,Si、C和O成键情况如下:
在C和O2
____________________________________________________.
(5)SiCl4(l)常用作烟雾剂,原因是Si存在3d轨道,能同H2O(l)配位而剧烈水解,在潮湿的空气中发烟,试用化学方程式表示其原理______________________.
3.键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
参考以下表格的键能数据,回答下列问题:
SiC__________Si; SiCl4___________SiO2
(2)工业上高纯硅可通过下列反应制取:
SiCl4(g) + 2H2(g)高温 Si(s)+4HCl(g) 计算该反应的反应热△H为___ ___ kJ/mol。
4.以下说法中正确的是()
A.分子中键能越大,键长越长,则分子越稳定
B.元素周期表中的第ⅠA族(除H外)和第ⅦA族元素的原子间不能形成共价键
C.水分子可表示为HO—H,分子中键角为180°
D.H—O键键能为463 kJ·mol-1,即18gH2O分解成H2和O2时,消耗能量为2×463 kJ
5.根据π键的特征判断C=C键的键能与C—C键的键能的关系正确的是()
A.双键的键能等于单键的键能的2倍
B.双键的键能大于单键的键能的2倍
C.双键的键能小于单键的键能的2倍
D.无法确定
6.下列说法正确的是()
A.键能越大,表示该分子越容易受热分解
B.共价键都具有方向性
C.在分子中,两个成键的原子间的距离叫键长
D.H—Cl的键能为431.8kJ·mol-1,H—Br的键能为366kJ·mol-1,这可以说明HCl比HBr 分子稳定
7.下列分子中键角最大的是()
A.CH4 B.NH3 C.H2O D.CO2
8. AB、CD、EF均为1∶1型离子化合物,其中A、C、E为+2价,B、D、F为-2价,根据下表数据判断它们的熔点由高到低的顺序是()
.EF>AB>CD
9.下列说法中正确的是()
A.烯中C===C的键能是乙烷中C—C的键能的2倍
B.氮气分子中含有1个σ键和2个π键
C.N—O键的极性比C—O键的极性大
D.NH4+中4个N—H键的键能不相同
10.键能的大小可以衡量化学键的强弱。
下列说法中错误的是()
A.4
C. C—C的键能大于Si—Si D.拆开1 mol晶体硅中的化学键所吸收的能量为176kJ
参考答案:
1.答案: D
解析:键角最大值是180°,二氧化碳是直线型分子。
2.答案:(1)[Ar]4s24p3(2)共价键(或σ键)
(3)4 正四面体原子
(4)Si-O键的键能大于C-O键的键能,C=O键的键能大于Si=O键的键能,所以Si和O形成单键分子,而C和O以双键形成稳定分子
(5)SiCl4(l)+3H2O(l)===H2SiO3(s)+4HCl(aq)
解析:(1)As是第4周期第ⅤA族元素,其最外层电子有5个,分别在4s和4p轨道上,其价电子排布式为:[Ar]4s24p3;(2)从题中可以看出氯化铝的熔点相对较低,可能是分子晶体,所以氯原子和铝原子之间应是共价键;(3)金刚石是原子晶体,而AlN与金刚石类似,应是原子晶体;(4)从键能的角度来看,碳氧双键的键能比碳氧单键的键能大得多,而硅氧双键和硅氧单键之间键能差别较小;同时碳氧双键的键能比硅氧双键的键能大.(5)SiCl4水解应生成H4SiO4,但原硅酸不稳定,易脱水生成硅酸.
3.答案:(1) >,< (2) +236
解析:
4.答案: B
解析:分子中键能越大,键长越短,分子越稳定,选项A错误;元素周期表中的ⅠA族(除H外)是活泼金属,ⅦA族元素是活泼非金属,它们形成的化合物中是离子键而不是共价键,选项B正确;水分子中键角为105°,选项C错误;18 g H2O分解成氢原子和氧原子时消耗能量为2×463 kJ,选项D错误。
5.答案: C
解析:根据题中所给出的信息分析,本题重点考查的是键参数的相关知识。
6.答案: D
解析:键能越大,分子越稳定,A项错,D项正确。
H—H键没有方向性,B项错。
形成共价键的两个原子之间的核间距叫键长,C项错。
7.答案: D
解析: CH4为正四面体形,键角为109.5°;NH3为三角锥形,键角107.3°;H2O为V形分子,键角为104.5°;CO2为直线形分子,键角为180°。
8.答案: D
解析:对于组成和结构相似的离子化合物,键长越小,键能越大,其晶格能越大,熔、沸点越高。
9.答案: D
解析:有机化合物中,碳原子与碳原子的原子轨道之间以“肩并肩”的方式形成π键的重叠程度要比以“头碰头”的方式形成σ键的重叠程度小得多。
两个碳原子之间形成的σ键比π键牢固,σ键的键能大于π键。
乙烯中两个碳原子间存在一个σ键和一个π键,乙烷中两
个碳原子间存在一个σ键,乙烯中C===C的键能应当大于乙烷中C—C的键能且小于乙烷中C—C的键能的2倍。
氮气分子中有三个共价键,1个σ键和2个π键,所以B选项的说法正确,符合题意。
形成共价键的两个原子对电子的吸引能力差别越大,共价键的极性就越强;N原子与O原子吸电子能力的差值小于C与O吸电子能力的差值,N—O键的极性比C—O键的极性小。
在NH4+中参与成键的8个电子分布在原子最外层的4个能量相等的sp3杂化轨道中,4个N—H键的键能键长键角都相等,D项说法错误。
10.答案: D
解析:。