键参数——键能、键长与键角
- 格式:doc
- 大小:34.00 KB
- 文档页数:2

第2课时键参数——键能、键长与键角题组一键参数——键能、键长与键角1.下列说法错误的是()A.键能是衡量化学键稳定性的参数之一,键能越大,则化学键就越牢固B.键长与共价键的稳定性没有关系C.键角是两个相邻共价键之间的夹角,说明共价键有方向性D.共价键是通过原子轨道重叠并共用电子对而形成的,所以共价键有饱和性2.下列说法正确的是()A.在分子中,两个原子间的距离叫键长B.非极性键的键能大于极性键的键能C.键能越大,表示该分子越容易受热分解D.H—Cl的键能为431 kJ·mol-1,H—I的键能为297 kJ·mol-1,这可说明HCl分子比HI分子稳定3.(2022·长沙高二检测)下列关于键参数的说法错误的是()A.双键的键能比单键的键能大B.一般来说,原子半径越小的原子形成的共价键键长越短C.H—F的键长是H—X中最短的D.可以利用X射线衍射实验测定共价键的键长等参数4.(2022·海南国兴中学高二检测)NH3分子的空间结构是三角锥形,而不是正三角形的平面结构,解释该事实的充分理由是()A.NH3分子中的共价键为极性键B.分子内3个N—H的键长相等,键角相等C.NH3分子内3个N—H的键长相等,3个键角都等于107°D.NH3分子内3个N—H的键长相等,3个键角都等于120°题组二键参数的应用5.(2022·西安高二检测)关于键长、键能和键角,下列说法不正确的是()A.通过反应物和生成物分子中键能数据可以粗略预测反应热的大小B.键长越长,键能越小,共价化合物越稳定C.键角是确定多原子分子空间结构的重要参数D.同种原子间形成的共价键键长长短总是遵循:三键<双键<单键。

第二章分子结构与性质第一节共价键第2课时键参数——键能、键长与键角学习目标1.知道共价键的键能、键长和键角可以用来描述键的强弱和分子的空间结构。
2.能根据共价键的结构特点说明简单分子的某些性质。
核心素养宏观辨识与微观探析:通过键参数对共价键的描述以及对物质化学性质、结构的影响,探析微观结构对宏观性质的影响,从宏观和微观相结合的视角分析解决实际问题。
证据推理与模型认知:结合键参数对物质结构与性质的影响,运用模型解释化学现象,揭示现象的本质和规律。
知识梳理一、共价键的三个键参数1.键能(1)概念:气态分子中1 mol化学键解离成所吸收的能量。
单位是kJ·mol-1。
(2)条件:键能通常是298.15 K,101 kPa条件下的标准值。
(3)实例:气态氢原子形成1 mol H—H释放的最低能量为436.0 kJ,则H—H的键能为。
(4)应用:下表中是H—X的键能数据①若使2 mol H—Cl断裂为气态原子,则发生的能量变化是吸收的能量。
②表中共价键最难断裂的是,最易断裂的是。
③由表中键能数据大小说明键能与分子稳定性的关系:HF、HCl、HBr、HI的键能依次,说明四种分子的稳定性依次,即HF分子很稳定,最分解,HI分子最不稳定,最分解。
2.键长(1)概念:构成化学键的两个原子的核间距。
如在Cl2分子中,两个氯原子的核间距就是Cl—Cl的键长。
(2)应用①判断共价键的稳定性键长越短,往往键能,表明共价键越。
②判断分子的空间结构键长是影响分子空间结构的因素之一。
如CH4分子的空间结构是正四面体形,而CH3Cl的空间结构是四面体形,即不是正四面体形,其原因是。
(3)实例:下列三种分子:①H2、②Cl2、③Br2,共价键的键长最长的是,键长最短的是,键能最大的是。
3.键角(1)概念:在多原子分子中,两个相邻共价键之间的夹角。
(2)意义:键角可反映分子的空间结构,是描述分子空间结构的重要参数,多原子分子的键角一定,表明共价键具有。



第2课时键参数——键能、键长与键角基础巩固1.下列说法正确的是()A.分子的结构是由键角决定的B.共价键的键能越大,共价键越牢固,由该键形成的分子越稳定C.CF4、CCl4、CBr4、CI4中C—X(X===F、Cl、Br、I)键的键长、键角均相等D.H2O分子中两个O—H键的键角为180°解析分子的结构是由键参数——键角、键长决定的,A项错误;由于F、Cl、Br、I的原子半径不同,故C—X(X=F、Cl、Br、I)键的键长不相等,C项错误;H2O分子中两个O—H键的键角为105°,D项错误。
答案B2.根据π键的成键特征判断C===C的键能与C—C键能的数量关系()A.双键的键能等于单键的键能的2倍B.双键的键能大于单键的键能的2倍C.双键的键能小于单键的键能的2倍D.无法确定解析由于π键的键能比σ键键能小,双键中有一个π键和一个σ键,所以双键的键能小于单键的键能的2倍。
答案C3.右表为元素周期表前4周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是()A.W、R元素单质分子内都存在非极性键B.X、Z元素都能形成双原子分子C.键长W—H<Y—H,键的极性Y—H>W—HD.键长X—H<W—H,键能X—H<W—H解析由元素在周期表中的位置可知,X为N、W为P、Y为S、R为Ar、Z为Br。
白磷单质中存在非极性键,但稀有气体分子为单原子分子,分子中没有化学键,A错误;氮气、溴单质都是双原子分子,B正确;原子半径W>Y,故键长W—H>Y—H,电负性W<Y,元素电负性越大,对键合电子吸引力越大,与H元素形成的化学键极性越大,故键的极性Y—H>W—H,C错误;原子半径W>X,故键长W—H>X—H,键长越短,键能越大,故键能W—H<X—H,D错误。
答案B4.下列说法中正确的是()A.分子中键能越大,键长越小,则分子越稳定B.只有非金属原子之间才能形成共价键C.水分子可表示为H—O—H,分子中键角为180°D.H—O键键能为463 kJ/mol,即18 g H2O分解成H2和O2时,消耗能量为(2×463) kJ解析在分子中键能越大,键长越小,分子越稳定,A正确;有些金属和非金属之间也能形成共价键,如AlCl3,B错误;水分子中两个H—O键的键角为105°,C错误;H—O键键能为463 kJ/mol指的是拆开1 mol H—O键形成气态氢原子和氧原子所吸收的能量为463 kJ,1 mol H2O中含2 mol H—O键,需吸收(2×463) kJ的能量形成气态氢原子和氧原子,但氢原子和氧原子进一步形成H2和O2时释放能量,即需知H—H键和O===O键的键能方能计算,故D错。

规律:成键原子相同的共价键的键能:单键的键能<双键的键能<三键的键能形成共价键的原子的原子半径越大,键能越小。
2.键长概念:构成化学键的两个原子的核间距。
单位:pm(1 pm=10-12m)原子半径决定化学键的键长,原子半径越小,共价键的键长越短。
【展示】展示常见化学键的键长。
【学生活动】请找出数据中的规律。
规律:同种类型的共价键,成键原子的原子半径越小,键长越小。
成键原子相同的共价键的键长:单键键长>双键键长>三键键长一般地,键长越短, 键能越大,共价键越牢固,由此形成的分子越稳定。
【思考交流】F-F不符合“键长越短,键能越大”的规律,为什么?【讲解】F原子半径很小,因此F-F的键长短,而由于键长短,两个F原子形成共价键时,原子核之间的距离小,排斥力大,因此键能小。
【思考交流】同为三原子分子,为什么CO2的空间结构是直线形,而H2O的空间结构是V形(角形)?【讲授】3.键角概念:在多原子分子中,两个相邻共价键之间的夹角称为键角。
【展示】CO2、H2O、NH3分子的键角。
【讲解】二氧化碳分子键角呈180°,分子呈现直线形;水分子键角呈105°,分子呈现V形,氨分子键角是107°,分子呈现三角锥形。
键角可反映分子的空间构型,是描述分子结构的重要参数,多原子分子的键角一定,表明共价键具有方向性。
【讲授】键参数的应用1、键能的应用①判断共价键的稳定性从键能的定义可知,破坏1mol化学键所需能量越多,即共价键的键能越大,则共价键越牢固。
②判断分子的稳定性一般来说,结构相似的分子中,共价键的键能越大,分子越稳定。
如分子的稳定性:HF>HCl>HBr>HI。
③估算化学反应的反应热同一化学键解离成气态原子所吸收的能量与气态原子结合形成化学键所释放的能量在数值上是相等的,故根据化学键的键能数据可计算化学反应的反应热,即ΔH=反应物中化学键键能之和﹣生成物中化学键键能之和。
【思考交流】N2、O2、F2分别与H2的能力依次增强,从键能的角度应如何理解这一化学事实?【讲解】N2、O2、F2与H2的反应能力依次增强,其原因是N≡N键、O=O键、F—F键的键能依次为946 kJ·mol-1、497.3 kJ·mol-1、157 kJ·mol-1,键能越来越小,共价键越来越容易断裂。

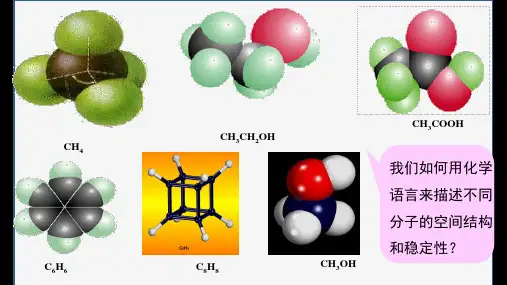


三角锥形107°NH3
V形(角形)105°H2O
直线形180°CO2、CS2、CH≡CH
(4)部分键角图解
【归纳总结】
(1)键长与分子空间结构的关系:键长是影响分子空间结构的因素之一。
如CH4分子的空间结构是正四面体,而CH3Cl只是四面体而不是正四面体,原因是C—H和C—Cl的键长不相等。
(2)定性判断键长的方法
①根据原子半径进行判断。
在其他条件相同时,成键原子的半径越小,键长越短。
①根据共用电子对数判断。
就相同的两原子形成的共价键而言,当两个原子形成双键或者三键时,由于原子轨道的重叠程度增大,原子之间的核间距减小,键长变短,故单键键长>双键键长>三键键长。
第2课时键参数——键能、键长与键角因此,原子形成共价键相互结合,放出能量,由此形成了键能的概念。
键能是气态基态原子形成l mol化学键释放的最低能量。
例如,形成l mol H—H键释放的最低能量为436.0 kJ,形成1 mol N≡N键释放的最低能量为946 kJ,这些能量就是相应化学键的键能,通常取正值。
[板书]1.键能:气态基态原子形成1 mol化学键释放的最低能量。
通常取正值。
[讲]单位kJ/mol,大家要注意的是,应为气态原子,以确保释放能量最低。
[投影]表2-1某些共价键键能[思考与交流]键能大小与化学键稳定性的关系?[讲]键能越大,即形成化学键时放出的能量越多,意味着这个化学键越稳定,越不容易被打断。
结构相似的分子中,化学键键能越大,分子越稳定。
[板书] 键能越大,化学键越稳定。
[讲]键长是衡量共价键稳定性的另一个参数,是形成共价键的两个原子之间的核间距。
学生观察教材表2-1,对表2-1进行总结:键能越大,化学键越稳定。
[板书]2.键长:形成共价键的两个原子之间的核间距。
[投影]表2-2 某些共价键的键长[讲]1 pm=10-12 m。
因成键时原子轨道发生重叠,键长小于成键原子的原子半径各。
是衡量共价键稳定性的另一个参数。
[投影]共价半径:相同原子的共价键键长的一半称为共价半径。
[思考与交流]键长与键能的关系?[板书]键长越短,键能越大,共价键越稳定。
[过渡]分子的形状有共价键之间的夹角决定,下面我们学习键角。
[板书]3.键角:在原子数超过2的分子中,两个共价键间的夹角称为键角。
[讲]在原子数超过2的分子中,两个共价键之间的夹角称为键角。
例如,三原子分子CO2的结构式为O=C=O,它的键角为180°,是一种直线形分子;又如,三原子分学生观察教材表2-2,对表2-2进行总结:键长越短,键能越大,共价键越稳定。
学生总结:键能和键长都是表述化学键稳定性的参数。
键能、键长、键角及其应用键参数:1、键能:①概念:气态基态原子形成1mol化学键释放的最低能量.通常取正值.单位:kJ/mol.如:形成1molH﹣H键释放的最低能量为436.0kJ,则H﹣H键能为436.0kJ/mol.②键能与化学键稳定性的关系:键能越大,化学键越牢固,分子越稳定.如H﹣H键的键能为436kJ/mol,Cl﹣Cl的键能为243kJ/mol.2、键长:①概念:形成共价键的两个原子之间的核间距.②键长与共价键的稳定性的关系:两个原子核之间的距离.键长越短,键能越大,化学键越牢固,分子越稳定.如H﹣F,H﹣Cl,H﹣Br,H﹣I键长依次递增,键能依次递减,分子的热稳定性依次递减.3、键角:①概念:多原子分子中,两个化学键之间的夹角.②键角的作用:键角一定,表明共价键具有方向性.键角是描述分子立体结构的重要参数,分子的许多性质与键角有关.键角决定空间构型和分子极性.【命题方向】本考点主要考察键能、键长、键角对化学键的影响.题型一:键能、键长和键角相关概念典例1:(2014•黄浦区一模)关于键长、键能和键角,下列说法不正确的是()A.键角是描述分子立体结构的重要参数B.键长的大小与成键原子的半径和成键数目有关C.键能越大,键长越长,共价化合物越稳定D.键角的大小与键长、键能的大小无关分析:A、键角与分子的立体结构有关;B、一般来讲形成共价键的两原子半径之和越小共用电子对数越多则共价键越牢固;C、键长越长,作用力越小,键能越小,化合物越不稳定;D、根据价层电子对互斥理论,中心原子外面的价层电子对数,直接决定分子的形状,同时也决定键角大小的主要因素.解答:A、键长和键角常被用来描述分子的空间构型,键角是描述分子立体结构的重要参数,故A正确;B、形成共价键的两原子半径之和越小共用电子对数越多,则共价键越牢固,键长越短,故B正确;C、键能越大,键长越短,共价化合物越稳定,故C错误;D、键角是分子内同一原子形成的两个化学键之间的夹角,与其分子结构有关,与键长键能无关,故D正确;故选:C.点评:本题考查了化学键的键参数的含义和判断,掌握概念的内涵是解题关键,题目较简单.题型二:键能的影响因素及应用典例2:下列物质性质的变化规律,与共价键的键能大小有关且正确的是()A.F2,Cl2,Br2,I2的熔点、沸点逐渐升高B.HF,HC1,HBr,HI的热稳定性依次增强C.金刚石的硬度、熔点、沸点都高于晶体硅D.NaF,NaCI,NaBr,NaI的熔点依次降低分析:A.F2、Cl2、Br2、I2属于分子晶体,影响熔沸点的因素是分子间作用力的大小;B.HF、HI、HBr、HCl属于共价化合物,影响稳定性的因素是共价键;C.金刚石、晶体硅属于原子晶体,影响熔沸点的因素是共价键;D.NaF、NaCl、NaBr、NaI属于离子晶体,影响熔沸点的因素是离子键.解答:A.F2、Cl2、Br2、I2属于分子晶体,影响熔沸点的因素是分子间作用力的大小,物质的相对分子质量越大,分子间作用力越强,沸点越高,与共价键的键能大小无关,故A 错误;B.HF、HI、HBr、HCl属于共价化合物,影响稳定性的因素是共价键,共价键的键能越大越稳定,与共价键的键能大小有关,但是HF,HC1,HBr,HI的热稳定性依次减弱,故B 错误;C.金刚石、晶体硅属于原子晶体,原子之间存在共价键,原子半径越小,键能越大,熔沸点越高,与共价键的键能大小有关且正确,故C正确;D.NaF、NaCl、NaBr、NaI属于离子晶体,离子半径越大,键能越小,熔沸点越低,与共价键的键能大小无关,故D错误.故选C.点评:本题考查晶体的熔沸点的比较,分子的稳定性,题目难度不大,注意晶体的类型以及影响晶体熔沸点高低的因素的判断.【解题思路点拨】键能和键长是共价键稳定性的重要参数,键角是分子在空间立体结构的重要参数,要学会根据这些参数分析判断分子的结构.。
§2-2 键参数——键能、键长与键角
【学习目标】1、初步了解键能、键长、键角的概念,能根据其数据认识共价键的强弱;
2、了解键能的应用—与反应热、分子稳定性的关系。
【重、难点】键参数及其应用
一、键参数包括____________、____________、________________
1.键能
(1)定义:___________原子形成________mol化学键释放的______能量。
(2)单位:_____________ 通常取_________
如H—H键的键能是436.0kJ·mol-1,表示_______________________________________。
(3)意义
①表示共价键的强弱:原子形成共价键时,轨道重叠程度______,体系能量降低______,释放出的能量_______,形成的共价键的键能_______,共价键__________。
②表示分子的稳定性:键能_________,分子越_________。
-1
分解为气态原子时,需要(填)能量;
2
(2)1mol H2在2 mol Cl2中燃烧,放出的热量kJ;
(3)由表中所列化学键形成的单质分子中,最稳定的是,最不稳定是,形成的化合物分子中,最稳定的是,最不稳定的是;
(4)在一定条件下,1mol H2与足量的Cl2、Br2、I2分别反应,放出热量由多到少的是__________________________________;
(5)预测1mol H2在足量F2中燃烧比在Cl2中放热。
【归纳】键能的应用——反应热与键能的关系
由键能求反应热的公式为:△H =____________的键能总和—____________的键能总和2.键长:
(1)概念:形成共价键的两个原子之间的________________
相同原子的共价键键长的一半称为_____________
(2)意义:一般来说,键长______,键能就_______,键就_______,分子就_________,受热时就________,热稳定性_________。
(3)影响因素:影响共价键长短的因素是_________。
原子半径越小,键长越短。
【思考】电负性大的双原子分子,键长短的键能一定大吗?__________________
3.键角
(1)定义:在原子数超过2的分子中,__________________的夹角。
多原子分子的键角一定,表明_______________________。
(2)键角对分子性质的影响:键角是描述__________________的重要参数。
【练习】写出下列分子的键角及空间构型:
CO2:________________________、_______________________
H2O:________________________、________________________
NH3:________________________、________________________
CH4:________________________、___________ _ ______
C2H4:_______________________、__________ _ __________
二、等电子原理
等电子原理是指________相同、________相同的分子具有相似的化学键特征,它们的许多性质(主要是物理性质)是________的。
【随堂检测】
1.下列说法正确的是()
A.键角决定了分子的结构
B.共价键的键能越大,共价键越牢固,含有该键的分子越稳定
C.CH4,CCl4中键长相等、键角不同
D.C=C中的键能是C—C中键能的两倍
2.下列各说法中正确的是()
A.分子中键能越高,键长越大,则分子越稳定
B.元素周期表中的ⅠA族(除H外)和ⅦA族元素的原子间不能形成共价键
C.水分子可表示为HO—H,分子中键角为180°
D.H—O键键能为463KJ/mol,即18克H2O分解成H2和O2时,消耗能量为2×4 3.能说明BF3分子中的4个原子处于同一平面的理由是()
A.3个B—F的键能相同
B.3个B—F的键长相同
C.3个B—F的键角均为120°
D.3个B—F的键均为σ键
4.1919年,langmuir提出等电子原理:原子数相同、最外层电子总数相同的分子,互称为等电子体。
等电子体的结构相似,物理性质相近。
(1)根据上述原理,仅由第二周期元素组成的共价分子中,互为等电子体的是:________ 和________;________和________。
(2)此后,等电子原理又有发展。
例如:由短周期元素组成的物质中,与NO2-互为等电子体的分子有:____________________。