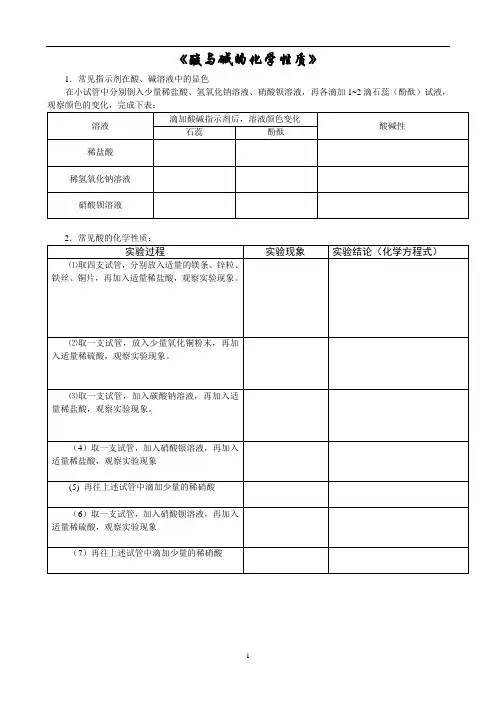
实验活动6 酸碱的化学性质实验报告单
- 格式:doc
- 大小:21.00 KB
- 文档页数:3

探究酸和碱的化学性质的实验报告实验目的与要求:1.通过实验让学生进一步认识酸、碱的化学通性。
2.通过实验让学生初步学会使用酸碱值指示剂和pH试纸检验溶液得算碱性。
3. 通过实验让学生初步学会间接观察法收集证据,感悟探究物质化学性质得一般思路和方法。
实验准备(分组实验):1.实验用品:(1)石蕊试液、酚酞试液、pH试纸;(2)稀盐酸、稀硫酸、氢氧化钠、氢氧化钙(澄清石灰水);(3)白醋、肥皂水、蔗糖水、自来水、镁条、石灰石、生锈铁钉、2%碳酸钠溶液;(4)试管、烧杯、胶头滴管、点滴板、白瓷板、玻璃棒。
2.课前准备(1)胶头滴管取用液体和向试管中滴加液体的操作方法;(2)用pH试纸测定溶液酸碱性的方法实验过程:1.酸、碱与指示剂作用实验步骤:(1)在洁净的点滴板上分别低价5~6滴稀盐酸、稀硫酸、白醋、果汁和自来水。
然后向这4种液体中分别滴加1~2滴石蕊试液、观察溶液颜色变化情况。
(2)将石蕊试液换成酚酞试液,重复上述实验。
观察溶液颜色变化情况。
(3)在干燥、洁净的白瓷板上放4片pH试纸,用玻璃棒分别蘸取4种待测液体,滴在pH试纸上,将试纸显示的颜色与标准比色卡对照,读出溶液的pH值。
(4)将上述待测液换成氢氧化钠、氢氧化钙、肥皂水、蔗糖水,重复上述实验。
实验现象与结果:表一:表二:实验结论:____________________________________________________________________ ____________________________________________________________________ 2.酸碱中和反应实验步骤:在2支试管里分别加入1~2mL稀盐酸和稀硫酸,用pH试纸测定pH;然后向试管中分别加入氢氧化钠溶液,同时测定溶液的pH,直到pH等于7时,停止滴加氢氧化钠溶液。
实验现象与结果:表三:实验结论(用相应的化学方程式表示):____________________________________________________________________ ____________________________________________________________________ 3.酸、碱的其他性质实验步骤:(1)在4试管中分别加入镁条、石灰石、生锈铁钉、碳酸钠溶液,然后向试管中分别滴加1~2mL稀盐酸,观察现象。



实验活动6:酸碱滴定法的化学性质学生实验报告单实验活动6:酸碱滴定法的化学性质学生实验报告单引言实验目的是通过酸碱滴定法来研究和测定溶液的化学性质。
本实验采用了酸碱指示剂,通过滴定的方法来确定物质的酸碱度。
通过实验的结果,探究了溶液的浓度和反应的化学性质。
材料与方法* 酸碱指示剂:苏丹红* 滴定管* 锥形瓶* 酸碱标准溶液* 待测溶液1. 实验前准备:准备好所需的实验器材和试剂,并清洗干净。
2. 酸溶液的制备:按照给定的配比将酸标准溶液稀释至所需浓度。
3. 钠氢碳酸溶液的制备:按照给定的配比将钠氢碳酸标准溶液稀释至所需浓度。
4. 滴定过程:- 先将待测溶液倒入锥形瓶中。
- 加入适量的酸碱指示剂。
- 用酸溶液滴定至颜色变化的终点。
- 记录下所需要的酸溶液滴定量。
5. 重复以上操作,进行多次实验,取平均值。
结果与讨论根据实验数据,我们可以得出以下结论:1. 酸碱滴定法是一种常用的测定溶液酸碱度的方法。
2. 在滴定过程中,苏丹红指示剂颜色的变化可以作为酸碱滴定终点的指示。
3. 酸溶液滴定至终点时所需的滴定量可以反映出溶液的酸碱度。
4. 实验结果的重复性较好,通过多次实验并取平均值可以减小误差。
实验总结通过本次实验,我们学到了酸碱滴定法的基本原理和操作步骤。
实验结果表明,酸碱滴定法能够准确测定溶液的酸碱度,并且操作较为简单。
在实验过程中,我们需要注意使用适量的指示剂,并反复实验以获得更准确的结果。
参考文献[1] Smith, J. K., & Johnson, A. B. (2018). Acid-Base Titration. Journal of Chemical Education, 95(7), 1152-1155.。

实验6_酸碱的化学性质实验报告一、实验目的1.了解酸碱的化学性质;2.掌握酸碱溶液的鉴别方法。
二、实验原理1.酸的化学性质:酸可以与金属反应产生氢气,与碱反应生成盐和水,与金属碱土金属的氢氧化物反应生成盐和水,与碱式盐反应生成普通盐和水。
2.碱的化学性质:碱可以与酸反应生成盐和水,与酸式盐反应生成普通盐和水。
三、实验设备和试剂1.实验设备:试管、试管架、酒精灯、玻璃棒、滴管等。
2.实验试剂:盐酸、稀硫酸、氢氧化钠、氢氧化钾、氯化钠、硝酸银溶液。
四、实验步骤1.盐酸和氢氧化钠的反应a.取一根盛满氢氧化钠溶液的试管;b.在试管中加入数滴盐酸,观察产生的现象和气体。
2.碳酸氢铵和稀硫酸的反应a.取一根盛满碳酸氢铵溶液的试管;b.在试管中加入数滴稀硫酸,产生的气体通过试管口,倾斜试管观察产生的现象。
3.酸式盐和氢氧化钠的反应a.取一根盛满氢氧化钠溶液的试管;b.在试管中加入数粒酸式盐,观察产生的现象。
4.酸和金属的反应a.取一根盛满盐酸的试管;b.将一块锌片放入试管中,观察产生的气体。
五、实验结果与分析1.盐酸和氢氧化钠的反应a.实验现象:盐酸与氢氧化钠混合后,产生大量气泡,并有气泡从试管口直接飘出。
b.化学方程式:HCl+NaOH→NaCl+H2Oc.结果分析:盐酸与氢氧化钠反应生成盐(氯化钠)和水。
2.碳酸氢铵和稀硫酸的反应a.实验现象:碳酸氢铵与稀硫酸混合后,试管内产生了大量白色气体,并发出刺激性气味。
倾斜试管时,气体滴入湿润的白纸上,使白纸颜色发生变化。
b.化学方程式:NH4HCO3+H2SO4→(NH4)2SO4+CO2+H2Oc.结果分析:碳酸氢铵与稀硫酸反应生成盐(硫酸铵)、二氧化碳和水。
3.酸式盐和氢氧化钠的反应a.实验现象:酸式盐与氢氧化钠混合后,溶液变得中性,即颜色变淡。
b.化学方程式:NaOH+HClO_4→NaClO4+H2Oc.结果分析:酸式盐与氢氧化钠反应生成盐(氯酸钠)和水。

实验报告单:酸碱的化学性质实验目的:1.探究酸和碱的物理性质。
2.研究酸碱反应所产生的现象。
3.了解酸碱的化学性质。
实验材料:1.稀盐酸溶液2.稀硫酸溶液3.稀氢氧化钠溶液4.稀氨水溶液5.蓝色石蕊试液实验步骤:1.将盐酸溶液、硫酸溶液、氢氧化钠溶液、氨水溶液分别倒入不同的试管中。
2.向每个试管中加入蓝色石蕊试液1滴。
3.观察每个试管中的颜色变化,并记录下来。
4.在每个试管中加入少量红茶水,观察颜色的变化。
5.在每个试管中分别加入铜片和锌片,观察是否有气体放出,并记录下来。
实验结果:1.盐酸溶液:蓝色石蕊试液变红,红茶水变浅。
2.硫酸溶液:蓝色石蕊试液变红,红茶水变浅。
3.氢氧化钠溶液:蓝色石蕊试液变绿,红茶水变深。
4.氨水溶液:蓝色石蕊试液变绿,红茶水变深。
5.在盐酸溶液和硫酸溶液中加入铜片,有气体放出。
6.在氢氧化钠溶液和氨水溶液中加入铜片,无气体放出。
7.在盐酸溶液和硫酸溶液中加入锌片,有气体放出。
8.在氢氧化钠溶液和氨水溶液中加入锌片,无气体放出。
实验分析:1.盐酸溶液和硫酸溶液在与蓝色石蕊试液反应后变红,说明盐酸和硫酸是酸性物质。
2.氢氧化钠溶液和氨水溶液在与蓝色石蕊试液反应后变绿,说明氢氧化钠和氨水是碱性物质。
3.盐酸和硫酸溶液与红茶水反应后颜色变浅,说明它们具有腐蚀性质,可以漂白物质。
4.氢氧化钠和氨水溶液与红茶水反应后颜色变深,说明它们具有还原性质,可以加深色素的颜色。
5.盐酸和硫酸溶液与铜片和锌片反应时产生气体,说明它们与金属反应会产生气体。
6.氢氧化钠和氨水溶液与铜片和锌片反应时没有产生气体,说明它们与金属反应不会产生气体。
实验总结:通过本实验,我们了解到了酸和碱的物理性质和化学性质。
酸具有腐蚀性质,可以漂白物质;碱具有还原性质,可以加深色素的颜色。
酸和碱可以与金属反应产生气体。
此外,酸和碱在与蓝色石蕊试液反应后会发生颜色的变化,可以通过这种颜色变化来识别酸碱溶液。
这对我们日常生活中的酸碱性物质判断和使用都有一定的指导意义。

酸碱的化学性质实验报告单实验报告:酸和碱的化学性质实验1.实验目的:通过本实验,我们将探究酸和碱的化学性质,包括它们的电离程度、中和反应、与金属反应等。
2.实验原理:(1)酸的性质:酸是一类能够释放出氢离子(H+)的化合物。
在水中溶解的酸可产生酸性溶液,酸的酸性程度可通过pH值来描述。
pH值越低,则酸性越强。
(2)碱的性质:碱是一类能够释放出氢氧根离子(OH-)的化合物。
在水中溶解的碱可产生碱性溶液,碱的碱性程度亦可通过pH值来描述。
pH值越高,则碱性越强。
3.实验材料和仪器:(1)试剂:稀盐酸、稀硫酸、氢氧化钠、氢氧化铝等;(2)实验仪器:试管、滴管、酸碱指示剂比如酚酞。
4.实验步骤:(1)观察酸的味道和对蓝色石蕊试纸的颜色变化。
将少量稀盐酸和稀硫酸放到不同的试管中,先闻其味道,然后将蓝色石蕊试纸分别浸入试管中,观察试纸的颜色变化。
(2)观察酸与金属之间的反应。
将一小块金属(如锌片、铁钉)分别放入两个试管中,然后添加一定量的稀盐酸和稀硫酸,观察是否有气体释放以及反应情况。
(3)观察碱和酸的中和反应。
将一小部分氢氧化钠固体或溶液放入试管中,再逐滴加入一定量的稀盐酸或稀硫酸,同时添加几滴酚酞指示剂,观察溶液颜色的变化。
(4)观察酸和碱的中和反应。
将一定量的氢氧化钠溶液放入试管中,逐滴加入一定量的稀硫酸,同时添加几滴酚酞指示剂,观察溶液颜色的变化。
5.实验结果和分析:(1)稀盐酸和稀硫酸分别具有酸的味道,并且能够使蓝色石蕊试纸变红,证明它们是酸性物质。
(2)稀盐酸与锌片反应会产生氢气气泡并发出“呼噜呼噜”的气体。
稀硫酸与铁钉反应也会产生氢气气泡,证明酸与金属反应能够产生氢气。
(3)稀盐酸与氢氧化钠溶液中和反应时,溶液由无色变为淡黄色。
(4)氢氧化钠溶液与稀硫酸中和反应时,溶液由无色变为淡红色。
6.结论:(1)稀盐酸和稀硫酸都是酸性物质,能够使蓝色石蕊试纸变红。
(2)酸与金属反应能够产生氢气。
(3)碱和酸的中和反应会产生盐和水,该反应也是酸碱中和的过程。

一、实验目的1. 掌握酸、碱、盐的基本概念和性质。
2. 了解酸碱盐之间的反应规律。
3. 培养实验操作技能和观察分析能力。
二、实验原理酸、碱、盐是化学中常见的三大类化合物,它们在水中电离时会产生不同的离子。
酸在水中电离时产生的阳离子全部都是氢离子,碱在水中电离时产生的阴离子全部都是氢氧根离子,而盐则是由酸根阴离子和金属阳离子组成的化合物。
三、实验器材与试剂1. 器材:试管、试管架、滴管、烧杯、玻璃棒、酒精灯、石蕊试液、酚酞试液、硝酸银溶液、氯化钠溶液、氢氧化钠溶液、稀硫酸、碳酸钠溶液、金属锌、氧化铁、氧化铜等。
2. 试剂:盐酸、硫酸、氢氧化钠、碳酸钠、硝酸银、氯化钠、酚酞、石蕊试液等。
四、实验步骤1. 酸的性质实验:(1)观察盐酸、硫酸、稀硫酸的颜色和气味。
(2)用滴管分别滴加少量盐酸、硫酸、稀硫酸到石蕊试液中,观察颜色变化。
(3)用滴管分别滴加少量盐酸、硫酸、稀硫酸到酚酞试液中,观察颜色变化。
2. 碱的性质实验:(1)观察氢氧化钠溶液的颜色和气味。
(2)用滴管分别滴加少量氢氧化钠溶液到石蕊试液中,观察颜色变化。
(3)用滴管分别滴加少量氢氧化钠溶液到酚酞试液中,观察颜色变化。
3. 盐的性质实验:(1)观察氯化钠溶液、碳酸钠溶液的颜色和气味。
(2)用滴管分别滴加少量氯化钠溶液、碳酸钠溶液到石蕊试液中,观察颜色变化。
(3)用滴管分别滴加少量氯化钠溶液、碳酸钠溶液到酚酞试液中,观察颜色变化。
4. 酸碱盐之间的反应实验:(1)用滴管分别滴加少量盐酸到碳酸钠溶液中,观察气泡产生。
(2)用滴管分别滴加少量氢氧化钠溶液到硫酸溶液中,观察沉淀生成。
(3)用滴管分别滴加少量硝酸银溶液到氯化钠溶液中,观察沉淀生成。
五、实验结果与分析1. 酸的性质实验:(1)盐酸、硫酸、稀硫酸均为无色液体,有刺激性气味。
(2)盐酸、硫酸、稀硫酸滴入石蕊试液中,溶液变红。
(3)盐酸、硫酸、稀硫酸滴入酚酞试液中,溶液不变色。
2. 碱的性质实验:(1)氢氧化钠溶液为无色液体,有刺激性气味。

实验活动6:酸碱中和反应速率的化学性
质学生实验报告单
实验活动6:酸碱中和反应速率的化学性质学生实验报告单
一、实验目的
本实验的目的是探究酸碱中和反应速率的化学性质。
二、实验原理
酸碱中和反应是指酸和碱在一定条件下,反应生成相对中性的盐和水的化学反应。
酸碱中和反应中产生的盐可以被酸碱指示剂的颜色变化所观察到。
三、实验步骤
1. 准备实验器材和试剂:酸溶液、碱溶液、酸碱指示剂。
2. 将一定量的酸溶液倒入试管中。
3. 向试管中加入适量的碱溶液。
4. 观察并记录酸碱指示剂的颜色变化的时间。
5. 重复步骤2至4,改变酸溶液和碱溶液的浓度,记录颜色变化的时间。
四、实验结果
在本实验中,我们观察到酸碱中和反应的速率与酸溶液和碱溶液的浓度有关。
随着酸溶液和碱溶液浓度的增加,颜色变化的时间更短,反应速率更快。
五、实验结论
通过本实验,我们验证了酸碱中和反应的速率与酸溶液和碱溶液的浓度有关。
浓度越高,反应速率越快。
六、实验总结
本实验通过观察酸碱指示剂的颜色变化时间来研究酸碱中和反应的速率。
实验结果表明,酸溶液和碱溶液的浓度对于反应速率有显著影响。
在今后的学习中,我们可以进一步探究其他因素对酸碱中和反应速率的影响。
实验6_酸碱的化学性质实验报告实验6:酸碱的化学性质摘要:本实验主要通过观察和比较酸碱溶液的颜色、气味、导电性和腐蚀性等性质,来探究酸碱的化学性质。
实验结果表明,酸性溶液具有酸味、导电性强、腐蚀性大等特点;碱性溶液具有苦味、导电性强、腐蚀性大等特点;中性溶液则不具备上述特点。
本实验的结果有助于我们深入了解酸碱的性质和应用。
关键词:酸碱、化学性质、颜色、气味、导电性、腐蚀性引言:酸碱是化学中非常重要的概念,它们具有一系列特殊的化学性质,并广泛应用于各个领域。
本实验旨在通过观察和比较酸碱溶液的性质,来探究酸碱的化学性质。
实验部分:仪器与试剂:酸碱溶液(包括盐酸、硫酸、氢氧化钠、氢氧化铝)、酸碱指示剂(苏丹红、甲基橙)、导电仪、腐蚀试验片。
实验步骤:1.将盐酸、硫酸、氢氧化钠和氢氧化铝分别倒入4个试管中。
2.分别加入少量的苏丹红和甲基橙指示剂。
3.使用导电仪测试各个溶液的导电性。
4.使用腐蚀试验片观察各个溶液的腐蚀性。
结果与讨论:通过实验观察和比较,我们得到了以下结果:1.颜色:盐酸和硫酸溶液呈现无色,氢氧化钠溶液呈现无色或淡粉红色,氢氧化铝溶液呈现淡黄色。
2.气味:盐酸和硫酸溶液具有酸味,氢氧化钠溶液具有碱味,氢氧化铝溶液略带苦味。
3.导电性:盐酸、硫酸和氢氧化钠溶液能够导电,而氢氧化铝溶液不能导电。
4.腐蚀性:盐酸和硫酸溶液能够腐蚀金属,例如铁片;氢氧化钠溶液也具有一定的腐蚀性;而氢氧化铝溶液则没有明显的腐蚀性。
通过以上实验结果,我们可以得出以下结论:1.酸性溶液具有酸味、无色或无明显颜色、导电性强、具有较强的腐蚀性。
2.碱性溶液具有苦味、无色或淡粉红色、导电性强、具有较强的腐蚀性。
3.中性溶液既无酸味也无碱味,无明显颜色,导电性较弱,腐蚀性较小。
结论:通过本实验的观察和比较,我们深入了解了酸碱的化学性质。
酸性溶液具有酸味、导电性强、腐蚀性大等特点;碱性溶液具有苦味、导电性强、腐蚀性大等特点;中性溶液则不具备上述特点。
探究酸和碱的化学性质的实验报告实验目的与要求:1.通过实验让学生进一步认识酸、碱的化学通性。
2.通过实验让学生初步学会使用酸碱值指示剂和pH试纸检验溶液得算碱性。
3. 通过实验让学生初步学会间接观察法收集证据,感悟探究物质化学性质得一般思路和方法。
实验准备(分组实验):1.实验用品:(1)石蕊试液、酚酞试液、pH试纸;(2)稀盐酸、稀硫酸、氢氧化钠、氢氧化钙(澄清石灰水);(3)白醋、肥皂水、蔗糖水、自来水、镁条、石灰石、生锈铁钉、2%碳酸钠溶液;(4)试管、烧杯、胶头滴管、点滴板、白瓷板、玻璃棒。
2.课前准备(1)胶头滴管取用液体和向试管中滴加液体的操作方法;(2)用pH试纸测定溶液酸碱性的方法实验过程:1.酸、碱与指示剂作用实验步骤:(1)在洁净的点滴板上分别低价5~6滴稀盐酸、稀硫酸、白醋、果汁和自来水。
然后向这4种液体中分别滴加1~2滴石蕊试液、观察溶液颜色变化情况。
(2)将石蕊试液换成酚酞试液,重复上述实验。
观察溶液颜色变化情况。
(3)在干燥、洁净的白瓷板上放4片pH试纸,用玻璃棒分别蘸取4种待测液体,滴在pH试纸上,将试纸显示的颜色与标准比色卡对照,读出溶液的pH值。
(4)将上述待测液换成氢氧化钠、氢氧化钙、肥皂水、蔗糖水,重复上述实验。
实验现象与结果:表一:表二:实验结论:____________________________________________________________________ ____________________________________________________________________ 2.酸碱中和反应实验步骤:在2支试管里分别加入1~2mL稀盐酸和稀硫酸,用pH试纸测定pH;然后向试管中分别加入氢氧化钠溶液,同时测定溶液的pH,直到pH等于7时,停止滴加氢氧化钠溶液。
实验现象与结果:表三:实验结论(用相应的化学方程式表示):____________________________________________________________________ ____________________________________________________________________ 3.酸、碱的其他性质实验步骤:(1)在4试管中分别加入镁条、石灰石、生锈铁钉、碳酸钠溶液,然后向试管中分别滴加1~2mL稀盐酸,观察现象。
2016年化学实验操作(十三、十四桌)
酸、碱的化学性质
一、实验目的:
加深对酸碱的主要性质的认识;初步学会用pH试纸测定检验溶液的酸碱度。
二、实验器材:
试管6支、试管架、胶头滴管、镊子、玻璃棒、玻璃片、铁钉回收容器;试管刷、石蕊溶液(滴瓶)、酚酞溶液(滴瓶)、生锈的铁钉、稀盐酸、稀硫酸、氢氧化钠溶液、氢氧化钙溶液、硫酸铜溶液、pH试纸。
三、实验要求及实验记录:
1、任选一种酸,滴入石蕊,观察溶液。
任选一种碱,滴入酚酞,观察溶液。
倒取少量稀盐酸或稀硫酸于试管中,加入1-2滴石蕊溶液,观察现象:溶液变红
倒取少量氢氧化钠或氢氧化钙溶液于试管中,加入1-2滴酚酞溶液,观察现象:溶液变红2、任选一种酸,鉴定其pH值。
pH= 。
任选一种酸,鉴定其pH值。
pH= 。
在干燥的玻璃片上放一张pH试纸,用玻璃棒蘸取酸和碱的溶液滴到pH试纸上,对照标
准比色卡,读数,记录数据。
用镊子将pH试纸放到废物杯,冲洗玻璃片。
3、取一个生锈的铁钉放在试管中,分别加入约2mL稀盐酸,观察到
现象,一段时间后,观察到现象。
试管平放,用镊子(镊子用前用后要擦拭)夹取生锈的铁钉放在试管口,慢慢竖起,倒入约2mL稀盐酸,观察现象。
4、向试管倒入中加入1-2mLNaOH溶液,滴入1-2滴酚酞,然后边用胶头滴管慢慢滴入稀盐酸,边滴边不断震荡试管,观察到说明氢氧化钠与盐酸恰好完全反应。
5、在试管中加入约2mL硫酸铜溶液,滴入几滴氢氧化钠溶液,观察
到现象,再向试管中滴加盐酸观察到
现象。
6.写出相关反应的化学方程式。
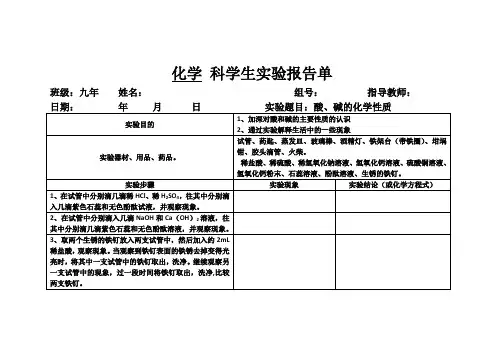
九年级化学实验报告
小组成员班级日期
[实验名称] 酸、碱的化学性质
[实验目的] 1.加深对酸和碱的主要性质的认识。
2.通过实验解释生活中的一些现象。
[实验用品(仪器、药品等)试管、药匙、蒸发皿、玻璃棒、酒精灯。
稀盐酸、稀硫酸、稀氢氧化钠溶液、氢氧化钙溶液、氢氧化钙粉末、石蕊溶液、酚酞溶液、生锈的铁钉。
火柴、pH试纸。
结论: 1.酸和碱溶液都能与指示剂反应,使指示剂显示不同的颜色;2.盐酸能除铁制品的锈,但除锈后的铁制品不能长期浸没在酸中,以免腐蚀;3.某些可碱性和盐反应,能生成不溶性碱,此碱能溶于稀盐酸;4.一些中和反应无明显现象,需通过指示剂揭示;5.氢氧化钙微溶于水,能与盐酸生成溶于水的氯化钙。
班级姓名组员
初三化学实验预习报告——酸的性质
实验课题:酸的性质
实验目的:巩固和加深对酸的性质的认识。
实验内容和步骤:
2、酸的物理性质
(1)盐酸是气体的水溶液。
纯净的浓盐酸是色,有气味气体,具有性。
(2)纯净的硫酸是色液体,挥发,浓硫酸有性,通常用做剂;硫酸溶于水,溶解时放出大量的热,因此在稀释浓硫酸时一定要把倒入中。
(1)取2支试管,
分别倒入稀盐酸、稀硫酸。
用
玻璃棒分别蘸取酸液于
在3支试管
小心加热(不要沸腾),
察铁钉表面和溶液颜色变化。
(1)取
几滴氯化钡溶液,观察现象。
(2)取
观察发生的现象
初三化学实验预习报告——碱和盐的性质
实验课题:碱的性质
实验目的:巩固和加深对碱的性质的认识
实验内容和步骤:
1
2
(1)氢氧化钠____溶解于水,溶解时______大量的热,其水溶液有_____味和______感。
其固体暴露在空气中易发生______,因此,可以用作某些气体的__________. (2)氢氧化钙溶于水,它的水溶液俗称;
如图取2种碱溶液各
观察颜色并闻气味。
用玻璃
棒分别蘸取碱液于
观察出现的现象
5mL
滴加稀盐酸,振荡
2mL氢氧化钠溶各加几滴氢氧化钠溶液。