抗肿瘤分子靶向药靶点总结
- 格式:docx
- 大小:2.00 MB
- 文档页数:12

2020年己上市靶向及免疫治疗靶点和适应症不限癌种1•药物靶点:PD-1:靶向药物划称:Pembrolizumab (派姆单抗):适应症:MSI-H或<1 的成人和实体瘤患者:上市时间:2017:中国是否上市:是;医保报销:是2.药物靶点:NTRK:靶向药物名称:larotrectinib (拉罗替尼):适应症:携带NTRK基因融合的局部晚期或转移性实体瘤;上市时间:2018;中国是否上市:否:医保报销:否3.药物靶点:NTRK/R0S1;靶向药物名称:Entrectinib (恩曲替尼):适应症:携带NTRK基因融合的局部晚期或转移性实体瘤+R0S1阳性的转移性非小细胞肺癌:上市时间:2019:中国是否上市:否;医保报销:否免疫检查点抑制剂1.硏发公司:基因泰克;靶点:PD-L1:药品名称:Atezolizumab (阿特珠单抗);获批适应症:局部晚期或转移性尿路上皮癌+转移性非小细胞肺癌+转移性三阴性乳腺癌+广泛期小细胞肺癌:国内是否上市:否:医保报销:否2.硏发公司:默沙东;靶点:PD-L1;药品名称:Avelumab (Bavencio):获批适应症:膀胱癌+默克尔细胞癌+晚期肾细胞癌:国内是否上市:否:医保报销:否3.硏发公司:辉瑞;靶点:PD-1;药品名称:Cemiplimab (Libtayo):获批适应症:转移性皮肤鳞状细胞癌:国内是否上市:否:医保报销:否4.硏发公司:阿斯利康;靶点:PD-L1;药品爼称:Durvalumab (得瓦鲁单抗);获批适应症:局部按期或转移性尿路上皮癌+非小细胞肺癌+小细胞肺癌;国内是否上市:是:医保报销:否5.研发公司:百时美施贵宝;靶点:PD-1;药品名称:Nivolumab (纳武单抗):获批适应症:黑色素瘤+非小细胞肺癌+肾癌+头颈鳞状细胞癌+尿路上皮癌+结直肠癌+ 经典型霍奇金淋巴瘤+肝细胞癌+小细胞肺癌+黑色素瘤的辅助治疗+MSI-H转移性结直肠癌;国内是否上市:是:医保报销:否6•硏发公司:默沙东;靶点:PD-1;药品名称:Pembrolizumab (帕姆单抗):获批适应症:黑色素瘤+非小细胞肺癌+肾癌+头颈鳞状细胞癌+尿路上皮癌+结直肠癌+经典型霍奇金淋巴瘤+肝细胞癌+胃癌及胃食俘交界癌+宫颈癌+晚期食管鳞状细胞癌+原发性纵隔B细胞淋巴瘤+MSI-H或dMMR的成人和实体瘤患者+默克尔细胞癌+ (TMB-H)M10实体肿瘤:国内是否上市:是:医保报销:否7•研发公司:君实;靶点:PD-1:药品需称:特瑞普利单抗:获批适应症:黑色素瘤: 国内是否上市:是:医保报销:否8•研发公司:信达生物;靶点:PD-1;药品名称:信迪利单抗;获批适应症:经典型霍奇金淋巴瘤:国内是否上市:是:医保报销:是9•研发公司:恒瑞医药;靶点:PD-1;药品需称:卡瑞丽珠单抗:获批适应症:经典型霍奇金淋巴瘤;国内是否上市:否;医保报销:否10.硏发公司:百济神州;靶点:PD-1;药品需称:替雷利珠单抗:获批适应症:经典型霍奇金淋巴瘤+尿路上皮癌;国内是否上市:是;医保报销:否肺癌1.药物靶点:EGFR;硏发公司:阿斯利康;靶向药物名称:Gefitin让(吉非替尼);上市时间:2003;中国是否上市:是;医保报销:是2.药物靶点:EGFR ;硏发公司:罗氏;靶向药物名称:Erlotinib (厄洛替尼):上市时间:2005:中国是否上市:是;医保报销:是3.药物靶点:EGFR;研发公司:阿斯利康;靶向药物拿称:Osimertinib (奥希替尼);上市时间:2015;中国是否上市:是:医保报销:是4.药物靶点:EGFR ;研发公司:贝达药业;靶向药物名称:Icotinib (埃克替尼);上市时间:2011;中国是否上市:是:医保报销:是5.药物靶点:EGFR;研发公司:礼来;靶向药物名称:Necitumumab(耐昔妥珠单抗);上市时间:2015;中国是否上市:否:医保报销:否6.药物靶点:EGFR/HER2/HER4 ;研发公司:勃林格殷格翰;靶向药物名称:Afatinib (阿法替尼):上市时间:2013;中国是否上市:是:医保报销:是7.药物靶点:EGFR/HER2/HER4 ;研发公司:辉瑞;靶向药物名称:Dacomitin让(达克替尼):上市时间:2018:中国是否上市:否:医保报销:否8.药物靶点:ALK/ROS1 ;硏发公司:辉瑞;靶向药物斜称:Lorlatinib (劳拉替尼);上市时间:2018;中国是否上市:否:医保报销:否9•药物靶点:ALK/R0S1/MET/MST1R;硏发公司:辉瑞;靶向药物剑称:crizotinib(克哇替尼):上市时间:2011;中国是否上市:是:医保报销:是10.药物靶点:ALK/ROS1/FLT3/IGF1 R/EGFR ;硏发公司:武田;靶向药物名称: brigatinib (布加替尼);上市时间:2017;中国是否上市:否:医保报销:否11.药物靶点:ALK/RET;研发公司:罗氏;靶向药物名称:Alectinib (艾乐替尼);上市时间:2015;中国是否上市:是:医保报销:是12.药物靶点:ALK/ROS1/INSR/IGF1R;硏发公司:诺华;靶向药物名称:Ceritinib(色瑞替尼):上市时间:2014;中国是否上市:是:医保报销:是13.药物靶点:ROS1 ;硏发公司:罗氏;靶向药物名称:Entrectinib (恩曲替尼):上市时间:2019;中国是否上市:否:医保报销:否14.药物靶点:BRAF ;研发公司:葛兰素史克;靶向药物名称:Dabrafenib (达拉非尼):上市时间:2017;中国是否上市:是;医保报销:否15.药物靶点:BRAF ;硏发公司:罗氏;靶向药物爼称:Vemurafenib (维莫非尼):上市时间:2017;中国是否上市:是;医保报销:是16.药物靶点:MEK ;研发公司:葛兰素史克;靶向药物爼称:Trametinib (曲美替尼):上市时间:2017:中国是否上市:是;医保报销:否17.药物靶点:MET ;研发公司:诺华;靶向药物名称:Capmatinib (卡马替尼):上市时间:2020;中国是否上市:否:医保报销:否18.药物靶点:RET;硏发公司:礼来;靶向药物名称:Selpercatinib(塞尔帕替尼);上市时间:2020;中国是否上市:否:医保报销:否19.药物靶点:PD-1 ;硏发公司:百时美施贵宝;靶向药物划称:Nivolumab (纳武单抗):上市时间:2015:中国是否上市:是:医保报销:否20.药物靶点:PD-1 ;硏发公司:默沙东;靶向药物名称:Pembrolizumab (派姆单抗):上市时间:2014:中国是否上市:是;医保报销:否21.药物靶点:PD-L1 ;研发公司:基因泰克;靶向药物名称:Atezolizumab (阿特珠单抗):上市时间:2015;中国是否上市:否:医保报销:否22.药物靶点:PD-L1 ;研发公司:阿斯利康;靶向药物名称:Durvalumab (得瓦鲁单抗):上市时间:2018:中国是否上市:否:医保报销:否23.药物靶点:VEGFR2/VEGFR3/KIT/FGFR ;研发公司:正大天晴;靶向药物名称:Anlotinib (安罗替尼):上市时间:2018:中国是否上市:是:医保报销:是24.药物靶点:VEGFR ;硏发公司:礼来;靶向药物统称:Ramucirumab(雷莫芦单抗);上市时间:2014;中国是否上市:否:医保报销:否25.药物靶点:VEGF ;研发公司:基因泰克;靶向药物名称:Bevacizumab (贝伐珠单抗):上市时间:2004:中国是否上市:是:医保报销:是26.药物靶点:NTRK ;研发公司:拜耳;靶向药物统称:Larotrectinib (拉罗替尼):上市时间:2018;中国是否上市:否;医保报销:否27.药物靶点:NTRK ;研发公司:罗氏;靶向药物名称:Alectinib (艾乐替尼)Entrectinib (恩曲替尼):上市时间:2019:中国是否上市:否;医保报销:否28.药物靶点:VEGF ;研发公司:古巴分子免疫中心;靶向药物名称:肺癌疫苗(CimaVax):上市时间:2011:中国是否上市:否(古巴已上市):医保报销:否乳腺癌1•药物靶点:CDK4/6 ;研发公司:辉瑞;靶向药物爼称:Palbociclib (帕博西林):上市时间:2015;中国是否上市:是:医保报销:是2.药物靶点:CDK4/6 ;研发公司:诺华;靶向药物名称:Ribociclib (瑞博西林);上市时间:2017;中国是否上市:否:医保报销:否3.药物靶点:CDK4/6 ;研发公司:礼来;靶向药物名称:Abemaciclib (玻玛西林):上市时间:2018;中国是否上市:否:医保报销:否4.药物靶点:HER2 ;硏发公司:阿斯利康;靶向药物名称:Fam-trastuzumab (Deruxtecan-nxki):上市时间:2019:中国是否上市:否;医保报销:否5.药物靶点:HER2 ;研发公司:基因泰克;靶向药物爼称:Tucatinib (图卡替尼);上市时间:2020;中国是否上市:否:医保报销:否6•药物靶点:HER2( Neu/ERBB2 );研发公司:罗氏;靶向药物名称:Ado-trastuzumab emtansine (T-DM1):上市时间:2013;中国是否上市:否:医保报销:否7.药物靶点:HER2 ( Neu/ERBB2 );硏发公司:罗氏;靶向药物名称:Pertuzumab (帕妥珠单抗);上市时间:2012;中国是否上市:是:医保报销:是8.药物靶点:HER2 ( Neu/ERBB2 );硏发公司:罗氏;靶向药物名称:Trastuzumab(曲妥珠单抗);上币时间:2015;中国是否上市:是:医保报销:是9.药物靶点:HER2/EGFR ;硏发公司:葛兰素史克;靶向药物需称:Lapatin让(拉帕替尼):上市时间:2007;中国是否上市:是:医保报销:是10.药物靶点:HER2/EGFR;研发公司:阿斯利康;靶向药物轻称:Neratinib (来那替尼):上市时间:2017;中国是否上市:否:医保报销:否11•药物靶点:HER2/EGFR ;研发公司:恒瑞;靶向药物名称:Pyrotinib (毗咯替尼):上市时间:2018:中国是否上市:是;医保报销:是12.药物靶点:mTOR ;研发公司:诺华;靶向药物爼称:Everolimus (依维莫司):上市时间:2009;中国是否上市:是:医保报销:是13.药物靶点:BRCA ;研发公司:辉瑞;靶向药物名称:Talaziparib (Talzenna):上市时间:2018;中国是否上市:否:医保报销:否14.药物靶点:BRCA ;研发公司:阿斯利康;靶向药物划称:Olaparib (奥拉帕尼):上市时间:2015;中国是否上市:是;医保报销:是15.药物靶点:PIK3CA ;研发公司:诺华;靶向药物名称:Alpelisib (阿培利司);上市时间:2019;中国是否上市:否:医保报销:否16.药物靶点:TROP-2 ;硏发公司:Immunomedics ;靶向药物夕i称:Sacituzumab (Govitecan-hziy Trodelvy):上市时间:2020:中国是否上市:否;医保报销:否17.药物靶点:PD-L1 ;研发公司:罗氏;靶向药物名称:Atezolizumab (阿特珠单抗):上市时间:2019:中国是否上市:否;医保报销:否1.药物靶点:HER1 ( EGFR/ERBB1 );硏发公司:百时美施贵宝;靶向药物名称:Cetuximab (四妥昔单抗-Erbitux):上市时间:2006:中国是否上市:是:医保报销:是2•药物靶点:HER1 ( EGFR/ERBB1 );研发公司:武田/安进;靶向药物名称:Panitumumab (帕尼单抗):上市时间:2005:中国是否上市:否;医保报销:否3•药物靶点:KIT/PDGFRB/RAF/RET ;硏发公司:拜耳;靶向药物名称:Regorafenib(瑞戈非尼):上市时间:2012;中国是否上市:是:医保报销:是4.药物靶点:VEGFR1/2/3 ;研发公司:和记黄埔;靶向药物名称:Fruquintinib (咲唾替尼):上市时间:2018:中国是否上市:是:医保报销:是5.药物靶点:VEGFRA/B ;研发公司:塞诺菲;靶向药物名称:Ziv-aflibercept (阿柏西普):上市时间:2012;中国是否上市:否:医保报销:否6.药物靶点:VEGFR2 ;研发公司:礼来;靶向药物名称:Ramucirumab (•雷莫芦单抗);上市时间:2014;中国是否上市:否;医保报销:否7.药物靶点:VEGFR ;硏发公司:基因泰克;靶向药物需称:Bevacizumab (贝伐珠单抗):上市时间:2004:中国是否上市:是:医保报销:是8.药物靶点:BRAF V600E ;研发公司:百时美施贵宝;靶向药物名称:Encorafenib(康奈菲尼):上市时间:2020;中国是否上市:否:医保报销:否9.药物靶点:PD-1 ;硏发公司:百时美施贵宝;靶向药物名称:Nivolumab (纳武单抗):上市时间:2015:中国是否上市:是;医保报销:是10.药物靶点:CTLA-4 ;硏发公司:百时美施贵宝;靶向药物爼称:Ip订imumab (伊匹单抗):上市时间:2011:中国是否上市:否:医保报销:否胃癌1•药物靶点:HER2 ;研发公司:罗氏;靶向药物爼称:Trastuzumab (曲妥珠单抗);上市时间:1998;中国是否上市:是:医保报销:是2.药物靶点:VEGFR2 ;研发公司:礼来;靶向药物名称:Ramucirumab (雷莫芦单抗);上市时间:2014;中国是否上市:否:医保报销:否3.药物靶点:PD-1 ;研发公司:默沙东;靶向药物名称:Pembrolizumab (派姆单抗):上市时间:2017;中国是否上市:是:医保报销:否胃肠间质瘤1•药物靶点:KIT/PDGFR/ABL ;硏发公司:诺华;靶向药物需称:Imatinib (伊马替尼):上市时间:2011:中国是否上市:是:医保报销:是2.药物靶点:PDGFRA/PDGFRB/VEGFR1/2/3 ;硏发公司:辉瑞;靶向药物名称:Sunitinib (舒尼替尼):上市时间:2006:中国是否上市:是:医保报销:是3.药物靶点:KIT/PDGFRB ;研发公司:拜耳;靶向药物名称:Regorafenib (瑞戈非尼):上市时间:2012:中国是否上市:是:医保报销:是4.药物靶点:KIT/PDGFR/ABL;研发公司:Decipher ;靶向药物名称:Rigretinib;上市时间:2020;中国是否上市:否:医保报销:否5.药物靶点:PDGFRA exon 18 ;硏发公司:基石药业;靶向药物名称:Avapritinib (Ayvakit):上市时间:2020:中国是否上市:否;医保报销:否胆管癌1.药物靶点:FGFR2 ;硏发公司:信达生物;靶向药物轻称:PemigatinibCPemazyre):上市时间:2020;中国是否上市:否:医保报销:否1•药物靶点:PD-1 ;研发公司:默沙东;靶向药物需称:Pembrolizumab (派姆单抗):上市时间:2019;中国是否上市:否:医保报销:否2.药物靶点:PD-1 ;硏发公司:百时美施贵宝;靶向药物名称:Nivolumab (纳武单抗):上市时间:2020:中国是否上市:否;医保报销:否3.药物靶点:VEGFR2 ;研发公司:礼来;靶向药物需称:Ramucirumab (•雷莫芦单抗);上市时间:2014;中国是否上市:否:医保报销:否4.药物靶点:HER2 ;研发公司:罗氏;靶向药物爼称:Trastuzumab (曲妥珠单抗);上市时间:1998;中国是否上市:是:医保报销:是胰腺癌1•药物靶点:EGFR ;硏发公司:罗氏;靶向药物需称:Erlotinib (厄洛替尼);上市时间:2005:中国是否上市:是;医保报销:否2.药物靶点:mTOR;硏发公司:诺华;靶向药物名称:Everolimus (依维莫司):上市时间:2009;中国是否上市:是;医保报销:否3.药物靶点:RTK ;研发公司:辉瑞;靶向药物名称:Sunitinib (舒尼替尼):上市时间:2006:中国是否上市:否;医保报销:是4.药物靶点:BRCA ;研发公司:阿斯利康;靶向药物名称:Olaparib (舒尼替尼);上市时间:2019;中国是否上市:否:医保报销:否肝癌1.药物靶点:VEGFR/PDGFR/KIT ;研发公司:拜耳;靶向药物剑称:Sorafenib (索拉非尼):上市时间:2007;中国是否上市:是:医保报销:否2.药物靶点:KIT/PDGFRB ;研发公司:拜耳;靶向药物名称:Regorafenib (瑞戈非尼):上市时间:2017:中国是否上市:是:医保报销:否3.药物靶点:多靶点;硏发公司:卫材;靶向药物名称:Lenvatinib (乐伐替尼);上市时间:2018;中国是否上市:是;医保报销:否4.药物靶点:PD-1 ;研发公司:百时美施贵宝;靶向药物需称:Nivolumab (纳武单抗):上市时间:2017;中国是否上市:否;医保报销:否5.药物靶点:PD-1 ;研发公司:默沙东;靶向药物鋼称:Pembrolizumab(派姆单抗):上市时间:2018;中国是否上市:是:医保报销:否6.药物靶点:VEGFR2 ;研发公司:礼来;靶向药物需称:Ramucirumab (•雷莫芦单抗);上市时间:2019;中国是否上市:否:医保报销:否原发性腹膜癌1•药物靶点:VEGFR2 ;硏发公司:礼来;靶向药物名称:Niraparib (尼拉帕尼);上市时间:2017:中国是否上市:否:医保报销:否2.药物靶点:VEGF ;研发公司:基因泰克;靶向药物名称:Bevacizumab (贝伐珠单抗):上市时间:2016:中国是否上市:是;医保报销:否神经内分泌瘤1•药物靶点:PD-L1 ;硏发公司:默沙东;靶向药物名称:Avelumab (Bavencio);上市时间:2017;中国是否上市:否:医保报销:否2.药物靶点:RTK ;研发公司:辉瑞;靶向药物名称:Sunitinib (舒尼替尼):上市时间:2006:中国是否上市:是;医保报销:是3.药物靶点:生长激素受体阳性;硏发公司:诺华;靶向药物名称:Lu 177 dotatate (LUTATHERA):上市时间:2018:中国是否上市:否;医保报销:否前列腺癌1.药物靶点:VEGFR/PDGFR/KIT/RAF ;研发公司:-;靶向药物名称:Sipueucel-T(前列腺治疗疫苗);上市时间:2010;中国是否上市:否:医保报销:否2.药物靶点:PAPR ;硏发公司:阿斯利康;靶向药物名称:Olaparib (奥拉帕尼);上市时间:2020;中国是否上市:否:医保报销:否3.药物靶点:BRCA ;研发公司:辉瑞;靶向药物名称:Rucaparib (Rubraca:x):上市时间:2020;中国是否上市:否;医保报销:否膀胱癌1•药物靶点:PD-1 ;研发公司:百时美施贵宝;靶向药物需称:Nivolumab (纳武单抗):上市时间:2015:中国是否上市:是;医保报销:是2.药物靶点:PD-1 ;研发公司:默沙东;靶向药物剑称:Pembrolizumab (派姆单抗): 上市时间:2014;中国是否上市:是:医保报销:是3.药物靶点:PD-L1 ;研发公司:阿斯利康;靶向药物名称:Durvalumab (得瓦鲁单抗):上市时间:2017:中国是否上市:否;医保报销:否4.药物靶点:PD-L1 ;硏发公司:默沙东;靶向药物名称:Avelumab (Bavencio): 上市时间:2017;中国是否上市:否:医保报销:否5.药物靶点:PD-L1 ;研发公司:基因泰克;靶向药物名称:Atezolizumab (阿特丽珠单抗):上市时间:2016:中国是否上市:否:医保报销:否6•药物靶点:FGFR3/FGFR2 ;研发公司:Janssen Biotech ;靶向药物名称:Erdafitinib (厄达替尼):上市时间:2019:中国是否上市:否;医保报销:否肾癌1•药物靶点:PD-1 ;硏发公司:百时美施贵宝;靶向药物名称:Nivolumab (纳武单抗):上市时间:2015:中国是否上市:是;医保报销:是2.药物靶点:VEGFR ;硏发公司:卫材;靶向药物名称:Lenvatinib (乐伐替尼);上市时间:2015;中国是否上市:是:医保报销:是3•药物靶点:mTOR;硏发公司:诺华;靶向药物爼称:Everolimus (依维莫司):上市时间:2009;中国是否上市:是:医保报销:是4.药物靶点:mTOR;研发公司:惠氏;靶向药物划称:Temsirolimus(替西罗莫司);上市时间:2007:中国是否上市:否:医保报销:否5.药物靶点:PDGFRA/PDGFRB ;研发公司:辉瑞;靶向药物名称:Sunitinib (舒尼替尼):上市时间:2006:中国是否上市:是;医保报销:是6.药物靶点:VEGF ;硏发公司:基因泰克;靶向药物名称:Bevacizumab (贝伐珠单抗):上市时间:2004:中国是否上市:是;医保报销:是7.药物靶点:VEGFR/PDGFR/KIT ;研发公司:葛兰素史克;靶向药物名称:Pazopanib (帕卩坐帕尼):上市时间:2009;中国是否上市:是:医保报销:是8.药物靶点:KIT/PDGFRB ;硏发公司:辉瑞;靶向药物名称:Axitinib(阿昔替尼);上市时间:2012;中国是否上市:是:医保报销:是9.药物靶点:FLT3/KIT/MET/RET ;硏发公司:武田;靶向药物名称:Cabozantinib(卡博替尼):上市时间:2011;中国是否上市:否:医保报销:否宫颈癌1•药物靶点:PD-1 ;研发公司:默沙东;靶向药物名称:Pembrolizumab (派姆单抗):上市时间:2018;中国是否上市:是:医保报销:是2.药物靶点:VEGF ;硏发公司:百时美施贵宝;靶向药物名称:Bevacizumab (贝伐珠单抗):上市时间:2004;中国是否上市:是:医保报销:是输卵管擋1.药物靶点:PARP ;硏发公司:默沙东;靶向药物爼称:Niraparib (尼拉帕尼);上市时间:2015;中国是否上市:是;医保报销:是卵巢癌1•药物靶点:PARP ;硏发公司:辉瑞;靶向药物爼称:Rucaparib (Rubraca™):上市时间:2016;中国是否上市:否;医保报销:否2.药物靶点:PARP ;硏发公司:阿斯利康;靶向药物名称:Olaparib (奥拉帕尼);上市时间:2014;中国是否上市:是:医保报销:是3•药物靶点:PARP ;研发公司:葛兰素史克;靶向药物名称:Niraparib (尼拉帕尼);上市时间:2017;中国是否上市:否:医保报销:否4.药物靶点:VEGF ;硏发公司:基因泰克;靶向药物划称:Bevacizumab (贝伐珠单抗):上市时间:2014:中国是否上市:是;医保报销:是白血病1•药物靶点:KIT ;硏发公司:诺华;靶向药物需称:Imatinib (伊马替尼):上市时间:2001:中国是否上市:是;医保报销:是2.药物靶点:BCR-AB1 ;硏发公司:诺华;靶向药物名称:Nil otinib (尼洛替尼);上市时间:2007;中国是否上市:是;医保报销:是3.药物靶点:多靶点;硏发公司:百时美施贵宝;靶向药物名称:Dasatinib (达沙替尼):上市时间:2006:中国是否上市:是:医保报销:是4.药物靶点:SRC-AB1 ;研发公司:辉瑞;靶向药物名称:Bosutinib (博舒替尼);上市时间:2012;中国是否上市:否:医保报销:否5.药物靶点:多靶点;硏发公司:Ariad ;靶向药物名称:Ponatinib (普纳替尼):上市时间:2012;中国是否上市:否:医保报销:否6.药物靶点:多靶点;硏发公司:诺华;靶向药物轻称:Midostaurin (Rydapt®);上市时间:2017;中国是否上市:否:医保报销:否7.药物靶点:BTK ;研发公司:Pharmacyclics ;靶向药物名称:Ibrutinib (伊鲁替尼):上市时间:2013:中国是否上市:是;医保报销:是8•药物靶点:CD20 ;硏发公司:基因泰克;靶向药物爼称:Obinutuzumab (奥滨尤妥珠单抗):上市时间:2013;中国是否上市:否:医保报销:否9.药物靶点:CD20 ;硏发公司:诺华;靶向药物爼称:Ofatumumab (奥法木单抗);上市时间:2014;中国是否上市:否:医保报销:否10.药物靶点:CD20 ;研发公司:基因泰克;靶向药物需称:Rituximab (利妥昔单抗):上市时间:1997:中国是否上市:是;医保报销:是11.药物靶点:PI3K6 ;研发公司:吉利德科学;靶向药物名称:Idelalisib(Zydelig®):上市时间:2014;中国是否上市:否:医保报销:否12.药物靶点:CD19 ;硏发公司:安进;靶向药物爼称:Blinatumomab (Blincyto®): 上市时间:2014;中国是否上市:否:医保报销:否13.药物靶点:BCL2 ;硏发公司:罗氏;靶向药物名称:Venetoclax (Venclexta™): 上市时间:2015;中国是否上市:否:医保报销:否淋巴瘤1•药物靶点:BTK ;研发公司:Pharmacyclics ;靶向药物划称:Ibrutinib (依鲁替尼):上市时间:2015:中国是否上市:是;医保报销:是2.药物靶点:CD20 ;研发公司:拜耳;靶向药物名称:Ibritumomab (替伊莫单抗);上市时间:2002;中国是否上市:否:医保报销:否3.药物靶点:CD20 ;硏发公司:罗氏;靶向药物名称:Rituximab (利妥昔单抗);上市时间:1997:中国是否上市:是:医保报销:是4.药物靶点:CD20 ;硏发公司:史克必成;靶向药物名称:Tositumomab (托四莫单抗):上市时间:2003:中国是否上市:否:医保报销:否5.药物靶点:CD20 ;研发公司:基因泰克;靶向药物爼称:Obinutuzumab (奥滨尤妥珠单抗):上市时间:2013;中国是否上市:否:医保报销:否6.药物靶点:CD30 ;硏发公司:千年制药;靶向药物名称:Brentuximab (本妥西单抗):上市时间:2011:中国是否上市:否;医保报销:否7.药物靶点:HDAC;硏发公司:Onxeo ;靶向药物名称:Belinostat (贝利司他);上市时间:2014;中国是否上市:否:医保报销:否8•药物靶点:HDAC ;研发公司:新基;靶向药物划称:Romidepsin (罗米地辛):9.药物靶点:HDAC ;研发公司:默沙东;靶向药物划称:Vorinostat (伏立诺他);上市时间:2006;中国是否上市:否:医保报销:否10.药物靶点:PI3K8 ;研发公司:吉利德科学;靶向药物名称:Idelalisib(Zydelig®);上市时间:2014;中国是否上市:否:医保报销:否11•药物靶点:PD-1 ;研发公司:百时美施贵宝;靶向药物爼称:Nivolumab (纳武单抗):上市时间:2015:中国是否上市:是:医保报销:否12.药物靶点:PD-1 ;硏发公司:默沙东;靶向药物名称:Pembrolizumab (派姆单抗):上市时间:2014:中国是否上市:是;医保报销:否13.药物靶点:Proteasome ;研发公司:杨森;靶向药物拿称:Bortezomib (硼替佐米):上市时间:2003:中国是否上市:是;医保报销:否多发性骨髓瘤1•药物靶点:Proteasome ;研发公司:杨森;靶向药物名称:Bortezomib (硼替佐米):上市时间:2003:中国是否上市:是;医保报销:是2.药物靶点:蛋白酶体;硏发公司:奧尼克斯;靶向药物冬称:Carfilzomib (卡菲司米托):上市时间:2012;中国是否上市:否:医保报销:否3.药物靶点:;研发公司:千年制药;靶向药物需称:Ixazomib citrate (Ninlaro®):上市时间:2015;中国是否上市:是:医保报销:否4.药物靶点:CD38 ;研发公司:杨森;靶向药物名称:Daratumumab (达雷木单抗);上市时间:2013;中国是否上市:否:医保报销:否5.药物靶点:SLAMF7 ( CS1/CD319/CRACC);研发公司:百时美施贵宝;靶向药物名称:Elotuzumab (埃罗妥珠单抗);上市时间:2014;中国是否上市:否:医保报销:否黑色素瘤1•药物靶点:PD-1 ;硏发公司:百时美施贵宝;靶向药物剑称:Nivolumab (纳武单抗):上市时间:2015:中国是否上市:是;医保报销:否2.药物靶点:PD-1 ;研发公司:默沙东;靶向药物名称:Pembrolizumab (派姆单抗):3.药物靶点:CTLA-4 ;研发公司:百时美施贵宝;靶向药物名称:Ip订imumab (伊普利姆玛):上市时间:2011;中国是否上市:否:医保报销:否4.药物靶点:BRAF ;研发公司:罗氏;靶向药物名称:Vemurafenib (维莫非尼):上市时间:2011;中国是否上市:是;医保报销:否5.药物靶点:BRAF ;硏发公司:诺华;靶向药物名称:Dabrafenib (达拉菲尼);上市时间:2013;中国是否上市:否:医保报销:否6•药物靶点:MEK ;研发公司:诺华;靶向药物塔称:Trametinib (曲美替尼):上市时间:2013:中国是否上市:否;医保报销:否2.药物靶点:MEK ;硏发公司:基因泰克;靶向药物名称:Cobimetinib(卡比替尼);上市时间:2015;中国是否上市:否:医保报销:否默克尔细胞癌1•药物靶点:PD-L1 ;硏发公司:默沙东;靶向药物需称:Avelumab (Bavencio): 上市时间:2017;中国是否上市:否:医保报销:否2.药物靶点:PD-1 ;研发公司:默沙东;靶向药物名称:Pembrolizumab (派姆单抗):上市时间:2014;中国是否上市:是:医保报销:否基底细胞癌1•药物靶点:PTCH/Smoothened ;研发公司:基因泰克;靶向药物需称:Yismodegib(维莫徳吉):上市时间:2012;中国是否上市:否:医保报销:否2.药物靶点:Smoothened ;研发公司:诺华;靶向药物名称:Sonidegib (索尼徳吉):上市时间:2015:中国是否上市:是;医保报销:否甲状腺癌1•药物靶点:VEGFR/PDGFR/KIT ;研发公司:拜耳;靶向药物名称:Sorafenib (索拉非尼):上市时间:2013:中国是否上市:是:医保报销:否2.药物靶点:VEGFR2 ;硏发公司:卫材;靶向药物冬称:Lenvatinib (乐伐替尼);上市时间:2015;中国是否上市:否:医保报销:否3•药物靶点:EGFR/HER1/ERBB1 ;硏发公司:阿斯利康;靶向药物名称:Yandetanib(凡徳他尼):上市时间:2017;中国是否上市:否:医保报销:否4.药物靶点:FLT3/KIT/MET/RET ;硏发公司:武田;靶向药物爼称:Cabozantinib(卡博替尼):上市时间:2012;中国是否上市:否:医保报销:否头颈部肿瘤1•药物靶点:VEGF;脑瘤;靶向药物需称:Bevacizumab (贝伐珠单抗):上市时间:2004:中国是否上市:是;医保报销:否2.药物靶点:mTOR;脑瘤;靶向药物划称:Everolimus (依维莫司):上市时间:2009:中国是否上市:是;医保报销:否3.药物靶点:EGFR( HER1/ERBB1 );头颈瘙;靶向药物名称:Cetuximab (西妥昔单抗):上市时间:2006:中国是否上市:否:医保报销:否4.药物靶点:PD-1 ;头颈癌;靶向药物名称:Nivolumab (纳武单抗);上市时间:2015;中国是否上市:是;医保报销:否5.药物靶点:PD-1 ;头颈癌;靶向药物名称:Pembrolizumab (派姆单抗);上市时间:2014;中国是否上市:是;医保报销:否6.药物靶点:GD2 ;高危神经母细胞瘤;靶向药物划称:Dinutuximab (Unituxin:*):上市时间:2015;中国是否上市:否:医保报销:否软组织肉瘤1.药物靶点:VEGFR/PDGFR/KIT ;研发公司:葛兰素史克;靶向药物名称:Pazopanib (帕卩坐帕尼):上市时间:2009;中国是否上市:是:医保报销:是2.药物靶点:EZH2 ;研发公司:Epizyme ;靶向药物名称:Tazemetostat (他泽司他):上市时间:2020:中国是否上市:否;医保报销:否3.药物靶点:一;研发公司:新基;靶向药物需称:Pomalidomide (泊马度胺);上市时间:2020;中国是否上市:否;医保报销:否。

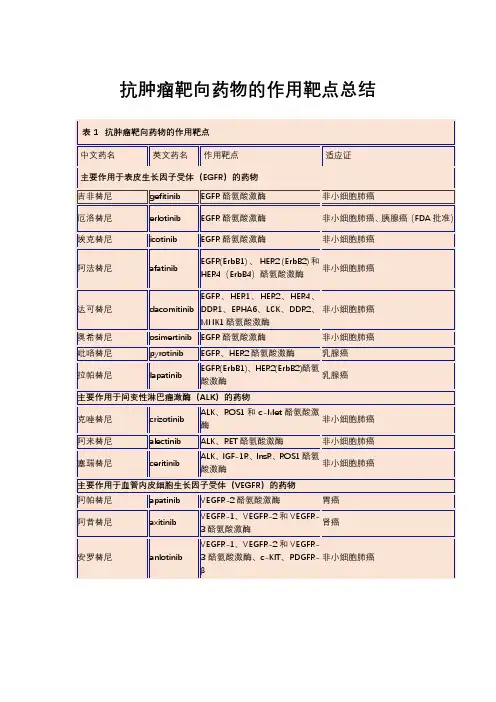

常用靶向治疗作用靶点常用靶向治疗作用的靶点是指在肿瘤细胞中的一些分子、信号转导途径或基因表达发生异常,使其具有特异性的治疗效应。
靶向治疗是一种通过特异靶点来选择性作用于肿瘤细胞,从而发挥抗肿瘤疗效的治疗方法。
下面是一些常用靶向治疗作用的靶点:1. 表皮生长因子受体(EGFR):EGFR是一种受体酪氨酸激酶,它促进细胞增殖和生存。
针对EGFR的靶向药物例如西妥昔单抗(Cetuximab)和埃洛替尼(Erlotinib)可用于治疗不同类型的恶性肿瘤,例如非小细胞肺癌和结直肠癌。
2. 基因突变产生的靶点:许多肿瘤发生的基因突变可导致肿瘤细胞的无限增殖和生长。
例如,绝大多数慢性骨髓性白血病(CML)患者具有BCR-ABL基因突变,可以靶向治疗这一靶点。
伊马替尼(Imatinib)是一种靶向BCR-ABL的药物,用于CML患者的治疗。
3. 血管内皮生长因子受体(VEGFR):VEGFR在血管生成和维持方面起重要作用。
靶向VEGFR的药物例如索拉非尼(Sorafenib)和阿昔替尼(Axitinib)已被批准用于恶性肿瘤的治疗,例如肝细胞癌和肾细胞癌。
4. 整合素:整合素是一类跨膜蛋白,它们在肿瘤细胞和周围组织之间起到粘附作用。
靶向整合素的药物例如贝伐单抗(Bevacizumab)用于治疗一些肿瘤,包括结直肠癌和乳腺癌。
5. 肿瘤坏死因子受体(TNFR):TNFR具有抗肿瘤作用,可诱导肿瘤细胞凋亡。
TNFR靶向治疗的药物例如奥法替尼(Olaratumab)已被批准用于治疗软组织肉瘤。
6. 细胞周期调控蛋白:细胞周期是细胞生长和分裂的关键过程。
靶向细胞周期调控蛋白的药物例如帕珠单抗(Palbociclib)和里帕替尼(Ribociclib)已被批准用于治疗乳腺癌。
7. 抑癌基因:抑癌基因在正常细胞中能够抑制肿瘤发展。
缺乏或突变的抑癌基因是肿瘤发展的重要驱动因素。
一些靶向治疗药物例如帕妥珠单抗(Pertuzumab)和拉帕替尼(Lapatinib)可用于治疗HER2阳性的乳腺癌。

常见的肺癌分子靶向治疗靶点近年来,随着分子生物学技术的提高和在细胞受体及增殖调控的分子水平对肿瘤发病机制的进一步认识,人们开始了针对细胞受体、关键基因和调控分子为靶点的治疗,并称之为“分子靶向治疗”。
分子靶向性药物不是将杀伤肿瘤细胞作为目标,而是将肿瘤细胞膜上或细胞内特异性表达或高表达的分子为作用靶点,这不仅能更加特异地作用于肿瘤细胞,阻断其生长、转移或诱导其凋亡,而且还同时降低了对正常细胞的杀伤作用。
近年来,在肺癌治疗中针对信号转导、生长因子及其受体的新型分子靶向药物,已经展现出值得期待的疗效。
一、以EGFR为靶点的肺癌靶向治疗表皮生长因子受体(EGFR)是原癌基因C-erbB-1(HER-1)的表达产物。
40%~80%的非小细胞肺癌(NSCLC)过度表达EGFR。
EGFR与配体形成二聚体能激活酪氨酸激酶(TK),使肿瘤细胞增殖分裂和永生化,因此目前针对EGFR的靶向治疗在肺癌治疗领域中运用广泛。
吉非替尼(易瑞沙,gefitinib)吉非替尼是一种可口服的EGFR TK小分子抑制剂,主要使癌细胞阻滞于G1期。
两项多中心双盲随机对照Ⅱ期临床试验:IDEAL 1和IDEAL2在2003年完成。
正是这两项Ⅱ期临床试验的结果促使美国食品与药物管理局(FDA)在Ⅲ期临床试验尚未完成的时候就迅速批准了吉非替尼作为NSCLC的三线治疗药物。
但是两项关于吉非替尼与标准一线化疗方案联用的多中心、随机、双盲对照Ⅲ期临床试验——INTACT 1及INTACT 2却带来令人失望的结果。
2项Ⅲ期研究的结果均显示,吉非替尼与化疗药物同期联用,其效果并不优于单纯化疗,有学者认为这可能是由于该药与化疗药物作用于同一周期的细胞,其作用被化疗药物所掩盖。
Thatcher等发表ISEL研究的结果显示,吉非替尼与安慰剂相比未能延长化疗失败NSCL C患者的生存期。
虽然研究显示在肿瘤缩小及缓解率方面吉非替尼具有优势,但并未能转化为有统计学差异的生存期延长。



肿瘤靶向药靶点治疗及不良反应总结肿瘤靶向药是一种能够特异性地靶向肿瘤细胞并抑制其增殖、侵袭和转移的药物。
与传统化疗药物相比,肿瘤靶向药具有更高的选择性、更好的耐受性和更低的毒副作用。
本文将对常见的肿瘤靶向药的靶点、治疗及不良反应进行总结。
一、抗EGFR(表皮生长因子受体)靶向药物:EGFR是一种过度表达于多种肿瘤细胞表面的膜蛋白,抑制EGFR可以阻止癌细胞的增殖和侵袭。
常见的抗EGFR靶向药物包括鲁西单抗、曲妥珠单抗。
不良反应方面,常见的包括皮疹、腹泻、疲劳等。
二、抗HER2(人类表皮生长因子受体2)靶向药物:HER2是乳腺癌和胃癌等肿瘤中过度表达的靶标,抑制HER2可以阻止癌细胞的增殖。
常见的抗HER2靶向药物包括曲妥珠单抗、帕妥珠单抗。
不良反应方面,常见的包括心脏毒性、恶心和呕吐等。
三、多酪氨酸激酶(BRAF)抑制剂:BRAF是一个在恶性黑色素瘤等肿瘤中突变的基因,抑制BRAF可以阻止癌细胞的增殖。
常见的BRAF抑制剂包括达沙替尼、维美替尼。
不良反应方面,常见的包括皮肤病变、发热和疲劳等。
四、ALK(酪氨酸激酶)抑制剂:ALK基因突变与非小细胞肺癌相关,抑制ALK可以阻止肿瘤细胞的生长。
常见的ALK抑制剂包括克唑替尼、阿法替尼。
不良反应方面,常见的包括肝功能异常、恶心和疲劳等。
五、PD-1(程序化细胞死亡蛋白1)抑制剂:PD-1是一种负调控肿瘤相关免疫反应的膜蛋白,抑制PD-1可以增强机体抗肿瘤免疫能力。
常见的PD-1抑制剂包括伊普伐木单抗、润达单抗。
不良反应方面,常见的包括乏力、皮疹、恶心等。
六、PARP(多精胺ADP核糖聚合酶)抑制剂:PARP在DNA损伤修复中起重要作用,抑制PARP可以阻止肿瘤细胞的DNA修复能力。
常见的PARP抑制剂包括奥拉帕尼布、利普帕尼布。
不良反应方面,常见的包括恶心、呕吐、疲劳等。
需要注意的是,不同的肿瘤靶向药对于不同的肿瘤类型存在差异,具体使用时需要根据患者的肿瘤类型、基因突变状态和身体状况进行选择。

肿瘤靶向药物靶点汇总肿瘤靶向药物是一类可以选择性地作用于肿瘤细胞特定靶点的药物。
这些靶点可以是肿瘤细胞上表达的特定分子、受体和酶。
通过作用于这些靶点,肿瘤靶向药物可以抑制肿瘤细胞的增殖,诱导其凋亡,阻断其侵袭和转移能力,从而达到治疗肿瘤的目的。
以下是肿瘤靶向药物常用的靶点的汇总:1.表皮生长因子受体(EGFR):EGFR是一种受体酪氨酸激酶,它在许多肿瘤细胞上高表达。
EGFR靶向药物包括西妥昔单抗、埃洛替尼等,可以抑制EGFR信号通路的活化,阻断肿瘤细胞的增殖和生存,适用于EGFR突变阳性的肿瘤,如非小细胞肺癌。
2.奥曲肽受体:奥曲肽受体是一种在神经内分泌肿瘤中高表达的受体。
奥曲肽受体靶向药物奥曲肽可以结合奥曲肽受体,抑制肿瘤细胞的增殖和释放,适用于胰腺神经内分泌肿瘤等。
3.CD20:CD20是B细胞表面的一种膜糖蛋白,也是一种B细胞淋巴瘤的标志物。
CD20靶向药物包括利妥昔单抗等,可以选择性地杀伤CD20阳性的B细胞,适用于非霍奇金淋巴瘤等。
4.血管内皮生长因子受体(VEGFR):VEGFR是一种与血管新生有关的受体酪氨酸激酶。
VEGFR靶向药物包括贝伐珠单抗、舒尼替尼等,可以抑制肿瘤细胞与血管内皮细胞的相互作用,阻断肿瘤的血供,适用于肾细胞癌、转移性结直肠癌等。
5.基因重排:一些肿瘤具有特定基因重排,这些基因重排产生了新的融合基因,参与肿瘤的发生和发展。
针对这些融合基因的靶向药物可以抑制这些基因的活性,如克唑替尼可以抑制ALK融合基因的活性,适用于ALK融合基因阳性的非小细胞肺癌。
6.细胞周期调节蛋白:肿瘤细胞的增殖过程离不开细胞周期调节蛋白的活性调节。
针对细胞周期调节蛋白的靶向药物可以干扰肿瘤细胞的细胞周期,如帕利珠单抗可以抑制CDK4/6蛋白的活性,适用于乳腺癌等。
7.PARP酶:PARP酶在DNA损伤修复过程中起重要作用。
针对PARP酶的靶向药物可以阻断DNA修复机制,导致肿瘤细胞死亡,适用于BRCA突变的卵巢癌等。

・专家笔谈・分子靶点和分子靶向抗肿瘤药研究进展方家椿△(北京大学临床肿瘤学院,北京肿瘤医院,北京市肿瘤防治研究所Ⅰ期临床研究室,北京 100036)[关键词]抗肿瘤药;肿瘤治疗方案;系统生物学[中图分类号]R730.53 [文献标识码]A [文章编号]16712167X (2006)0620575204 抗肿瘤药物研究是肿瘤防治研究最活跃的领域之一。
自上个世纪40年代以来,临床使用过的抗肿瘤药已近六百种,其中西药三百多种,中药二百多种。
目前临床常用的抗肿瘤药有七十种左右,已进入临床试验的抗肿瘤新药有四百多种。
抗肿瘤药物的数量虽多,但理想的药物数量却很少。
为了寻找疗效好、毒副作用小的抗肿瘤药,研究人员一直在不懈地努力。
1 分子靶点治疗(molecular target 2based therapy )和分子靶向治疗(molecular target 2directed therapy )成为抗肿瘤药物研发的主要方向 长期以来,为了克服细胞毒类抗肿瘤药选择性差,毒性大的弊端,研究人员一直在努力寻找能特异识别并杀伤肿瘤细胞的药物。
随着肿瘤细胞分子生物学的迅速发展,针对肿瘤发生、发展机制的分子靶点治疗药和将细胞毒性物质或非毒性前体药靶向导入肿瘤组织的分子靶向治疗药成为研究的热点,近十多年来,先后有一大批此类抗肿瘤新药上市。
1.1 以微管为靶点的抗肿瘤药长春瑞滨(Navelbine,NVB ,诺维本),1989年首先在法国上市,其抑制微管蛋白聚集,是目前单药治疗非小细胞肺癌(NSCLC )最有效的药物之一。
紫杉醇(Taxol ),1992年上市,抑制微管解聚,其半合成衍生物多西紫杉醇(Docetaxel,泰索帝),1995年上市,用于治疗卵巢癌、乳腺癌、非小细胞性肺癌、头颈部恶性肿瘤等。
1.2 以DNA 合成为靶点的抗肿瘤药 拓扑异构酶抑制剂:依立替康(Irinotecan,CPT 211),1994年上市;拓扑替康(T opotecan,TPT ),1996年上市。

最热门抗肿瘤靶点及小分子靶向药物全景报告抗肿瘤靶点是指对肿瘤生长、转移等过程具有重要调控作用的蛋白分子或通路。
小分子靶向药物是一类能够专一靶向抗肿瘤靶点并抑制其活性的化学物质。
随着抗肿瘤研究的不断深入,越来越多的抗肿瘤靶点及小分子靶向药物被发现并应用于临床。
以下将介绍一些当前最热门的抗肿瘤靶点及小分子靶向药物:1.EGFR(表皮生长因子受体):EGFR是一种跨膜酪氨酸激酶受体,参与肿瘤细胞的生长和分化等过程。
一些小分子靶向药物如吉非替尼和厄洛替尼等通过抑制EGFR的酪氨酸激酶活性,抑制肿瘤细胞生长。
2.HER2(人表皮生长因子受体2):HER2是一种细胞表面受体,参与调节细胞增殖和存活等过程。
一些小分子靶向药物如曲妥珠单抗和拉普替尼等能够靶向结合HER2,抑制其信号传导,减少肿瘤细胞的增殖。
3.ALK(酪氨酸激酶受体):ALK是一种重排基因,其突变被发现与多种肿瘤的发生和发展相关。
小分子靶向药物如克唑替尼和艾尔莎替尼能够抑制ALK的活性,阻断肿瘤细胞的生长和转移。
4.BRAF(B型RAF激酶):BRAF是一种信号转导分子,突变导致了多种恶性黑色素瘤的发生。
例如,维米非尼和达替尼等小分子靶向药物能够抑制BRAF的活性,减少肿瘤细胞的增殖和转移。
5.PD-1(程序性死亡受体1)和PD-L1(程序性死亡配体1):PD-1和PD-L1参与抑制免疫系统对肿瘤的攻击,突变导致肿瘤逃避免疫监视。
一些免疫检查点抑制剂如伊普替尼和纳武利尼等能够靶向PD-1或PD-L1,恢复免疫系统的抗肿瘤活性。
除了上述靶点外,还有许多其他热门的抗肿瘤靶点及小分子靶向药物,如PI3K、FLT3、VEGFR等。
这些靶点及药物的发现和应用为肿瘤治疗提供了新的进展和希望。
需要注意的是,虽然靶向药物在抗肿瘤治疗中具有重要作用,但并非适用于所有患者。
个体化治疗是当前的研究热点,通过检测患者的肿瘤基因和蛋白表达水平来选择最合适的靶向药物,以提高治疗效果和减少不良反应。
西医院肿瘤科年终总结肿瘤靶向治疗的新进展与疗效西医院肿瘤科在过去一年中取得了令人瞩目的成绩,特别是在肿瘤靶向治疗方面。
本文将对我们肿瘤科在肿瘤靶向治疗领域中的新进展和疗效进行总结。
一、背景介绍肿瘤靶向治疗作为一种新型的抗癌治疗方法,具有针对性强、毒副作用小等优点,已经成为肿瘤治疗的重要手段之一。
在这一领域中,西医院肿瘤科一直积极探索并引入最新的技术和药物,致力于提高患者的治疗效果和生存质量。
二、新进展1. 靶向药物的研发和应用:在过去一年中,我们肿瘤科引入了多种新型的靶向药物,并积极开展相关的临床试验。
这些药物能够精准地作用于肿瘤细胞的特定靶点,从而使肿瘤细胞的生长和传播受到抑制。
通过这些靶向药物的应用,我们在多种肿瘤类型中取得了良好的治疗效果。
2. 个体化靶向治疗策略:针对不同类型的肿瘤患者,我们根据其个体化的基因变异情况,制定相应的靶向治疗方案。
通过对患者的基因检测和分析,我们能够准确判断靶向药物的敏感性,并制定相应的治疗方案,从而提高治疗效果和预后。
3. 综合治疗策略的优化:肿瘤靶向治疗作为综合治疗的重要组成部分,我们不断完善和优化综合治疗策略。
与放化疗等手段相结合,肿瘤靶向治疗能够更好地发挥作用,提高治疗效果。
在过去一年中,我们通过不同的治疗组合和序贯治疗等方式,明显改善了患者的生存质量。
三、疗效评估我们肿瘤科在肿瘤靶向治疗方面取得了显著的疗效,具体表现在以下几个方面:1. 效果卓越:通过靶向治疗,我们成功控制了多种肿瘤类型的发展,并取得了较为理想的治疗效果。
患者的肿瘤负荷得到明显缓解,疾病稳定率大幅提高,细胞增殖得到有效控制。
2. 生存期延长:与传统治疗方法相比,肿瘤靶向治疗显著延长了患者的生存期。
在某些肿瘤类型中,我们观察到了患者生存期的显著延长,为患者提供了更多的治疗机会和希望。
3. 生活质量改善:除了治疗效果的提升,肿瘤靶向治疗还显著改善了患者的生活质量。
相对于放化疗等治疗方法,靶向治疗的副作用更小,患者的生活状态和身体功能得到了明显改善。
近年来,随着生物技术和分子生物学研究的不断深入,肿瘤靶向药物逐渐成为肿瘤治疗领域的研究热点。
本文将对肿瘤靶向药物的研究进展进行总结,以期为我国肿瘤治疗提供参考。
一、肿瘤靶向药物的定义肿瘤靶向药物是指针对肿瘤细胞特异性分子靶点设计的药物,通过靶向作用于肿瘤细胞,抑制其生长、增殖和转移,同时减少对正常细胞的损伤。
与传统的化疗药物相比,肿瘤靶向药物具有高效、低毒、特异性强的特点。
二、肿瘤靶向药物的研究进展1. 靶向治疗药物(1)单克隆抗体:如利妥昔单抗(美罗华)针对CD20蛋白,用于治疗非霍奇金淋巴瘤和慢性淋巴细胞白血病;贝伐珠单抗(安维汀)针对VEGF蛋白,用于治疗结直肠癌、肾细胞癌等。
(2)小分子靶向药物:如索拉非尼(多吉美)针对多靶点,用于治疗肾细胞癌、肝癌;伊马替尼(格列卫)针对BCR-ABL融合基因,用于治疗慢性粒细胞白血病。
2. 免疫检查点抑制剂免疫检查点抑制剂通过解除肿瘤细胞对免疫系统的抑制,激活免疫系统攻击肿瘤细胞。
如纳武利尤单抗(Opdivo)针对PD-1蛋白,用于治疗黑色素瘤、肺癌、肾细胞癌等;帕博利珠单抗(Keytruda)针对PD-L1蛋白,用于治疗黑色素瘤、肺癌、头颈癌等。
3. 连接子技术连接子技术是一种将强效细胞毒药物连接到载体上,实现药物在肿瘤组织内的特异性释放的技术。
如Val-Cit连接子已被成功用于多个上市的药物偶联物中。
连接子技术的应用广泛,且不断有新的研究进展。
4. 基因检测与靶向治疗基因检测技术可以帮助医生确定患者的肿瘤基因突变,从而为患者提供针对性的靶向治疗方案。
如针对NTRK融合基因的二代NTRK抑制剂瑞波替尼(TPX-0005)。
三、肿瘤靶向药物的应用前景肿瘤靶向药物具有广泛的应用前景,有望为肿瘤患者带来新的治疗选择。
随着研究的深入,肿瘤靶向药物的种类和疗效将不断提高,为我国肿瘤治疗事业做出更大贡献。
总之,肿瘤靶向药物的研究与开发为肿瘤治疗带来了新的希望。
恶性肿瘤的分子靶向治疗肿瘤分子靶向治疗的概念就是针对性地瞄准一个靶位进行治疗“有的放矢的治疗”肿瘤分子靶向治疗是指利用肿瘤特异性为靶点,达到直接治疗或导向治疗目的的一类疗法。
阻断其生长、转移或诱导其凋亡,抑制或杀死肿瘤细胞,达到控制肿瘤之目的。
肿瘤分子靶向治疗常用的治疗靶点有:细胞受体、信号传导和抗血管生成等。
一、单抗类药物:单克隆抗体是利用抗原抗体特异性结合一种治疗方法。
肿瘤细胞表面有一些特异的肿瘤抗原可供利用作为单克隆抗体攻击的靶点1、曲妥珠单抗-贺赛汀:是一种针对人类表皮生长因子受体2HER-2单抗,HER-2受体过度表达的乳腺癌。
静脉给药输液反应和心脏毒性。
需要检测靶点。
一年治疗费用为30万。
2、利妥昔单抗-美罗华:是近年来治疗低度恶性淋巴瘤的最重要进展。
低度恶性B细胞淋巴瘤,有效和稳定者维持治疗6个月。
过敏反应.CD20抗原膜外,需要检测靶点,每3周1次静滴,6~8次。
2.4万/次(6个月)。
3、贝伐单抗-阿瓦斯汀:为新型的抗血管内皮生长因子受体单克隆抗体,目前正在进行治疗非小细胞肺癌、结直肠癌和乳腺癌。
静脉给药。
不需要检测靶点。
胃肠穿孔/伤口愈合困难。
4、爱必妥(西妥昔单抗):是目前临床上最为先进的抗表皮生长因子受体单克隆抗体,结直肠癌和头颈部鳞癌。
2007年中国上市。
需要检测靶点。
过敏反应,呼吸困难,低血压二、小分子酪氨酸激酶抑制剂1 伊马替尼,格列卫:能抑制酪氨酸激酶信号转导的抑制剂,对Ph阳性的急性淋巴细胞性白血病(ALL)缓解率也高达70%,胃肠道恶性基质细胞瘤,对化疗和放疗高度拮抗的恶性胶质瘤(最常见的脑肿瘤)可能有效。
口服需要检测靶点。
2 吉非替尼易瑞沙:表皮生长因子受体拮抗剂,铂类、泰素帝等化疗失败的非小细胞性肺癌,对乳腺癌、前列腺癌及头颈部肿瘤等均证实有效。
亚洲人、腺癌、女性和未吸烟者疗效优势。
不需要检测靶点,口服。
间质性肺病,皮疹,腹泻3 埃罗替尼、厄罗替尼、特洛凯、特罗凯:表皮生长因子受体拮抗剂。
药物靶点总结报告药物靶点总结报告药物靶点是指药物在体内起效的分子目标,是药物研发的重要方向之一。
本报告对近年来药物靶点的研究进展进行了总结,主要包括靶向蛋白、靶向RNA以及靶向DNA三个方面。
靶向蛋白是目前研究最为广泛的药物靶点之一。
其中,蛋白激酶作为一类重要的蛋白靶点,受到了广泛的关注。
近年来,有多个蛋白激酶靶点的抑制剂被开发出来,并成功进入临床试验。
例如,针对肿瘤相关激酶BRAF的抑制剂Vemurafenib在治疗黑色素瘤中取得了显著的疗效。
此外,近年来还发现了多种新的蛋白靶点,如免疫疗法中的PD-1和CTLA-4,以及神经系统疾病中的Tau和β-淀粉样蛋白。
靶向RNA是近年来的热点研究领域之一。
RNA作为一种重要的生物分子,其异常表达和功能紊乱与多种疾病的发生发展密切相关。
通过调控RNA的表达和功能,可以实现对疾病的治疗。
例如,近年来研究人员发展了多种靶向microRNA的药物,并在肿瘤治疗中取得了良好的效果。
此外,CRISPR/Cas9等基因编辑技术的发展,也为RNA作为药物靶点的研究提供了新的思路和方法。
靶向DNA是药物靶点研究的另一个重要方向。
DNA是生物体内贮存遗传信息的重要分子,通过靶向DNA可以实现对疾病相关基因的调控。
例如,通过靶向DNA进行基因修饰,可以治疗一些遗传性疾病,如囊性纤维化和地中海贫血。
此外,DNA损伤修复途径的靶向调控也成为了一种新的治疗策略,比如通过抑制PARP酶来增加DNA的损伤,从而提高肿瘤细胞对放疗和化疗的敏感性。
总结而言,药物靶点研究在近年来取得了显著进展,靶向蛋白、靶向RNA以及靶向DNA成为研究的热点。
通过对这些靶点的研究,可以开发出更具针对性和高效性的药物,为疾病的治疗带来新的希望。
同时,随着基因编辑技术的发展和深入研究,药物靶点的研究也将迎来新的突破和发展。
分子靶向药比传统化疗药的疗效高明一筹,毋庸置疑,但是价格却贵了许多。
因为西药单体的作用分得太细,所以也是要多种药物综合使用,包括分子靶向药与传统化疗药联合,而且分子靶向药的副作用也不可避免(比直接抑制分裂增殖的传统化疗药相比副作用好些,因为分子靶向药主要是针对细胞核外的相关分子),西药提纯自作聪明地想单挑,但疾病往往并不这样。
药学终究不是临床,化学终究也不是生命的本质,总统终究不是一个国家,分子靶向药最多也是减慢恶性肿瘤进程罢了,这是大家要明白的,点到为止。
背景知识的介绍:
①表皮生长因子受体(EGFR)家族是一类跨膜糖蛋白受体酪氨酸激酶。
EGFR家族是由4个成员组成:HER-1(EGFR)、HER-2(Neu)、HER-3和HER-4。
HER-2和HER-3并不与任何已知配体结合,而是结合其他EGFR家族成员形成异质二聚体。
EGFR也被发现存在于细胞核内。
K-RAS是EGFR信号转导的下游因子,K-RAS突变可激活RAF/MEK/ERK信号通路。
①间变淋巴瘤激酶(anaplastic lymphomakinase,ALK)是继表皮生长因子受体(epidermal growth factor receptor,EGFR)之后在非小细胞肺癌(nonsmall-cell lung cancer,NSCLC)中发现的第2个靶向治疗的靶点。
ALK融合基因发生于3%~7%的NSCLC患者,临床上常见于不吸烟的年轻腺癌患者,通常与EGFR或KRAS突变的发生互相排斥。
EML4-ALK是肺癌ALK融合的主要类型,ALK受体酪氨酸激酶调控RAS-MAPK和PI3K-AKT信号转导。
①间质上皮转化(mesenchymal epithelial transition,MET)受体是c-MET原癌基因编码的蛋白产物。
MET是目前唯一已知的HGF 受体。
HGF/SF与MET在浆膜上的结合可激活下游信号级联反应,首先使胞质酪氨酸激酶磷酸化,继而导致MET的自身磷酸化。
许多原发及转移的肿瘤中出现MET基因扩增,继而引起蛋白过表达和结构性激酶活化。
还认为MET和HGF过表达可导致肿瘤细胞对化疗和放疗的耐受。
EGFR可与胰岛素样生长因子(IGF)、肝细胞生长因子(HGF)结合参与调控下游的激酶通路如HGF/c-MET通路。
作用于该通路的药物有:西妥昔单抗、厄洛替尼、拉帕替尼、吉非替尼等。
①血管生成相关的:血管内皮生长因子(vascular endothelial growth factor,VEGF)及其受体(vascular endothelial growth factor receptor,VEGFR)是内皮细胞增殖形成新生血管的关键步骤。
同时,血小板源生长因子(platelet derived growth factor,PDGF)及其受体(platelet derived growth factor receptor,PDGFR)对肿瘤基质的调节至关重要,其激活可导致细胞外膜和血管平滑肌的生成和稳定。
胰岛素样生长因子(insulin-like growth factor,IGF)及其受体IGFR1在VEGF刺激血管生成中发挥重要作用,抑制IGF-R1可以抑制血管生成。
①免疫相关的:细胞程序性死亡受体1(PD-1)主要在激活的T 淋巴细胞和B淋巴细胞中表达,功能是抑制免疫细胞的激活,这是免疫系统的一种正常的自稳机制,因为过度的T/B细胞激活会引起自身免疫性疾病。
但是,肿瘤微环境会诱导浸润的T细胞高表达PD-1
分子,肿瘤细胞高表达配体PD-L1和PD-L2,导致肿瘤微环境中PD-1通路持续激活,T细胞功能被抑制,无法杀伤肿瘤细胞。
PD-1的抗体可阻断这一通路,部分恢复T细胞的功能,继续杀伤肿瘤细胞。
正常情况下,T细胞可经第一信号(抗原-抗体复合物)和第二信号(CD28/B7介导的活化信号)通路激活,而CTLA-4与CD28/B7活化信号结合后,会产生抑制T细胞激活的信号,进而抑制特异性T细胞活化。
阻断CTLA-4和CD28/B7结合,去除抗肿瘤免疫抑制,从而调动免疫细胞,识别肿瘤抗原,就可启动特异性抗肿瘤免疫反应。
①几乎所有的生长因子刺激细胞增殖的信号,以及大部分细胞因子的信号、抗原结合淋巴细胞表面受体诱发细胞各种反应,都离不开酪氨酸激酶(Tyrosine Kinase)受体通路。
有两个家族的酪氨酸激酶:跨膜受体的激酶和胞质的非受体激酶。
非抗体的小分子酪氨酸激酶抑制剂,主要依靠和ATP结合域的相互作用。
①哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)作为PI3K/Akt下游的一种重要的丝氨酸-苏氨酸蛋白激酶,通过激活核糖体激酶调节肿瘤细胞的增殖、存活和侵袭转移。
近年来,PI3K/Akt/mTOR通路备受关注,mTOR抑制剂在针对神经内分泌肿瘤、肾癌、乳腺癌等一系列临床研究中被证实具有可观的治疗前景。
mTOR通路整合来自于胰岛素、生长因子和氨基酸的上游通路信息,参与基因转录、蛋白质翻译、核糖体合成和细胞凋亡等生物过程,在细胞生长中发挥了重要作用。
mTOR途径激活会导致转移风险增高,降低生存率。
大量研究显示,在各种肉瘤亚型中均可见到
PI3K/Akt/mTOR通路被激活。
①哺乳动物细胞中的RAF家族是由A-RAF、B-RAF、C-RAF 三大成分组成。
调查研究显示,大约有65%的直肠癌、卵巢癌和甲状腺癌等恶性肿瘤与该家族中的B-RAF突变体相关。
由于B-RAF的N-端(负向调节区)常处于磷酸化状态,导致其活化区段的酶足以开启;同样持续磷酸化的N-端分子亦会阻止自身抑制,从而被视为B-RAF活化形成的触发点。
BRAF与RAS同为RAS/RAF/MEK/ERK信号通路的上游调节因子。
Ras和Braf促进细胞增殖、生存及诱导所谓“癌基因成瘾”状态,均需要Ras-Raf-MEK-ERK级联反应的关键分子MEK激酶参与。
Braf突变患者多伴有MEK激酶过度激活。
①细胞周期蛋白依赖性激酶(CDKs)以及细胞周期蛋白,负责调节细胞周期的进展。
各种CDK随细胞周期时相交替活化,磷酸化相应底物,使细胞周期事件有序进行,这个过程的中断在恶性肿瘤中非常常见。
①大部分细胞内的蛋白质降解通过泛素-蛋白酶体系统(UPS),蛋白质被泛素标记,然后由26S蛋白酶体复合物识别并降解为小肽。
UPS的失调关联包括恶性肿瘤在内的许多人类疾病。
泛素-蛋白酶体通路作用机制荣获2004年诺贝尔化学奖。
①一般情况下,组蛋白的乙酰化有利于DNA与组蛋白八聚体的解离,核小体结构松弛,从而使各种转录因子和协同转录因子能与DNA 结合位点特异性结合,激活基因的转录。
在细胞核内,组蛋白乙酰化与组蛋白去乙酰化过程处于动态平衡。
在癌细胞中,组蛋白去乙酰化
酶(Histone deacelytase,HDAC)的过度表达不利于特定基因的表达,包括一些肿瘤抑制基因,因此HDAC抑制剂对肿瘤异常表观遗传具有调控作用。
HDACIs对于肿瘤的治疗作用也与免疫系统密切相关。
(一)单抗类(Mab)
(1)Her-2抗体:乳腺癌、胃癌曲妥珠单抗
(2)EGFR抗体
西妥昔单抗
(3)VEGF抗体
贝伐珠单抗
(4)CD20抗体:非霍奇金淋巴瘤、慢性淋巴细胞白血病
利妥昔单抗
(二)蛋白激酶抑制剂(PKI)
蛋白激酶和各种信号通路有关,不仅仅包括EGFR-TKI,而且各种信号通路之间可能还存在交叉。
(1)初步分类
①单靶点的受体酪氨酸激酶抑制剂
EGFR-TKI:吉非替尼(易瑞沙)、厄洛替尼①多靶点的受体酪氨酸激酶抑制剂
索拉菲尼、舒尼替尼
①非受体酪氨酸激酶抑制剂
伊马替尼(格列卫):能与Bcr-Ab1酪氨酸激酶作用,用于治疗费城染色体(Bcr-Abl)阳性的慢性骨髓性白血病(简称CML),是最早期的TKI(可以追溯到2001年)。
(2)ALK抑制剂
克唑替尼、色瑞替尼
ROS1与ALK在结构上存在一定的同源性,故可应用ALK抑制剂来治疗ROS1重排的NSCLC。
(3)c-Met抑制剂
克唑替尼:是ALK和c-MET基因或其变异体的双重阻断剂。
(4)BRAF抑制剂和MEK抑制剂
达拉菲尼(BRAF-TKI)+曲美替尼(MEK抑制剂)用于黑色素瘤。
(5)CDK抑制剂
Flavopiridol:是一种非选择性的CDK1、2、4、6、7、9抑制剂,为一种源于原产于印度的植物(Dysoxylum binectariferum)的黄酮类化合物。
(6)mTOR抑制剂
依维莫司、西罗莫司
(三)免疫检查点抑制剂
PD-1/PD-L1抑制剂、CTLA4 抑制剂
(四)蛋白酶体抑制剂
硼替佐米(BTZ,26S蛋白酶体的可逆性抑制剂):用于多发性骨髓
瘤。
(五)组蛋白去乙酰化酶抑制剂(HDACI)
西达本胺(Chidamide,商品名爱谱沙/epidaza):用于外周T细胞淋巴瘤(PTCL)
(六)其它。