电化学难题选择典型题例题压轴题
- 格式:doc
- 大小:1.01 MB
- 文档页数:11

备战高考化学与化学能与电能有关的压轴题及答案一、化学能与电能1.如图所示,E为浸有Na2SO4溶液的滤纸,并加入几滴酚酞。
A、B均为Pt片,压在滤纸两端,R、S为电源的电极。
M、N为惰性电极。
G为检流计,K为开关。
试管C、D和电解池中都充满KOH溶液。
若在滤纸E上滴一滴紫色的KMnO4溶液,断开K,接通电源一段时间后,C、D中有气体产生。
(1)R为电源的__,S为电源的__。
(2)A极附近的溶液变为红色,B极的电极反应式为__。
(3)滤纸上的紫色点移向__(填“A极”或“B极”)。
(4)当试管C、D中的气体产生到一定量时,切断外电源并接通开关K,经过一段时间,C、D中气体逐渐减少,主要是因为_,写出有关的电极反应式:__。
【答案】负极正极 2H2O-4e-=4H++O2↑ B极氢气和氧气在碱性环境下发生原电池反应,消耗了氢气和氧气 2H2+4OH--4e-=4H2O(负极),O2+2H2O+4e-=4OH-(正极)【解析】【分析】(1)根据电极产物判断电解池的阴阳极及电源的正负极;(2)根据电解池原理及实验现象书写电极反应式;(3)根据电解池原理分析电解质溶液中离子移动方向;(4)根据燃料电池原理分析解答。
【详解】(1)断开K,通直流电,电极C、D及氢氧化钾溶液构成电解池,根据离子的放电顺序,溶液中氢离子、氢氧根离子放电,分别生成氢气和氧气,氢气和氧气的体积比为2:1,通过图象知,C极上气体体积是D极上气体体积的2倍,所以C极上得氢气,D极上得到氧气,故R是负极,S是正极,故答案为:负极;正极;(2)A极是阴极,电解高锰酸钾时,在该极上放电的是氢离子,所以该极上碱性增强,酚酞显红色,B极是阳极,该极附近发生的电极反应式为:2H2O-4e-=4H++O2↑,故答案为:2H2O-4e-=4H++O2↑;(3)浸有高锰酸钾的滤纸和电极A、B与电源也构成了电解池,因为R是负极,S是正极,所以B极是阳极,A极是阴极,电解质溶液中的阴离子高锰酸根离子向阳极移动,紫色点移向B极,故答案为:B极;(4)当C、D里的气体产生到一定量时,切断外电源并接通开关K,构成氢氧燃料电池,氢气和氧气在碱性环境下发生原电池反应,消耗了氢气和氧气;在燃料电池中,燃料氢气为负极,在碱性环境下的电极反应式为:2H2+4OH--4e-=4H2O,C中的电极作负极,D中的电极作正极,电极反应式为O2+2H2O+4e-=4OH-,故答案为:氢气和氧气在碱性环境下发生原电池反应,消耗了氢气和氧气;2H2+4OH--4e-=4H2O(负极),O2+2H2O+4e-=4OH-(正极)。

压轴题08“另类”电化学试题分析电化学是高考化学的重要核心知识点,是每年高考化学试题中必考的题型之一,具有一定的信度与区分度,也是近几年江苏高考的重要考查形式,电化学试题仍然是2023年江苏高考考查的必考重点难点。
所以要求考生了解题型的知识点及要领,对于常考的模型要求有充分的认知。
经过对比发现高考中不同与常规“另类”的电化学试题,在准确而深刻理解知识原理上,着力考查考生的创新思维、发散思维、及迁移贯通等能力,同时“另类”的电化学试题也体现了高考试题一直是稳中有变,在传承中变化创新理念。
“另类”的电化学试题而在备考过程中却一直被忽视,成为知识点复习的“死角”,常见的考查角度涉及电解质溶液中存在金属导体、电流电子方向在过程中发生改变、原电池、电解池的串联考查、涉及电化学知识的说理叙述、吸氧与析氢电化学腐蚀同时存在、有悖于放电顺序的离子在电极上的放电等。
一、电解质溶液中存在金属导体1.(北京卷)用石墨电极完成下列电解实验。
实验一实验二装置现象a 、d 处试纸变蓝;b 处变红,局部褪色;c 处无明显变化两个石墨电极附近有气泡产生;n 处有气泡产生;……下列对实验现象的解释或推测不合理的是A .a 、d 处:2H 2O+2e -=H 2↑+2OH -B .b 处:2Cl --2e -=Cl 2↑C .c 处发生了反应:Fe-2e -=Fe 2+D .根据实验一的原理,实验二中m 处能析出铜解析:根据实验一、二装置及现象分析可得都是串联的电解池,当分析其中某一装置时其它串联装置看作导线,实验一中的a 、d 与电源的负极相连为电解NaCl 溶液的阴极,电极反应a :2H 2O+2e -=H 2↑+2OH -,呈碱性,a 、d 处试纸变蓝,A 正确;b 、c 与电源的正极相连为阳极,b处:2Cl--2e-=Cl2↑,Cl2与H2O反应生成具有漂白性的HClO致使局部褪色,b处变红,说明还发生2H2O+4e-=O2↑+4H+,溶液呈酸性,c极的Fe为活性的阳极,优先失电子,电极反应为Fe-2e-=Fe2+,C正确;同理分析可得:实验二相当于三个串联的电解池,阴极石墨电极反应:2H++2e-=H2↑,阳极石墨电极反应:2H2O+4e-=O2↑+4H+,附近都有气泡产生,电解稀硫酸相当与电解H2O;一个球两面为不同的电极,钢珠的m为阴极,Cu2++2e-= Cu,另一球朝向m的一面为阳极(n的背面),相当于电镀,m处能析出铜,n极为阴极,2H++2e-=H2↑有气泡产生,故D正确,答案选B。
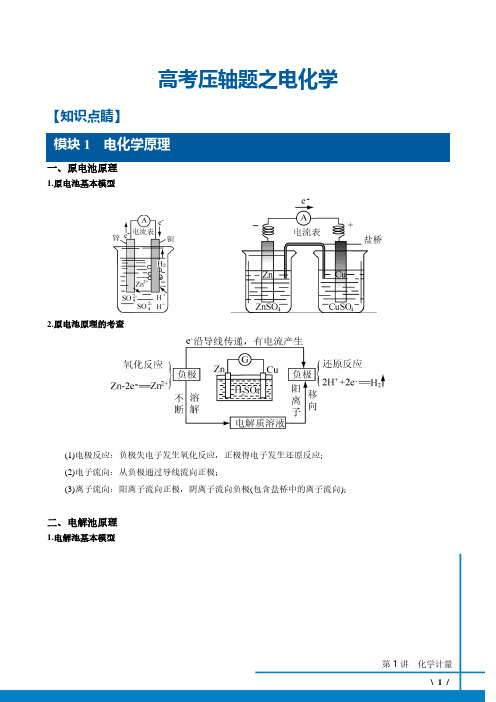
高考压轴题之电化学【知识点睛】1一、原电池原理1.原电池基本模型2.原电池原理的考查(1)电极反应:负极失电子发生氧化反应,正极得电子发生还原反应;(2)电子流向:从负极通过导线流向正极;(3)离子流向:阳离子流向正极,阴离子流向负极(包含盐桥中的离子流向);二、电解池原理1.电解池基本模型2.电解池原理(1)电子流向:(电源)负极-e −−−−−→电子()流出阴极;阳极e -−−−−−→电子()流入(电源)正极。
(2)离子流向:阳离子−−−→移向阴极;阴离子−−−→移向阳极. [注]当电解池存在离子交换膜时,则只能允许阳离子或阴离子透过交换膜移向某极;三、电解质溶液pH 的变化 1.电极附近电解液pH 的变化(1)若电极反应消耗OH -(或H +),则电极周围溶液的pH 减小(或增大); (2)若电极反应生成OH -(或H +),则电极周围溶液的pH 增大(或减小)。
2.电解液pH 的变化(1)若总反应的结果是消耗OH -(或H +),则溶液的pH 减小(或增大); (2)若总反应的结果是生成OH -(或H +),则溶液的pH 增大(或减小)。
(3)若两极消耗等物质的量的OH -(或H +),则溶液的pH 变化通常看是否有水等物质生成。
【经典例题】【例1】 根据下图,下列判断正确的是 A. 电子从极流出,流入极,经盐桥回到极B. 烧杯b 中发生的电极反应为C. 烧杯a 中发生反应,溶液pH 降低D. 向烧杯a 中加入少量溶液,有蓝色沉淀生成【例2】 利用生物燃料电池原理研究室温下氨的合成,电池工作时在电极与酶之间传递电子,示意图如图所示。
下列说法错误的是( )A. 相比现有工业合成氨,该方法条件温和,同时还可提供电能B. 阴极区,在氢化酶作用下发生反应C. 正极区,固氮酶为催化剂,发生还原反应生成D. 电池工作时质子通过交换膜由负极区向正极区移动模块2电极的判断与电极反应式的书写一、电池类型的判断二、电化学电极的判断方法1.正负极的判断2.阴阳极的判断三、电极反应式的书写 1.原电池电极反应式的书写(1)找出化合价发生变化的物质及变化后的产物,从而找出氧化剂和还原剂、氧化产物和还原产物。

备战高考化学与化学能与电能有关的压轴题含详细答案一、化学能与电能1.研究+6价铬盐不同条件下微粒存在形式及氧化性,某小组同学进行如下实验:已知:Cr2O72-(橙色)+H2O2CrO42-(黄色)+2H+△H=+13.8kJ/mol,+6价铬盐在一定条件下可被还原为Cr3+,Cr3+在水溶液中为绿色。
(1)试管c和b对比,推测试管c的现象是_____________________。
(2)试管a和b对比,a中溶液橙色加深。
甲认为温度也会影响平衡的移动,橙色加深不一定是c(H+)增大影响的结果;乙认为橙色加深一定是c(H+)增大对平衡的影响。
你认为是否需要再设计实验证明?__________(“是”或“否”),理由是____________________________________________________。
(3)对比试管a、b、c的实验现象,可知pH增大2-272-4c(Cr O)c(CrO)_____(选填“增大”,“减小”,“不变”);(4)分析如图试管c继续滴加KI溶液、过量稀H2SO4的实验现象,说明+6价铬盐氧化性强弱为Cr2O72-__________CrO42-(填“大于”,“小于”,“不确定”);写出此过程中氧化还原反应的离子方程式_________。
(5)小组同学用电解法处理含Cr2O72-废水,探究不同因素对含Cr2O72-废水处理的影响,结果如表所示(Cr2O72-的起始浓度,体积、电压、电解时间均相同)。
实验ⅰⅱⅲⅳ是否加入Fe2(SO4)3否否加入5g否是否加入H2SO4否加入1mL加入1mL加入1mL电极材料阴、阳极均为石墨阴、阳极均为石墨阴、阳极均为石墨阴极为石墨,阳极为铁Cr2O72-的去除率/%0.92212.720.857.3①实验ⅱ中Cr2O72-放电的电极反应式是________________。
②实验ⅲ中Fe3+去除Cr2O72-的机理如图所示,结合此机理,解释实验iv中Cr2O72-去除率提高较多的原因_______________。

高考化学考点电化学试题(含答案)一、选择题(每题3分,共30分)1. 下列关于电化学的叙述正确的是()A. 原电池的正极发生氧化反应,负极发生还原反应B. 电流的方向是从电源的正极流向负极C. 电解质溶液的导电能力与溶液中离子的浓度成正比D. 电池工作时,化学能转化为电能答案:D2. 下列装置中,属于原电池的是()A. 燃料电池B. 酸性电池C. 电解池D. 伏打电池答案:D3. 下列关于电解质的说法正确的是()A. 电解质溶液的导电能力与电解质的浓度无关B. 电解质溶液的导电能力与电解质的电离度成正比C. 强电解质的溶液一定比弱电解质的溶液导电能力强D. 非电解质在水中不能导电答案:B4. 在下列反应中,氧化剂和还原剂物质的量之比最大的是()A. 2KMnO4 + 16HCl = 2KCl + 2MnCl2 + 5Cl2↑ + 8H2OB. Cu + 2AgNO3 = Cu(NO3)2 + 2AgC. Fe2O3 + 3CO = 2Fe + 3CO2D. 2H2O2 = 2H2O + O2↑答案:B5. 下列电池中,能实现电能转化为化学能的是()A. 酸性电池B. 燃料电池C. 铅酸电池D. 镍氢电池答案:C6. 下列关于电化学腐蚀的叙述正确的是()A. 金属腐蚀过程中,金属失去电子B. 金属腐蚀过程中,金属得到电子C. 金属腐蚀过程中,金属与氧气发生反应D. 金属腐蚀过程中,金属与水发生反应答案:A二、填空题(每题5分,共30分)7. 在下列电池符号中,属于原电池的是__________,属于电解池的是__________。
答案:Zn/CuSO4/Cu;Fe/FeSO4/Fe8. 写出下列电池的电极反应:(1)锌-铜原电池:负极反应:__________,正极反应:__________。
(2)氢氧燃料电池(酸性环境):负极反应:__________,正极反应:__________。
答案:(1)Zn - 2e^- = Zn^2+;Cu^2+ + 2e^- = Cu(2)H2 - 2e^- = 2H^+;O2 + 4H^+ + 4e^- =2H2O9. 铅酸电池充电和放电过程中,正极和负极的反应分别为:放电时正极反应:__________,负极反应:__________。

电化学选择题专项练习题含答案电化学选择题专项练习1.电解NO制备NH4NO3的工作原理如图所示,为使电解产物全部转化为NH4NO3,需要补充物质M。
下列有关分析或说法中正确的是()A.a应接直流电源的正极B.阳极的电极反应式:NO+5e-+6H+=NH4++H2OC.电路中通过5mol电子时,理论上最可处理22.4L标况下的NOD.补充的物质M是NH32.电-Fenton法是用于水体中有机污染物降解的高级氧化技术,其反应原理如图所示。
其中电解产生的H2O2与Fe2+发生Fenton反应:H2O2+Fe2+=Fe3++OH-+·OH,生成的羟基自由基(·OH)能氧化降解有机污染物。
下列说法中正确的是A.电源的X极为正极,Y极为负极B.阴极的电极反应式为Fe2+-e-=Fe3+C.阳极的电极反应式为H2O-e-=H++·OHD.每消耗1molO 2,整个电解池中理论上可产生2mol·OH3.将反应5IO3﹣+I﹣+6H+?3I2+3H2O设计成如图所示的原电池.开始时向甲烧杯中加入少量浓硫酸,电流计指针发生转,一段时间后,电流计指针回到零,再向甲烧杯中滴入几滴浓NaOH溶液,电流计指针再次发生偏转.下列判断不正确的是()A.开始加入少量浓硫酸时,乙中石墨电极上发生氧化反应B.开始加入少量浓硫酸时,同时在甲、乙烧杯中都加入淀粉溶液,只有乙烧杯中溶液变蓝C.电流计读数为零时,反应达到化学平衡状态D.两次电流计指针偏转方向相反4.液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点。
一种以肼(N2H4)为燃料的电池装置如图所示。
该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质。
下列关于该燃料电池的叙述不正确的是A.电流从右侧电极经过负载后流向左侧电极B.负极发生的电极反应式为N2H4+4OH--4e-=N2↑+4H2OC.该燃料电池的电极材料应采用多孔导电材料,以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触D.该燃料电池持续放电时,K+从负极向正极迁移,因而离子交换膜需选用阳离子交换膜5.最近有研究人员利用隔膜电解法处理高浓度的乙醛废水.乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸.实验室以一定浓度的乙醛﹣Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示.下列说法不正确的是()A.电解过程中,阴极附近的乙醛被氧化B.阳极反应CH3CHO﹣2e﹣+H2O═CH3COOH+2H+C.若以CH4﹣空气燃料电池为直流电源,燃料电池的b极应通入CH4D.现处理含1mol乙醛的废水,至少需转移2mol电子6.以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,通过电解原理来降解酸性废水中的NO3-,下列说法错误的是A.该新型电池工作时,负极的电极反应式是Al+4OH--3e-=AlO2-+2H2OB.为增强溶液的导电性,I区水中可加入少量Na2SO4C.A为电源正极,H+从Ⅰ区移向Ⅱ区D.阴极反应式为:2NO3-+6H2O+10e-=N2↑+12OH-7.最近中美研究人员发明了一种可快速充放电的铝离子电池,该电池电解质为离子液体{AlCl3/[EMIM]Cl},放电时有关离子转化如图所示.下列说法正确的是()A.充电时,阴极发生:4Al2Cl7﹣+3e﹣═Al+7AlCl4﹣B.充电时,泡沫石墨极与外电源的负极相连C.放电时,负极发生:2AlCl4﹣﹣e﹣═Al2Cl7﹣+Cl﹣D.放电时,电路中每流过3mol电子,正极减少27g8.用NO生产硝酸,可以有效消除污染,其原理如图所示.下列说法正确的是()A.a极是该电极的正极B.电流由a极经导线流向b极C.a极的电极反应式为NO﹣3e﹣+2H2O═NO3﹣+4H+D.若消耗2.24L(标准状况下)氧气,则会有0.4molH+通过质子交换膜进入a极区9.据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2做原料的燃料电池,负极材料采用Pt/C.正极材料采用MnO2,可用做空军通信卫星电源,其工作原理如图所示.下列说法中错误的是()A.电池放电时Na+从a极区移向b极区B.电极b采用MnO2,MnO2既做电极材料又有催化作用C.该电池的负极反应为BH4-+8OH﹣一8e﹣═BO2-+6H2OD.每消耗3molH2O2,转移的电子为3mol10.普通锌锰干电池的简图(如图所示),它是用锌皮制成的锌筒作电极兼做容器,中央插一根碳棒,碳棒顶端加一铜帽.在石墨碳棒周围填满二氧化锰和炭黑的混合物,并用离子可以通过的长纤维纸包裹作隔膜,隔膜外是用氯化锌、氯化铵和淀粉等调成糊状作电解质溶液;该电池工作时的总反应为:Zn+2NH4++2MnO2=[Zn(NH3)2]2++Mn2O3+H2O关于锌锰干电池的下列说法中正确的是()A.当该电池电压逐渐下降后,利用电解原理能重新充电复原B.电池正极的电极反应式为:2MnO2+2NH4++2e﹣═Mn2O3+2NH3+H2OC.电池工作时,电子由正极通过外电路流向负极D.外电路中每通过0.1mol电子,锌的质量理论上减小6.5g11.硼氢化钠(NaBH4)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,其工作原理如图.下列说法正确的是()A.电极a为正极,b为负极B.放电时,Na+从b极区移向a极区C.电极b上发生的电极反应为H2O2+2e﹣═2OH﹣D.每生成1molBO2﹣转移6mol电子12.某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和C3H8O.下列说法错误的是()A.该装置将光能和电能转化为化学能B.该装置工作时,H+从a极区向b极区迁移C.每还原44gCO2,理论上可生成33.6LO2D.b电极的反应为:3CO 2+18H++18e﹣═C3H8O+5H2O13.瓦斯爆炸是煤矿开采中的重大危害,一种瓦斯分析仪(如图甲)在煤矿巷道中的甲烷浓度达到一定值时,其传感器就可以显示。
高考化学与化学能与电能有关的压轴题含答案一、化学能与电能1.二氧化氯(ClO2)具有强氧化性,在工业上常用作水处理剂、漂白剂。
ClO2是一种易溶于水的黄绿色气体,其体积分数超过10%时易引起爆炸。
某研究小组欲用以下三种方案制备ClO2,回答下列问题:(1)以黄铁矿(FeS2)、氯酸钠和硫酸溶液混合反应制备ClO2,黄铁矿中的硫元素在酸性条件下被ClO3-氧化成SO42-,写出制备ClO2的离子方程式__。
(2)用过氧化氢作还原剂,在硫酸介质中还原NaClO3制备ClO2,并将制得的ClO2用于处理含CN-废水。
实验室模拟该过程的实验装置(夹持装置略)如图所示。
①装置A的名称是__,装置C的作用是__。
②反应容器B应置于30℃左右的水浴中,目的是__。
③通入氮气的主要作用有3个,一是可以起到搅拌作用,二是有利于将ClO2排出,三是__。
④ClO2处理含CN-废水的离子方程式为__,装置E的作用是__。
(3)氯化钠电解法是一种可靠的工业生产ClO2的方法。
①用于电解的食盐水需先除去其中的Ca2+、Mg2+、SO42-等杂质。
某次除杂操作时,往粗盐水中先加入过量的__(填化学式),至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去。
②用石墨做电极,在一定条件下电解饱和食盐水制取ClO2,工作原理如图所示,写出阳极产生ClO2的电极反应式__。
【答案】FeS2+15ClO3-+14H+=15ClO2+Fe3++2SO42-+7H2O 恒压漏斗安全瓶提高化学反应速率,同时防止过氧化氢受热分解稀释ClO2,防止其爆炸 2CN-+2ClO2=2CO2+N2+2Cl-吸收ClO2等气体,防止污染大气 BaCl2 Cl--5e-+2H2O=ClO2↑+4H+【分析】二氧化氯(ClO2)具有强氧化性,在工业上常用作水处理剂、漂白剂。
分别利用无机反应和电解原理制备二氧化氯,三种方法均利用了氧化还原反应。
盐桥 X YA CuSO 4溶液 电流计Ag 【考点直击】考点一、原电池原理该考点经常以选择题题型出现。
判断一个装置是否构成原电池的关键就是抓好“一看二标”,即看是否有自发的氧化还原反应存在,以构成原电池的三个条件为标准:两个活泼性不同的电极、插入电解质溶液、形成闭合回路。
形成闭合回路的方式有多种,可以是用导线连接两个电极,也可以是两电极直接接触。
【典例1】某小组为研究电化学原理,设计如图2装置。
下列叙述不正确的是A .a 和b 不连接时,铁片上会有金属铜析出B .a 和b 用导线连接时,铜片上发生的反应为:Cu 2++2e -= CuC .无论a 和b 是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色D .a 和b 分别连接直流电源正、负极,电压足够大时,Cu 2+向铜电极移动【变式1】如图所示,将紧紧缠绕不同金属的铁钉放入培养皿中,再加入含有适量酚酞和NaCl 的琼脂热溶液,冷却后形成琼胶(离子在琼胶内可以移动)。
下列叙述正确的是 ( B )A .a 中铁钉附近呈现红色B .b 中铁钉上发生还原反应C .a 中铜丝上发生氧化反应D .b 中铝条附近有气泡产生考点二 原电池正负极的判断方法该考点经常以选择题题型出现。
【典例2】 (2011·北京理综,8)结合下图判断,下列叙述正确的是 ( A )A .Ⅰ和Ⅱ中正极均被保护B .Ⅰ和Ⅱ中负极反应均是Fe -2e -===Fe 2+C .Ⅰ和Ⅱ中正极反应均是O 2+2H 2O +4e -===4OH -D .Ⅰ和Ⅱ中分别加入少量K 3[Fe(CN )6]溶液,均有蓝色沉淀【变式训练2】如图所示,杠杆AB 两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向水槽中滴入浓CuSO 4 液,一段时间后,下列有关杠杆的偏向判断正确的是 ( C )A .杠杆为导体或绝缘体时,均为A 端高B 端低 B .杠杆为导体或绝缘体时,均为A 端低B 端高C .当杠杆为导体时,A 端低B 端高;杠杆为绝缘体时,A 端高B 端低D .当杠杆为导体时,A 端高B 端低;杠杆为绝缘体时,A 端低B 端高考点三 电极反应式的书写【典例3】依据氧化还原反应:2Ag +(aq )+Cu(s ) = Cu 2+(aq )+2Ag(s)设计的原电池如图所示。
高考化学与化学能与电能有关的压轴题附答案解析一、化学能与电能1.方法与规律提炼:(1)某同学利用原电池装置证明了反应Ag++Fe2+=Ag+Fe3+能够发生,设计的装置如下图所示。
为达到目的,其中石墨为_________极,甲溶液是____________,证明反应Ag++Fe2+=Ag +Fe3+能够发生的实验操作及现象是_________________________(2)用零价铁(Fe)去除水体中的硝酸盐(NO)已成为环境修复研究的热点之一。
Fe还原水体中NO3-的反应原理如图所示。
上图中作负极的物质是___________。
正极的电极反应式是______________。
(3)在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如下图所示:阴极区的电极反应式为_______________。
电路中转移1 mol电子,需消耗氧气_______L(标准状况)。
(4)KClO3也可采用“电解法”制备,装置如图所示。
写出电解时阴极的电极反应式___________________电解过程中通过阳离子交换膜的离子主要为_________,其迁移方向是_____________(填a→b或b→a)。
学法题:通过此题的解答,请归纳总结书写电极反应式的方法____【答案】负 FeSO4或FeCl2溶液分别取电池工作前与工作一段时间后左侧烧杯中溶液,同时滴加KSCN溶液,后者红色加深铁 NO3-+8e-+10H+=NH4++3H2O Fe3++e-= Fe2+ 5.6L 2H++2e-= H2 ↑ K+a→b原电池中先确定原电池的正负极,列出正负极上的反应物质,并标出相同数目电子的得失;注意负极反应生成的阳离子与电解质溶液中的阴离子是否共存。
电解池中电极反应式的书写看阳极材料,如果阳极是惰性电极(Pt、Au、石墨),则应是电解质溶液中的离子放电,应根据离子的放电顺序进行书写。