高2020届高2017级步步高高中化学一轮复习全套课件学案第四章第17讲
- 格式:docx
- 大小:2.36 MB
- 文档页数:31


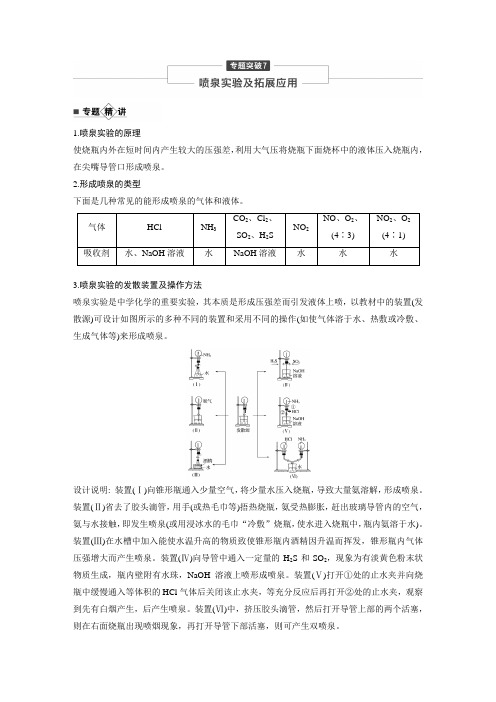
1.喷泉实验的原理使烧瓶内外在短时间内产生较大的压强差,利用大气压将烧瓶下面烧杯中的液体压入烧瓶内,在尖嘴导管口形成喷泉。
2.形成喷泉的类型下面是几种常见的能形成喷泉的气体和液体。
气体HCl NH3CO2、Cl2、SO2、H2SNO2NO、O2、(4∶3)NO2、O2(4∶1) 吸收剂水、NaOH溶液水NaOH溶液水水水3.喷泉实验的发散装置及操作方法喷泉实验是中学化学的重要实验,其本质是形成压强差而引发液体上喷,以教材中的装置(发散源)可设计如图所示的多种不同的装置和采用不同的操作(如使气体溶于水、热敷或冷敷、生成气体等)来形成喷泉。
设计说明: 装置(Ⅰ)向锥形瓶通入少量空气,将少量水压入烧瓶,导致大量氨溶解,形成喷泉。
装置(Ⅱ)省去了胶头滴管,用手(或热毛巾等)捂热烧瓶,氨受热膨胀,赶出玻璃导管内的空气,氨与水接触,即发生喷泉(或用浸冰水的毛巾“冷敷”烧瓶,使水进入烧瓶中,瓶内氨溶于水)。
装置(Ⅲ)在水槽中加入能使水温升高的物质致使锥形瓶内酒精因升温而挥发,锥形瓶内气体压强增大而产生喷泉。
装置(Ⅳ)向导管中通入一定量的H2S和SO2,现象为有淡黄色粉末状物质生成,瓶内壁附有水珠,NaOH溶液上喷形成喷泉。
装置(Ⅴ)打开①处的止水夹并向烧瓶中缓慢通入等体积的HCl气体后关闭该止水夹,等充分反应后再打开②处的止水夹,观察到先有白烟产生,后产生喷泉。
装置(Ⅵ)中,挤压胶头滴管,然后打开导管上部的两个活塞,则在右面烧瓶出现喷烟现象,再打开导管下部活塞,则可产生双喷泉。
4.喷泉实验产物的浓度计算关键是确定所得溶液中溶质的物质的量和溶液的体积,标准状况下的气体进行喷泉实验后所得溶液的物质的量浓度:(1)HCl、NH3、NO2气体或它们与其他不溶于水的气体混合时: 所得溶液的物质的量浓度为122.4mol·L-1。
(2)当是NO2和O2的混合气体且体积比为4∶1时,c(HNO3)=128mol·L-1。

第4讲 一定物质的量浓度的溶液及其配制考纲要求 1.了解溶液的含义。
2.了解溶解度、饱和溶液的概念。
3.了解溶液浓度的表示方法。
理解溶液中溶质的质量分数和物质的量浓度的概念,并能进行有关计算。
4.掌握配制一定溶质质量分数溶液和物质的量浓度溶液的方法。
考点一 物质的量浓度及相关计算1.物质的量浓度(1)概念:表示单位体积溶液里所含溶质B 的物质的量。
(2)表达式:c B =n BV。
(3)单位:mol·L -1(或 mol/L)。
2.溶质的质量分数――→概念⎪⎪⎪以溶液里溶质质量与溶液质量的比值表示溶液组成的物理量,一般用百分数表示――→表达式w (B)=m (B )m (aq )×100%(1)1 mol·L -1 NaCl 溶液是指此溶液中含有1 mol NaCl( )(2)用100 mL 水吸收0.1 mol HCl 气体所得溶液的物质的量浓度恰好是1 mol·L -1( )(3)1 L 水中溶解5.85 g NaCl 所形成的溶液的物质的量浓度是0.1 mol·L -1( )(4)将25 g CuSO 4·5H 2O 晶体溶于75 g 水中所得溶质的质量分数为25%( ) (5)将40 g SO 3溶于60 g 水中所得溶质的质量分数为49%( )(6)同浓度的三种溶液:Na 2SO 4、MgSO 4、Al 2(SO 4)3,其体积比为3∶2∶1,则SO 2-4浓度之比为3∶2∶3( ) (7)0.5 mol·L-1的稀H 2SO 4溶液中c (H +)为1.0 mol·L -1( )【参考答案】:(1)× (2)× (3)× (4)× (5)√ (6)× (7)√1.在标准状况下,将V L 氨气溶于0.1 L 水中,所得溶液的密度为ρ g·cm -3,则此氨水的物质的量浓度为____________ mol·L -1。


⾼2020届⾼2017级步步⾼⾼中化学⼀轮复习全套课件学案第⼗⼆章第38讲第38讲分⼦结构与性质考纲要求 1.了解共价键的形成、极性、类型(σ键和π键),了解配位键的含义。
2.能⽤键能、键长、键⾓等说明简单分⼦的某些性质。
3.了解杂化轨道理论及简单的杂化轨道类型(sp、sp2、sp3)。
4.能⽤价层电⼦对互斥理论或者杂化轨道理论推测简单分⼦或离⼦的⽴体构型。
5.了解范德华⼒的含义及对物质性质的影响。
6.了解氢键的含义,能列举存在氢键的物质,并能解释氢键对物质性质的影响。
考点⼀共价键及其参数1.本质在原⼦之间形成共⽤电⼦对(电⼦云的重叠)。
2.特征具有饱和性和⽅向性。
3.分类特别提醒(1)只有两原⼦的电负性相差不⼤时,才能形成共⽤电⼦对,形成共价键,当两原⼦的电负性相差很⼤(⼤于1.7)时,不会形成共⽤电⼦对,⽽形成离⼦键。
(2)同种元素原⼦间形成的共价键为⾮极性键,不同种元素原⼦间形成的共价键为极性键。
4.键参数(1)概念(2)键参数对分⼦性质的影响①键能越⼤,键长越短,分⼦越稳定。
②5.等电⼦原理原⼦总数相同,价电⼦总数相同的分⼦具有相似的化学键特征和⽴体结构,许多性质相似,如N2与CO、O3与SO2、N2O与CO2、CH4与NH+4等。
(1)共价键的成键原⼦只能是⾮⾦属原⼦(×)(2)在任何情况下,都是σ键⽐π键强度⼤(×)(3)分⼦的稳定性与分⼦间作⽤⼒的⼤⼩⽆关(√)(4)s-s σ键与s-p σ键的电⼦云形状对称性相同(√)(5)σ键能单独形成,⽽π键⼀定不能单独形成(√)(6)σ键可以绕键轴旋转,π键⼀定不能绕键轴旋转(√)(7)碳碳三键和碳碳双键的键能分别是碳碳单键键能的3倍和2倍(×)(8)键长等于成键两原⼦的半径之和(×)1.有以下物质:①HF,②Cl2,③H2O,④N2,⑤C2H4,⑥C2H6,⑦H2,⑧H2O2,⑨HCN(H—C≡N)。
【步步高】(全国)2017版高考化学一轮复习第4章非金属及其化合第17讲氮及其化合物考点一氮气及其氧化物1.氮气写出有关化学方程式:点燃①3Mg+N2Mg3N2;高温、高压②N2+3H23;放电或高温③N2+O2。
2.氮的氧化物氮有多种价态的氧化物:N2O、NO、N2O3、NO2、N2O4、N2O5等。
完成下表中NO和NO2的比较:3.氮氧化物对环境的污染及防治(1)常见的污染类型①光化学烟雾:NOx在紫外线作用下,与碳氢化合物发生一系列光化学反应,产生了一种有毒的烟雾。
②酸雨:NOx排入大气中后,与水反应生成HNO3和HNO2,随雨雪降到地面。
③破坏臭氧层:NO2可使平流层中的臭氧减少,导致地面紫外线辐射量增加。
④NO与血红蛋白结合使人中毒。
(2)常见的NOx 尾气处理方法①碱液吸收法2NO2+2NaOH===NaNO3+NaNO2+H2O NO2+NO+2NaOH===2NaNO2+H2ONO2、NO的混合气体能被足量烧碱溶液完全吸收的条件是n(NO2)≥n(NO)。
一般适合工业尾气中NOx的处理。
②催化转化法在催化剂、加热条件下,氨可将氮氧化物转化为无毒气体(N2)或NOx 与CO在一定温度下催化转化为无毒气体(N2和CO2)。
一般适用于汽车尾气的处理。
深度思考1.俗话说“雷雨发庄稼”,这说明雷雨中含有能被植物吸收利用的化合态的氮。
请写出三个有关的化学方程式:(1)________________________________________________________________________;(2)________________________________________________________________________;(3)________________________________________________________________________。
专题讲座二 常见气体的实验室制备、净化和收集1.气体制备实验的基本思路2.重要气体的发生装置依据制备气体所需的反应物状态和反应条件,可将制备气体的发生装置分为三类: (1)固体+固体――→△气体 发生装置:制备气体: O 2、NH 3、CH 4等。
(2)固体+液体或液体+液体――→△气体 发生装置:制备气体: Cl 2、C 2H 4等。
(3)固体+液体(不加热)―→气体 发生装置:制备气体: 选择合适的药品和装置能制取中学化学中常见的气体。
(1)改进的目的: 用于加热易熔化的固体物质的分解,这样可有效地防止固体熔化时造成液体的倒流,如草酸晶体受热分解制取CO 2气体。
(2)“固体+液体―→气体”装置的创新(3)“固(液)+液――→△气体”装置的创新图A 的改进优点是能控制反应液的温度。
图B 的改进优点是使圆底烧瓶和分液漏斗中的气体压强相等,便于液体顺利流下。
4.气体的除杂方法(1)除杂试剂选择的依据: 主体气体和杂质气体性质上的差异,如溶解性、酸碱性、氧化性、还原性。
除杂原则: ①不损失主体气体;②不引入新的杂质气体;③在密闭装置内进行;④先除易除的杂质气体。
类型液态干燥剂固态干燥剂固态干燥剂固体,加热装置ⅠⅡⅢⅣ常见干燥剂浓H2SO4(酸性、强氧化性)无水氯化钙(中性) 碱石灰(碱性)除杂试剂Cu、CuO、Mg等当CO2中混有O2杂质时,应选用上述Ⅰ~Ⅳ中的Ⅳ装置除O2,除杂试剂是Cu粉。
5.气体的收集方法收集方法收集气体的类型收集装置可收集的气体(举例)排水法难溶于水或微溶于水,又不与水反应的气体O2、H2、NO、CO等排空气法向上排空气法密度大于空气且不与空气中的成分反应Cl2、SO2、NO2、CO2向下排空气法密度小于空气且不与空气中的成分反应H2、NH36.集气装置的创新——排液集气装置装置(Ⅰ)从a管进气b管出水可收集难溶于水的气体,如H2、O2等。
若将广口瓶中的液体更换,还可以收集以下气体。
第17讲 氮及其化合物考纲要求 1.了解氮元素单质及其重要化合物的制备方法,掌握其主要性质及其应用。
2.了解氮的化合物对环境的影响。
考点一 氮气及其氧化物1.氮的固定2.氮气(1)物理性质:无色无味气体,密度比空气略小,难溶于水。
(2)化学性质写出有关化学方程式: ①3Mg +N 2=====点燃Mg 3N 2; ②N 2+3H 2高温、高压催化剂2NH 3;③N 2+O 2=====放电或高温2NO 。
3.氮的氧化物(1)氮有多种价态的氧化物,氮元素从+1~+5价都有对应的氧化物,如N 2O 、NO 、N 2O 3、NO 2(或N 2O 4)、N 2O 5,其中属于酸性氧化物的是N 2O 3、N 2O 5。
(2)NO 和NO 2的比较(1)固氮反应一定属于氧化还原反应( )(2)NO 中的NO 2杂质气体,可通过盛有水的洗气瓶除去( ) (3)CO 、NO 、NO 2都是大气污染气体,在空气中都稳定存在( ) (4)N 2与O 2在放电条件下直接化合成NO 2( ) (5)NO 2溶于水时,NO 2是氧化剂,水是还原剂( )(6)可用NO 2与水反应制取硝酸,故NO 2是酸性氧化物( ) 【参考答案】:(1)√ (2)√ (3)× (4)× (5)× (6)×【试题解析】:(5)3NO 2+H 2O===2HNO 3+NO,NO 2既是氧化剂,又是还原剂。
1.汽车尾气主要含有CO 2、CO 、SO 2、NO x 等物质,这种尾气逐渐成为城市空气污染的主要来源之一。
(1)汽车尾气中的CO 来自于________________,NO 来自于____________________________。
汽车尾气对环境的危害主要有____________________(至少填两种)。
(2)汽车尾气中的CO 、NO x 在适宜温度下采用催化转化法处理,使它们相互反应生成参与大气循环的无毒气体。
写出NO 被CO 还原的化学方程式:______________________________ ________________________________________________________________________。
【参考答案】:(1)汽油的不完全燃烧 N 2与O 2在汽车汽缸内的高温环境下的反应 形成硝酸型酸雨、导致光化学烟雾、产生温室效应(任填两种即可) (2)2CO +2NO=====催化剂N 2+2CO 2【试题解析】:(1)汽车汽缸内不断进行着汽油的燃烧反应,当空气不足时,汽油燃烧不完全,会产生CO ;当空气过量时,N 2和O 2在放电或高温条件下反应生成NO 。
汽车尾气对环境的危害很大,可以形成硝酸型酸雨,导致光化学烟雾,产生温室效应。
(2)CO 、NO x 反应后生成的无毒气体为CO 2和N 2。
2.氮氧化合物(用NO x 表示)是大气污染的重要因素,根据NO x 的性质特点,开发出多种化学治理氮氧化合物污染的方法。
(1)用氨可将氮氧化物转化为无毒气体。
如,4NH 3+6NO=====催化剂△5N 2+6H 2O, 写出氨气转化NO 2的化学方程式____________________________________________________________________________________________________________________, 氧化产物与还原产物的质量之比为________。
(2)工业尾气中氮的氧化物常采用碱液吸收法处理。
①NO 2被烧碱溶液吸收时,生成两种钠盐,其物质的量之比为1∶1,写出该反应的化学方程式:________________________________________________________________________ ________________________________________________________________________。
②NO 与NO 2按物质的量之比1∶1被足量NaOH 溶液完全吸收后只得到一种钠盐,该钠盐的化学式是__________。
【参考答案】:(1)8NH 3+6NO 2=====催化剂△7N 2+12H 2O 4∶3 (2)①2NO 2+2NaOH===NaNO 3+NaNO 2+H 2O ②NaNO 2【试题解析】:(2)①生成两种钠盐,必须是NO 2的歧化反应,依据量的关系可知两种盐分别为NaNO 3和NaNO 2。
②NO 中氮的化合价为+2价,NO 2中氮的化合价为+4价,二者1∶1混合时与NaOH 反应生成一种钠盐,依据电子守恒可知,钠盐中氮的化合价为+3,即为NaNO 2。
氮氧化物对环境的污染及防治(1)常见的污染类型①光化学烟雾:NO x 在紫外线作用下,与碳氢化合物发生一系列光化学反应,产生了一种有毒的烟雾。
②酸雨:NO x 排入大气中后,与水反应生成HNO 3和HNO 2,随雨雪降到地面。
③破坏臭氧层:NO 2可使平流层中的臭氧减少,导致地面紫外线辐射量增加。
④NO 与血红蛋白结合使人中毒。
(2)常见的NO x 尾气处理方法 ①碱液吸收法2NO 2+2NaOH===NaNO 3+NaNO 2+H 2O NO 2+NO +2NaOH===2NaNO 2+H 2ONO 2、NO 的混合气体能被足量烧碱溶液完全吸收的条件是n (NO 2)≥n (NO)。
一般适合工业尾气中NO x 的处理。
②催化转化法在催化剂、加热条件下,氨可将氮氧化物转化为无毒气体(N 2),或NO x 与CO 在一定温度下催化转化为无毒气体(N 2和CO 2)。
一般适用于汽车尾气的处理。
题组一氮气及氧化物的性质和应用1.下列有关氮气用途的说法不正确的是()A.作焊接金属的保护气B.制硝酸和化肥的原料C.食品袋中充氮气来防腐D.与氧气反应制NO从而制硝酸【参考答案】:D【试题解析】:氮气的化学性质不活泼,能防止金属在高温下被空气中的氧气氧化,A项正确;氮气可用于合成氨,氨可作制硝酸和化肥的原料,B项正确;食品袋中充氮气可减缓食品被氧化而变质的速率,C项正确;氮气与氧气的反应很难进行,不宜用氮气与氧气反应制NO从而制备硝酸,D项错误。
2.Murad等三位教授提出NO在人体内有独特的功能,关于NO的叙述正确的是()①NO可以是某些含低价氮物质氧化的产物②NO是亚硝酸的酸酐③NO可以是某些含高价氮物质还原的产物④NO是无色气体,在空气中可变为红棕色A.全部B.①③④C.②③④D.①④【参考答案】:B【试题解析】:NO中氮元素的化合价处于中间价态,它可以是还原产物,如HNO3→NO,也可以是氧化产物,如NH3→NO;HNO2的酸酐是N2O3;NO是无色气体,可被空气中的氧气氧化为红棕色的NO2。
3.下图为装有活塞的密闭容器,内盛22.4 mL一氧化氮。
若通入11.2 mL氧气(气体体积均在标准状况下测定),保持温度、压强不变,则容器内物质的密度为()A.等于1.369 g·L-1B.等于2.054 g·L-1C.在1.369 g·L-1和2.054 g·L-1之间D.大于2.054 g·L-1【参考答案】:D【试题解析】:一氧化氮与氧气恰好发生反应生成了二氧化氮,2NO + O 2 === 2NO 2 2 1 2 22.4 mL 11.2 mL 22.4 mL反应后生成了22.4 mL 二氧化氮,假设二氧化氮体积不变,则容器中气体的密度为 ρ(NO 2)=46 g·mol -1×22.4×10-3 L22.4 L·mol -122.4×10-3L≈2.054 g·L -1,因存在转化平衡:2NO 2N 2O 4,则混合气体的体积小于22.4 mL,所以容器中气体ρ应大于2.054 g·L -1。
题组二 氮氧化物溶于水的定量判断4.(NO x 与H 2O 反应计算)如图所示,相同条件下,两个容积相同的试管分别装满NO 2和NO 气体,分别倒置于水槽中,然后通过导管缓慢通入氧气,边通边慢慢摇动试管,直到两个试管内充满液体。
假设试管内的溶质不向水槽中扩散,则两个试管内溶液物质的量浓度之比为( )A.1∶1B.5∶7C.7∶5D.4∶3 【参考答案】:A【试题解析】:NO 2、NO 装满试管,则体积相同,根据阿伏加德罗定律:n (NO 2)=n (NO),根据氮原子守恒所得硝酸的物质的量相同,溶液的体积相同,所以两个试管中溶液物质的量浓度之比为1∶1。
5.(2018·贵阳模拟)同温同压下,在3支相同体积的试管中分别充有等体积混合的2种气体,它们是①NO 和NO 2,②NO 2和O 2,③NH 3和N 2。
将3支试管均倒置于盛水的水槽中,充分反应后,试管中剩余气体的体积分别为V 1、V 2、V 3,则下列的关系正确的是( ) A.V 1>V 2>V 3 B.V 1>V 3>V 2 C.V 2>V 3>V 1 D.V 3>V 1>V 2【参考答案】:B【试题解析】:设各种气体的体积都为1体积。
①根据3NO 2+H 2O===2HNO 3+NO,即剩余NO 的体积V 1=(1+13)体积。
②根据4NO 2+O 2+2H 2O===4HNO 3,即剩余O 2的体积V 2=(1-14)体积。
③剩余N 2的体积V 3=1体积。
即B 项符合题意。
氮氧化物溶于水的问题分析无论是单一气体(NO 2),还是NO 、NO 2、O 2中的两者的混合气体,反应的实质是3NO 2+H 2O===2HNO 3+NO,2NO +O 2===2NO 2,故若有气体剩余只能是NO 或O 2,不可能是NO 2。
(1)若NO 和O 2通入水中,总关系式为4NO +3O 2+2H 2O===4HNO 3(4∶3)。
(2)若NO 2和O 2通入水中,总关系式为4NO 2+O 2+2H 2O===4HNO 3(4∶1)。
考点二 典型的氧化性酸——硝酸1.物理性质硝酸是无色易挥发的液体,有刺激性气味。
2.化学性质(1)不稳定性反应:4HNO 3(浓) =========△或光照2H 2O +4NO 2↑+O 2↑。
(2)强氧化性硝酸无论浓、稀都有强氧化性,而且浓度越大,氧化性越强。
按要求完成下列反应的方程式: ①与金属反应: 稀硝酸与铜反应:3Cu +8HNO 3(稀)===3Cu(NO 3)2+2NO ↑+4H 2O ; 浓硝酸与铜反应:Cu +4HNO 3(浓)===Cu(NO 3)2+2NO 2↑+2H 2O 。