高2020届高2017级步步高高中化学一轮复习全套课件学案第一章第4讲
- 格式:docx
- 大小:945.69 KB
- 文档页数:19



专题过关检测4第Ⅰ卷一、选择题(本题包括18小题,每小题3分,共54分。
在每小题给出的四个选项中,只有一项是符合题目要求的)1.下列过程中,没有发生化学变化的是()A.工业上用氮气和氢气合成氨B.蔗糖中加入浓硫酸,蔗糖变黑,体积膨胀C.雷雨天气氮气转化为氮的氧化物D.液氨常用作制冷剂答案 D解析A项,工业上用氮气和氢气合成氨产生了新物质,属于化学变化,错误;B项,蔗糖中加入浓硫酸,蔗糖变黑,体积膨胀,有新物质产生,例如碳、二氧化碳、二氧化硫等,属于化学变化,错误;C项,雷雨天气氮气转化为氮的氧化物产生了新物质,属于化学变化,错误;D项,液氨常用作制冷剂只是物质状态的变化,不是化学变化,属于物理变化,正确。
2.形成酸雨的过程如图所示。
下列说法正确的是()A.含NO x、SO2的烟气和酸雨的分散剂相同B.酸雨沉降到地面后酸性还会有所增强C.机动车尾气中的NO x来源于燃油中的含氮物质D.在已酸化的土壤中加消石灰可以减少酸雨的形成答案 B解析含NO x、SO2的烟气的分散剂是空气,酸雨的分散剂是水,两者不同,故A项错误;硫酸型酸雨的形成过程是SO2+H2O H2SO3,亚硫酸是弱酸,不稳定易被氧化成硫酸,所以沉降到地面后酸性还会有所增强,故B项正确;机动车尾气中的NO x来源于在电火花的条件下,空气中氮气和氧气反应生成的氮的氧化物,故C项错误;在已酸化的土壤中加消石灰可以中和土壤的酸性,不能减少酸雨的形成,故D项错误。
3.大气中氮氧化物和碳氢化合物受紫外线作用可产生二次污染物光化学烟雾,其中某些反应过程如图所示。
下列说法正确的是()A.丙烯发生氧化反应生成甲醛和乙醛B.生成O3的反应属于氧化还原反应C.反应Ⅰ属于复分解反应D.该过程中O2作催化剂答案 A解析A项,丙烯转化成甲醛和乙醛,是丙烯中的双键发生断裂,此反应属于氧化反应,正确;B 项,根据示意图,O2→O3,化合价没有发生变化,因此生成O3的反应不属于氧化还原反应,错误;C项,反应Ⅰ中NO转化成NO2,化合价升高,即反应Ⅰ为氧化还原反应,错误;D项,有O2参与反应,但后面没有O2的生成,因此O2不作催化剂,错误。

检查装置气密性的基本思路是使装置内外压强不等,观察气泡或液面变化。
(1)微热法: 如图a。
用酒精灯微热或用手捂热试管,导管口____________,停止加热或松开手后导管内________________,证明装置不漏气。
(2)液差法: 如图b、c。
连接好仪器,b中夹紧弹簧夹,从长颈漏斗中注入适量水,使b中长颈漏斗中的液面________锥形瓶中的液面,静置,若________________________,证明装置不漏气。
c中,从乙管加入适量水,使乙管液面________甲管液面,静置,若液面__________________,证明装置不漏气。
(3)滴液法: 如图d。
向分液漏斗中注入适量水,关闭弹簧夹,打开分液漏斗活塞,水在下端形成一段水柱,如果______________________,则证明装置气密性良好。
(4)抽气(吹气)法: 如图e、f。
e中关闭分液漏斗的活塞,轻轻向外拉动或向里推动注射器的活塞,一段时间后,活塞________________,证明装置的气密性良好。
f中打开弹簧夹,向导管口吹气,如果长颈漏斗中的液面__________,且停止吹气后,夹上弹簧夹,长颈漏斗液面____________,则证明装置的气密性良好。
(液差法的拓展)答案(1)产生气泡形成一段水柱(2)高于液面位置保持不变高于位置保持不变(3)一段时间后,水柱的水位不会下降(4)能回到原来的位置上升保持稳定1.下列是一些装置气密性检查的方法,其中正确的是()答案 B解析A、C、D中都未形成封闭体系。
2.(2018·成都高三模拟)下列装置中,不添加其他仪器无法检查气密性的是()答案 A解析B项利用液差法: 夹紧弹簧夹,从长颈漏斗中向试管内加水,长颈漏斗中会形成一段液柱,停止加水后,通过液柱是否变化即可检查;C项利用加热(手捂)法: 用酒精灯微热(或用手捂热)试管,通过观察烧杯中有无气泡以及导管中水柱是否变化即可检查;D项利用抽气法: 向外轻轻拉动注射器的活塞,通过观察浸没在水中的玻璃导管口是否有气泡冒出即可检查。
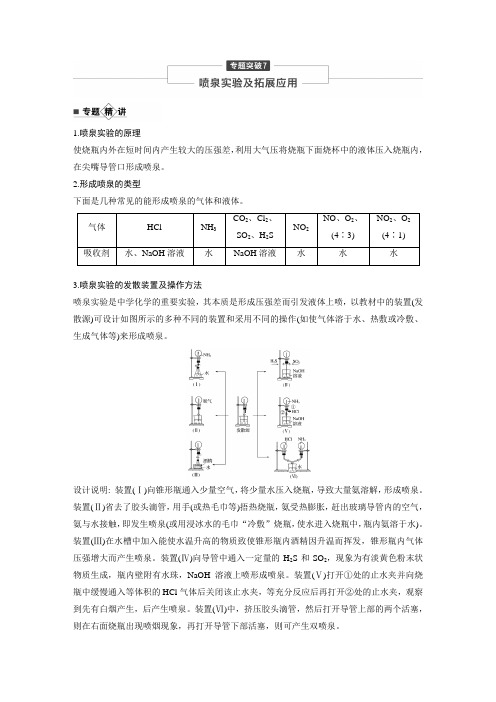
1.喷泉实验的原理使烧瓶内外在短时间内产生较大的压强差,利用大气压将烧瓶下面烧杯中的液体压入烧瓶内,在尖嘴导管口形成喷泉。
2.形成喷泉的类型下面是几种常见的能形成喷泉的气体和液体。
气体HCl NH3CO2、Cl2、SO2、H2SNO2NO、O2、(4∶3)NO2、O2(4∶1) 吸收剂水、NaOH溶液水NaOH溶液水水水3.喷泉实验的发散装置及操作方法喷泉实验是中学化学的重要实验,其本质是形成压强差而引发液体上喷,以教材中的装置(发散源)可设计如图所示的多种不同的装置和采用不同的操作(如使气体溶于水、热敷或冷敷、生成气体等)来形成喷泉。
设计说明: 装置(Ⅰ)向锥形瓶通入少量空气,将少量水压入烧瓶,导致大量氨溶解,形成喷泉。
装置(Ⅱ)省去了胶头滴管,用手(或热毛巾等)捂热烧瓶,氨受热膨胀,赶出玻璃导管内的空气,氨与水接触,即发生喷泉(或用浸冰水的毛巾“冷敷”烧瓶,使水进入烧瓶中,瓶内氨溶于水)。
装置(Ⅲ)在水槽中加入能使水温升高的物质致使锥形瓶内酒精因升温而挥发,锥形瓶内气体压强增大而产生喷泉。
装置(Ⅳ)向导管中通入一定量的H2S和SO2,现象为有淡黄色粉末状物质生成,瓶内壁附有水珠,NaOH溶液上喷形成喷泉。
装置(Ⅴ)打开①处的止水夹并向烧瓶中缓慢通入等体积的HCl气体后关闭该止水夹,等充分反应后再打开②处的止水夹,观察到先有白烟产生,后产生喷泉。
装置(Ⅵ)中,挤压胶头滴管,然后打开导管上部的两个活塞,则在右面烧瓶出现喷烟现象,再打开导管下部活塞,则可产生双喷泉。
4.喷泉实验产物的浓度计算关键是确定所得溶液中溶质的物质的量和溶液的体积,标准状况下的气体进行喷泉实验后所得溶液的物质的量浓度:(1)HCl、NH3、NO2气体或它们与其他不溶于水的气体混合时: 所得溶液的物质的量浓度为122.4mol·L-1。
(2)当是NO2和O2的混合气体且体积比为4∶1时,c(HNO3)=128mol·L-1。

第一单元认识有机化合物[考试标准] 1.有机化学的发展与应用:①有机化学的发展简史(a)。
②有机化合物在日常生活中的重要应用(a)。
③有机化合物与人类的生命活动的关系(a)。
④常见有机材料的组成、性能及其发展现状(a)。
2.科学家怎样研究有机物:①有机化合物的组成、结构和性质特点(a)。
②研究有机化合物组成的常用方法(a)。
③根据1H核磁共振谱确定有机化合物的分子结构(b)。
④研究有机化合物结构的常用方法(b)。
⑤同位素示踪法研究化学反应历程(b)。
⑥手性碳原子与手性分子(a)。
⑦根据化学式进行式量、元素的质量分数的计算(b)。
⑧由元素质量分数或组成元素的质量比、式量推断有机物分子式(c)。
3.有机化合物的结构:①有机物中碳原子的成键特点(a)。
②甲烷、乙烯和乙炔的组成、结构和空间构型(b)。
③结构式、结构简式和键线式(b)。
④同分异构体(碳架异构、官能团类别异构和官能团位置异构)(c)。
⑤立体异构与生命现象的联系(a)。
4.有机化合物的分类和命名:①同系物及其通式(b)。
②有机化合物的分类方法(b)。
③烷烃的系统命名法和常见有机物的习惯命名(b)。
考点一有机物的官能团、分类、命名和手性碳原子1.有机化合物概述(1)概念:含有碳元素的化合物称为有机化合物,简称有机物。
但CO、CO2、碳酸及其盐、金属碳化物、金属氰化物等由于组成、性质与无机物相似,属于无机物。
绝大多数有机化合物都含有氢元素。
C、H、O、N、S、P、卤素是有机物中的主要组成元素。
(2)性质特点(大多数有机物)难溶于水,易溶于汽油、酒精、苯等有机溶剂;多数为非电解质,不导电;多数熔、沸点较低;多数易燃、易分解,反应复杂等。
2.碳原子的成键特点(1)碳原子的结构及成键特点碳原子最外层有4个电子,不易失去或获得电子而形成阳离子或阴离子,碳原子易通过共价键与碳原子或其他非金属原子相结合。
(2)有机化合物中碳原子的结合方式 ①碳原子间可形成稳定的单键、双键或叁键。
第4讲 一定物质的量浓度的溶液及其配制考纲要求 1.了解溶液的含义。
2.了解溶解度、饱和溶液的概念。
3.了解溶液浓度的表示方法。
理解溶液中溶质的质量分数和物质的量浓度的概念,并能进行有关计算。
4.掌握配制一定溶质质量分数溶液和物质的量浓度溶液的方法。
考点一 物质的量浓度及相关计算1.物质的量浓度(1)概念:表示单位体积溶液里所含溶质B 的物质的量。
(2)表达式:c B =n BV。
(3)单位:mol·L -1(或 mol/L)。
2.溶质的质量分数――→概念⎪⎪⎪以溶液里溶质质量与溶液质量的比值表示溶液组成的物理量,一般用百分数表示――→表达式w (B)=m (B )m (aq )×100%(1)1 mol·L -1 NaCl 溶液是指此溶液中含有1 mol NaCl( )(2)用100 mL 水吸收0.1 mol HCl 气体所得溶液的物质的量浓度恰好是1 mol·L -1( )(3)1 L 水中溶解5.85 g NaCl 所形成的溶液的物质的量浓度是0.1 mol·L -1( )(4)将25 g CuSO 4·5H 2O 晶体溶于75 g 水中所得溶质的质量分数为25%( ) (5)将40 g SO 3溶于60 g 水中所得溶质的质量分数为49%( )(6)同浓度的三种溶液:Na 2SO 4、MgSO 4、Al 2(SO 4)3,其体积比为3∶2∶1,则SO 2-4浓度之比为3∶2∶3( ) (7)0.5 mol·L-1的稀H 2SO 4溶液中c (H +)为1.0 mol·L -1( )【参考答案】:(1)× (2)× (3)× (4)× (5)√ (6)× (7)√1.在标准状况下,将V L 氨气溶于0.1 L 水中,所得溶液的密度为ρ g·cm -3,则此氨水的物质的量浓度为____________ mol·L -1。
【参考答案】: 1 000Vρ17V +2 240【试题解析】:n (NH 3)=V22.4 mol,溶液体积:V =V22.4×17+100ρ×10-3 Lc =V 22.4V22.4×17+100ρ×10-3mol·L -1=1 000Vρ17V +2 240mol·L -1。
2.将32.2 g Na 2SO 4·10H 2O 溶于水配成1 L 溶液。
(1)该溶液中Na 2SO 4的物质的量浓度为____________,溶液中Na +的物质的量浓度为____________。
(2)向该溶液中加入一定量NaCl 固体,使溶液中Na +的物质的量浓度为0.4 mol·L -1(假设溶液体积不变)需加入NaCl 的质量为__________,Cl -的物质的量浓度为____________。
【参考答案】:(1)0.1 mol·L -1 0.2 mol·L -1 (2)11.7 g 0.2 mol·L -1【试题解析】:(1)n (Na 2SO 4)=n (Na 2SO 4·10H 2O)=32.2 g 322 g·mol -1=0.1 mol,c (Na 2SO 4)=0.1 mol·L -1,c (Na +)=0.2 mol·L -1。
(2)n (Na +)=0.4 mol·L -1×1 L =0.4 mol,则加入n (NaCl)=0.4 mol -0.2 mol =0.2 mol, m (NaCl)=0.2 mol ×58.5 g·mol -1=11.7 g,c (Cl -)=0.2 mol 1 L=0.2 mol·L -1。
1.正确判断溶液的溶质并计算其物质的量(1)与水发生反应生成新的物质,如Na 、Na 2O 、Na 2O 2――→水NaOH ;SO 3――→水H 2SO 4;NO 2――→水HNO 3。
(2)特殊物质:如NH 3溶于水后溶质为NH 3·H 2O,但计算浓度时仍以NH 3作为溶质。
(3)含结晶水的物质:CuSO 4·5H 2O ―→CuSO 4;Na 2CO 3·10H 2O ―→Na 2CO 3。
2.准确计算溶液的体积不能用水的体积代替溶液的体积,尤其是固体、气体溶于水,一般根据溶液的密度进行计算:V =m (气体或固体)+m (溶剂)ρ×10-3 L 。
3.注意溶质的浓度与溶液中某离子浓度的关系溶质的浓度和离子浓度可能不同,要注意根据化学式具体分析。
如1 mol·L -1 Al 2(SO 4)3溶液中c (SO 2-4)=3 mol·L -1,c (Al 3+)=2 mol·L -1(考虑Al 3+水解时,则其浓度小于2 mol·L -1)。
题组一 有关物质的量浓度、溶质质量分数、溶解度的换算1.[2016·全国卷Ⅱ,36(5)节选]一种双氧水的质量分数为27.5%(密度为1.10 g·cm -3),其浓度为________mol·L -1。
【参考答案】:8.9【试题解析】:假设溶液的体积为1 L,则1 L 溶液中含H 2O 2的质量: m =1 000 mL ×1.10 g·cm -3×27.5%=1.10×275 gc (H 2O 2)=n V =1.10×275 g34 g·mol -11 L≈8.9 mol·L -1。
2.某氯化镁溶液的密度为1.18 g·cm -3,其中镁离子的质量分数为5.1%,300 mL 该溶液中Cl -的物质的量浓度为____________。
【参考答案】:5 mol·L -1【试题解析】:300 mL 溶液中n (Mg 2+)=300 mL ×1.18 g·cm -3×5.1%24 g·mol -1≈0.75 mol, 依据MgCl 2的化学式可知n (Cl -)=0.75 mol ×2=1.5 mol, c (Cl -)=1.5 mol 0.3 L=5 mol·L -1。
3.已知某饱和NaCl 溶液的体积为V mL,密度为ρ g·cm -3,质量分数为w ,物质的量浓度为cmol·L -1,溶液中含NaCl 的质量为m g 。
(1)用m 、V 表示溶液的物质的量浓度:________________________________________________________________________。
(2)用w 、ρ表示溶液的物质的量浓度:________________________________________________________________________。
(3)用c 、ρ表示溶质的质量分数:________________________________________________________________________。
(4)用w 表示该温度下NaCl 的溶解度:________________________________________________________________________。
【参考答案】:(1)1 000m 58.5V mol·L -1 (2)1 000ρw 58.5 mol·L -1 (3)58.5c 1 000ρ×100% (4)100w 1-wg【试题解析】:(1)c =m 58.5V 1 000 mol·L -1=1 000m 58.5V mol·L -1(2)c =1 000 mL·ρ g·mL -1·w 58.5 g·mol -1×1 L=1 000ρw 58.5 mol·L -1。
(3)w =58.5 g·mol -1·c mol·L -11 000 mL·L -1·ρ g·mL-1×100%=58.5c1 000ρ×100%。
(4)S 100=w 1-w ,S =100w 1-wg 。
从定义式出发进行物质的量浓度、质量分数、溶解度的换算(1)由定义式出发,运用守恒(溶质守恒、溶剂守恒等)及公式c =nV 、质量分数=溶质的质量溶液的质量×100%进行推理,注意密度的桥梁作用,不要死记公式。
(2)在进行物质的量浓度、质量分数、溶解度三者之间的转换时,除利用上述方法外,我们还可以运用假设法,使问题简单化。
例如:已知溶质的质量分数w ,溶液的密度为ρ g·cm -3,溶质的摩尔质量为M g·mol -1,求物质的量浓度c 。
我们可以假设溶液为1 L,所以溶液质量为1×1 000×ρ g,溶质的质量为1×1 000×ρ×w g,溶质的物质的量为1 000ρw M mol,这样我们就很容易求出该溶液的物质的量浓度c =1 000ρw M mol·L -1。
题组二 溶液的稀释与混合4.V mL Al 2(SO 4)3溶液中含有Al 3+m g,取V 4 mL 该溶液用水稀释至4V mL,则SO 2-4物质的量浓度为( )A.125m 36V mol·L -1B.125m 9V mol·L -1 C.125m 54V mol·L -1 D.125m 18Vmol·L -1 【参考答案】:A【试题解析】:V 4 mL 溶液中Al 3+的物质的量为m g ×1427 g·mol -1=m 108 mol,稀释后溶液中Al 3+的物质的量浓度为c (Al 3+)=m108 mol 4V ×10-3 L =250m 108V mol·L -1,c (SO 2-4)=32c (Al 3+)=32×250m 108V mol·L -1=125m 36V mol·L -1。
5.现有V L 0.5 mol·L-1的盐酸,欲将其浓度扩大一倍,以下方法中最宜采用的是( )A.加热浓缩到原来体积的一半B.加入5 mol·L-1的盐酸0.125V LC.加入10 mol·L-1的盐酸0.1V L,再稀释至1.5V LD.标况下通入11.2 L 氯化氢气体 【参考答案】:C【试题解析】:加热蒸发,HCl 挥发,溶液浓度降低,故A 错误;溶液的体积不具有加和性,故B 错误;混合后溶液中的HCl 的物质的量为 0.5 mol·L -1×V L +10 mol·L -1×0.1V L =1.5V mol,所以混合后HCl 的浓度为1.5V mol 1.5V L =1 mol·L -1,故C 正确;通入氯化氢气体,溶液的体积发生变化,无法求出浓度,故D 错误。