物质的溶解性(1)
- 格式:ppt
- 大小:301.00 KB
- 文档页数:16





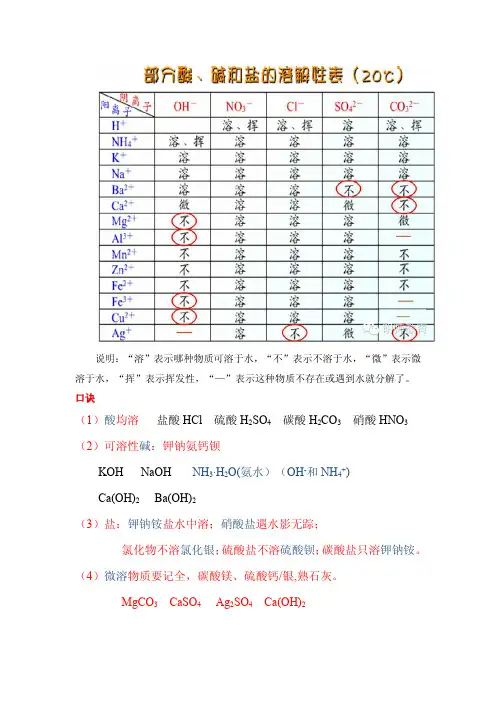
说明:“溶”表示哪种物质可溶于水,“不”表示不溶于水,“微”表示微溶于水,“挥”表示挥发性,“—”表示这种物质不存在或遇到水就分解了。
口诀
(1)酸均溶盐酸HCl硫酸H2SO4碳酸H2CO3硝酸HNO3(2)可溶性碱:钾钠氨钙钡
KOH NaOH NH3·H2O(氨水)(OH-和NH4+)
Ca(OH)2Ba(OH)2
(3)盐:钾钠铵盐水中溶;硝酸盐遇水影无踪;
氯化物不溶氯化银;硫酸盐不溶硫酸钡;碳酸盐只溶钾钠铵。
(4)微溶物质要记全,碳酸镁、硫酸钙/银,熟石灰。
MgCO3CaSO4Ag2SO4Ca(OH)2
五大阴离子四大酸根离子
物质名称化学式
物质分类
(酸碱盐)
溶解性
(溶不微)
例:氯化钠NaCl盐溶1硫酸
2氯化银
3碳酸钠
4氢氧化镁
5氯化铜
6硫酸钡
7硝酸银
8氢氧化铁
9氨水
10硫酸锌
11碳酸镁
12硝酸铜
13氯化亚铁
14碳酸铵
15硝酸铵
16硝酸铝
17氢氧化钡
18硫酸钠
19硝酸钡
20硝酸
21硫酸铁
22碳酸钙
23氢氧化钙
24氢氧化锌
25氯化铵
26碳酸钡
27硫酸钙
28高锰酸钾
29硝酸亚铁
30碳酸
31硫酸铜
32氢氧化铝
33氯化铝。


20192020浙教版八年级上科学同步提高必刷题训练1.5.1物质的溶解性和饱和溶液◆要点1 物质的溶解性(1)溶解性①定义:一种物质溶解在另一种物质里的能力。
②影响因素:一定温度下,物质的溶解性与溶质和溶剂的性质有关。
③物质溶解性的比较:要比较不同物质的溶解性,必须在一定温度下、一定量的溶剂及该溶质不能再继续溶解的条件下进行比较。
(2)溶解过程的吸、放热:物质在溶解时,有些会放出热量,有些会吸收热量,还有些溶解时温度没有明显变化。
①溶解时吸热的物质:硝酸铵(NH4NO3)等;②溶解时放热的物质:氢氧化钠(NaOH)、浓硫酸(浓H2SO4)等;③溶解时既不吸热也不放热的物质:氯化钠(NaCl)、蔗糖等。
◆要点2 饱和溶液和不饱和溶液的概念(1)饱和溶液:在一定温度下,在一定量的溶剂里不能继续溶解某种溶质的溶液,称为这种溶质的饱和溶液。
(2)不饱和溶液:在一定温度下,在一定量的溶剂里还能继续溶解某种溶质的溶液,称为这种溶质的不饱和溶液。
◆要点3 饱和溶液和不饱和溶液之间的转换对于大多数饱和溶液和不饱和溶液之间可以相互转换饱和溶液增加溶剂或升高温度降低温度、蒸发溶剂、增加溶质饱和溶液大多数固体物质在一定量水中溶解的最大量随温度的升高而增大,但也有例外,如氯化钠的溶解度随温度的升高无明显变化,熟石灰的溶解度随温度的升高而降低。
◆要点4 浓溶液和稀溶液一定量溶剂里,溶有较多溶质的溶液称为浓溶液;溶有较少溶质的溶液称为稀溶液。
说明:(1)浓溶液不一定是饱和溶液,稀溶液不一定是不饱和溶液。
(2)对于同一种溶质和溶剂形成的溶液来说,在一定温度下的饱和溶液一定比不饱和溶液浓一些。
Δ基础题系列◆1.(2015浙江义乌、绍兴中考)在装有水的四个烧杯中,分别加入少量牛奶、食盐、菜油和面粉,充分搅拌后可形成溶液的是()A.牛奶B.食盐C.菜油D.面粉【答案】B【解析】食盐能够溶解于水中形成溶液,牛奶、菜油与水混合形成乳浊液,面粉与水混合形成悬浊液。


1.5物质的溶解知识整理知识点1物质的溶解性1.溶解性的概念溶解性是指一种物质(溶质)溶解在另一种物质(溶剂)中的能力。
一般情况下,在一定温度下,在一定量的溶剂里溶质溶解的能力是。
大多数固体物质,随着温度的升高,溶解能力逐渐增强;常见的固体物质中,氢氧化钙随着温度的升高,溶解能力。
2.影响固体物质溶解性的因素影响固体物质溶解性的因素有:的性质、的性质和温度等。
(1)不同的物质在同一溶剂中的溶解性不同(物质的溶解性与溶质本身的性质有关)。
(2)同一种物质在不同的溶剂中的溶解性不同(物质的溶解性与溶剂的性质有关)。
(3)同一种物质在同一溶剂中的溶解性与有关。
3.物质溶解时的吸热放热现象有的物质溶解时,会放出热量,使溶液温度升高,如氢氧化钠、浓硫酸等;有的物质溶解时,会吸收热量,使溶液温度降低,如硝酸铵等;也有许多物质溶解时,溶液的温度没有明显变化,如氯化钠等。
知识点2饱和溶液和不饱和溶液1.概念在一定温度下,在一定量的里,不能继续溶解某种溶质的溶液,称为这种溶质的溶液。
还能继续溶解某种溶质的溶液,称为这种溶质的溶液。
说明①必须要指明“一定温度”“一定量的溶剂”,因为溶液是否饱和不仅与温度有关,也与溶剂的量有关。
②必须指明是何种溶质的饱和溶液或不饱和溶液。
例如在一定条件下,某溶液不能再继续溶解硝酸钾但可继续溶解氯化钠,此时的溶液对硝酸钾来说是饱和溶液,但对氯化钠来说就是不饱和溶液。
2.饱和溶液和不饱和溶液的判断在不改变温度等其他条件的情况下,往溶液中继续加入该溶质,看能否继续溶解。
如果能,则原溶液是该溶质的不饱和溶液;如果不能继续溶解,则原溶液是该溶质的饱和溶液。
说明 一定温度下,大多数物质在一定量的溶剂中都能形成其饱和溶液,而酒精能与水以任意比例混溶,所以不存在酒精饱和溶液。
3.饱和溶液和不饱和溶液的相互转化(1)一般情况下,对于大多数固体物质来说有以下转化关系: 饱和溶液 或增加溶质、蒸发溶剂或降低温度 不饱和溶液(2)特殊情况,对于少部分物质(如氢氧化钙)来说,有以下转化关系: 饱和溶液增加溶剂或降低温度增加溶质、 或 不饱和溶液 4.浓溶液和稀溶液(1)为了粗略地表示溶液中溶质含量的多少,常把溶液分为浓溶液和稀溶液。

常见物质溶解性(一)钾盐铵盐都易溶,硝酸盐遇水影无踪。
硫酸盐不溶钡和铅,氯化物不溶银、亚汞。
其它盐类溶三种,①沉淀溶于强酸中。
钾钠钡钙碱可溶,②其它也溶强酸中。
注:①除硝酸盐、硫酸盐、氯化物以外的盐类只有钾、钠、铵盐可溶。
②氢氧化钙Ca(OH)2是微溶。
常见物质溶解性(二)钾钠铵盐水易溶,硝酸盐类性相同;“硫”盐不溶钡与铅,①“氯”盐不溶银亚汞;②弱碱和那弱酸盐,水中大部分不能溶。
注:①“硫”盐,指硫酸盐。
②“氯”盐,指盐酸盐。
盐类物质的溶解性一切钠、钾盐全部溶,铵盐、硝酸盐也相同。
硫酸钡、铅要除外,氯化亚汞、银不溶,亚硫酸盐、磷酸盐,钠、钾、铵溶余不溶,碳酸盐和硅酸盐,全跟上面相雷同。
硫化钾、钡、钠、镁溶,硫化钙微溶余不溶。
盐类溶解性歌硝酸钾钠溶,碳硅和亚硫,盐酸除银汞,钠后都不溶。
①硫酸去钡铅,微溶氯化铅,磷盐多不溶。
硫酸钙银汞。
注:①溶解性表中钠以后的金属盐都不溶于水。
酸碱盐溶解性钾钠铵盐硝酸盐,都能溶于水中间,盐酸除了银和汞,硫酸难溶是钡铅。
碳酸磷酸不多溶,溶者只有钾钠铵,碱有钾钠铵和钡,硫化物中加镁盐。
余者皆是难溶物,微溶几个记心间:碱中只有钙一个,亚汞、钙银是硫酸盐,氯化物中仅有铅,附着镁是亚硫酸;硫化物里有个钙,有心记住并不难。
主要碱、盐溶解性口诀钾、钠、铵、硝、溶(钾盐、钠盐、铵盐、硝酸盐全溶)盐酸除银、汞(Hg+),(盐酸盐中Ag Cl和Hg2Cl2不溶)硫酸不溶有钡、铅,(硫酸盐中Ba SO4和P bSO4不溶)溶碱只有钾、钠、钡、钙、铵。
[Ca(OH)2微溶](碳酸、磷酸盐、只溶钾、钠、铵)。
第5节 物质的溶解1 溶解性与饱和溶液课程标准课标解读 1.了解不同的物质具有不同的溶解性。
2. 知道物质溶解时既可能放出热量,也可能吸收热量。
3. 理解饱和溶液的含义;掌握饱和溶液与不饱和溶液的转化关系。
解读1:区别饱和溶液与不饱和溶液;列出影响物质溶解度的一些因素,了解温度对物质的溶解度的影响直是中考的重点,难度较小,常见题型有选择题、填空题等。
知识点01 物质的溶解性溶液是由溶质和溶剂组成的,不同的溶质在同一种溶剂里的溶解性不同,同一种溶质在不同种溶剂里的溶解性也不同。
(一)溶解性(1)定义:一种物质溶解在另一种物质里的能力。
(2)影响因素:对于固体物质,溶解性与溶质和溶剂的性质及温度有关。
对于气体,溶解性还受压强影响。
(3)举例:食盐易溶于水而不溶于汽油;相同质量的水中,蔗糖在热水中的溶解能力比在冷水中强得多;在相同的条件下,不同的物质在同种溶剂中的溶解能力是不一样的。
如食盐的溶解能力比氢氧化钙强得多。
(二)物质溶解时的吸热和放热现象物质溶解时,是从外界吸收热量,还是向外界释放热量呢?实验表明:有的物质溶解时,会放出热量,使溶液温度升高,如氢氧化钠、浓硫酸等有的物质溶解时,会吸收热量,使溶液温度降低,如硝酸铵;也有许多物质溶解时,溶液的温度没有明显变化,如氯化钠等。
目标导航知识精讲【能力拓展】固体物质溶解性与温度有关,与溶质和溶剂的种类也有关,搅拌能加快溶解但不能改变溶解度气体溶解性与温度和压强有关,与溶质和溶剂的种类也有关【即学即练1】如图向小试管中分别加入一定量下列各物质,能使U形管中左端液面升高该物质是( )A.食盐B.蔗糖C.硝酸铵D.氢氧化钠【答案】C【解析】向小试管中分别加入一定量物质,要使U形管中左端的液面升高,则需集气瓶内压强减小,食盐、蔗糖溶解温度没有明显变化, U形管液面无变化,氢氧化钠溶解放热,会使压强增大,U形管液面左低右高,硝酸铵溶解吸热,可使集气瓶内压强减小,U形管左侧面液体升高;【即学即练2】探究影响气体溶解能力大小的因素。
1.5物质的溶解一, 物质的溶解性1, 概念: 通常把一种物质溶解在另一种物质里的能力叫做2,影响物质溶解性的因素:溶解性的大小与_______、_________的性质(内因)有关,也与_______、________(外因)有关。
如:食盐易溶于水,却不易溶于油脂,这说明物质的溶解性和有关。
高锰酸钾易溶于水,碘却不易溶于水,这说明物质的溶解性和有关。
气体溶质的溶解性与压强、温度有关,而固体、液体溶质的溶解性一般只与温度有关,不考虑压强。
教材第25页蔗糖溶解实验的活动通过实验得到的结论:说明在一定条件下,。
这里的一定条件是指_____________________________________________。
3 物质溶解时吸热、放热的情况某些物质溶于水时会放热,如__________溶于水放出热量,表现为溶液温度升高。
某些物质溶于水时会吸热,如___________溶于水吸收热量,表现为溶液温度降低。
也有一些物质溶于水时温度无明显变化,如___________溶于水时温度无明显变化。
当堂练习:1.下列说法正确的是( )A.在一定温度下,一定量的水中可以无限制溶解食盐B.温度越高,物质的溶解能力越强C.所有物质都能溶于水D.气体的溶解性受温度影响2.下列有关物质的溶解性的说法,错误的是( )A.在一定条件下,物质能够溶解的数量是有限的B.相同条件下,不同物质的溶解能力是不同的C.气体也能溶解在液体中,且温度越高,气体溶解能力越强D.物质溶解时,有的放热,有的吸热3.植物油不能溶解在水中,却可以溶解在香蕉水中,由此说明( )A.香蕉水的溶解能力比水强B.水的溶解能力比香蕉水差C.一切物质都能溶解在香蕉水中D.同一种物质在不同溶剂中溶解能力不同4.用凉开水养金鱼,金鱼就会死亡,其中的主要原因是( )A.凉开水温度太低B.凉开水中溶解的氧气太少C.凉开水中没有养料D.凉开水中存在细菌5.在20摄氏度时往盛有20毫升水的烧杯中,加入两药匙蔗糖后搅拌,蔗糖很快溶解完,再加入一药匙蔗糖,充分搅拌后仍有部分蔗糖不能溶解,关于上述现象,说法正确的是( )A.降低水的温度可以使蔗糖完全溶解B.加入的蔗糖越多,能够溶解的数量就越多C.在一定条件下,物质能够溶解的数量是有限的D.在20摄氏度时,20毫升水中不能溶解两药匙的蔗糖6.如图所示,向小试管中分别加入下列一定量的物质,右侧U形管中的液面左端升高,该物质是( )A.食盐 B.硝酸铵 C.蔗糖 D.氢氧化钠7.在煮汤时放一些香油和味精,使汤更加鲜美,搅拌后发现,香油总是漂浮在汤的表面,而味精却看不见了,这说明。