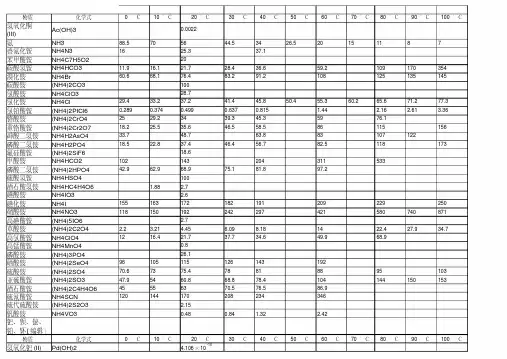
初中化学中常见物质的溶解性情况
- 格式:doc
- 大小:29.50 KB
- 文档页数:2

常见沉淀白色:BaSO4/BaCO3/CaCO3/AgCl/Ag2CO3/Mg(OH)2/Fe(OH)2/Al(OH)3/CuCO3/ZnCO3/MnCO3/Zn(OH)2 Fe(OH)2蓝色:Cu(OH)2浅黄色:AgBr红褐色:Fe(OH)3沉淀鉴别Cu(OH)2蓝色沉淀Fe(OH)3红褐色沉淀AgBr淡黄色沉淀AgI ,Ag3PO4黄色沉淀CuO 黑色沉淀Cu2O 红色沉淀Fe2O3 红棕色沉淀FeO 黑色沉淀FeS2 黄色沉淀PbS 黑色沉淀FeCO3 灰色沉淀Ag2CO3 黄色沉淀AgBr 浅黄色沉淀AgCl 白色沉淀Cu2(OH)2CO3 暗绿色沉淀BaCO3白色沉淀(且有CO2生成)CaCO3白色沉淀(且有CO2生成)BaSO4白色沉淀不溶的碳酸盐白色沉淀(且有CO2生成)不溶的碱、金属氧化物白色沉淀(且有CO2生成)Fe(OH)2为白色絮状沉淀(在空气中很快变成灰绿色,再变成Fe(OH)3红褐色沉淀)相关口诀钾钠铵盐硝酸盐均可溶盐酸盐银不溶硫酸盐钡不溶白色沉淀: CaCO3. BaCO3 . BaSO4. AgCL. Mg(OH)2蓝色沉淀: Cu(OH)2红褐色沉淀: Fe(OH)3不建议死记硬背,只需记住每个阴离子里哪个不溶即可,钾钠铵硝都溶溶解性口诀一钾钠铵盐溶水快,①硫酸盐除去钡银铅钙。
②氯化物不溶氯化银,硝酸盐溶液都透明。
③氢氧根多溶一个钡④口诀中未有皆下沉。
⑤注:①钾钠铵盐都溶于水;②硫酸盐中只有硫酸钡、硫酸铅不溶(硫酸钙硫酸银微溶也是沉淀);③硝酸盐都溶于水;④碱性物质中除了钾离子钠离子铵离子锂离子还有钡离子也可溶⑤口诀中没有涉及的盐类都不溶于水;溶解性口诀二钾、钠、铵盐、硝酸盐;氯化物除银、亚汞;硫酸盐除钡和铅;碳酸、磷酸盐,只溶钾、钠、铵。
说明,以上四句歌谣概括了8类相加在水中溶解与不溶的情况。
溶解性口诀三钾钠铵硝皆可溶、盐酸盐不溶银亚汞;硫酸盐不溶钡和铅、碳磷酸盐多不溶。


初中化学溶解度知识要点归纳学校化学溶解度学问溶解度1、固体的溶解度溶解度定义:在肯定温度下,某固态物质在100g溶剂里到达饱和状态时所溶解的质量四要素:①条件:肯定温度②标准:100g溶剂③状态:到达饱和④质量:单位:克溶解度的含义:20℃时NaCl的溶液度为36g含义:在20℃时,在100克水中最多能溶解36克NaCl或在20℃时,NaCl在100克水中到达饱和状态时所溶解的质量为36克2、影响固体溶解度的因素①溶质、溶剂的性质(种类)②温度大多数固体物的溶解度随温度上升而上升;如KNO3少数固体物质的溶解度受温度的影响很小;如NaCl极少数物质溶解度随温度上升而降低。
如Ca(OH)23、溶解度曲线t3℃时A的溶解度为80gP点的的含义在该温度时,A和C的溶解度相同N点为t3℃时A的不饱和溶液,可通过加入A物质,降温,蒸发溶剂的方法使它变为饱和t1℃时A、B、C、溶解度由大到小的挨次CBA从A溶液中猎取A晶体可用降温结晶的方法猎取晶体。
从A溶解度是80g。
t2℃时A、B、C的饱和溶液各W克,降温到t1℃会析出晶体的有A和B无晶体析出的有C,所得溶液中溶质的质量分数由小到大依次为A除去A中的泥沙用过滤法;分别A与B(含量少)的混合物,用结晶法4、气体的溶解度气体溶解度的定义:在压强为101kPa和肯定温度时,气体溶解在1体积水里到达饱和状态时的气体体积。
影响因素:①气体的性质②温度(温度越高,气体溶解度越小)③压强(压强越大,气体溶解度越大)5、混合物的分别过滤法:分别可溶物+难溶物结晶法:分别几种可溶性物质结晶的两种方法:①蒸发溶剂,如NaCl(海水晒盐)②降低温度(冷却热的饱和溶液,如KNO3)初三化学基础学问氧气一、氧气的性质【物理性质】密度略大于空气的密度。
不易溶于水。
气态的氧是无色无味的,液态氧和固态氧是淡蓝色的。
【化学性质】氧气化学性质比较活泼。
氧气具有助燃性和氧化性。
注:氧气具有助燃性,没有可燃性,不能作燃料。

化学常见常见沉淀及溶解性口诀编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(化学常见常见沉淀及溶解性口诀)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为化学常见常见沉淀及溶解性口诀的全部内容。
常见沉淀白色:BaSO4/BaCO3/CaCO3/AgCl/Ag2CO3/Mg(OH)2/Fe(OH)2/Al(OH)3/CuCO3/ZnCO3/MnCO3/Zn(OH)2Fe(OH)2蓝色:Cu(OH)2浅黄色:AgBr红褐色:Fe(OH)3沉淀鉴别Cu(OH)2蓝色沉淀Fe(OH)3红褐色沉淀AgBr淡黄色沉淀AgI ,Ag3PO4黄色沉淀CuO 黑色沉淀Cu2O 红色沉淀Fe2O3 红棕色沉淀FeO 黑色沉淀FeS2 黄色沉淀PbS 黑色沉淀FeCO3 灰色沉淀Ag2CO3 黄色沉淀AgBr 浅黄色沉淀AgCl 白色沉淀Cu2(OH)2CO3 暗绿色沉淀BaCO3白色沉淀(且有CO2生成)CaCO3白色沉淀 (且有CO2生成) BaSO4白色沉淀不溶的碳酸盐白色沉淀(且有CO2生成)不溶的碱、金属氧化物白色沉淀(且有CO2生成)Fe(OH)2为白色絮状沉淀(在空气中很快变成灰绿色,再变成Fe(OH)3红褐色沉淀)相关口诀钾钠铵盐硝酸盐均可溶盐酸盐银不溶硫酸盐钡不溶白色沉淀: CaCO3。
BaCO3 . BaSO4。
AgCL. Mg(OH)2蓝色沉淀: Cu(OH)2红褐色沉淀: Fe(OH)3不建议死记硬背,只需记住每个阴离子里哪个不溶即可,钾钠铵硝都溶溶解性口诀一钾钠铵盐溶水快,①硫酸盐除去钡银铅钙. ②氯化物不溶氯化银,硝酸盐溶液都透明. ③氢氧根多溶一个钡④口诀中未有皆下沉. ⑤注:①钾钠铵盐都溶于水;②硫酸盐中只有硫酸钡、硫酸铅不溶(硫酸钙硫酸银微溶也是沉淀);③硝酸盐都溶于水;④碱性物质中除了钾离子钠离子铵离子锂离子还有钡离子也可溶⑤口诀中没有涉及的盐类都不溶于水;溶解性口诀二钾、钠、铵盐、硝酸盐;氯化物除银、亚汞;硫酸盐除钡和铅;碳酸、磷酸盐,只溶钾、钠、铵。

化学常见酸碱盐溶解性中考重点|化学常见酸碱盐溶解性1.酸:氢离子和各酸根离子构成酸,都是可溶的。
注意:硝酸(HNO3),盐酸(HCl)以及硫酸(H2SO4)属于三大强酸,碳酸(H2CO3)则属于弱酸。
除了浓硫酸具有吸水性,另外三种酸都具有挥发性。
2.碱:由金属元素或铵根与氢氧根组成的化合物,称为碱。
记住常见的碱中可溶性的碱,五个字:“钾钠钙钡铵”【KOH、NaOH、Ca(OH)2、Ba(OH)2、NH3∙H2O】都是可溶性的碱。
补充:氢氧化钙微溶于水,也就是我们经常提到的澄清石灰水,氢氧化铜是蓝色絮状沉淀,氢氧化铁是红棕色的絮状沉淀。
物质的特性,在推断题中常作为物质的信息点和突破口。
Cu(OH)2沉淀Fe(OH)3沉淀前方高能!重!点!来!了!3.盐:金属离子(或铵根)与酸根离子构成的化合物3.1.三个字——“钾钠铵”。
在盐的分类中,根据盐中金属元素(或铵根) 的种类,盐可以分为钾盐(KCl、K2CO3、K2SO4),钠盐(NaCl、Na2CO3、NaNO3),铵盐(NH4Cl、NH4NO3、NH4HCO3)等。
由钾、钠、铵【K、Na、NH4】组成的盐,一定都是可溶的,以上已举例。
3.2. 三个字——“三强酸”找三强酸的酸根,前面讲到三大强酸,分别是硝酸,盐酸,和硫酸。
当盐中有盐酸根(Cl−),硫酸根(SO42−),硝酸根(NO3−)的时候,都是可溶的。
比如:NaCl、Na2SO4、NaNO3。
但是!但是!记住两个挑事儿的特例①含有盐酸根(Cl−)的盐当中,氯化银(AgCl)是不可溶的白色沉淀;②含有硫酸根(SO42−)的盐中,硫酸钡(BaSO4)是不可溶的白色沉淀;这两个是含有三强酸酸根的常见盐当中唯一两个不可溶的碱。
所以,如果某种盐中既没有钾钠铵,也没有三强酸酸根,则该种盐为不可溶性盐。
你也会发现,大部分的碳酸盐,都是不可溶的。
下面你可以花30s时间来记住以上几点。
然后检查一下自己是否有理解和记住:判断以下三种物质的溶解性:(1) MgSO4 (2) BaCO3 (3) Mg(OH)2(1) MgSO4:属于盐,以三强酸中的硫酸根结尾,为可溶性盐;(2) BaCO3:属于盐,没有钾钠铵,也没有三强酸的酸根,为不可溶性盐;(3) Mg(OH)2:属于碱,非“钾钠钙钡铵”其中之一,为不可溶性碱。

初中化学知识点归纳物质的溶解度与溶解过程在化学当中,溶解是指物质在溶液中弥散分散的过程。
在初中化学的学习中,了解物质的溶解度和溶解过程是非常重要的知识点。
本文将对这两个知识点进行归纳总结,帮助读者更好地理解。
一、物质的溶解度1.1 溶解度的概念物质的溶解度是指在一定温度下,单位溶剂中能够溶解最大量溶质的质量。
溶解度通常用质量分数、体积分数和摩尔浓度等来表示。
1.2 影响物质的溶解度的因素1.2.1 温度的影响温度的升高通常会使溶解度增大,这是因为在较高的温度下,溶液的分子能量增大,分子活动性增强,势能垒降低,使得溶质能够更好地溶解入溶剂中。
1.2.2 压力的影响压力对溶解度的影响主要是针对气体溶解度而言。
当压力升高时,溶解度也会增大,这是因为气体溶解在溶液中是一个逆向的自由化学反应,增加压力会使反应达到平衡时反应的产物增多,从而使溶解度升高。
1.2.3 溶质与溶剂的性质溶质与溶剂的性质对溶解度也有一定的影响。
例如极性溶质在极性溶剂中的溶解度通常较大,而非极性溶质在非极性溶剂中的溶解度也比较大。
1.3 溶解度曲线溶解度曲线是指在一定温度下,溶剂中溶解溶质的变化关系曲线。
对于大部分物质溶解度随温度升高而增大的溶解度曲线为正斜率曲线,而对于部分物质,溶解度随温度升高而减小的溶解度曲线为负斜率曲线。
二、溶解过程2.1 溶解的定义及特点溶解是物质在溶液中实现离子间或分子间相互作用的分散过程。
在溶解过程中,溶质分子或离子与溶剂分子之间通过吸引力相互结合,形成扩散均匀分布在溶剂中的溶液。
2.2 溶解过程的热效应溶解过程中存在着热效应,通常分为溶解热和溶解热量变。
溶解热是指单位物质的溶解时所吸收或释放的热量,单位通常是焓变/摩尔。
溶解热量变是指单位溶质物质的溶解引起的液体溶液温度的变化。
2.3 溶解过程的速度溶解过程的速度受到多个因素的影响,主要包括溶质粒子的大小、溶剂的搅拌和温度等。
一般情况下,溶解速度会随着溶质粒子的大小的增加而增加,搅拌会加快溶解速度,而温度的升高也会促进溶解过程的进行。

初中化学常见物质溶解性表1. 水(H2O):水是一种非常常见的液体,它是一种极性分子,这意味着水分子具有部分正电和部分负电。
这种极性使得水能够方便地溶解许多极性分子,如纤维素和蛋白质。
但它不能流畅地溶解许多非极性物质,如油和脂肪。
2. 氧气(O2):氧气是一种非极性气体,因为它由两个相同的非极性原子氧组成。
它不能在水中溶解,但可以在一些有机溶剂中溶解。
它具有较低的溶解度,所以它是一种不良的生物体呼吸气体。
3. 纯乙醇(C2H5OH):纯乙醇是一种极性分子,它能够在水中溶解。
但它的溶解度依赖于温度和乙醇的浓度。
当乙醇浓度比较低时,它能够溶解于水中,但浓度超过一定值时,它的溶解度会变得很小。
4. 盐酸(HCl):盐酸是一种强酸,它能够在水中溶解,因为水分子能够解开盐酸的离子键,使盐酸分解为氢离子和氯离子。
这两种离子极易溶于水中。
它的溶解度取决于温度和盐酸的浓度。
5. 氨水(NH3):氨水是一种弱碱,它能够在水中溶解,因为水分子和氨分子之间存在氢键。
当氨水分解为氨离子和氢离子时,它能够轻松地溶于水中。
它的溶解度也取决于温度和氨水的浓度。
6. 碳酸钙(CaCO3):碳酸钙是一种难溶于水的盐。
它可以在水中存在,但只是以微小的量。
当碳酸钙沉淀时,它会从水中移除,使水变得干净。
它的溶解度取决于水的pH值、温度和溶液中的其它离子浓度。
7. 溴水(Br2):溴水是一种非极性分子,在水中溶解度很小。
溴水溶解的时候,它会形成一些氧化物和酸,但由于其溶解度较小,这些产物不会在水中停留很长时间。
8. 硝酸(HNO3):硝酸是一种强酸,能够在水中溶解。
它的溶解度也取决于温度和硝酸的浓度。
当浓度比较高的时候,硝酸变得非常危险,可以腐蚀和腐蚀很多材料。
9. 乳酸(C3H6O3):乳酸是一种极性分子,能够在水中溶解。
但随着浓度的增加,它在水中的溶解度会降低。
这使得乳酸变得难以用于一些需要高浓度的应用中。
10. 溴化镁(MgBr2):溴化镁是一种离子化合物,能够在水中溶解。
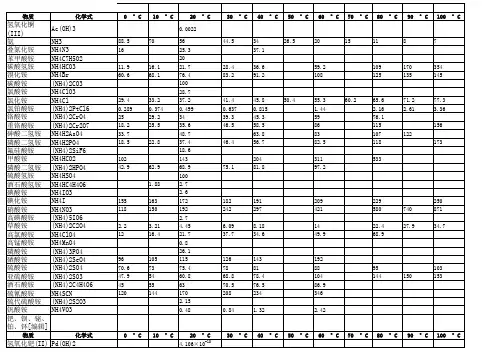

罕有沉淀之五兆芳芳创作白色:BaSO4/BaCO3/CaCO3/AgCl/Ag2CO3/Mg(OH)2/Fe(OH)2/Al(OH)3/C uCO3/ZnCO3/MnCO3/Zn(OH)2Fe(OH)2蓝色:Cu(OH)2浅黄色:AgBr红褐色:Fe(OH)3沉淀辨别Cu(OH)2蓝色沉淀Fe(OH)3红褐色沉淀AgBr淡黄色沉淀AgI ,Ag3PO4黄色沉淀CuO 玄色沉淀Cu2O 白色沉淀Fe2O3 红棕色沉淀FeO 玄色沉淀FeS2 黄色沉淀PbS 玄色沉淀FeCO3 灰色沉淀Ag2CO3 黄色沉淀AgBr 浅黄色沉淀AgCl 白色沉淀Cu2(OH)2CO3 暗绿色沉淀BaCO3白色沉淀(且有CO2生成)CaCO3白色沉淀(且有CO2生成)BaSO4白色沉淀不溶的碳酸盐白色沉淀(且有CO2生成)不溶的碱、金属氧化物白色沉淀(且有CO2生成)Fe(OH)2为白色絮状沉淀(在空气中很快酿成灰绿色,再酿成Fe(OH)3红褐色沉淀)相关隘诀钾钠铵盐硝酸盐均可溶盐酸盐银不溶硫酸盐钡不溶白色沉淀: CaCO3. BaCO3 . BaSO4. AgCL. Mg(OH)2蓝色沉淀: Cu(OH)2红褐色沉淀: Fe(OH)3不建议死记硬背,只需记住每个阴离子里哪个不溶便可,钾钠铵硝都溶溶解性口诀一钾钠铵盐溶水快,①硫酸盐除去钡银铅钙. ②氯化物不溶氯化银,硝酸盐溶液都透明. ③氢氧根多溶一个钡④口诀中未有皆下沉. ⑤注:①钾钠铵盐都溶于水;②硫酸盐中只有硫酸钡、硫酸铅不溶(硫酸钙硫酸银微溶也是沉淀);③硝酸盐都溶于水;④碱性物质中除了钾离子钠离子铵离子锂离子还有钡离子也可溶⑤口诀中没有涉及的盐类都不溶于水;溶解性口诀二钾、钠、铵盐、硝酸盐;氯化物除银、亚汞;硫酸盐除钡和铅;碳酸、磷酸盐,只溶钾、钠、铵.说明,以上四句歌谣归纳综合了8类相加在水中溶解与不溶的情况.溶解性口诀三钾钠铵硝皆可溶、盐酸盐不溶银亚汞;硫酸盐不溶钡和铅、碳磷酸盐多不溶.多数酸溶碱少溶、只有钾钠铵钡溶溶解性口诀四钾、钠、硝酸溶,(钾盐、钠盐和硝酸盐都溶于水.)盐酸除银(亚)汞,(盐酸盐里除氯化银和氯化亚汞外都溶.)再说硫酸盐,不容有钡、铅,(硫酸盐中不溶的是硫酸钡和硫酸铅.)其余几类盐,(碳酸盐、亚硫酸盐、磷酸盐、硅酸盐和硫化物)只溶钾、钠、铵,(只有相应的钾盐、钠盐和铵盐可溶)最后说碱类,钾、钠、铵和钡. (氢氧化钾、氢氧化钠、氢氧化钡和氨水可溶)另有几种微溶物,可单独记住.溶解性口诀五(适合初中化学课本前面的附录)钾钠铵盐硝酸盐①氢氧根多钡离子②硫酸盐除钡钙银③碳酸溶氢钾钠铵④生成沉淀氯化银⑤溶解性口诀六(初学记忆)不是沉淀物……我们初中的口诀是钾【化合物】、钠【化合物】、铵【铵根】、硝【硝酸盐】都可溶氯化物里银不溶硫酸盐里钡不溶解释①钾盐、钠盐、铵盐、硝酸盐都溶于水②除了以上四种,氢氧根和钡离子结应时也溶于水③硫酸铲除了和钡离子、钙离子、银离子结应时不溶于水,其他都溶④碳酸铲除了和氢离子、钾离子、钠离子和铵离子结应时溶于水,其他都不溶⑤氯离子只有和银离子结应时不溶于水初中经常使用溶解性口诀(溶解性口诀七)铵钾钠钡氢氧溶①碳酸只溶铵钾钠②所有硝酸都能溶③盐酸只有银不溶④硫酸只有钡不溶⑤解释①氢氧化铵,氢氧化钾,氢氧化钠,氢氧化钡都溶于水,其余带氢氧根的都不溶于水.②碳酸铵,碳酸钾,碳酸钠都溶于水,其余带碳酸根的都不溶于水.③所有带硝酸根的都能溶于水..④带氯离子的只有氯化银不溶于水,其余都溶于水.(因为盐酸中有氯离子,所以在这里所有带氯离子的都称为盐酸的同一类物质,注意:此说法只用于理解此溶解性口诀,实际中没有此说法)⑤带硫酸根的只有硫酸钡不溶于水,其余都溶于水.适合高中使用的口诀:碳酸只溶钾钠铵;(碳酸盐里钾钠铵盐易溶)氢氧多溶了钡的碱.(氢氧根比碳酸根多溶解一个钡离子)硫酸不溶钡和铅;(硫酸盐里钡和铅不溶)三价碳酸天地间.(三价的阳离子和碳酸根离子都生成气体和沉淀,即上天和入地)仍是氢氧人水性好,水底忍渴好几年.(氢氧根和银离子会生成氧化银沉淀是为水底,忍渴指还生成了水)氯化不溶唯有银;(氯化物中只有银盐不溶)硝酸大度溶万金.(硝酸盐都易溶)溶解性口诀八钾钠铵盐均可溶;硝盐入水无影踪.难溶硫酸铅和钡;还有氯化银亚汞.至于磷酸碳酸盐;绝大多数均难溶.溶解性口诀九钾钠铵盐均可溶;硝盐遇水影无踪.硫盐不溶铅与钡;氯物不溶银亚汞.碳酸与磷酸,钾钠铵才溶.罕有的酸根离子有:碳酸根CO3 -2价碳酸氢根HCO3 -1价硫离子常显 -2价硫酸根SO4 -2价亚硫酸根SO3 -2价磷酸根PO4 -3价磷酸氢根HPO4 -2价磷酸二氢根H2PO4 -1价高锰酸根MnO4 -1价锰酸根MnO4 -2价氯离子常显 -1价氯酸根ClO3 -1价亚氯酸根ClO2 -1价次氯酸根ClO -1价高氯酸根ClO4 -1价硝酸根NO3 -1价亚硝酸根NO2 -1价碘酸根IO3 -1价硼酸根BO3 -3价钨酸根WO4 -2价硅酸根SiO3 -2价硒酸根搜索引擎优化4 -2价铬酸根CrO4 -2价二铬酸根Cr2O7 -2价铁酸根FeO2 -1价高铁酸根FeO4 -2价铝酸根AlO3 -3价偏铝酸根AlO2 -1价氢氰根CN -1价草酸根C2O4 -2价初中课本罕有:碳酸根CO3 -2价,硫酸根SO4 -2价,亚硫酸根SO3-2价,次氯酸根ClO -1价,硝酸根NO3 -1价.几种重要阳离子的查验(l)H+ 能使紫色石蕊试液或橙色的甲基橙试液变成白色. (2)Na+、K+ 用焰色反响来查验时,它们的火焰辨别呈黄色、浅紫色(通过钴玻片). (3)Ba2+ 能使稀硫酸或可溶性硫酸盐溶液产生白色BaSO4沉淀,且沉淀不溶于稀硝酸. (4)Mg2+ 能与NaOH溶液反响生成白色Mg(OH)2沉淀,该沉淀能溶于NH4Cl溶液. (5)Al3+ 能与适量的NaOH溶液反响生成白色Al(OH)3絮状沉淀,该沉淀能溶于盐酸或过量的NaOH溶液. (6)Ag+ 能与稀盐酸或可溶性盐酸盐反响,生成白色AgCl沉淀,不溶于稀 HNO3,但溶于氨水,生成〔Ag(NH3)2〕+. (7)NH4+ 铵盐(或浓溶液)与NaOH浓溶液反响,并加热,放出使湿润的白色石蕊试纸变蓝的有刺激性气味NH3气体. (8)Fe2+ 能与少量NaOH溶液反响,先生成白色Fe(OH)2沉淀,迅速酿成灰绿色,最后酿成红褐色Fe(OH)3沉淀.或向亚铁盐的溶液里参加KSCN溶液,不显白色,参加少量新制的氯水后,立即显白色.2Fe2++Cl2=2Fe3++2Cl-(9)Fe3+ 能与 KSCN溶液反响,酿成血白色 Fe(SCN)3溶液,能与NaOH溶液反响,生成红褐色Fe(OH)3沉淀. (10)Cu2+ 蓝色水溶液(浓的CuCl2溶液显绿色),能与NaOH溶液反响,生成蓝色的Cu(OH)2沉淀,加热后可转变成玄色的 CuO沉淀.含Cu2+溶液能与Fe、Zn片等反响,在金属片上有白色的铜生成.几种重要的阴离子的查验(1)OH-能使无色酚酞、紫色石蕊、橙色的甲基橙等指示剂辨别变成白色、蓝色、黄色. (2)Cl-能与硝酸银反响,生成白色的AgCl沉淀,沉淀不溶于稀硝酸,能溶于氨水,生成[Ag(NH3)2]+. (3)Br-能与硝酸银反响,生成淡黄色AgBr沉淀,不溶于稀硝酸. (4)I-能与硝酸银反响,生成黄色AgI沉淀,不溶于稀硝酸;也能与氯水反响,生成I2,使淀粉溶液变蓝. (5)SO42-能与含Ba2+溶液反响,生成白色BaSO4沉淀,不溶于硝酸. (6)SO32-浓溶液能与强酸反响,产生无色有刺激性气味的SO2气体,该气体能使品红溶液褪色.能与BaCl2溶液反响,生成白色BaSO3沉淀,该沉淀溶于盐酸,生成无色有刺激性气味的SO2气体. (7)S2-能与Pb(NO3)2溶液反响,生成玄色的PbS沉淀. (8)CO32-能与BaCl2溶液反响,生成白色的BaCO3沉淀,该沉淀溶于硝酸(或盐酸),生成无色无味、能使澄清石灰水变混浊的CO2气体. (9)HCO3-取含HCO3-盐溶液煮沸,放出无色无味CO2气体,气体能使澄清石灰水变混浊.或向HCO3-盐酸溶液里参加稀MgSO4溶液,无现象,加热煮沸,有白色沉淀 MgCO3生成,同时放出 CO2气体. (10)PO43-含磷酸根的中性溶液,能与AgNO3反响,生成黄色Ag3PO4沉淀,该沉淀溶于硝酸. (11)NO3-浓溶液或晶体中参加铜片、浓硫酸加热,放出红棕色气体.几种重要有机物的查验(1)苯能与纯溴、铁屑反响,产生HBr白雾.能与浓硫酸、浓硝酸的混杂物反响,生成黄色的苦杏仁气味的油状(密度大于1)难溶于水的硝基苯. (2)乙醇能够与灼热的螺旋状铜丝反响,使其概略上玄色CuO变成光明的铜,并产生有刺激性气味的乙醛.乙醇与乙酸、浓硫酸混杂物加热反响,将生成的气体通入饱和Na2CO3溶液,有透明油状、水果香味的乙酸乙酯液体浮在水面上. (3)苯酚能与浓溴水反响生成白色的三溴苯酚沉淀.能与FeCl3溶液反响,生成紫色溶液. (4)乙醛能产生银镜反响,或能与新制的蓝色Cu(OH)2加热反响,生成白色的 Cu2O沉淀.用一种试剂或不必试剂辨别物质用一种试剂来辨别多种物质时,所选用的试剂必须能和被鉴此外物质大多数能产生反响,并且能产生不合的实验现象.经常使用的辨别试剂有FeCl3溶液、NaOH溶液、Na2CO3溶液、稀H2SO4、Cu(OH)2悬浊液等. 不必其他试剂来辨别一组物质,一般情况从两个方面考虑:①利用某些物质的特殊性质(如颜色、气味、溶解性等),首先辨别出来,然后再用该试剂去辨别其他物质. ②采取一种试剂与其他物质相互反响的现象不合,进行综合阐发辨别.。

溶解性口诀钾钠铵盐溶水快,硫酸盐除去钡铅钙。
氯化物不溶氯化银,硝酸盐溶液都透明。
口诀中未有皆下沉。
金属活动性口诀钾钙钠镁铝。
锌铁锡铅氢,铜汞银铂金。
注:①钾钠铵盐都溶于水;②硫酸盐中只有硫酸钡、硫酸铅、硫酸钙不溶;③硝酸盐都溶于水④口诀中没有涉及的盐类都不溶于水;制氧气口诀:二氧化锰氯酸钾;混和均匀把热加。
制氧装臵有特点;底咼口低略倾斜。
集气口诀:与水作用用排气法;根据密度定上下。
不溶微溶排水法;所得气体纯度大。
电解水口诀:正氧体小能助燃;负氢体大能燃烧。
化合价口诀:常见元素的主要化合价:氟氯溴碘负一价;正一氢银与钾钠。
氧的负二先记清;正二镁钙钡和锌。
正三是铝正四硅;下面再把变价归。
全部金属是正价;一二铜来二三铁。
锰正二四与六七;碳的二四要牢记。
非金属负主正不齐;氯的负一正一五七。
氮磷负三与正五;不同磷三氮二四。
有负二正四六;边记边用就会熟。
常见根价口诀一价铵根硝酸根;氢卤酸根氢氧根。
高锰酸根氯酸根;高氯酸根醋酸根。
二价硫酸碳酸根;氢硫酸根锰酸根。
暂记铵根为正价;负三有个磷酸根。
金属活动性顺序表:(初中)钾钙钠镁铝、锌铁锡铅氢、铜汞银铂金。
(高中)钾钙钠镁铝锰锌、铬铁镍、锡铅氢;铜汞银铂金。
化合价口诀二:一价氢氯钾钠银;二价氧钙钡镁锌,三铝四硅五氮磷;二三铁二四碳,二四六硫都齐;全铜以二价最常见。
盐的溶解性:钾钠铵硝皆可溶、盐酸盐不溶银亚汞;硫酸盐不溶钡和铅、碳磷酸盐多不溶多数酸溶碱少溶、只有钾钠铵钡溶制氧气口诀:二氧化锰氯酸钾;混和均匀把热加。
制氧装臵有特点;底高口低略倾斜。
集气口诀:与水作用用排气法;根据密度定上下。
不溶微溶排水法;所得气体纯度大。
电解水口诀:正氧体小能助燃;负氢体大能燃烧。
化合价口诀:常见元素的主要化合价氟氯溴碘负一价;正一氢银与钾钠。
氧的负二先记清;正二镁钙钡和锌。
正三是铝正四硅;下面再把变价归。
全部金属是正价;一二铜来二三铁。
锰正二四与六七;碳的二四要牢记。
非金属负主正不齐;氯的负一正一五七。
初中化学中常见物质的溶解性情况单质1、【金属单质....】:所有金属几乎难溶于水〔但一些金属由于很活泼,在常温下能够和水发生反响:例如K、Ca、Na等〕。
2、【非金属单质.....】:①〔固态〕C、S、P等难溶于水;②(气态) N2、H2 等难溶于水,O2 不易溶于水。
化合物1、【酸的溶解性.....】【大局部酸及酸性氧化物(非金属氧化物)能溶于水,〔酸性氧化物+水→酸〕大局部碱性氧化物〔金属氧化物〕不溶于水,能溶的有:氧化钡、氧化钾、氧化钙、氧化钠〔碱性氧化物+水→碱〕】。
2、【碱的溶解性.....】▲溶于水的碱有:氢氧化钡、氢氧化钾、氢氧化钠和氨水。
▲其他的碱大局部不溶于水:难溶性碱中Fe(OH)3是红褐色沉淀,Cu(OH)2是蓝色沉淀,其他难溶性碱为白色〔包括Fe〔OH〕2〕。
▲其中AgOH 为白色固体,属于碱,常温下AgOH极不稳定,易分解为棕褐色难溶于水的氧化银固体.低温下可制得氢氧化银在水中的白色沉淀,Ca(OH)2为微溶于水的白色固体。
3、【盐的溶解性.....】★含有钾、钠、硝酸根、铵根的物质都溶于水;★含Cl- 的化合物只有AgCl不溶于水,其他都溶于水;★含SO42-的化合物只有BaSO4不溶于水,Ag2SO4、CaSO4微溶于水, 其他都溶于水;★含CO32-的物质只有K2CO3、Na2CO3、〔NH4〕2CO3溶于水,其他绝大局部不溶于水,一些微溶于水或者遇到水发生水解。
注意:【沉淀物中AgCl和BaSO4不溶于稀硝酸,其他沉淀物能溶于酸。
如:Mg(OH)2、CaCO3、BaCO3、Ag2 CO3等】4、【氧化物的溶解性.......】▲金属氧化物一般都不溶解,例如:CuO, Fe2O3, Fe3O4 ,MgO, Al2O3 ,MnO2等, 其中CaO能与水反响。
▲非金属氧化物:①难溶于水,例如:CO、NO等。
②可溶于水,例如:CO2〔其中CO2 溶于水后又能与水反响〕。
初中化学溶解度知识要点归纳初中化学溶解度知识要点归纳化学是自然科学的一种。
化学是主要在分子、原子层面,研究物质的组成、性质、结构与变化规律的科学。
以下是店铺为大家整理的初中化学溶解度知识要点归纳,希望对大家有所帮助。
初中化学溶解度知识溶解度1、固体的溶解度溶解度定义:在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量四要素:①条件:一定温度②标准:100g溶剂③状态:达到饱和④质量:单位:克溶解度的含义:20℃时NaCl的溶液度为36g含义:在20℃时,在100克水中最多能溶解36克NaCl或在20℃时,NaCl在100克水中达到饱和状态时所溶解的质量为36克2、影响固体溶解度的因素①溶质、溶剂的性质(种类)②温度大多数固体物的溶解度随温度升高而升高;如KNO3少数固体物质的溶解度受温度的影响很小;如NaCl极少数物质溶解度随温度升高而降低。
如Ca(OH)23、溶解度曲线t3℃时A的溶解度为80gP点的的含义在该温度时,A和C的溶解度相同N点为t3℃时A的不饱和溶液,可通过加入A物质,降温,蒸发溶剂的方法使它变为饱和t1℃时A、B、C、溶解度由大到小的顺序C>B>A从A溶液中获取A晶体可用降温结晶的方法获取晶体。
从A溶解度是80g。
t2℃时A、B、C的饱和溶液各W克,降温到t1℃会析出晶体的有A和B无晶体析出的有C,所得溶液中溶质的质量分数由小到大依次为A除去A中的泥沙用过滤法;分离A与B(含量少)的混合物,用结晶法4、气体的溶解度气体溶解度的定义:在压强为101kPa和一定温度时,气体溶解在1体积水里达到饱和状态时的气体体积。
影响因素:①气体的性质②温度(温度越高,气体溶解度越小)③压强(压强越大,气体溶解度越大)5、混合物的分离过滤法:分离可溶物+难溶物结晶法:分离几种可溶性物质结晶的两种方法:①蒸发溶剂,如NaCl(海水晒盐)②降低温度(冷却热的饱和溶液,如KNO3)初三化学基础知识氧气一、氧气的性质【物理性质】密度略大于空气的密度。
初中化学知识点总结:溶解度一.溶液1.溶液的定义:一种或几种物质分散在另一种物质中,均一、稳定的混合物叫做溶液。
2,溶液的特征(1)均一性:是制溶液**部分组成、性质完全相同。
(2)稳定性:是指外界条件不变(温度、压强等),溶剂的量不变时,溶液长期放置不会分层也不会析出固体或气体。
二。
饱和溶液与不饱和溶液1,概念:(1)饱和溶液:在一定温度下、一定量的溶剂里,不能溶解某种绒织的溶液,叫做这种溶质的饱和溶液。
(2)不饱和溶液:在一定温度下、一定量的溶剂里,还能继续溶解某种溶质的溶液,叫做这种溶质的不饱和溶液。
2.饱和溶液与不饱和溶液的意义在于指明一定温度和一定量的溶剂,且可以相互转化:饱和溶液降低温度或蒸发溶剂或增加溶质不饱和溶液三.固体物质的溶解度以及溶解度曲线1.概念:在一定温度下,某固体物质在100g溶剂里达到饱和状态时,所溶解溶质的质量,叫做这种物质在这种溶解里的溶解度。
2.影响固体溶解度大小的因素(1)溶质、溶剂本身的性质(2)温度3.溶解度曲线(1)溶解度曲线的意义:①溶解度曲线表示某物质在不同温度下的溶解度或溶解度随温度的变化情况。
②溶解度曲线上的每一个点表示溶质在某一温度下的溶解度。
此时,溶液必定是饱和溶液.③两条曲线的交叉点表示两种物质在该温度下具有相同的溶解度.在该温度下,这两种物质的饱和溶液中溶质的质量分数相等。
④在溶解度曲线的下方的点,表示该温度下的溶液是该物质的不饱和溶液。
⑤在溶解度曲线上方的点,表示该温度下的溶液是该物质的过饱和溶液,也就是说,在溶液中存在未溶解的溶质.(2)溶解度曲线变化的规律大多数固体物质的溶解度随温度的升高而增大,一般表现在曲线坡度比较陡,如硝酸钾;少数固体物质的溶解度受温度的影响较小,表现在曲线的坡度比较平缓,如氯化钠;极少数固体物质的溶解度随温度的升高而减小,表现在曲线的坡度下降,如熟石灰。
四。
结晶的方法:(1)蒸发结晶(蒸发溶剂法):将固体溶质的溶液加热(或日晒,或在风力的作用下)使溶剂蒸发,使溶液又不饱和溶液转化为饱和溶液,再继续蒸发溶剂,使溶质从溶液中析出.适用范围:溶解度受温度变化影响不大的物质,如氯化钠.(2)降温结晶(冷却热饱和溶液法)冷却热的饱和溶液,使溶质从溶液中结晶析出.适用范围:溶解度受温度变化影响较大的物质,如氯酸钾。
初中化学中常见物质的溶解性情况
单质
1、【金属单质
....】:所有金属几乎难溶于水(但一些金属由于很活泼,在常温下能够和水发生反应:例如K、Ca、Na等)。
2、【非金属单质
.....】:①(固态)C、S、P等难溶于水;
②(气态) N2、H2 等难溶于水,O2 不易溶于水。
化合物
1、【酸的溶解性
.....】
【大部分酸及酸性氧化物(非金属氧化物)能溶于水,(酸性氧化物+水→酸)大部分碱性氧化物(金属氧化物)不溶于水,能溶的有:氧化钡、氧化钾、氧化钙、氧化钠(碱性氧化物+水→碱)】。
2、【碱的溶解性
.....】
▲溶于水的碱有:氢氧化钡、氢氧化钾、氢氧化钠和氨水。
▲其他的碱大部分不溶于水:难溶性碱中Fe(OH)3是红褐色沉淀,Cu(OH)2是蓝色沉淀,其他难溶性碱为白色(包括Fe(OH)2)。
▲其中AgOH 为白色固体,属于碱,常温下AgOH极不稳
定,易分解为棕褐色难溶于水的氧化银固体.低温下可制得氢氧化银在水中的白色沉淀,Ca(OH)2为微溶于水的白色固体。
3、【盐的溶解性
.....】
★含有钾、钠、硝酸根、铵根的物质都溶于水;
★含Cl- 的化合物只有AgCl不溶于水,其他都溶于水;★含SO42-的化合物只有BaSO4不溶于水,Ag2SO4、CaSO4微溶于水, 其他都溶于水;
★含CO32-的物质只有K2CO3、Na2CO3、(NH4)2CO3溶于水,其他绝大部分不溶于水,一些微溶于水或者遇到水发生水解。
注意:【沉淀物中AgCl和BaSO4不溶于稀硝酸,其他沉淀物能溶于酸。
如:Mg(OH)2、CaCO3、BaCO3、Ag2 CO3等】
4、【氧化物的溶解性
.......】
▲金属氧化物一般都不溶解,例如:CuO, Fe2O3, Fe3O4 ,MgO, Al2O3 ,MnO2等, 其中CaO能与水反应。
▲非金属氧化物:①难溶于水,例如:CO、NO等。
②可溶于水,例如:CO2(其中CO2 溶于水后又能与水反应)。
③易溶于水:例如:SO2、NO2等。
5、【其他
......】
..物质的溶解性
▲①难溶于水:CH4 ;②易溶于水: HCl、NH3 (其中NH3溶于水后又能与水反应)、葡萄糖、蔗糖等。