物质的溶解性
- 格式:doc
- 大小:141.00 KB
- 文档页数:9


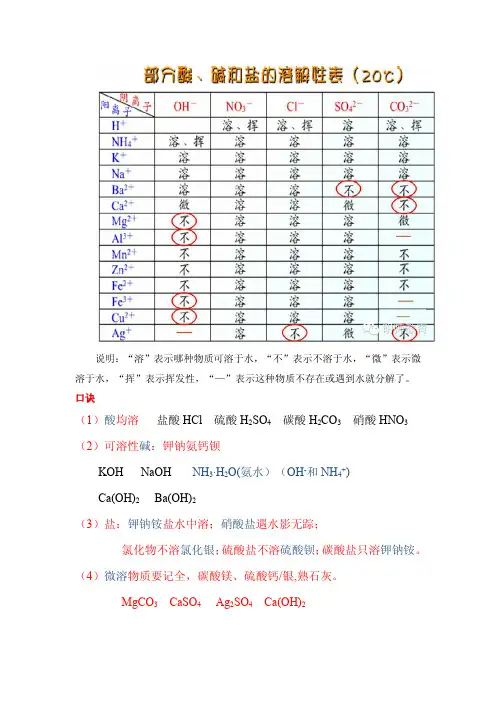
说明:“溶”表示哪种物质可溶于水,“不”表示不溶于水,“微”表示微溶于水,“挥”表示挥发性,“—”表示这种物质不存在或遇到水就分解了。
口诀
(1)酸均溶盐酸HCl硫酸H2SO4碳酸H2CO3硝酸HNO3(2)可溶性碱:钾钠氨钙钡
KOH NaOH NH3·H2O(氨水)(OH-和NH4+)
Ca(OH)2Ba(OH)2
(3)盐:钾钠铵盐水中溶;硝酸盐遇水影无踪;
氯化物不溶氯化银;硫酸盐不溶硫酸钡;碳酸盐只溶钾钠铵。
(4)微溶物质要记全,碳酸镁、硫酸钙/银,熟石灰。
MgCO3CaSO4Ag2SO4Ca(OH)2
五大阴离子四大酸根离子
物质名称化学式
物质分类
(酸碱盐)
溶解性
(溶不微)
例:氯化钠NaCl盐溶1硫酸
2氯化银
3碳酸钠
4氢氧化镁
5氯化铜
6硫酸钡
7硝酸银
8氢氧化铁
9氨水
10硫酸锌
11碳酸镁
12硝酸铜
13氯化亚铁
14碳酸铵
15硝酸铵
16硝酸铝
17氢氧化钡
18硫酸钠
19硝酸钡
20硝酸
21硫酸铁
22碳酸钙
23氢氧化钙
24氢氧化锌
25氯化铵
26碳酸钡
27硫酸钙
28高锰酸钾
29硝酸亚铁
30碳酸
31硫酸铜
32氢氧化铝
33氯化铝。



常见物质的溶解性1、气体:溶的:CO2、HCl、SO2、NH3等。
不溶(或不易溶):O2、H2、CH4、CO、N2等。
2、金属氧化物:除CaO、Na2O、K2O、BaO溶外,大多数不溶3、酸:大多数溶4、碱:除氢氧化钡、氢氧化钾、氢氧化钙、氢氧化钠和氨水溶外,其他碱不溶于水;5、盐:含有钾、钠、硝酸根、铵根的盐都溶于水;含Cl-的盐只有AgCl不溶于水,其他都溶于水;含SO42-的盐只有BaSO4不溶于水,其他都溶于水;含CO32-的盐只有含K+、Na+、NH4+溶于水,其他都不溶于水。
酸碱盐溶解性口诀:1、酸类多数都易溶;2、碱类易溶钾钠钡铵,钙是微溶余不溶;3、盐类:①钾盐钠盐硝酸盐,还有铵盐都易溶;(钾钠铵硝都易溶)②硫酸盐中钡不溶,硫酸钙银是微溶。
③氯化物中银不溶;④碳酸盐只溶钾钠氨,但是全能溶于酸。
⑤AgCl、BaSO4遇酸也不溶,加稀硝酸不溶解。
常见物质的颜色(一)固体的颜色1、黑色固体:木炭C,氧化铜CuO,二氧化锰MnO2,四氧化三铁Fe3O4,铁粉Fe(铁块银白色)2、紫黑色固体:高锰酸钾KMnO43、红色固体:铜Cu—紫红色,氧化铁Fe2O3——红(棕)色红磷P4、红褐色沉淀:氢氧化铁Fe(OH)35、浅黄色固体:硫磺S6、蓝色:硫酸铜晶体CuSO4·5H2O(无水硫酸铜白色),氢氧化铜沉淀Cu(OH)27、大部分固体:白色,如无水硫酸铜CuSO4,CaO,CaCO3沉淀(即不溶于水的盐和碱):①盐:白色↓:CaCO3、BaCO3(溶于酸)AgCl、BaSO4(也不溶于稀HNO3) 等;②碱:蓝色↓:Cu(OH)2;红褐色↓:Fe(OH)3;白色↓:其余不溶性碱为白色。
(二)液体的颜色1、大部分液体:无色,如水,稀盐酸,稀硫酸,酚酞试液等2、蓝色溶液:含有Cu2+的溶液—硫酸铜Cu SO4溶液,氯化铜CuCl2溶液,硝酸铜Cu(NO3)2溶液3、黄色溶液:含有Fe3+的溶液—Fe2(SO4)3溶液,FeCl3溶液,Fe(NO3)3硝酸铁溶液4、浅绿色溶液:含有Fe2+的溶液—FeSO4溶液,FeCl2溶液,硝酸亚铁Fe(NO3)2溶液5、紫红色溶液:高锰酸钾溶液KMnO46、紫色溶液:石蕊溶液(三)常见气体、无色气体:单质:氧气O2,氢气H2,氮气N2。

常见物质溶解性(一)(参见初中化学课本P273表)钾盐铵盐都易溶,硝酸盐遇水影无踪。
硫酸盐不溶钡和铅,氯化物不溶银、亚汞。
其它盐类溶三种,①沉淀溶于强酸中。
钾钠钡钙碱可溶,②其它也溶强酸中。
注:①除硝酸盐、硫酸盐、氯化物以外的盐类只有钾、钠、铵盐可溶。
②氢氧化钙Ca(OH)2是微溶。
常见物质溶解性(二)钾钠铵盐水易溶,硝酸盐类性相同;“硫”盐不溶钡与铅,①“氯”盐不溶银亚汞;②弱碱和那弱酸盐,水中大部分不能溶。
注:①“硫”盐,指硫酸盐。
②“氯”盐,指盐酸盐。
盐类物质的溶解性一切钠、钾盐全部溶,铵盐、硝酸盐也相同。
硫酸钡、铅要除外,氯化亚汞、银不溶,亚硫酸盐、磷酸盐,钠、钾、铵溶余不溶,碳酸盐和硅酸盐,全跟上面相雷同。
硫化钾、钡、钠、镁溶,硫化钙微溶余不溶。
盐类溶解性歌硝酸钾钠溶,碳硅和亚硫,盐酸除银汞,钠后都不溶。
①硫酸去钡铅,微溶氯化铅,磷盐多不溶。
硫酸钙银汞。
注:①溶解性表中钠以后的金属盐都不溶于水。
鸟之诗[先知]比中学化学课本上的要详细溶解度表維基百科,自由的百科全書跳轉到: 導航, 搜尋關於高中階段使用的用於判斷溶解性的簡易表格,請參見溶解性表。
溶解度表以化學品中特徵元素的拼音順序排列。
所有數據都為1atm下的數據,單位為g/100cm3。
內容列表:錒、氨、銨、鈀、鋇、鉍、鉑、鈈、氮、鏑、鉺、釩、釓、鈣、鋯、鎘、鉻、汞、鈷、矽、鉿、氦、鈥、鎵、鉀、金、鈧、鑭、鋰、硫、鑥、鋁、鎂、錳、鈉、鎳、釹、硼、鈹、釙、鐠、氫、鉛、銣、銫、釤、砷、鈰、鍶、鉈、碳、鋱、銻、鐵、銅、釷、錫、氙、鋅、溴、氬、氧、銦、釔、鐿、銀、鈾、銪、有機化合物物質化學式0°C10°C20°C30°C40°C50°C60°C70°C80°C90°C100°C 乙酸鈉CH3COONa36.240.846.454.665.6139153161170疊氮化鈉NaN338.939.940.8苯甲酸鈉NaC7H5O253.0溴酸鈉NaBrO324.230.336.442.648.862.675.790.8溴化鈉NaBr80.285.290.898.4107118120121121碳酸鈉Na2CO3712.521.539.7494643.943.9氯酸鈉NaClO379.687.695.9105115137167184204氯化鈉NaCl35.735.835.936.136.437.13838.539.2鉻酸鈉Na2CrO431.750.1848896115125126氰化鈉NaCN40.848.158.771.2水解重鉻酸鈉Na2Cr2O7163172183198215269376405415磷酸二氫鈉NaH2PO456.569.886.9107133172211234。

三、物质的溶解性
1、盐的溶解性
含有钾、钠、硝酸根、铵根的物质都溶于水
含Cl的化合物只有AgCl不溶于水,其他都溶于水;
含SO42-的化合物只有BaSO4 不溶于水,其他都溶于水。
含CO32-的物质只有K2CO3、Na2CO3、(NH4)2CO3溶于水,其他都不溶于水
2、碱的溶解性
溶于水的碱有:氢氧化钡、氢氧化钾、氢氧化钙、氢氧化钠和氨水,其他碱不溶于水。
难溶性碱中Fe(OH)3是红褐色沉淀,Cu(OH)2是蓝色沉淀,其他难溶性碱为白色。
(包括Fe (OH)2)注意:沉淀物中AgCl和BaSO4 不溶于稀硝酸,
其他沉淀物能溶于酸。
如:Mg(OH)2 CaCO3 BaCO3 Ag2 CO3 等
3、大部分酸及酸性氧化物能溶于水,(酸性氧化物+水→酸)大部分碱性氧化物不溶于水,能溶的有:氧化钡、氧化钾、氧化钙、氧化钠(碱性氧化物+水→碱)。



§6-3物质的溶解性一、素质教育目标:(一)知识目标1.通过三组探究实验了解影响物质溶解性的三个因素:溶质与溶剂的本身性质和温度。
2.通过探究活动了解饱和溶液与不饱和溶液的概念,并与日常生活为基础,交流讨论饱和溶液与不饱和溶液的相互转化的方法。
3.在学习溶解性和饱和溶液的基础上继续学习并知道物质溶解性的定量表示(固体溶解度的概念),影响固体溶解度的因素,并知道可以用固体溶解度曲线表示某物质在一定温度时的溶解度。
4.学习描绘固体溶解度曲线,并能利用它解决一些问题。
5.稍微了解气体溶解度的有关情况。
6.通过探究活动了解结晶现象并知道结晶在生产生活中的广泛应用。
(二)能力目标1.培养学生通过实验解决问题的能力,更突出的是培养学生在实验基础上的分析能力和思维能力。
2.利用实验和数据的结合,培养学生区分不同概念的比较能力和分析思维能力。
3.培养学生识图和用图解决一些问题的能力。
4.培养学生实验操作能力,以及他们对实验过程和实验结果的表述能力。
(三)德育目标1.通过对实验的分析研究,培养学生沿着“问题—实验探究—分析—结论”的思路,以科学的方法去解决问题的能力。
2.通过探究与讨论,发展同学们合作学习、勤于思考、严谨求实、勇于实践的科学精神。
二、重点:1.建立溶解性、溶解度、饱和溶液与不饱和溶液、结晶的概念2.知道饱和溶液与不饱和溶液相互转化的方法。
3.知道影响物质溶解性和固体溶解度的因素。
4.了解固体溶解度曲线的意义并学习描绘和使用固体溶解度曲线。
5.利用结晶方法,分离几种可溶性物质的混合物的原理。
三、难点:1.正确理解物质溶解性的定量表示——溶解度的概念,区分溶解性与溶解度在概念上的不同。
2.饱和溶液与不饱和溶液相互转化的方法。
3.描绘和使用固体溶解度曲线。
4.利用结晶方法,分离几种可溶性固体物质的混合物的原理。
四、课时安排:3课时。
五、课前准备:教师准备:(物质)投影仪、电脑、(分组实验用品)食盐、蔗糖、消石灰、水、汽油、食用油、硝酸钾、饱和蔗糖水溶液、试管、烧杯、酒精灯、滴管、水槽、玻璃片、玻璃棒、硫酸亚铁晶体、硫酸铜晶体、硝酸钾晶体、重铬酸钾晶体、温度计、移液管、铁架台、(知识)有关有机溶剂的知识、干洗原理、血渍清洗知识、油笔芯清洗知识学生准备:小实验与社会实践1.小实验取一份食用油,试验其在水、汽油中的溶解性。
厨房中常见的食品还有哪些物质间可以互溶形成溶液,列表格加以说明。
2.社会实践(1)了解毛料衣服干洗的原理。
(2)了解并收集化工产品、涂料、黏接剂、化妆品、药剂生产中用到的溶剂的名称。
讨论这些溶剂使用的大致范围。
并以“溶剂”为题写一份调查报告。
3了解海水晒盐过程和原理4.(家庭小实验)你有下列这些体会吗?如果没有,请不妨动手做一做,再预习书本P163—P165后完成填空。
(1)向10ml水中不断加入食盐,将会出现的现象(2)向10ml冷水中不断加入蔗糖,将会出现的现象(3)向10ml开水中不断加入蔗糖,将会出现的现象(4)向10ml水中不断加入面粉,将会出现的现象(5)向10ml水中不断加入酒精,将会出现的现象(6)向10ml食用油中不断加入盐,将会出现的现象由上述实验得出的结论是(1)(2)(3)(4)(7)取大约20ml的水于玻璃杯中,不断加入食盐(边加边搅拌)至溶液中有少量固体残留时,此时实验溶液已达到状态,然后小心倒出一部分溶液,再向其中加入少量蔗糖,经搅拌后可见,该实验可得出的结论是。
六、教学过程第一课时课前展示活动目标,插入背景音乐,稳定学生的情绪,为学生进入学习状态创设情景。
(引言)同学们,通过前面一、二节的学习,我们已知道许多物质能溶于水,形成水溶液。
老师让你们做的家庭小实验及所得结论带来了吗?请拿出来展示交流。
(承接)看来大家对物质的溶解性有了初步的认识,我们把一种物质(溶质)溶解在另一种物质(溶剂)里的能力称为溶解性。
物质的溶解性与哪些因素有关呢?请同学们讨论一下。
(学生)1.可能与物质本身有关2.可能与溶剂有关3. 可能与温度有关(设计实验)根据桌上所给药品和仪器进行实验设计,然后交流并与教材P164“活动与探究”比较,明了实验中控制变量的方法(教师提示)探究1的可能性,我们把温度、溶剂量(一般是水)保持一致,在加入不同溶质,我们请第一组同学进行探究。
探究2的可能性,我们把温度、溶质(统一用食用油)保持一致,在加入不同溶剂,我们请第二组同学进行探究。
探究3的可能性,我们把溶质、溶剂保持一致,但一支试管在常温下,另一支试管加热至沸,我们请第三、四组同学进行探究。
2.同一种物质在不同溶剂中溶解能力不同(的确与溶剂性质有关)3. 同一种物质在同一溶剂中的溶解能力与温度有关(讲解)物质的溶解性大小与溶质、溶剂性质的关系到现在为止,科学家还没有找到一条普遍的规律,只有一条应用教广的经验规则:即跟它结构相似的溶剂里容易溶解,称为“相似相溶”。
希望同学们中多出一些化学科学家,去找这条规律。
在日常应用中,人们常常应用这条规则,如用酒精、汽油、香蕉水、氯仿、苯等溶剂溶解某些在水中难以溶解的物质,例如用酒精溶解化妆品中的香精、中草药中的有效成分,用氯仿溶解有机玻璃。
在许多化工产品、涂料、粘接剂的生产过程中也要用到酒精、苯、香蕉水等溶剂。
(联接一些资料图片)(提问)干洗原理、血渍清洗知识、油笔芯清洗知识(承接)联系同学们的家庭小实验,一起来探究固体物质在水中能否无限制的溶解。
(教师)那么影响是否达到饱和的因素是什么?要想让刚才的饱和溶液中剩余的固体溶解,你们有什么好主意?(学生)一定温度下,一定量的溶剂中,能继续溶解某溶质的溶液叫做不饱和溶液;不能继续溶解某溶质的溶液叫做饱和溶液。
(教师)这个概念还有欠缺吗?还有什么地方不严密?如果一杯水中氯化钠不能溶解了,其他物质还能溶解吗?(学生中会出现不同观点,他们会想到实验来探究,但如何观察一种新的物质在某溶质的饱和溶液中溶解呢?)(教师)可以用有色的物质。
(学生)饱和溶液与不饱和溶液的概念中应注意三个问题:一定温度,一定量的溶剂,一种物质达到饱和时,其他物质可以溶解。
(交流与讨论)学习了饱和溶液与不饱和溶液。
那么如何判断饱和溶液与不饱和溶液呢? 根据书本P165交流与讨论1进行总结1. 向两溶液中分别加入少量硝酸钠固体,能溶解或硝酸钠减少的是不饱和溶液2. 将两溶液分别降温,先析出晶体的是饱和溶液3. 将两溶液分别蒸发少量水,先析出晶体的是饱和溶液(教师)如何实现饱和溶液与不饱和溶液相互转化呢?(学生以组为单位讨论、实验、探索转化的方法,教师观察学生的活动,积极参与许的讨论交流,适当的给予指导。
)(学生小组交流,展示和汇报他们的方法。
)(小结)1、只有指明“一定温度,一定量的溶剂”,“饱和溶液”与“不饱和溶液”才有意义2、饱和溶液 不饱和溶液3、当温度确定、溶剂量确定时,某溶质的饱和状态表示这种溶质溶解的最大值 (学生)有没有物质,温度越高,溶解的越少?(教师)有,熟石灰[Ca(OH)2] 那么熟石灰的饱和溶液与不饱和溶液又如何转化呢? (学生回答)(教师)为了粗略地表示溶液里溶质含量的多少,人们常把溶液分为浓溶液和稀溶液,但是,是不是浓溶液一定是饱和溶液,稀溶液就一定是不饱和溶液(引入)我们已知道,不同的物质在同一溶剂中溶解性不同,如何描述物质溶解性的大小呢?大家不妨讨论一下。
(学生)可描述为易溶,微溶、难溶、甚至不溶。
(教师)其实这些是物质溶解性的分类,而物质溶解性是难于直接测定的。
怎么办?①我们能否用一个可测的物理量来表示这个物理性质?例如:“物质可能溶解的最大克数(质量)”来表示物质溶解性的大小。
②这个“溶解的最大克数“怎样确定?同学们进行讨论(教师提示)要用控制变量的方法。
同学们进行讨论,并与书本P166溶解度定义相比较 (讲解)人们常用溶解度来定量描述物质的溶解性升温或加溶剂 降温、加溶质或蒸发溶剂固体物质的溶解度是指在一定温度下,该物质在100g溶剂(通常溶剂是水)里达到饱和状态时所溶解溶质的克数。
例如:20℃时氯化钠的溶解度为36.0g。
它的含义是什么呢?(请学生讨论、交流后得出)(小结)1。
溶解度概念要认清四个要素:“三个前提(缺一不可)”条件下的“一个克数”。
3.我们通常说的通过搅拌和振荡使物质加速溶解,是指溶解时间的缩短,并不意味着溶解度的增大。
4.固体物质溶解度大小除跟溶质、溶剂的性质有关外,还跟外界温度有关,但跟溶剂的量的增加减少无关,因为100 g溶剂(水)已规定。
所以影响固体物质的溶解度外界因素是温度例:20℃时,100 g水最多溶解NaCl36 g,20℃时NaCl的溶解度为36 g;再加100 g水,200 g水最多溶解72 gNaCl,随着溶剂的量的增加,溶解溶质的量也增加了,但溶解度仍为36 g,并没有改变。
(练习)1。
在书本P166表6-9物质的溶解度下面写上溶解性的分类2.下列叙述是否正确(1)食盐在水中的溶解度是36g(2)20℃时,硝酸钾的溶解度为31.6g(3)20℃时,200g水中加入72g食盐后溶液达到饱和,因此,20℃时,食盐在水中的溶解度是72g(4)10℃时,100g水中溶解了15g蔗糖,所以10℃时,蔗糖的溶解度为15g(引入)物质的溶解度要强调温度,下面我们来测定硝酸钾在不同温度下在水中的溶解度(实验)硝酸钾溶解度的测定:称取6.0 g硝酸钾(KNO3)放入大试管中,再用移液管取5 mL 水(设水的密度为lg/cm3)加人大试管中,然后将试管放人热水浴中。
将温度计插入试管的溶液中,边搅拌边看温度计读数;当硝酸钾全部溶解后自然冷却,用玻璃棒搅拌,当溶液中刚好出现丝状晶体,记录下温度读数。
再用移液管取lmL水加人该试管中,水浴加热至晶体全部溶解,取出试管边搅拌边冷却,观察温度读数和溶液,当刚出现丝状晶体,记下温度读数;然后继续用移液管加1毫升水,共做7个样品,即6g硝酸钾作为固定量,溶剂水的量分别为5、6、7、8、9、10、11,最后据此填下表。
(实验)温度对固体物质溶解度的影响(1)温度对硝酸钾、氯化钠、氢氧化钙溶解度的影响按图所示的数量,将三种溶质分别加入盛有蒸馏水的三只烧杯中并充分搅拌后。
(1)和(2)烧杯中硝酸钾和氯化钠不能完全溶解,(2)中氢氧化钙全部溶解。
然后对三个烧杯同时加热:(1)中的硝酸钾很快溶解完;(2)中剩余的氯化钠无明显减少;(3)加热至沸腾时溶液明显变浑浊。
( 实验分析):实验表明,温度升高时硝酸钾的溶解度明显变大;氯化钠的溶解度变化不大;氢氧化钙的溶解度减少。
下表为以上三种物质在不同温度下的溶解度(g)。
(教师)我们看到,同一物质的溶解度随温度的变化而变化,这种变化关系可用物质的溶解度曲线来表示,请同学们实验得出的硝酸钾、及上表中的氯化钠、氢氧化钙在不同温度时的溶解度绘制溶解度曲线(学生画的曲线用投影打出)书本图6-16和图6-17给出了几种常见固体物质在水中的溶解度曲线。