物质的溶解性
- 格式:pdf
- 大小:88.21 KB
- 文档页数:4

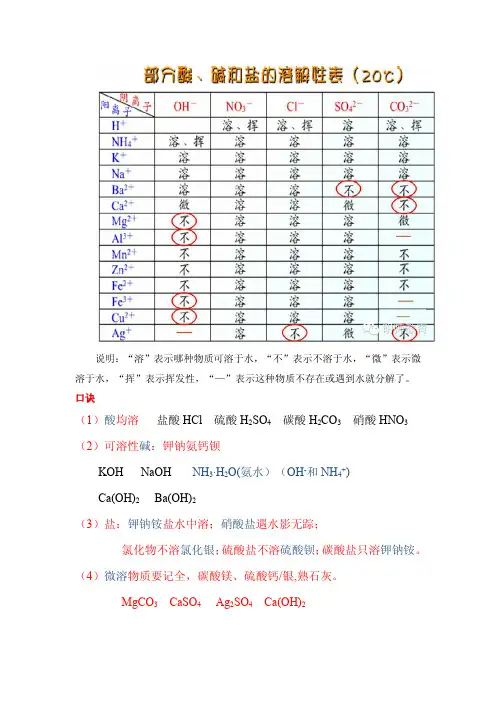
说明:“溶”表示哪种物质可溶于水,“不”表示不溶于水,“微”表示微溶于水,“挥”表示挥发性,“—”表示这种物质不存在或遇到水就分解了。
口诀
(1)酸均溶盐酸HCl硫酸H2SO4碳酸H2CO3硝酸HNO3(2)可溶性碱:钾钠氨钙钡
KOH NaOH NH3·H2O(氨水)(OH-和NH4+)
Ca(OH)2Ba(OH)2
(3)盐:钾钠铵盐水中溶;硝酸盐遇水影无踪;
氯化物不溶氯化银;硫酸盐不溶硫酸钡;碳酸盐只溶钾钠铵。
(4)微溶物质要记全,碳酸镁、硫酸钙/银,熟石灰。
MgCO3CaSO4Ag2SO4Ca(OH)2
五大阴离子四大酸根离子
物质名称化学式
物质分类
(酸碱盐)
溶解性
(溶不微)
例:氯化钠NaCl盐溶1硫酸
2氯化银
3碳酸钠
4氢氧化镁
5氯化铜
6硫酸钡
7硝酸银
8氢氧化铁
9氨水
10硫酸锌
11碳酸镁
12硝酸铜
13氯化亚铁
14碳酸铵
15硝酸铵
16硝酸铝
17氢氧化钡
18硫酸钠
19硝酸钡
20硝酸
21硫酸铁
22碳酸钙
23氢氧化钙
24氢氧化锌
25氯化铵
26碳酸钡
27硫酸钙
28高锰酸钾
29硝酸亚铁
30碳酸
31硫酸铜
32氢氧化铝
33氯化铝。



常见物质的溶解性1、气体:溶的:CO2、HCl、SO2、NH3等。
不溶(或不易溶):O2、H2、CH4、CO、N2等。
2、金属氧化物:除CaO、Na2O、K2O、BaO溶外,大多数不溶3、酸:大多数溶4、碱:除氢氧化钡、氢氧化钾、氢氧化钙、氢氧化钠和氨水溶外,其他碱不溶于水;5、盐:含有钾、钠、硝酸根、铵根的盐都溶于水;含Cl-的盐只有AgCl不溶于水,其他都溶于水;含SO42-的盐只有BaSO4不溶于水,其他都溶于水;含CO32-的盐只有含K+、Na+、NH4+溶于水,其他都不溶于水。
酸碱盐溶解性口诀:1、酸类多数都易溶;2、碱类易溶钾钠钡铵,钙是微溶余不溶;3、盐类:①钾盐钠盐硝酸盐,还有铵盐都易溶;(钾钠铵硝都易溶)②硫酸盐中钡不溶,硫酸钙银是微溶。
③氯化物中银不溶;④碳酸盐只溶钾钠氨,但是全能溶于酸。
⑤AgCl、BaSO4遇酸也不溶,加稀硝酸不溶解。
常见物质的颜色(一)固体的颜色1、黑色固体:木炭C,氧化铜CuO,二氧化锰MnO2,四氧化三铁Fe3O4,铁粉Fe(铁块银白色)2、紫黑色固体:高锰酸钾KMnO43、红色固体:铜Cu—紫红色,氧化铁Fe2O3——红(棕)色红磷P4、红褐色沉淀:氢氧化铁Fe(OH)35、浅黄色固体:硫磺S6、蓝色:硫酸铜晶体CuSO4·5H2O(无水硫酸铜白色),氢氧化铜沉淀Cu(OH)27、大部分固体:白色,如无水硫酸铜CuSO4,CaO,CaCO3沉淀(即不溶于水的盐和碱):①盐:白色↓:CaCO3、BaCO3(溶于酸)AgCl、BaSO4(也不溶于稀HNO3) 等;②碱:蓝色↓:Cu(OH)2;红褐色↓:Fe(OH)3;白色↓:其余不溶性碱为白色。
(二)液体的颜色1、大部分液体:无色,如水,稀盐酸,稀硫酸,酚酞试液等2、蓝色溶液:含有Cu2+的溶液—硫酸铜Cu SO4溶液,氯化铜CuCl2溶液,硝酸铜Cu(NO3)2溶液3、黄色溶液:含有Fe3+的溶液—Fe2(SO4)3溶液,FeCl3溶液,Fe(NO3)3硝酸铁溶液4、浅绿色溶液:含有Fe2+的溶液—FeSO4溶液,FeCl2溶液,硝酸亚铁Fe(NO3)2溶液5、紫红色溶液:高锰酸钾溶液KMnO46、紫色溶液:石蕊溶液(三)常见气体、无色气体:单质:氧气O2,氢气H2,氮气N2。

化学物质的溶解性与溶解度化学物质的溶解性是指在特定条件下溶解于溶剂中的物质的能力。
而溶解度是指在特定条件下溶质在溶剂中溶解的最大量。
溶解性和溶解度是研究化学物质在溶液中行为的重要参数。
本文将从溶解性的影响因素和溶解度的计算方法两个方面展开介绍。
一、溶解性的影响因素溶解性受到多种因素的影响,主要包括以下几个方面:1. 温度:温度是影响溶解性的重要因素。
一般来说,固体在液体中的溶解性随着温度的升高而增加,而气体在液体中的溶解度随着温度的升高而减小。
这是因为温度升高,溶质分子的平均动能增加,有利于溶质分子与溶剂分子之间的相互作用,从而促进溶解。
2. 压力:对于溶解气体的情况,压力也是一个重要的影响因素。
溶解气体的溶解度随着压力的增加而增加,这是因为增加压力会增加气体分子与溶液中溶剂分子的碰撞频率,从而促进气体的溶解。
3. 物质的性质:溶解性也受到物质自身性质的影响。
例如,极性分子通常更容易溶解于极性溶剂中,而非极性分子更容易溶解于非极性溶剂中。
此外,离子化合物的溶解性也受到其晶格能和溶剂中离子的溶解度等因素的影响。
4. pH值:溶液中的酸碱性对一些化学物质的溶解性也有影响。
有些物质在酸性或碱性条件下更容易溶解,而有些物质则在中性条件下溶解性较好。
二、溶解度的计算方法溶解度是表征溶质在溶剂中溶解程度的指标,通常用单位质量溶剂中溶质的质量来表示。
下面介绍两种常见的计算溶解度的方法。
1. 溶解度的质量分数计算:溶解度的质量分数是指单位质量溶剂中溶质的质量。
计算公式如下:溶解度质量分数 = (溶解质的质量 / 溶剂总质量) × 100%2. 溶解度的摩尔分数计算:溶解度的摩尔分数是指单位摩尔溶剂中溶质的摩尔数量。
计算公式如下:溶解度摩尔分数 = (溶解物的摩尔浓度 / 溶剂摩尔浓度) × 100%通过以上计算方法,我们可以较为准确地衡量出溶质在溶剂中的溶解度,从而进一步研究溶液的行为和性质。


化学物质的溶解性化学物质的溶解性是指一种物质在另一种物质中的溶解程度和速度。
溶解性的研究对于理解物质的性质和应用具有重要意义。
本文将介绍溶解性的基本概念、影响溶解性的因素以及溶解度的计算方法。
一、溶解性的概念溶解性是指一种物质在另一种物质中的溶解程度和速度。
溶解是物质分子或离子与溶剂分子之间发生相互作用的过程,在溶解的过程中,溶质分子或离子与溶剂分子相互作用形成溶液。
溶解性反映了溶质分子或离子与溶剂分子之间的相互吸引程度,直接影响到物质在溶液中的存在状态。
二、影响溶解性的因素1. 温度:温度对溶解性有显著的影响。
一般来说,溶解性随温度的升高而增加。
这是因为在高温下,物质的分子动能增大,进而使分子和离子之间的相互作用力增强,使溶解速率增加。
2. 压力:对于气体溶解在液体中的情况,压力对溶解性有一定影响。
根据亨利定律,气体的溶解度随压力增加而增加。
这是因为增加压力会使气体分子与液体分子之间的相互作用增强,从而促进溶解过程。
3. 分子结构:溶解性与溶质和溶剂的分子结构密切相关。
分子间的相互作用力越强,溶解性越大。
例如,极性分子与极性溶剂之间的相互作用力较强,因此它们的溶解性较好。
4. 溶剂的选择:选择适合溶质的溶剂有助于提高溶解度。
常用的溶剂包括水、醇类、酮类、酯类等,不同的溶剂对不同的溶质具有不同的溶解性。
三、溶解度的计算方法溶解度是指单位溶剂中溶质的最大溶解量。
通常以质量单位的溶解度来衡量。
计算溶解度可以使用溶解度曲线或溶解度表,其中溶解度曲线表示在一定温度下溶质的溶解度随溶剂中溶质的浓度变化的关系。
溶解度表则列举了在不同温度下溶质的溶解度。
四、实际应用溶解性是化学领域中一个重要的研究方向,对于理解和应用化学物质具有重要意义。
在药物研发中,了解药物的溶解性有助于确定药物的适宜剂型以及药物的有效吸收。
在环境保护方面,研究溶解性可以帮助我们了解化学物质在水体中的溶解度,从而评估其对环境的影响。
综上所述,溶解性是指物质在溶剂中的溶解程度和速度。


