【推荐】限制性内切酶的特点有哪些-范文word版 (2页)
- 格式:docx
- 大小:17.73 KB
- 文档页数:2
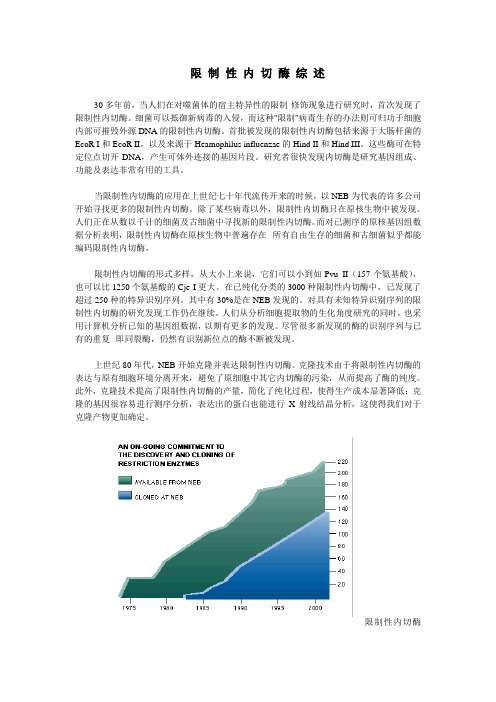
限制性内切酶综述30多年前,当人们在对噬菌体的宿主特异性的限制-修饰现象进行研究时,首次发现了限制性内切酶。
细菌可以抵御新病毒的入侵,而这种"限制"病毒生存的办法则可归功于细胞内部可摧毁外源DNA的限制性内切酶。
首批被发现的限制性内切酶包括来源于大肠杆菌的EcoR I和EcoR II,以及来源于Heamophilus influenzae的Hind II和Hind III。
这些酶可在特定位点切开DNA,产生可体外连接的基因片段。
研究者很快发现内切酶是研究基因组成、功能及表达非常有用的工具。
当限制性内切酶的应用在上世纪七十年代流传开来的时候,以NEB为代表的许多公司开始寻找更多的限制性内切酶。
除了某些病毒以外,限制性内切酶只在原核生物中被发现。
人们正在从数以千计的细菌及古细菌中寻找新的限制性内切酶。
而对已测序的原核基因组数据分析表明,限制性内切酶在原核生物中普遍存在--所有自由生存的细菌和古细菌似乎都能编码限制性内切酶。
限制性内切酶的形式多样,从大小上来说,它们可以小到如Pvu II(157个氨基酸),也可以比1250个氨基酸的Cje I更大。
在已纯化分类的3000种限制性内切酶中,已发现了超过250种的特异识别序列。
其中有30%是在NEB发现的。
对具有未知特异识别序列的限制性内切酶的研究发现工作仍在继续。
人们从分析细胞提取物的生化角度研究的同时,也采用计算机分析已知的基因组数据,以期有更多的发现。
尽管很多新发现的酶的识别序列与已有的重复--即同裂酶,仍然有识别新位点的酶不断被发现。
上世纪80年代,NEB开始克隆并表达限制性内切酶。
克隆技术由于将限制性内切酶的表达与原有细胞环境分离开来,避免了原细胞中其它内切酶的污染,从而提高了酶的纯度。
此外,克隆技术提高了限制性内切酶的产量,简化了纯化过程,使得生产成本显著降低;克隆的基因很容易进行测序分析,表达出的蛋白也能进行X射线结晶分析,这使得我们对于克隆产物更加确定。

限制性核酸内切酶是一类能够识别双链DNA分子中的某种特定核苷酸序列(一般4-8bp),并在此处切割DNA双链的核酸内切酶。
主要存在于原核生物,是原核生物自我保护的一种机制。
它的作用包含两类,一种是对外的,限制作用,指一定类型的细菌可以通过限制性核酸内切酶的作用,破坏入侵的外源DNA,使得外源DNA对生物细胞的入侵受到限制。
另一种是对内的,修饰作用,指在特定位置发生甲基化,可免遭自身限制性酶的破坏。
限制性核酸内切酶的发现是在本世纪中期,Arber等人对λ噬菌体在大肠杆菌不同菌株上的平板培养效应的研究为基础,发现了原核生物体内存在着寄主控制的限制和修饰系统。
实验是:在K株或B株大肠杆菌上生长繁殖的噬菌体λ(K)或λ(B),再次感染原寄主菌体的成斑率为1,而感染新的寄主菌株的成斑率则分别为10-4和4*10-4所以说受到了限制。
在 20 世纪 60 年代,噬菌体学家阐明了宿主限制和修饰现象的生化机制。
该研究工作在 Me-selson 和 Yuan(1968)纯化得到了大肠杆菌 K12 的限制性内切酶时达到高峰。
因为这个内切酶可以把未修饰的 DNA 切割成大的分离片段,人们认为它一定识别一个靶序列。
从而提供了对 DNA 进行可控操作的前景。
但不幸的是,K12 内切酶不具备人们希望的性质。
虽然它确实是结合到一定的区域序列上,切割却在几千个碱基对以外“随机”发生的(Yuan 等,1980)。
经过大量努力后,终于在1970 年取得了突破,人们发现了在流感嗜血杆菌(Haemophilusinfluenzae)中存在一种酶,其作用更加简单(Kelly & Smith,1970;Smith & W ilcox,1970),即这个酶可以识别双链 DNA 分子中的一个特定靶序列,并在该序列之内切断多聚核苷酸链,从而产生长度和序列一定的分离片段。
突破性的进展始于 Hamilton Smith 的发现,他从嗜血流感细菌(Haemophilus influenzae)菌株 Rd中找到了一种限制性内切酶(Smith & Wilcox,1970),并阐明了它在噬菌体 T7 DNA 中切割的核苷酸序列(Kelly & Smith,1970)。

限制性内切酶限制性内切酶(又称限制酶)首先是在细菌体内发现的,但后来在部分古细菌中也发现了这种成分。
通常,限制性内切酶会切割双链DNA,每个限制性内切酶会识别特定的DNA序列,根据不同的内切酶类型,可在识别序列内或距识别序列不远的位置处切割DNA,识别序列长度通常为4-8bp,酶切之后会形成粘性末端和平末端。
上世纪50年代初期,许多研究团队观测到了噬菌体对于同一物种的不同细菌宿主菌株存在感染效率差异[1,2],即:使用在一种细菌菌株(例如,大肠杆菌C)内繁殖的噬菌体λ感染同一种类的灵异菌株(例如大肠杆菌K),结果发现,相比于重新感染宿主菌株(大肠杆菌C),大肠杆菌K的感染率出现明显下降。
新的宿主(大肠杆菌K)似乎可以选择性抵御或“耐受”侵入的噬菌体。
研究人员还发现,这一现象并没有遗传性,因为经过一轮感染后,在新菌株中生长的噬菌体还可以以正常的感染率感染该菌株。
这种现象被称为“宿主控制变异”,有关其背后的机制也成为了频繁研究的领域[3]。
直到上世纪60年代,人们才发现宿主变异的机制,其与噬菌体DNA的酶切有关,进而发现并分理出了限制性内切酶。
上世纪60年代初Werner Arber观测发现,宿主范围内的决定性遗传物质都存在于噬菌体DNA中,而后续实验证明甲硫氨酸参与宿主的自我保护[4]。
这些发现最终催生了限制性修饰(R-M)体系的概念,通过该体系,来自于宿主的限制性内切酶和甲基化酶共同作用,切割外来病毒(非甲基化)DNA,同时保护宿主的DNA不受甲基化[5]。
随着DNA连接酶的发现以及位点特异性限制性内切酶的家族不断壮大,重组DNA 技术应运而生。
限制性内切酶的命名规则,考虑到内切酶来源的三种特性——属名、种名和菌株或血清型——组成了一个简短的名称,后面加上罗马数字,代表来自同一菌株的多个限制性内切酶[6]。
例如,以HindⅢ酶为代表:“H”代表Haemophilus“in”代表influenzae“d”代表血清型d“Ⅲ”用于区分来自于Haemophilusinfluenza血清型d的其它限制性内切酶限制性内切酶的分类,根据结构的复杂程度、识别序列、切割位点位置以及辅助因子要求,限制性内切酶分为四类:TypeⅠ:同时具有限制性和甲基化活性的多亚基蛋白需要ATP切割位点与识别位点间的间距不定TypeⅡ:特异性的识别序列切割位点位于识别序列内或邻近识别序列在切割位点生成5'磷酸基和3'羟基末端需要M2+TypeⅢ:由两个相反的识别序列组成切割位点与其中一个识别序列的间距恒定需要ATPTypeⅣ:仅切割甲基化的DNA切割位点大约距离识别位点30bp由于自身特殊的特点,TypeⅡ限制性内切酶已经成为分子克隆、法医学DNA分析等许多研究应用最常用的限制性内切酶。


限制酶使用说明一、分类目前,已被发现的限制酶,根据其反应的必须因子和切断点等特性,被分为以下三大类:类别反应必须因子切点酶例 I 型 s-腺苷基蛋氨酸、ATP、Mg2+识别部位和切点不同,切断部位不定Eco B、Eco KII 型 Mg2+切断识别部位或其附近的特定部位Eco R I、Bam H I III 型 ATP、Mg2+识别部位和切点不同,但切断特定部位Eco P I、Hin f III 应用于基因工程研究用的限制酶,一般全是II型酶,现在市场上销售的酶都属于II型酶, 这些限制酶由于其反应条件和底物DNA种类的不同,其切断状况及出现Star活性的频率等各有不同,并且其程度也根据酶的不同而千差万别。
因而在使用限制酶时,必须对这些要素充分注意,确保目标序列的切断反应能顺利进行,下面具体介绍一下使用限制酶时的一些注意点。
二、注意事项1. 甲基化的影响从带有DNA甲基化酶基因的宿主菌中制备的DNA,其碱基的一部分已经被甲基化,因此即便使用能够识别、切断被甲基化部分的序列的限制酶,也几乎无法切断被甲基化的部分。
被甲基化的部位,根据底物DNA及宿主种类的不同而不同。
例如宿主菌为大肠杆菌的情况下,根据宿主的种类有以下两种情况:在进行转化时,通常使用的菌株为C600、HB101、JM109等,因为都带有dam、dcm甲基化酶,所以使用这些菌株制备的DNA时,必须注意。
另外,动物由来的DNA,CG序列多为5m CG;植物由来的DNA,CG及CNG序列多为5m CG和5m CNG。
2. Star活性限制酶在一些特定条件下使用时,对于底物DNA的特异性可能降低。
即可以把与原来识别的特定的DNA序列不同的碱基序列切断,这个现象叫Star活性。
Star活性出现的频率,根据酶、底物DNA、反应条件的不同而不同,可以说几乎所有的限制酶都具有Star活性。
并且,它们除了识别序列的范围增大之外,还发现了在DNA的一条链上加入切口的单链切口活性,所以为了极力抑制Star活性,一般情况下,即使会降低反应性能,我们也提倡在低甘油浓度、中性pH、高盐浓度条件下进行反应。

限制性内切酶及其特点
在生物体内有一类酶,它们能将外来的DNA切断,即能够限制异源DNA 的侵入并使之失去活力,但对自身的DNA却无损害。
科学家还注意到,这种酶是从DNA分子内部切断DNA的,因此,这种酶称做限制性内切酶。
美国生物学家内森斯和史密斯因发现了限制性内切酶而获得1978年度的诺贝尔生理学或医学奖。
限制性内切酶通常能识别4~6个碱基长度的特定DNA序列,并能以特定的模式剪切DNA链。
一般来说,被识别的DNA序列是回文序列。
这种序列的特点是,当从左右两端分别阅读这段双链DNA的碱基序列时,双链上的碱基序列是相同的。
按照切割的方式,限制性内切酶可以分为错位切和平切两种,它们分别产生黏性末端和平末端。
目前大约已有500种限制性内切酶,这些酶的命名方式与EcoRⅠ一样遵循统一的规则。
第一个字母是分离出此酶的细菌属名的第一个字母,后两个字母为种名的前两个字母,小写,株系数字通常都省略,罗马数字用来表示从同一个细菌中分离出的不同的限制性内切酶。
如HpaⅠ和HpaⅡ就是从同一种细菌中分离出来的第一种和第二种内切酶。
几种常用的限制性内切酶及其酶切位点如下表(表13)。
表13 几种常用限制性内切酶及其酶切位点
1/ 1。
基因工程中使用的限制酶其特点基因工程中使用的限制酶其特点是什么在日常生活或是工作,学习中,大家一定都或多或少地接触过一些生物知识,下面是店铺为大家收集的有关基因工程中使用的限制酶其特点相关内容,仅供参考,希望能够帮助到大家。
基因工程中的限制酶的特点特异性地识别和切割DNA关于基因工程中的限制酶(1)“分子手术刀”——限制性核酸内切酶(限制酶)①来源:主要是从原核生物中分离纯化出来的。
②功能:能够识别双链DNA分子的某种特定的核苷酸序列,并且使每一条链中特定部位的两个核苷酸之间的磷酸二酯键断开,因此具有专一性。
③结果:经限制酶切割产生的DNA的片段末端通常有两种形式:黏性末端和平末端。
即,当限制性内切酶作用于特定的DNA时,把这段序列沿着特定的切点切开的这个过程分两种情况:a、沿着中轴线切口(即沿着DNA双链中对应的磷酸二酯键)切开,得到的就是两个平末端;b、在中轴线的两端切口切开,得到的就是两个黏性末端。
例如:EcoRⅠ限制性内切酶就可以识别G/AATTC的DNA序列,然后在G和A间切开,得到的就是两个黏性末端(之间可以根据碱基互补配对原则重组)限制酶的切口不都是一长一短的,一长一短的叫黏性末端,一样长的叫平末端。
“粘性末端”在高中教材中也作“黏性末端”。
基因工程的操作步骤工具(1)酶:限制性核酸内切酶、DNA连接酶、(2)载体:质粒载体、噬菌体载体、Ti质粒、人工染色体1.提取目的基因获取目的基因是实施基因工程的第一步。
如植物的抗病(抗病毒,抗细菌)基因,种子的贮藏蛋白的基因,以及人的胰岛素基因干扰素基因等,都是目的基因。
要从浩瀚的“基因海洋”中获得特定的目的基因,是十分不易的。
科学家们经过不懈地探索,想出了许多办法,其中主要有两条途径:一条是从供体细胞的DNA中直接分离基因;另一条是人工合成基因。
直接分离基因最常用的方法是“鸟枪法”,又叫“散弹射击法”。
鸟枪法的具体做法是:用限制酶将供体细胞中的DNA切成许多片段,将这些片段分别载入运载体,然后通过运载体分别转入不同的受体细胞,让供体细胞提供的DNA(即外源DNA)的所有片段分别在各个受体细胞中大量复制(在遗传学中叫做扩增,如使用PCR技术),从中找出含有目的基因的细胞,再用一定的方法把带有目的基因的DNA的片段分离出来。
《基因工程的基本工具》知识清单一、限制性内切酶限制性内切酶,又称限制酶,是基因工程中最重要的工具之一。
它就像一把极其精准的“分子剪刀”,能够识别特定的核苷酸序列,并在特定的位点切割 DNA 分子。
限制酶的作用特点具有高度的特异性。
每种限制酶所识别的核苷酸序列通常是回文序列,即从两条链的5'端向3'端读取,序列是相同的。
例如,EcoRⅠ识别的序列是 GAATTC,切割位点就在 G 和 A 之间。
限制酶的切割方式有两种:一种是在识别序列的中轴线两侧进行切割,产生的 DNA 片段末端是平末端;另一种是在中轴线处切割,产生的 DNA 片段末端是黏性末端。
黏性末端因为具有互补的单链,所以在DNA 连接酶的作用下更容易连接。
限制酶在基因工程中的主要用途是切割目的基因和载体,以便于构建重组 DNA 分子。
二、DNA 连接酶有了“剪刀”把 DNA 切开,还需要“胶水”把它们粘起来,这时候就轮到 DNA 连接酶发挥作用了。
DNA 连接酶能够将两个具有相同末端的 DNA 片段连接在一起。
常见的 DNA 连接酶有两种,分别是 E·coli DNA 连接酶和 T4 DNA 连接酶。
E·coli DNA 连接酶只能连接黏性末端,而 T4 DNA 连接酶既可以连接黏性末端,也可以连接平末端,但连接平末端的效率相对较低。
在基因工程中,DNA 连接酶用于将切割后的目的基因和载体连接,形成重组 DNA 分子。
三、载体载体是将外源基因送入受体细胞的“运输工具”。
它需要具备一些特定的条件。
首先,载体要有一个或多个限制酶切点,以便插入目的基因。
其次,载体要有自我复制的能力,或者能整合到受体细胞的染色体 DNA 上,随染色体 DNA 一起复制。
再者,载体要有标记基因,便于重组 DNA分子的筛选。
常见的标记基因有抗生素抗性基因、荧光蛋白基因等。
常见的载体有质粒、噬菌体和动植物病毒等。
质粒是一种小型的环状 DNA 分子,广泛存在于细菌和酵母菌等微生物中。
限制性内切酶1,发现限制性内切酶能保护细菌不受噬菌体的感染,行使微生物免疫功能,缺乏限制性内切酶的大肠杆菌极易被噬菌体感染,但是如果拥有限制性内切酶,被感染的几率就会降低。
限制性内切酶在原核生物中普遍存在,所有自由生存的细菌和古细菌几乎都能编码限制性内切酶。
2,限制-修饰(R-M)系统大多数限制性内切酶常常伴随有一两种修饰酶(DNA甲基化酶),从而保护细胞自身的DNA不被限制性内切酶破坏。
修饰酶识别的位点与相应的限制性内切酶相同,但它们的作用是甲基化每条链中的一个碱基,而不是切开DNA链。
甲基化所形成的甲基基团能够伸入到限制性内切酶识别位点的双螺旋的大沟中,阻碍限制性内切酶发挥作用,即组成R-M系统。
在R-M系统中,有些限制性内切酶和修饰酶是两种不同的蛋白,独立行使自己的功能,有些本身就是一种大的限制-修饰复合酶,由不同的亚基或同一亚基的不同结构域分别执行自己的功能。
3,分类最常用的II型限制性内切酶,能够在识别序列内部或附近特异性的切开DNA链,产生特性的片段和凝胶电泳条带,是唯一一类能用于DNA分析和克隆的限制性内切酶。
限制性内切酶切割后产生一个3-羟基和5-磷酸基,只有当镁离子存在时才具有活性,而相应的修饰酶则需要S-腺苷甲硫氨酸的存在。
备注:NEBuffer: Tris-HCl , MgCl, DTT(二硫苏糖醇,强还原剂)星号活性:在非理想条件下,内切酶切割与识别位点相似但不完全相同的序列,称为星号活性。
使用高保真内切酶,即经过基因工程改造降低了星号活性。
同裂酶:识别序列相同的限制性内切酶即为同裂酶,第一个被发现的内切酶称为原酶,后来发现的识别序列相同的内切酶称为原酶的内裂酶。
4,甲基化(1)原核生物甲基化在原核生物中,DNA甲基化酶作为限制修饰系统的一个组成部分广泛存在,作用是保护宿主菌不被相应的限制性内切酶切割。
Dam甲基化酶:G m ATCDcm甲基化酶:C m CAGG和C m CTGG例如,从dam+ E.coli 中分离的质粒DNA则不能被识别序列为GA TC的限制性内切酶所切割,但是被Dam甲基化阻断的限制性位点可以通过克隆方法去甲基化,及将DNA转入至dam-的菌种中进行增殖。
限制性内切酶原理限制性内切酶(Restriction Enzyme)是一种常见的酶类,能够帮助细菌对抗侵入的病毒DNA,通过识别特定的DNA序列并将其切割成特定的片段。
限制性内切酶具有辨识性、切割性和钳制性、修复性四个基本特点。
限制性内切酶启示了分子生物学领域的许多实验技术,如DNA测序、聚合酶链反应(PCR)等,在生命科学研究中得到广泛应用。
限制性内切酶的辨识性是指它们能够识别DNA序列中的特定短序列,并只切割该序列。
每种限制性内切酶具有特定的辨识序列,也称为限制性酶切位点。
这些辨识序列通常是4-8个碱基对长,具有特定的配对规则,如EcoRI的辨识序列是5'-GAATTC-3',其中A和T配对,G和C配对。
在DNA双螺旋结构中,限制性酶通过辨识序列与DNA结合,形成特异性的结合位点。
限制性内切酶的切割性是指它们能够在辨识序列的特定位置切割DNA双螺旋结构。
限制性内切酶通常通过切割特定的磷酸二酯键来断裂DNA链。
它们在辨识序列的特定位点周围创建一个切割位点,通常是辨识序列两侧的不同位置,如EcoRI在辨识序列的前后各切割一个磷酸二酯键,形成两个单链断裂端。
限制性内切酶的钳制性是指它们能够将切割的DNA片段留在切割位点附近,形成特定的断裂端。
例如,EcoRI在切割DNA后会在切割位点的切割位点之间留下两个黏性末端,形成一个单链和一个突出的单链片段。
这种特定的断裂端形式通常有助于进一步的DNA处理和连接。
限制性内切酶的修复性是指它们能够修复被切割的DNA。
在细菌细胞内,限制性内切酶的活性通常伴随着相应的修复酶系统,可以恢复被切割的DNA双链结构。
这种修复过程有助于防止细菌自己的DNA也被限制性内切酶过度切割。
限制性内切酶在分子生物学研究中得到广泛应用。
通过利用限制性内切酶的辨识性,科学家可以在特定的DNA序列上进行定点切割。
切割后的DNA片段可以被进一步用于DNA测序、PCR等实验技术。
【推荐】限制性内切酶的特点有哪些-范文word版
本文部分内容来自网络整理,本司不为其真实性负责,如有异议或侵权请及时联系,本司将立即删除!
== 本文为word格式,下载后可方便编辑和修改! ==
限制性内切酶的特点有哪些
限制性核酸内切酶是可以识别特定的核苷酸序列,并在每条链中特定部位
的两个核苷酸之间的磷酸二酯键进行切割的一类酶,简称限制酶。
下面是小编
给大家整理的限制性内切酶的特点,希望能帮到大家!
限制性内切酶的特点
1、识别位点的DNA序列呈二重旋转对称(即具有迥文结构);
2、切割DNA均产生含5’-磷酸和3’-羟基的末端;
3、错位切割产生具有5’-或3’-突出的粘性末端;而沿对称轴切割双链DNA产生平头末端,也称钝性末端。
4、少数不同的限制酶可识别和切割相同的位点,这些酶称为同切酶,如MboI Ⅰ和 Sau3A。
限制性内切酶的分类性质
根据酶的功能特性、大小及反应时所需的辅助因子,限制性内切酶可分为
两大类,即I类酶和Ⅱ酶。
最早从大肠杆菌中发现的EcoK、EcoB就属于I类酶。
其分子量较大;反应过程中除需Mg2+外,还需要S-腺苷-L甲硫氨酸、ATP;在DNA分子上没有特异性的酶解片断,这是I、Ⅱ类酶之间最明显的差异。
因此,
I类酶作为DNA的分析工具价值不大。
Ⅱ类酶有EcoR I、BamH I、Hind Ⅱ、Hind Ⅲ等。
其分子量小于105道尔顿;反应只需Mg2+;最重要的是在所识别的
特定碱基顺序上有特异性的切点,因而DNA分子经过Ⅱ类酶作用后,可产生特
异性的酶解片断,这些片断可用凝胶电泳法进行分离、鉴别。
限制性内切酶识别DNA序列中的回文序列。
有些酶的切割位点在回文的一
侧(如EcoR I、BamH I、Hind等),因而可形成粘性末端,另一些Ⅱ类酶如Alu I、BsuR I、Bal I、Hal Ⅲ、HPa I、Sma I等,切割位点在回文序列中间,形
成平整末端。
Alu I的切割位点如下:
5'-A G^C T-3'
3'-T C^G A-5'。